1.2.2离子反应 课件(共31张PPT)-高一化学人教版必修一课件
文档属性
| 名称 | 1.2.2离子反应 课件(共31张PPT)-高一化学人教版必修一课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 11.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-05 11:33:56 | ||
图片预览










文档简介
(共31张PPT)
第一章 第二节
第2课时 离子反应
1.通过实验事实认识离子反应,并掌握离子反应发生的条件。
2.掌握离子方程式的书写方法及正误判断。
核心素养
发展目标
离子反应及发生的条件
一
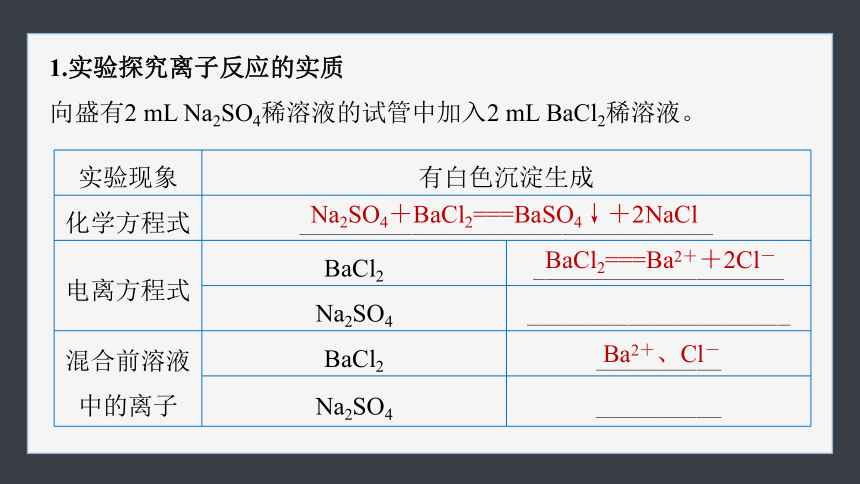
1.实验探究离子反应的实质
向盛有2 mL Na2SO4稀溶液的试管中加入2 mL BaCl2稀溶液。
实验现象 有白色沉淀生成
化学方程式 _________________________________
电离方程式 BaCl2 ____________________
Na2SO4 _____________________
混合前溶液中的离子 BaCl2 __________
Na2SO4 __________
Na2SO4+BaCl2===BaSO4↓+2NaCl
BaCl2===Ba2++2Cl-
Ba2+、Cl-
混合后溶液中的离子 离子数目减少, 离子数目不变
实验结论 两溶液混合, 都没有发生化学反应,______ 发生了化学反应,生成BaSO4白色沉淀
Na+、Cl-
Na+、Cl-
Ba2+
2.离子反应的概念
电解质在溶液中的反应实质上是 之间的反应,这样的反应属于离子反应。
离子
【思考】 下列溶液混合能否发生离子反应,能发生离子反应的说出参与反应的离子(微粒),不能发生离子反应的说出原因。
(1)氯化钠溶液与硝酸银溶液
(2)氢氧化钾溶液与硝酸溶液
(3)盐酸与碳酸钠溶液
提示 能,Ag+与Cl-反应生成AgCl沉淀。
提示 能,H+与OH-生成H2O。
(4)CH3COONa溶液与稀盐酸
(5)硝酸钠溶液与氯化钾溶液
(6)锌与CuSO4溶液
提示 能,CH3COO-与H+生成CH3COOH。
提示 不能,因为无沉淀、气体或难电离的物质生成。
提示 能,Zn与Cu2+发生置换反应。
3.离子反应的实质
(1)从微观角度,酸、碱、盐在水溶液中发生的复分解反应,实质上是两种电解质在溶液中 的反应。
(2)离子反应使溶液中某些离子的浓度 。
相互交换离子
减小
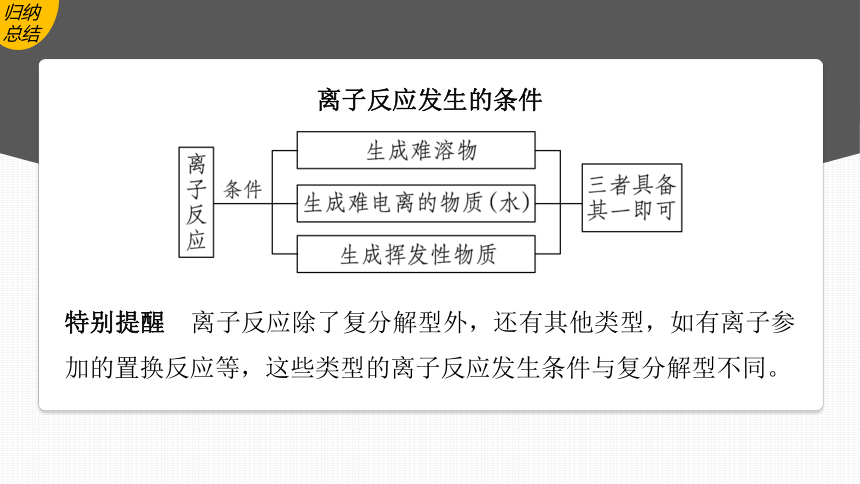
归纳总结
离子反应发生的条件
特别提醒 离子反应除了复分解型外,还有其他类型,如有离子参加的置换反应等,这些类型的离子反应发生条件与复分解型不同。
应用体验
1.(2022·广西南宁英华学校高一月考)下列物质中,不能发生离子反应的是
A.Na2SO4和CuCl2 B.Ba(NO3)2和Na2CO3
C.CO2和KOH D.CaCO3和HCl
√
Na2SO4和CuCl2不能结合生成沉淀、气体、水等,不能发生离子反应;Ba(NO3)2和Na2CO3反应生成碳酸钡沉淀;CO2和KOH反应生成碳酸钾和水;CaCO3和HCl反应生成氯化钙、水和二氧化碳。
应用体验
2.加入NaOH溶液后,下列溶液中的离子数目不会减少的是
A.Cu2+ B.Fe3+ C. D.H+
凡是能与OH-反应的离子,其数目均会减少,Cu2+、Fe3+、H+均可以与OH-反应;而 不与OH-反应,离子数目不会减少。
√
返回
离子方程式
二
1.离子方程式的概念
用实际参加反应的 符号来表示反应的式子。
2.离子方程式的书写步骤
以BaCl2溶液和Na2SO4溶液的反应为例:
(1)写:写出反应的化学方程式(必须根据实验事实):
。
(2)拆:把易溶于水、易电离的物质写成离子形式:
。
离子
BaCl2+Na2SO4===BaSO4↓+2NaCl
(3)删:删去方程式两边不参加反应的离子,并将方程式化为最简:
。
(4)查:检查离子方程式两边各元素的原子个数和电荷总数是否相等以及反应条件、沉淀符号、气体符号等。
3.离子方程式中的“拆”与“不拆”的原则
【思考1】 (1)书写离子方程式时,哪些类别的物质要拆分写成离子的形式?
提示 易溶于水且易电离的电解质要写成离子的形式:
①强酸,如HCl、H2SO4、HNO3、HBr、HI等;
②强碱,如KOH、NaOH、Ba(OH)2等;
③大部分可溶性盐,如钾盐、钠盐、铵盐、硝酸盐等。
(2)书写离子方程式时,哪些类别的物质要写成化学式?
提示 单质、气体、氧化物、难溶物质、难电离的物质(如水、弱酸、弱碱)等写成化学式。
特别提醒 ①盐的溶解性:钾、钠、铵盐水中溶;硝酸盐见水无影踪;盐酸盐不溶银(熟记AgCl不拆);硫酸盐不溶钡和铅(熟记BaSO4不拆);碳酸盐只溶钾、钠、铵;碱中只溶钾、钠、钡。
②对微溶物,如Ca(OH)2,如果反应物为澄清石灰水,应拆成Ca2+和OH-的形式,如果是生成物或是石灰乳等,则保留化学式Ca(OH)2。
③物质“拆分”原则:物质在离子方程式中“拆”与“不拆”,关键看该物质在溶液中的存在形式。如CaCO3难溶于水,在溶液中以CaCO3固体的形式存在,故CaCO3写成化学式。
4.离子方程式的意义
【思考2】 写出下列反应的化学方程式和离子方程式:
溶液中反应物 化学方程式 离子方程式
盐酸与氢氧化钠 ________________________ _________________
盐酸与氢氧化钾 ________________________ _________________
HCl+NaOH===NaCl+H2O
H++OH-===H2O
HCl+KOH===KCl+H2O
H++OH-===H2O
硫酸与氢氧化钠 _________________________ _________ _________________
强酸、强碱发生中和反应的实质 强酸电离出的H+和强碱电离出的OH-结合生成水
根据上表,分析说明离子方程式不仅可以表示 的化学反应,还可以表示 的离子反应。
H2SO4+2NaOH===Na2SO4
+2H2O
H++OH-===H2O
某个具体
同一类型
【思考3】 (1)H2SO4溶液与Ba(OH)2溶液反应的离子方程式:_____
;
NaHSO4溶液与KOH溶液反应的离子方程式: 。
(2)判断正误
①酸碱中和反应的离子方程式都是H++OH-===H2O
②H++OH-===H2O仅表示强酸与强碱的中和反应
2H++
H++OH-===H2O
×
×
应用体验
1.书写下列反应的离子方程式。
(1)氧化镁溶于稀盐酸:_________________________。
(2)用碳酸钙与稀盐酸反应制备二氧化碳:________________________
______________。
(3)向盐酸中滴加碳酸钠溶液:__________________________。
(4)NaHCO3溶液与HNO3溶液反应:_________________________。
(5)二氧化碳与澄清石灰水反应生成沉淀:________________________
_______________。
(6)铁与稀硫酸反应生成氢气:_______________________。
MgO+2H+===Mg2++H2O
CaCO3+2H+===Ca2++
CO2↑+H2O
Ca2++2OH-+CO2===
CaCO3↓+H2O
Fe+2H+===Fe2++H2↑
应用体验
2.离子方程式Ba2++ ===BaSO4↓可能表示
①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应
②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应
③稀硫酸与可溶性钡盐溶液之间的反应
④氢氧化钡溶液与稀硫酸的反应
A.①② B.①②④ C.②③ D.①②③
√
氢氧化钡溶液与稀硫酸反应的离子方程式为Ba2++2OH-+2H++
===BaSO4↓+2H2O,④不正确,①②③正确。
返回
随堂演练 知识落实
1
2
3
4
1.依据现有知识分析判断,下列选项中不满足离子反应发生条件的是
A.NaOH+KCl===NaCl+KOH
B.AgNO3+HCl===AgCl↓+HNO3
C.Na2CO3+Ca(OH)2===2NaOH+CaCO3↓
D.BaCO3+2HNO3===Ba(NO3)2+H2O+CO2↑
√
随堂演练
氢氧化钠和氯化钾不反应,因为无沉淀、气体或难电离的物质生成,故选A。
2.(2022·广东惠州高一上期末)下列离子方程式正确的是
A.用小苏打治疗胃酸过多: +2H+===CO2↑+H2O
B.氢氧化钡溶液与稀硫酸反应:Ba2++ ===BaSO4↓
C.铜片插入硝酸银溶液:Cu+Ag+===Cu2++Ag
D.稀盐酸与石灰石反应:CaCO3+2H+===Ca2++H2O+CO2↑
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
用小苏打治疗胃酸过多的离子方程式为 +H+===CO2↑+H2O,A错误;
氢氧化钡溶液与稀硫酸反应的离子方程式为Ba2++2OH-+2H++
===BaSO4↓+2H2O,B错误;
铜片插入硝酸银溶液中的离子方程式为Cu+2Ag+===Cu2++2Ag,C错误;
石灰石(碳酸钙)溶于稀盐酸的离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑,D正确。
3.(2022·湖南衡阳高一月考)下列各组中的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.氢氧化钠与盐酸;氢氧化钠与碳酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与稀硝酸;BaCO3溶液与稀硝酸
D.石灰石与稀硝酸;石灰石与稀盐酸
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
A项,HCl可拆成离子形式,而H2CO3是弱酸,不能拆成离子,因此不能用同一离子方程式表示;
B项,BaCl2溶液与Na2SO4溶液反应生成硫酸钡沉淀和氯化钠,Ba(OH)2溶液与H2SO4溶液反应生成硫酸钡沉淀和水,水不能拆,因此不能用同一离子方程式表示;
C项,Na2CO3能拆为碳酸根离子,而BaCO3不能拆,因此不能用同一离子方程式表示;
D项,石灰石与稀硝酸反应和石灰石与稀盐酸反应的离子方程式都是CaCO3+2H+===Ca2++CO2↑+H2O。
4.写出与下列离子反应相对应的一个化学方程式。
(1)Cu 2++2OH-=== Cu(OH)2↓
(2)2H++ ===CO2↑+H2O
(3)Cu 2++Fe===Cu+Fe2+
随堂演练
1
2
3
4
答案 (答案不唯一,合理即正确)
(1)CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
(2)H2SO4+Na2CO3===Na2SO4+CO2↑+H2O
(3)CuSO4+Fe===Cu +FeSO4
第一章 第二节
第2课时 离子反应
1.通过实验事实认识离子反应,并掌握离子反应发生的条件。
2.掌握离子方程式的书写方法及正误判断。
核心素养
发展目标
离子反应及发生的条件
一
1.实验探究离子反应的实质
向盛有2 mL Na2SO4稀溶液的试管中加入2 mL BaCl2稀溶液。
实验现象 有白色沉淀生成
化学方程式 _________________________________
电离方程式 BaCl2 ____________________
Na2SO4 _____________________
混合前溶液中的离子 BaCl2 __________
Na2SO4 __________
Na2SO4+BaCl2===BaSO4↓+2NaCl
BaCl2===Ba2++2Cl-
Ba2+、Cl-
混合后溶液中的离子 离子数目减少, 离子数目不变
实验结论 两溶液混合, 都没有发生化学反应,______ 发生了化学反应,生成BaSO4白色沉淀
Na+、Cl-
Na+、Cl-
Ba2+
2.离子反应的概念
电解质在溶液中的反应实质上是 之间的反应,这样的反应属于离子反应。
离子
【思考】 下列溶液混合能否发生离子反应,能发生离子反应的说出参与反应的离子(微粒),不能发生离子反应的说出原因。
(1)氯化钠溶液与硝酸银溶液
(2)氢氧化钾溶液与硝酸溶液
(3)盐酸与碳酸钠溶液
提示 能,Ag+与Cl-反应生成AgCl沉淀。
提示 能,H+与OH-生成H2O。
(4)CH3COONa溶液与稀盐酸
(5)硝酸钠溶液与氯化钾溶液
(6)锌与CuSO4溶液
提示 能,CH3COO-与H+生成CH3COOH。
提示 不能,因为无沉淀、气体或难电离的物质生成。
提示 能,Zn与Cu2+发生置换反应。
3.离子反应的实质
(1)从微观角度,酸、碱、盐在水溶液中发生的复分解反应,实质上是两种电解质在溶液中 的反应。
(2)离子反应使溶液中某些离子的浓度 。
相互交换离子
减小
归纳总结
离子反应发生的条件
特别提醒 离子反应除了复分解型外,还有其他类型,如有离子参加的置换反应等,这些类型的离子反应发生条件与复分解型不同。
应用体验
1.(2022·广西南宁英华学校高一月考)下列物质中,不能发生离子反应的是
A.Na2SO4和CuCl2 B.Ba(NO3)2和Na2CO3
C.CO2和KOH D.CaCO3和HCl
√
Na2SO4和CuCl2不能结合生成沉淀、气体、水等,不能发生离子反应;Ba(NO3)2和Na2CO3反应生成碳酸钡沉淀;CO2和KOH反应生成碳酸钾和水;CaCO3和HCl反应生成氯化钙、水和二氧化碳。
应用体验
2.加入NaOH溶液后,下列溶液中的离子数目不会减少的是
A.Cu2+ B.Fe3+ C. D.H+
凡是能与OH-反应的离子,其数目均会减少,Cu2+、Fe3+、H+均可以与OH-反应;而 不与OH-反应,离子数目不会减少。
√
返回
离子方程式
二
1.离子方程式的概念
用实际参加反应的 符号来表示反应的式子。
2.离子方程式的书写步骤
以BaCl2溶液和Na2SO4溶液的反应为例:
(1)写:写出反应的化学方程式(必须根据实验事实):
。
(2)拆:把易溶于水、易电离的物质写成离子形式:
。
离子
BaCl2+Na2SO4===BaSO4↓+2NaCl
(3)删:删去方程式两边不参加反应的离子,并将方程式化为最简:
。
(4)查:检查离子方程式两边各元素的原子个数和电荷总数是否相等以及反应条件、沉淀符号、气体符号等。
3.离子方程式中的“拆”与“不拆”的原则
【思考1】 (1)书写离子方程式时,哪些类别的物质要拆分写成离子的形式?
提示 易溶于水且易电离的电解质要写成离子的形式:
①强酸,如HCl、H2SO4、HNO3、HBr、HI等;
②强碱,如KOH、NaOH、Ba(OH)2等;
③大部分可溶性盐,如钾盐、钠盐、铵盐、硝酸盐等。
(2)书写离子方程式时,哪些类别的物质要写成化学式?
提示 单质、气体、氧化物、难溶物质、难电离的物质(如水、弱酸、弱碱)等写成化学式。
特别提醒 ①盐的溶解性:钾、钠、铵盐水中溶;硝酸盐见水无影踪;盐酸盐不溶银(熟记AgCl不拆);硫酸盐不溶钡和铅(熟记BaSO4不拆);碳酸盐只溶钾、钠、铵;碱中只溶钾、钠、钡。
②对微溶物,如Ca(OH)2,如果反应物为澄清石灰水,应拆成Ca2+和OH-的形式,如果是生成物或是石灰乳等,则保留化学式Ca(OH)2。
③物质“拆分”原则:物质在离子方程式中“拆”与“不拆”,关键看该物质在溶液中的存在形式。如CaCO3难溶于水,在溶液中以CaCO3固体的形式存在,故CaCO3写成化学式。
4.离子方程式的意义
【思考2】 写出下列反应的化学方程式和离子方程式:
溶液中反应物 化学方程式 离子方程式
盐酸与氢氧化钠 ________________________ _________________
盐酸与氢氧化钾 ________________________ _________________
HCl+NaOH===NaCl+H2O
H++OH-===H2O
HCl+KOH===KCl+H2O
H++OH-===H2O
硫酸与氢氧化钠 _________________________ _________ _________________
强酸、强碱发生中和反应的实质 强酸电离出的H+和强碱电离出的OH-结合生成水
根据上表,分析说明离子方程式不仅可以表示 的化学反应,还可以表示 的离子反应。
H2SO4+2NaOH===Na2SO4
+2H2O
H++OH-===H2O
某个具体
同一类型
【思考3】 (1)H2SO4溶液与Ba(OH)2溶液反应的离子方程式:_____
;
NaHSO4溶液与KOH溶液反应的离子方程式: 。
(2)判断正误
①酸碱中和反应的离子方程式都是H++OH-===H2O
②H++OH-===H2O仅表示强酸与强碱的中和反应
2H++
H++OH-===H2O
×
×
应用体验
1.书写下列反应的离子方程式。
(1)氧化镁溶于稀盐酸:_________________________。
(2)用碳酸钙与稀盐酸反应制备二氧化碳:________________________
______________。
(3)向盐酸中滴加碳酸钠溶液:__________________________。
(4)NaHCO3溶液与HNO3溶液反应:_________________________。
(5)二氧化碳与澄清石灰水反应生成沉淀:________________________
_______________。
(6)铁与稀硫酸反应生成氢气:_______________________。
MgO+2H+===Mg2++H2O
CaCO3+2H+===Ca2++
CO2↑+H2O
Ca2++2OH-+CO2===
CaCO3↓+H2O
Fe+2H+===Fe2++H2↑
应用体验
2.离子方程式Ba2++ ===BaSO4↓可能表示
①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应
②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应
③稀硫酸与可溶性钡盐溶液之间的反应
④氢氧化钡溶液与稀硫酸的反应
A.①② B.①②④ C.②③ D.①②③
√
氢氧化钡溶液与稀硫酸反应的离子方程式为Ba2++2OH-+2H++
===BaSO4↓+2H2O,④不正确,①②③正确。
返回
随堂演练 知识落实
1
2
3
4
1.依据现有知识分析判断,下列选项中不满足离子反应发生条件的是
A.NaOH+KCl===NaCl+KOH
B.AgNO3+HCl===AgCl↓+HNO3
C.Na2CO3+Ca(OH)2===2NaOH+CaCO3↓
D.BaCO3+2HNO3===Ba(NO3)2+H2O+CO2↑
√
随堂演练
氢氧化钠和氯化钾不反应,因为无沉淀、气体或难电离的物质生成,故选A。
2.(2022·广东惠州高一上期末)下列离子方程式正确的是
A.用小苏打治疗胃酸过多: +2H+===CO2↑+H2O
B.氢氧化钡溶液与稀硫酸反应:Ba2++ ===BaSO4↓
C.铜片插入硝酸银溶液:Cu+Ag+===Cu2++Ag
D.稀盐酸与石灰石反应:CaCO3+2H+===Ca2++H2O+CO2↑
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
用小苏打治疗胃酸过多的离子方程式为 +H+===CO2↑+H2O,A错误;
氢氧化钡溶液与稀硫酸反应的离子方程式为Ba2++2OH-+2H++
===BaSO4↓+2H2O,B错误;
铜片插入硝酸银溶液中的离子方程式为Cu+2Ag+===Cu2++2Ag,C错误;
石灰石(碳酸钙)溶于稀盐酸的离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑,D正确。
3.(2022·湖南衡阳高一月考)下列各组中的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.氢氧化钠与盐酸;氢氧化钠与碳酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与稀硝酸;BaCO3溶液与稀硝酸
D.石灰石与稀硝酸;石灰石与稀盐酸
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
A项,HCl可拆成离子形式,而H2CO3是弱酸,不能拆成离子,因此不能用同一离子方程式表示;
B项,BaCl2溶液与Na2SO4溶液反应生成硫酸钡沉淀和氯化钠,Ba(OH)2溶液与H2SO4溶液反应生成硫酸钡沉淀和水,水不能拆,因此不能用同一离子方程式表示;
C项,Na2CO3能拆为碳酸根离子,而BaCO3不能拆,因此不能用同一离子方程式表示;
D项,石灰石与稀硝酸反应和石灰石与稀盐酸反应的离子方程式都是CaCO3+2H+===Ca2++CO2↑+H2O。
4.写出与下列离子反应相对应的一个化学方程式。
(1)Cu 2++2OH-=== Cu(OH)2↓
(2)2H++ ===CO2↑+H2O
(3)Cu 2++Fe===Cu+Fe2+
随堂演练
1
2
3
4
答案 (答案不唯一,合理即正确)
(1)CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
(2)H2SO4+Na2CO3===Na2SO4+CO2↑+H2O
(3)CuSO4+Fe===Cu +FeSO4
