6.1.4化学反应与能量变化复习课 课件(共24张PPT)-高一化学人教版必修第二册同步课件
文档属性
| 名称 | 6.1.4化学反应与能量变化复习课 课件(共24张PPT)-高一化学人教版必修第二册同步课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-05 11:39:21 | ||
图片预览








文档简介
(共24张PPT)
化学反应与能量变化复习课
第4课时
第一节 化学反应与能量变化
1.能根据化学键的相应数据,计算化学反应放出或吸收的能量。
2.理解化学反应中能量变化的图示。
3.能书写简单的电极反应式。
1.计算化学反应中放出或吸收的能量。
2.电极反应式的书写。
[学习目标]
[重点难点]
化学能与热能的相互转化
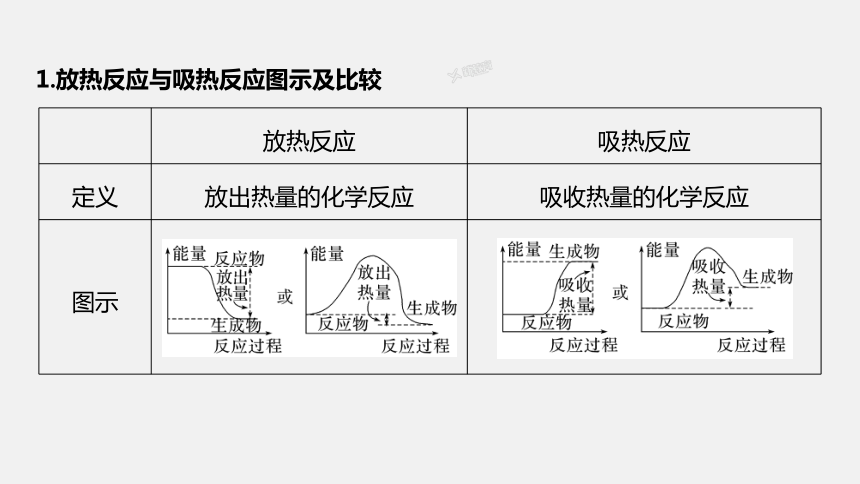
1.放热反应与吸热反应图示及比较
放热反应 吸热反应
定义 放出热量的化学反应 吸收热量的化学反应
图示
常见反 应类型 ①大多数化合反应;②所有的燃烧反应;③酸碱中和反应; ④金属与水、酸反应; ⑤物质的缓慢氧化 ①大多数分解反应;②盐酸与碳酸氢钠的反应;
③Ba(OH)2·8H2O与NH4Cl反应;
④C和CO2、C和H2O(g)反应
2.化学反应中的能量变化计算公式
(1)反应的能量变化=生成物能量之和-反应物能量之和。
(2)反应的能量变化=反应物断键吸收的能量之和-生成物成键放出的能量之和。
(2022·北京牛栏山一中高一阶段检测)下列反应既是氧化还原反应,又是吸热反应的是
A.铝片与稀H2SO4反应 B.Ca(OH)2与NH4Cl的反应
C.CO在O2中的燃烧反应 D.灼热的木炭与H2O(g)反应
练习1
√
铝片与稀H2SO4反应是放热的氧化还原反应,A不合题意;
Ca(OH)2与NH4Cl的反应是吸热的非氧化还原反应,B不合题意;
CO在O2中的燃烧反应是放热的氧化还原反应,C不合题意;
灼热的木炭与H2O(g)反应是吸热的氧化还原反应,D符合题意。
(2022·杭州四中高一期中)1868年狄青和洪特发现了用空气中的氧气来氧化氯化氢气体制取氯气的方法:4HCl(g)+O2(g)===2Cl2(g)+2H2O(g)。化学反应与能量变化如图所示。下列说法正确的是
练习2
A.该反应为吸热反应
B.若H2O为液态,则生成物总能量将变大
C.4HCl(g)和O2(g)总能量高于2Cl2(g)+2H2O(g)的总能量,反应时向环境释放
能量
D.断开旧化学键吸收的总能量大于形成新化学键所释放的总能量
√
图示可知,4HCl(g)+O2(g)的总能量高于2Cl2(g)+2H2O(g)的总能量,反应为放热反应,故A错误;
若H2O为液态,气体变为液体,物质能量减小,生成物总能量将变小,故B错误;
反应为放热反应,断开旧化学键吸收的总能量小于形成新化学键所释放的总能量,故D错误。
电极反应式的书写及正误判断
1.电极反应式的书写
(1)书写电极反应式的原则
电极反应式遵循质量守恒、得失电子守恒及电荷守恒。
(2)电极反应式的书写思路
特别提醒 给出原电池总反应式书写电极反应式时,可以先写出比较简单的某一电极的电极反应式,复杂的电极反应式=总反应式-较简单的电极反应式,利用此式计算时,须保证总式与分式中得失电子数相等。
2.电极反应式的正误判断
在选择题选项中出现电极反应式时,一般从以下方面判断其正误
(1)注意电子转移的方向与数目是否正确。如O2-4e-+2H2O===4OH-( × )
(2)注意电极反应式与正负极是否对应。如某电池正极反应式为Zn-2e-+2OH-===Zn(OH)2( × )
(3)注意电极反应式是否符合溶液的酸碱性。如碱性条件下:CH4-8e-+2H2O===CO2+8H+( × )
(4)注意电极产物与电解质溶液是否反应。如铅酸蓄电池负极:Pb-2e-===Pb2+( × )
银锌电池是一种常见的化学电源,其反应原理:Zn+Ag2O===ZnO+2Ag,其工作原理如图所示。
练习1
(1)在装置中Ag2O作_____(填“正”或“负”)极,发生______(填“还原”或“氧化”)反应,电极反应式为______________________________。
(2)在装置中Zn作_____(填“正”或“负”)极,发生______(填“还原”或“氧化”)反应,电极反应式为_____________________________。
正
还原
Ag2O+2e-+H2O===2Ag+2OH-
负
氧化
Zn-2e-+2OH-===ZnO+H2O
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
实验测得OH-定向移向A电极,则___(填“A”或“B”)电极入口通CH4,其电极反应式为___________
_____________________,另一电极的电极反应式为________________________,电池总反应式为_______
__________________________。
练习2
A
CH4-8e-+
2O2+8e-+4H2O===8OH-
CH4+
实验测得OH-定向移向A电极,则A电极为负极,B电极为正极,CH4燃料电池中,通入CH4的电极为负极,则A电极入口通CH4,在KOH溶液中,CH4在负极发生失电子的氧化反应生成 ,电极反应式为CH4-8e-+10OH-=== +7H2O,另一电极反应式为2O2+
8e-+4H2O===8OH-,二者相加得总反应:CH4+2OH-+2O2=== +3H2O。
1
2
3
自我测试
1.(2022·长沙高一检测)下列关于能量的叙述错误的是
A.如图可以表示NH4Cl固体和Ba(OH)2·8H2O反应的能
量变化图
B.化学反应过程中同时存在物质和能量的变化
C.高温分解石灰石是吸热反应
D.原电池是一种将化学能转化为电能的装置
4
√
1
2
3
自我测试
4
从图中可以看出,反应物的总能量高于生成物的总能量,该反应为放热反应,而NH4Cl固体和Ba(OH)2·8H2O的反应是吸热反应,故A错误;
化学反应过程中同时存在物质和能量的变化,故B正确;
大多数的分解反应是吸热反应,高温分解石灰石是吸热反应,故C正确;
原电池是一种将自发的氧化还原反应的化学能转化为电能的装置,故D正确。
自我测试
1
2
3
2.(2022·江苏沭阳县潼阳中学高一检测)某原电池的电池反应为Fe+2Fe3+===3Fe2+,与此电池反应不符合的原电池是
A.铜片、铁片、FeCl3溶液组成的原电池
B.石墨、铁片、Fe(NO3)3溶液组成的原电池
C.铁片、锌片、Fe2(SO4)3溶液组成的原电池
D.银片、铁片、FeCl3溶液组成的原电池
√
4
自我测试
1
2
3
铜片、铁片、FeCl3溶液组成的原电池,负极是铁,电池反应为Fe+2Fe3+===3Fe2+,A符合;
石墨、铁片、Fe(NO3)3溶液组成的原电池,负极是铁,电池反应为Fe+2Fe3+
===3Fe2+,B符合;
铁片、锌片、Fe2(SO4)3溶液组成的原电池,负极是锌,电池反应为Zn+2Fe3+
===2Fe2++Zn2+,C不符合;
银片、铁片、FeCl3溶液组成的原电池,负极是铁,电池反应为Fe+2Fe3+===3Fe2+,D符合。
4
自我测试
1
2
3
3.(2022·河北衡水高一期中)热激活电池常用作火箭的工作电源,某种热激活电池以Ca和PbSO4为电极材料,以无水LiCl-KCl为电解质,电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。当电解质受热熔融后,电池即可瞬间放电。下列有关说法不正确的是
A.PbSO4电极发生还原反应
B.负极的电极反应式为Ca-2e-===Ca2+
C.放电时,K+向负极移动
D.每转移1 mol电子,正极质量减少48 g
4
√
自我测试
1
2
3
4
PbSO4为原电池正极,正极发生还原反应,A项正确;
负极发生氧化反应,电极反应为Ca-2e-===Ca2+,B项正确;
放电时K+移向正极,C项错误;
正极反应式为PbSO4+2e-===Pb+ ,每转移1 mol电子,正极消耗0.5 mol PbSO4,产生0.5 mol Pb,故正极减少的质量为0.5 mol×96 g·mol-1=48 g,D项正确。
自我测试
1
2
3
4.根据原电池工作原理,结合装置图,按要求解答问题:
(1)若X为Mg,Y为Al,Z为氢氧化钠溶液,则X为_____(填电极名称),Y电极可能观察到的现象是_______________,电池总反应式为_____________________________________。
4
正极
铝电极逐渐溶解
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
Mg-Al-NaOH溶液电池,虽然Mg更活泼,但Mg与NaOH溶液不反应,而Al与NaOH溶液反应:2Al+2OH-+2H2O===2 +3H2↑,所以Al作负极。
自我测试
1
2
3
(2)若X为Fe,Y为Cu,Z为浓硝酸,则Cu为______(填电极名称),铜电极区域可能观察到的现象是__________________________,电极反应式为_________________。
4
Fe-Cu-浓HNO3电池,由于常温下Fe遇浓HNO3钝化,故Cu作负极。
负极
铜电极逐渐溶解,溶液变蓝
Cu-2e-===Cu2+
化学反应与能量变化复习课
第4课时
第一节 化学反应与能量变化
1.能根据化学键的相应数据,计算化学反应放出或吸收的能量。
2.理解化学反应中能量变化的图示。
3.能书写简单的电极反应式。
1.计算化学反应中放出或吸收的能量。
2.电极反应式的书写。
[学习目标]
[重点难点]
化学能与热能的相互转化
1.放热反应与吸热反应图示及比较
放热反应 吸热反应
定义 放出热量的化学反应 吸收热量的化学反应
图示
常见反 应类型 ①大多数化合反应;②所有的燃烧反应;③酸碱中和反应; ④金属与水、酸反应; ⑤物质的缓慢氧化 ①大多数分解反应;②盐酸与碳酸氢钠的反应;
③Ba(OH)2·8H2O与NH4Cl反应;
④C和CO2、C和H2O(g)反应
2.化学反应中的能量变化计算公式
(1)反应的能量变化=生成物能量之和-反应物能量之和。
(2)反应的能量变化=反应物断键吸收的能量之和-生成物成键放出的能量之和。
(2022·北京牛栏山一中高一阶段检测)下列反应既是氧化还原反应,又是吸热反应的是
A.铝片与稀H2SO4反应 B.Ca(OH)2与NH4Cl的反应
C.CO在O2中的燃烧反应 D.灼热的木炭与H2O(g)反应
练习1
√
铝片与稀H2SO4反应是放热的氧化还原反应,A不合题意;
Ca(OH)2与NH4Cl的反应是吸热的非氧化还原反应,B不合题意;
CO在O2中的燃烧反应是放热的氧化还原反应,C不合题意;
灼热的木炭与H2O(g)反应是吸热的氧化还原反应,D符合题意。
(2022·杭州四中高一期中)1868年狄青和洪特发现了用空气中的氧气来氧化氯化氢气体制取氯气的方法:4HCl(g)+O2(g)===2Cl2(g)+2H2O(g)。化学反应与能量变化如图所示。下列说法正确的是
练习2
A.该反应为吸热反应
B.若H2O为液态,则生成物总能量将变大
C.4HCl(g)和O2(g)总能量高于2Cl2(g)+2H2O(g)的总能量,反应时向环境释放
能量
D.断开旧化学键吸收的总能量大于形成新化学键所释放的总能量
√
图示可知,4HCl(g)+O2(g)的总能量高于2Cl2(g)+2H2O(g)的总能量,反应为放热反应,故A错误;
若H2O为液态,气体变为液体,物质能量减小,生成物总能量将变小,故B错误;
反应为放热反应,断开旧化学键吸收的总能量小于形成新化学键所释放的总能量,故D错误。
电极反应式的书写及正误判断
1.电极反应式的书写
(1)书写电极反应式的原则
电极反应式遵循质量守恒、得失电子守恒及电荷守恒。
(2)电极反应式的书写思路
特别提醒 给出原电池总反应式书写电极反应式时,可以先写出比较简单的某一电极的电极反应式,复杂的电极反应式=总反应式-较简单的电极反应式,利用此式计算时,须保证总式与分式中得失电子数相等。
2.电极反应式的正误判断
在选择题选项中出现电极反应式时,一般从以下方面判断其正误
(1)注意电子转移的方向与数目是否正确。如O2-4e-+2H2O===4OH-( × )
(2)注意电极反应式与正负极是否对应。如某电池正极反应式为Zn-2e-+2OH-===Zn(OH)2( × )
(3)注意电极反应式是否符合溶液的酸碱性。如碱性条件下:CH4-8e-+2H2O===CO2+8H+( × )
(4)注意电极产物与电解质溶液是否反应。如铅酸蓄电池负极:Pb-2e-===Pb2+( × )
银锌电池是一种常见的化学电源,其反应原理:Zn+Ag2O===ZnO+2Ag,其工作原理如图所示。
练习1
(1)在装置中Ag2O作_____(填“正”或“负”)极,发生______(填“还原”或“氧化”)反应,电极反应式为______________________________。
(2)在装置中Zn作_____(填“正”或“负”)极,发生______(填“还原”或“氧化”)反应,电极反应式为_____________________________。
正
还原
Ag2O+2e-+H2O===2Ag+2OH-
负
氧化
Zn-2e-+2OH-===ZnO+H2O
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
实验测得OH-定向移向A电极,则___(填“A”或“B”)电极入口通CH4,其电极反应式为___________
_____________________,另一电极的电极反应式为________________________,电池总反应式为_______
__________________________。
练习2
A
CH4-8e-+
2O2+8e-+4H2O===8OH-
CH4+
实验测得OH-定向移向A电极,则A电极为负极,B电极为正极,CH4燃料电池中,通入CH4的电极为负极,则A电极入口通CH4,在KOH溶液中,CH4在负极发生失电子的氧化反应生成 ,电极反应式为CH4-8e-+10OH-=== +7H2O,另一电极反应式为2O2+
8e-+4H2O===8OH-,二者相加得总反应:CH4+2OH-+2O2=== +3H2O。
1
2
3
自我测试
1.(2022·长沙高一检测)下列关于能量的叙述错误的是
A.如图可以表示NH4Cl固体和Ba(OH)2·8H2O反应的能
量变化图
B.化学反应过程中同时存在物质和能量的变化
C.高温分解石灰石是吸热反应
D.原电池是一种将化学能转化为电能的装置
4
√
1
2
3
自我测试
4
从图中可以看出,反应物的总能量高于生成物的总能量,该反应为放热反应,而NH4Cl固体和Ba(OH)2·8H2O的反应是吸热反应,故A错误;
化学反应过程中同时存在物质和能量的变化,故B正确;
大多数的分解反应是吸热反应,高温分解石灰石是吸热反应,故C正确;
原电池是一种将自发的氧化还原反应的化学能转化为电能的装置,故D正确。
自我测试
1
2
3
2.(2022·江苏沭阳县潼阳中学高一检测)某原电池的电池反应为Fe+2Fe3+===3Fe2+,与此电池反应不符合的原电池是
A.铜片、铁片、FeCl3溶液组成的原电池
B.石墨、铁片、Fe(NO3)3溶液组成的原电池
C.铁片、锌片、Fe2(SO4)3溶液组成的原电池
D.银片、铁片、FeCl3溶液组成的原电池
√
4
自我测试
1
2
3
铜片、铁片、FeCl3溶液组成的原电池,负极是铁,电池反应为Fe+2Fe3+===3Fe2+,A符合;
石墨、铁片、Fe(NO3)3溶液组成的原电池,负极是铁,电池反应为Fe+2Fe3+
===3Fe2+,B符合;
铁片、锌片、Fe2(SO4)3溶液组成的原电池,负极是锌,电池反应为Zn+2Fe3+
===2Fe2++Zn2+,C不符合;
银片、铁片、FeCl3溶液组成的原电池,负极是铁,电池反应为Fe+2Fe3+===3Fe2+,D符合。
4
自我测试
1
2
3
3.(2022·河北衡水高一期中)热激活电池常用作火箭的工作电源,某种热激活电池以Ca和PbSO4为电极材料,以无水LiCl-KCl为电解质,电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。当电解质受热熔融后,电池即可瞬间放电。下列有关说法不正确的是
A.PbSO4电极发生还原反应
B.负极的电极反应式为Ca-2e-===Ca2+
C.放电时,K+向负极移动
D.每转移1 mol电子,正极质量减少48 g
4
√
自我测试
1
2
3
4
PbSO4为原电池正极,正极发生还原反应,A项正确;
负极发生氧化反应,电极反应为Ca-2e-===Ca2+,B项正确;
放电时K+移向正极,C项错误;
正极反应式为PbSO4+2e-===Pb+ ,每转移1 mol电子,正极消耗0.5 mol PbSO4,产生0.5 mol Pb,故正极减少的质量为0.5 mol×96 g·mol-1=48 g,D项正确。
自我测试
1
2
3
4.根据原电池工作原理,结合装置图,按要求解答问题:
(1)若X为Mg,Y为Al,Z为氢氧化钠溶液,则X为_____(填电极名称),Y电极可能观察到的现象是_______________,电池总反应式为_____________________________________。
4
正极
铝电极逐渐溶解
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
Mg-Al-NaOH溶液电池,虽然Mg更活泼,但Mg与NaOH溶液不反应,而Al与NaOH溶液反应:2Al+2OH-+2H2O===2 +3H2↑,所以Al作负极。
自我测试
1
2
3
(2)若X为Fe,Y为Cu,Z为浓硝酸,则Cu为______(填电极名称),铜电极区域可能观察到的现象是__________________________,电极反应式为_________________。
4
Fe-Cu-浓HNO3电池,由于常温下Fe遇浓HNO3钝化,故Cu作负极。
负极
铜电极逐渐溶解,溶液变蓝
Cu-2e-===Cu2+
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
