5.2.2氨和铵盐 课件(共25张PPT)
文档属性
| 名称 | 5.2.2氨和铵盐 课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 49.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-05 11:44:41 | ||
图片预览







文档简介
(共25张PPT)
第二节 氮及其化合物
氨和铵盐
第2课时
1.掌握NH3的性质。
2.掌握铵盐的性质及 的检验方法。
1.NH3的性质、 的检验、铵盐的性质。
2.喷泉实验的原理及拓展应用。
[学习目标]
[重点难点]
台州市一家电瓶车配件厂发生液氨泄漏事件。在距离事发点100多米的范围内充斥着氨的刺激性气味,人的眼睛很难睁开。消防战士边用水枪对现场进行稀释,边查找泄漏点,找到了泄露的那个氨气瓶,并很快关掉漏气阀门。为防止泄漏出来的氨给人们带来危害,消防战士紧接着又用水枪对泄漏现场进行了稀释处理。经过长达2个多小时的紧急救援,现场氨的浓度降至了安全范围,险情成功得以排除。
情 景 引 入
目标一 氨的性质
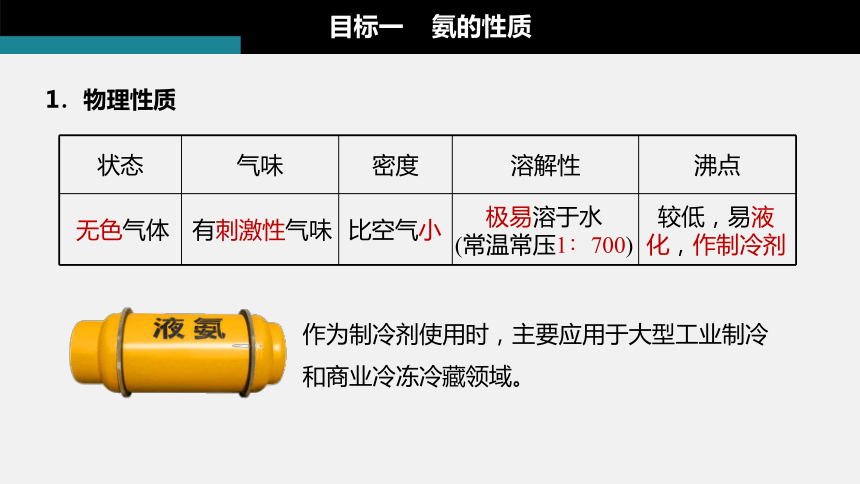
1.物理性质
状态 气味 密度 溶解性 沸点
无色气体
比空气小
极易溶于水
(常温常压1∶700)
较低,易液
化,作制冷剂
有刺激性气味
作为制冷剂使用时,主要应用于大型工业制冷和商业冷冻冷藏领域。
2.化学性质
(1)实验探究
实验装置 操作及现象 结论
①打开弹簧夹,并挤压胶头滴管 ②烧杯中的溶液由玻璃管进入烧瓶,形成喷泉,瓶内液体呈红色
将分别蘸有浓盐酸和浓氨水的玻璃棒靠近,产生白烟
氨极易溶于水,其水溶液(俗称氨水)呈碱性
氨与氯化氢均易挥发,反应生成白色晶体
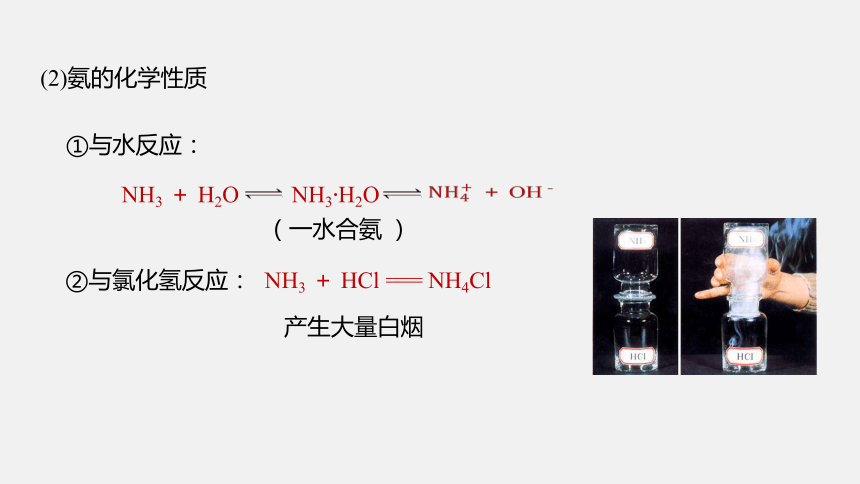
①与水反应:
(一水合氨 )
产生大量白烟
NH3 + HCl === NH4Cl
②与氯化氢反应:
(2)氨的化学性质
NH3 + H2O NH3·H2O
+ OH﹣
NH3表现还原性
4NH3+5O2 ==== 4NO+6H2O
催化剂
△
化合价升高,失5e-×4,氧化反应
化合价降低,得2e-×10,还原反应
现象:把烧红了的铂丝插入盛浓氨水的锥形瓶中(不接触溶液),观察到悬在液面上的铂丝更加红亮,同时有红棕色气体生成,并有白色烟雾产生。
③催化氧化
3CuO+2NH 3 3Cu+N2+3H2O
2NH3+3Cl2 === N2+6HCl(少量NH3)
8NH3+3Cl2 === N2+6NH4Cl (过量NH3)
铂丝
浓氨水
玻璃棒
空气
氨水呈弱碱性且不稳定,加热时易分解。
NH3 · H2O === NH3 ↑ + H2O
△
(3)氨水
(1)某同学做氨气溶于水的喷泉实验时,打开弹簧夹后将胶头滴管内的水挤入烧瓶内,并未产生喷泉,试分析实验失败可能的原因。
思考
提示 ①装置气密性不好;②收集的NH3纯度较低;③烧瓶不干燥等。
(2)哪些气体与吸收剂也能形成喷泉实验?
提示
气体 HCl NH3 CO2、Cl2、SO2、H2S、NO2 NO2与O2
吸收剂 水或NaOH溶液 水或盐酸 NaOH溶液 水
液氨、氨水、一水合氨的区别
名称 液氨 氨水 一水合氨
物质 类别 纯净物、氢化物、非电解质 氨的水溶液、混合物、溶质为NH3 一元弱碱、纯净物、电解质
粒子 种类 NH3 NH3·H2O、NH3、H2O 、、OH-、H+ NH3·H2O
主要性质
还原性
具有碱的通性
判断正误
(1)液氨可用作制冷剂,是因为其汽化时吸收大量的热( )
(2)1 mol·L-1的氨水中c(NH3·H2O)为1 mol·L-1 ( )
(3)氨水可以导电,所以NH3为电解质( )
(4)浓氨水与所有酸反应均有白烟产生( )
(5)氨中氮元素的化合价为-3价,在反应中只能升高而具有还原性( )
√
练习1
×
×
×
√
练习2
氨是一种重要的工业原料,工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气,下列说法错误的是
A.若管道漏气,遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应
D.生成1 mol N2时有6 mol 电子转移
√
氧化还原反应不可能为复分解反应
NH3+HCl === NH4Cl (白烟)
Cl:0价→﹣1价,Cl2作氧化剂
N:﹣3价→0价
喷泉是一种常见的自然现象,其产生的原因是存在压强差。
练习3
(1)如果只提供如图2的装置(气体为氨,液体为水),请说明引发喷泉的方法:
________________________________________________________________。
打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中冒出,移去热毛巾
(2)某同学用图1所示装置,在圆底烧瓶中盛放不同的气体进行喷泉实验。
请帮助分析实验后圆底烧瓶中所得溶液的浓度(假设是在标准状况下完成实验,且溶质不扩散)。
①若用HCl气体,则c(HCl)=________________。
设圆底烧瓶的容积为V L,则n(HCl)= mol。
溶液体积为V L,c(HCl)== mol·L-1。
形成喷泉后,溶液充满烧瓶。
②若用NO2气体,则c(HNO3)=___________________。
硫酸铵【(NH4)2SO4 ,俗称硫铵,又称肥粉】
氯化铵【NH4Cl,俗称氯铵】
硝酸铵【NH4NO3,俗称硝铵、炸药】
碳酸氢铵【NH4HCO3,俗称碳铵】
尿素【CO(NH2)2】
常见铵盐:
氯化铵
硫酸铵
硫酸铵
碳酸氢铵
尿素
目标二 铵盐的性质、的检验
实验操作 实验现象 结论
加热氯化铵固体
加热碳酸氢铵固体
①试管中固体逐渐消失;
②试管口有白色固体生成
氯化铵固体受热分解,生成的NH3和HCl在试管口反应生成NH4Cl
①固体逐渐消失;
②试管口有水珠生成;
③石灰水变浑浊
碳酸氢铵固体受热分解生成H2O、CO2和NH3
NH4HCO3 NH3↑+ H2O + CO2 ↑
NH4Cl NH3↑+HCl ↑
2NH4NO3======== 2N2↑+O2↑+4H2O
或高温
猛烈撞击
(可用作炸药)
铵盐在农业上常用作化肥,绝大多数铵盐易溶于水
(1)不稳定性
并不是所有铵盐受热都生成NH3
2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑ + 2H2O
(2)与碱反应
1.铵盐
NH4NO3 N2O↑ +2H2O
(1)实验探究
2.的检验
实验操作
三支试管中分别盛有少量NH4Cl溶液、NH4NO3溶液和(NH4)2SO4溶液
实验现象
实验原理
应用
三支试管中均有无色气体放出,均使湿润的红色石蕊试纸变蓝色
检验的存在和制取氨
+OH- === NH3 ↑ + H2O
△
(2)铵盐()的检验流程
未知溶液
气 体
试纸变蓝
说明原溶液中含有
浓氢氧化
钠并加热
湿润的红色石蕊试纸
说明有碱性气体氨气产生
取少许样品于试管中,放入碱后加热,用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明样品中含有 。
特别提醒
判断正误
(1)绝大多数铵盐易溶于水,可作氮肥,贮存时要密封包装且放于阴凉处( )
(2)铵盐都不稳定,受热分解都生成NH3( )
(3)向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶液中一定无 ( )
(4)NH4Cl受热易分解,所以可用加热的方法分离NH4Cl和NaCl( )
(5)NH4HCO3与足量NaOH溶液共热时,发生反应的离子方程式为+OH-
NH3↑+H2O( )
√
练习1
×
×
√
×
练习2
下列说法正确的是
A.铵盐都能与碱反应,不能与酸反应
B.所有铵盐都易溶于水,所有铵盐中的N均呈-3价
C.NH4Cl溶液中加入NaOH浓溶液共热时反应的离子方程式为+OH-===
NH3↑+H2O
D.可以用NaOH溶液鉴别Na2SO4、NH4NO3、KCl、(NH4)2SO4四种溶液
√
Ba(OH)2
白色沉淀
刺激性气味的气体
白色沉淀+刺激性气味的气体
课 堂 小 结
刺激性气味、易液化、极易溶于水
物理
性质
还原性
溶于水得氨水
与酸的反应
喷泉实验
氨的性质
易溶于水
铵盐的
性质
受热易分解
与碱共热生成氨气
检验铵根离子
化学性质
第二节 氮及其化合物
氨和铵盐
第2课时
1.掌握NH3的性质。
2.掌握铵盐的性质及 的检验方法。
1.NH3的性质、 的检验、铵盐的性质。
2.喷泉实验的原理及拓展应用。
[学习目标]
[重点难点]
台州市一家电瓶车配件厂发生液氨泄漏事件。在距离事发点100多米的范围内充斥着氨的刺激性气味,人的眼睛很难睁开。消防战士边用水枪对现场进行稀释,边查找泄漏点,找到了泄露的那个氨气瓶,并很快关掉漏气阀门。为防止泄漏出来的氨给人们带来危害,消防战士紧接着又用水枪对泄漏现场进行了稀释处理。经过长达2个多小时的紧急救援,现场氨的浓度降至了安全范围,险情成功得以排除。
情 景 引 入
目标一 氨的性质
1.物理性质
状态 气味 密度 溶解性 沸点
无色气体
比空气小
极易溶于水
(常温常压1∶700)
较低,易液
化,作制冷剂
有刺激性气味
作为制冷剂使用时,主要应用于大型工业制冷和商业冷冻冷藏领域。
2.化学性质
(1)实验探究
实验装置 操作及现象 结论
①打开弹簧夹,并挤压胶头滴管 ②烧杯中的溶液由玻璃管进入烧瓶,形成喷泉,瓶内液体呈红色
将分别蘸有浓盐酸和浓氨水的玻璃棒靠近,产生白烟
氨极易溶于水,其水溶液(俗称氨水)呈碱性
氨与氯化氢均易挥发,反应生成白色晶体
①与水反应:
(一水合氨 )
产生大量白烟
NH3 + HCl === NH4Cl
②与氯化氢反应:
(2)氨的化学性质
NH3 + H2O NH3·H2O
+ OH﹣
NH3表现还原性
4NH3+5O2 ==== 4NO+6H2O
催化剂
△
化合价升高,失5e-×4,氧化反应
化合价降低,得2e-×10,还原反应
现象:把烧红了的铂丝插入盛浓氨水的锥形瓶中(不接触溶液),观察到悬在液面上的铂丝更加红亮,同时有红棕色气体生成,并有白色烟雾产生。
③催化氧化
3CuO+2NH 3 3Cu+N2+3H2O
2NH3+3Cl2 === N2+6HCl(少量NH3)
8NH3+3Cl2 === N2+6NH4Cl (过量NH3)
铂丝
浓氨水
玻璃棒
空气
氨水呈弱碱性且不稳定,加热时易分解。
NH3 · H2O === NH3 ↑ + H2O
△
(3)氨水
(1)某同学做氨气溶于水的喷泉实验时,打开弹簧夹后将胶头滴管内的水挤入烧瓶内,并未产生喷泉,试分析实验失败可能的原因。
思考
提示 ①装置气密性不好;②收集的NH3纯度较低;③烧瓶不干燥等。
(2)哪些气体与吸收剂也能形成喷泉实验?
提示
气体 HCl NH3 CO2、Cl2、SO2、H2S、NO2 NO2与O2
吸收剂 水或NaOH溶液 水或盐酸 NaOH溶液 水
液氨、氨水、一水合氨的区别
名称 液氨 氨水 一水合氨
物质 类别 纯净物、氢化物、非电解质 氨的水溶液、混合物、溶质为NH3 一元弱碱、纯净物、电解质
粒子 种类 NH3 NH3·H2O、NH3、H2O 、、OH-、H+ NH3·H2O
主要性质
还原性
具有碱的通性
判断正误
(1)液氨可用作制冷剂,是因为其汽化时吸收大量的热( )
(2)1 mol·L-1的氨水中c(NH3·H2O)为1 mol·L-1 ( )
(3)氨水可以导电,所以NH3为电解质( )
(4)浓氨水与所有酸反应均有白烟产生( )
(5)氨中氮元素的化合价为-3价,在反应中只能升高而具有还原性( )
√
练习1
×
×
×
√
练习2
氨是一种重要的工业原料,工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气,下列说法错误的是
A.若管道漏气,遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应
D.生成1 mol N2时有6 mol 电子转移
√
氧化还原反应不可能为复分解反应
NH3+HCl === NH4Cl (白烟)
Cl:0价→﹣1价,Cl2作氧化剂
N:﹣3价→0价
喷泉是一种常见的自然现象,其产生的原因是存在压强差。
练习3
(1)如果只提供如图2的装置(气体为氨,液体为水),请说明引发喷泉的方法:
________________________________________________________________。
打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中冒出,移去热毛巾
(2)某同学用图1所示装置,在圆底烧瓶中盛放不同的气体进行喷泉实验。
请帮助分析实验后圆底烧瓶中所得溶液的浓度(假设是在标准状况下完成实验,且溶质不扩散)。
①若用HCl气体,则c(HCl)=________________。
设圆底烧瓶的容积为V L,则n(HCl)= mol。
溶液体积为V L,c(HCl)== mol·L-1。
形成喷泉后,溶液充满烧瓶。
②若用NO2气体,则c(HNO3)=___________________。
硫酸铵【(NH4)2SO4 ,俗称硫铵,又称肥粉】
氯化铵【NH4Cl,俗称氯铵】
硝酸铵【NH4NO3,俗称硝铵、炸药】
碳酸氢铵【NH4HCO3,俗称碳铵】
尿素【CO(NH2)2】
常见铵盐:
氯化铵
硫酸铵
硫酸铵
碳酸氢铵
尿素
目标二 铵盐的性质、的检验
实验操作 实验现象 结论
加热氯化铵固体
加热碳酸氢铵固体
①试管中固体逐渐消失;
②试管口有白色固体生成
氯化铵固体受热分解,生成的NH3和HCl在试管口反应生成NH4Cl
①固体逐渐消失;
②试管口有水珠生成;
③石灰水变浑浊
碳酸氢铵固体受热分解生成H2O、CO2和NH3
NH4HCO3 NH3↑+ H2O + CO2 ↑
NH4Cl NH3↑+HCl ↑
2NH4NO3======== 2N2↑+O2↑+4H2O
或高温
猛烈撞击
(可用作炸药)
铵盐在农业上常用作化肥,绝大多数铵盐易溶于水
(1)不稳定性
并不是所有铵盐受热都生成NH3
2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑ + 2H2O
(2)与碱反应
1.铵盐
NH4NO3 N2O↑ +2H2O
(1)实验探究
2.的检验
实验操作
三支试管中分别盛有少量NH4Cl溶液、NH4NO3溶液和(NH4)2SO4溶液
实验现象
实验原理
应用
三支试管中均有无色气体放出,均使湿润的红色石蕊试纸变蓝色
检验的存在和制取氨
+OH- === NH3 ↑ + H2O
△
(2)铵盐()的检验流程
未知溶液
气 体
试纸变蓝
说明原溶液中含有
浓氢氧化
钠并加热
湿润的红色石蕊试纸
说明有碱性气体氨气产生
取少许样品于试管中,放入碱后加热,用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明样品中含有 。
特别提醒
判断正误
(1)绝大多数铵盐易溶于水,可作氮肥,贮存时要密封包装且放于阴凉处( )
(2)铵盐都不稳定,受热分解都生成NH3( )
(3)向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶液中一定无 ( )
(4)NH4Cl受热易分解,所以可用加热的方法分离NH4Cl和NaCl( )
(5)NH4HCO3与足量NaOH溶液共热时,发生反应的离子方程式为+OH-
NH3↑+H2O( )
√
练习1
×
×
√
×
练习2
下列说法正确的是
A.铵盐都能与碱反应,不能与酸反应
B.所有铵盐都易溶于水,所有铵盐中的N均呈-3价
C.NH4Cl溶液中加入NaOH浓溶液共热时反应的离子方程式为+OH-===
NH3↑+H2O
D.可以用NaOH溶液鉴别Na2SO4、NH4NO3、KCl、(NH4)2SO4四种溶液
√
Ba(OH)2
白色沉淀
刺激性气味的气体
白色沉淀+刺激性气味的气体
课 堂 小 结
刺激性气味、易液化、极易溶于水
物理
性质
还原性
溶于水得氨水
与酸的反应
喷泉实验
氨的性质
易溶于水
铵盐的
性质
受热易分解
与碱共热生成氨气
检验铵根离子
化学性质
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
