5.2.1氮气和氮氧化物 课件(共28张PPT)-高一化学人教版必修第二册同步课件
文档属性
| 名称 | 5.2.1氮气和氮氧化物 课件(共28张PPT)-高一化学人教版必修第二册同步课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 83.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-05 11:48:18 | ||
图片预览








文档简介
(共28张PPT)
第二节 氮及其化合物
第1课时
氮气和氮氧化物
1.通过对氮元素“位—构—性”的分析,认识氮元素在自然界中的存在形式,
了解氮的固定的意义。
2.掌握N2的性质。
3.掌握NO、NO2的性质及二者相互转化。
1.NO、NO2的性质及相互转化。
2.NO、NO2与O2混合溶于水的相关计算。
[学习目标]
[重点难点]
“死亡谷”——青藏高原上的那棱格勒峡谷,每当牧民和牲畜进入后,风和日丽的晴天顷刻电闪雷鸣,狂风大作,人畜常遭雷击而倒毙。奇怪的是这里牧草茂盛,水草肥美,这是为什么呢?
情 景 引 入
第二周期,第ⅤA族
+7
2
5
既不容易得到 3 个电子,也不容易失去 5 个电子。
位置
结构
性质
目标一 氮气与氮的固定
(1)氮
1.氮元素
一般通过共用电子对与其他原子相互结合构成物质
大气中N2
NH3
尿素及动植物遗体
土壤中的微生物
氮素化肥
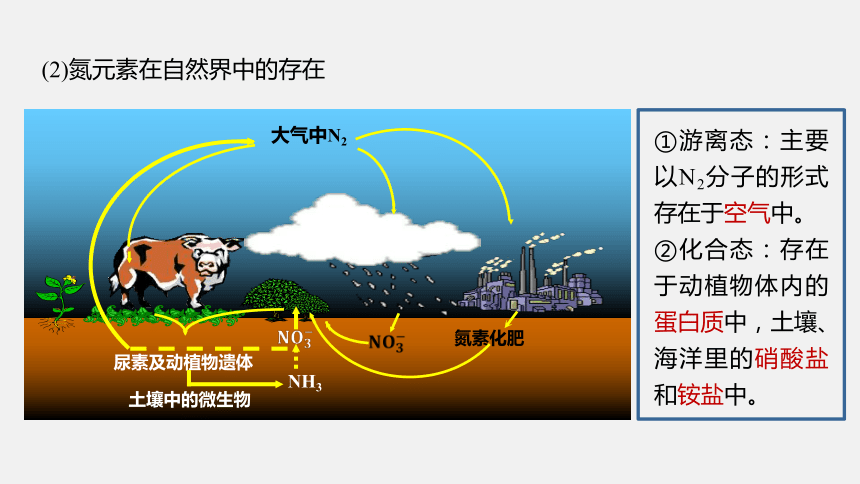
①游离态:主要以N2分子的形式存在于空气中。
②化合态:存在于动植物体内的蛋白质中,土壤、海洋里的硝酸盐和铵盐中。
(2)氮元素在自然界中的存在
颜色 气味 状态 密度 水溶解
无色
无味
难溶
气体
密度比空气稍小
液氮
2.氮气
思考1
根据氮原子核外电子排布和氮气分子的结构,推测氮气的化学活性。
断开氮氮三键需要较多的能量,化学性质比较稳定,通常情况下很难与其他物质发生化学反应。
N2
N
N
N
N
+7
2
5
氧化性
还原性
氧化性
纯净的氮化镁
含杂质的氮化镁
离子化合物
在高温、放电等条件下,氮气可以与镁、氢气、氧气等发生反应。
写出镁条在空气中燃烧发生反应的化学方程式。
思考2
氮的固定
概念:将大气中游离态的氮转化为氮的化合物的过程
分类
自然固氮
—
高能固氮
生物固氮(如豆科植物的根瘤菌固氮)
人工固氮
合成氨(工业上合成氨)
仿生固氮(某些金属有机化合物可起到根瘤菌的作用)
3.氮的固定
目标一 氮气与氮的固定
( N2+O2 ==== 2NO )
放电
哈伯
人 工 固 氮
合 成 氨
博施
合成氨是人类科学技术发展史上的一项重大成就。1909年,德国化学家哈伯经过反复的实验研究后发现,在500~600 ℃、17.5 MPa~20.0 MPa和锇为催化剂的条件下,反应后氨的含量可超过6%,具备了工业化生产的可能性。德国工程师博施为了把哈伯合成氨的实验室方法转化为规模化的工业生产也作出了重要贡献。
科 学 史 话
判断正误
(1)N2和O2在高温的条件下会生成NO( )
(2)N2中N元素价态为0价,处于中间价态,因此既有氧化性,又有还原性
( )
(3)氮气常用作焊接金属、填充灯泡、保存食品的保护气( )
(4)氮的固定中氮元素一定被氧化( )
(5)工业上将NH3转化为其他铵态化肥属于人工固氮( )
√
练习1
√
√
×
×
练习2
(2022·浙江高一检测)自然界中时刻存在着氮的转化。实现氮按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图:
下列叙述正确的是
A.N2→NH3,NH3→NO均属于氮
的固定
B.在催化剂a作用下,氮原子发生了氧化反应
C.N2很稳定,不支持任何物质的燃烧
D.使用催化剂a、b均可以提高单位时间内生成物的产量
√
N2→NH3,发生了还原反应
游离态的氮→氮的化合物
(1)氮的固定为将游离态的N2转化为化合态含氮物质的过程,为氧化还原反应。
(2)氮气性质的“一惰性两反应”。氮气化学性质很稳定,通常状况下,很难与其他物质反应,但是在一定条件下,
也能与氢气、氧气等反应。
(3)氮元素是多价态元素。氮气中氮
元素处于中间价态,故氮气既有氧
化性(与H2反应),又有还原性(与O2反应)。
特别提醒
目标二 一氧化氮和二氧化氮
氮的氧化物 N2O(笑气) NO N2O3 NO2 N2O4 N2O5
氮元素化合价 ____ ___ ____ ___ ____ ____
+1
+2
+3
+4
+4
+5
上述氮的氧化物中属于酸性氧化物的是 。
N2O5和N2O3
氮的氧化物都有毒,是大气污染物
1.NO和NO2的物理性质
颜色 状态 气味 水溶性
NO 无色 气态 无味 不溶
NO2 红棕色 气态 有刺激性气味 易溶
2.NO和NO2的化学性质
(1)实验探究
装置
操作 在一支50 mL的注射器里充入20 mL NO,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器 ①打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹
②振荡注射器
现象 __________ ①无色气体变为____
②_________________________
无明显现象
红棕色
红棕色气体逐渐变为无色,注射器活塞向左移动
(2)实验结论及解释
①NO不溶于水,也不与水反应,与O2反应生成红棕色的NO2:
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
②NO2能与水反应生成无色的NO:
如果要将注射器中的NO充分转化为硝酸,可以采取什么措施?上述实验对工业上生产硝酸有什么启示?
提示 采取的措施是继续通入过量的空气。上述实验对工业上生产硝酸的启示是在用水吸收NO2制取硝酸的反应过程中,要不断地补充空气,使NO2尽可能多地转化为硝酸。
思考1
若将充满 NO2 的试管倒置在装满水的水槽里,会有什么现象 若同时向倒置试管中不断地缓慢通入 O2 ,最终现象是什么
①3NO2+H2O===2HNO3+NO
②2NO+O2===2NO2
①×2+②得:
①×2+②×3得:
4NO2+O2+2H2O===4HNO3
4NO+3O2+2H2O===4HNO3
4∶1
4∶3
恰好完全被水吸收
3.NO、NO2溶于水的相关计算
思考2
若将充满 NO2 的试管倒置在装满水的水槽里,会有什么现象 若同时向倒置试管中不断地缓慢通入 O2 ,最终现象是什么
3.NO、NO2溶于水的相关计算
提示 若将充满NO2的试管倒置于水槽中,试管中的红棕色逐渐褪去,水槽里的水倒吸入试管中,最终试管里剩余气体占 若同时向倒置试管中通入O2,则水槽中的液体最终充满整个试管。
思考2
(2)对于连续发生的化学反应,可用化学方程式叠加的方法而得到复合反应,解决问题更简便。
(1) 无论是单一气体 ( NO2 ),还是 NO、NO2、O2 中的两者或三者的混合气体溶于水,若有气体剩余只能是 NO 或 O2 ,不可能是NO2。
归纳总结
4.氮氧化物对环境的污染
(1)NOx在紫外线作用下与碳氢化合物发生一系列光化学反应,产生光化学烟雾。
(2)NOx排入大气中后,与水反应生成HNO3和HNO2,随雨雪降到地面形成酸雨。
(3)破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
(4)NO与血红蛋白结合使人中毒。
目标二 一氧化氮和二氧化氮
判断正误
(1)由于NO极易与O2反应,并且其密度与空气相差不多,因此收集NO只能用排水法( )
(2)由于NO2极易与水反应且密度比空气大,因此收集NO2只能用向上排空气法 ( )
(3)NO2与H2O的反应中,NO2只做氧化剂( )
(4)NO和NO2都是有刺激性气味的有毒气体,它们都是大气污染物( )
√
练习1
√
×
×
练习2
4NO2+O2+2H2O===4HNO3、3NO2+H2O===2HNO3+NO
设原混合气体中O2的体积为V(O2),剩余气体可能是O2,也可能是NO。
现有NO2、O2的混合气体12 mL,通入足量水中,充分反应后剩余气体2 mL(同温同压下),则原混合气体中氧气的体积可能是_______________。
4 mL或1.2 mL
①若剩余O2,则V剩=V(O2)-[12 mL-V(O2)]=2 mL,解得V(O2)=4 mL。
②若剩余NO,则V剩=[12 mL-V(O2)-4V(O2)]=2 mL,解得V(O2)=1.2 mL。
课 堂 小 结
氮气
氮氧化物
氮气
氮的固定
氮的氧化物
(NO NO2)
自然界中氮的循环
氮气的性质
自然固氮
人工固氮
物理性质
化学性质
氮的氧化物溶于水的计算
第二节 氮及其化合物
第1课时
氮气和氮氧化物
1.通过对氮元素“位—构—性”的分析,认识氮元素在自然界中的存在形式,
了解氮的固定的意义。
2.掌握N2的性质。
3.掌握NO、NO2的性质及二者相互转化。
1.NO、NO2的性质及相互转化。
2.NO、NO2与O2混合溶于水的相关计算。
[学习目标]
[重点难点]
“死亡谷”——青藏高原上的那棱格勒峡谷,每当牧民和牲畜进入后,风和日丽的晴天顷刻电闪雷鸣,狂风大作,人畜常遭雷击而倒毙。奇怪的是这里牧草茂盛,水草肥美,这是为什么呢?
情 景 引 入
第二周期,第ⅤA族
+7
2
5
既不容易得到 3 个电子,也不容易失去 5 个电子。
位置
结构
性质
目标一 氮气与氮的固定
(1)氮
1.氮元素
一般通过共用电子对与其他原子相互结合构成物质
大气中N2
NH3
尿素及动植物遗体
土壤中的微生物
氮素化肥
①游离态:主要以N2分子的形式存在于空气中。
②化合态:存在于动植物体内的蛋白质中,土壤、海洋里的硝酸盐和铵盐中。
(2)氮元素在自然界中的存在
颜色 气味 状态 密度 水溶解
无色
无味
难溶
气体
密度比空气稍小
液氮
2.氮气
思考1
根据氮原子核外电子排布和氮气分子的结构,推测氮气的化学活性。
断开氮氮三键需要较多的能量,化学性质比较稳定,通常情况下很难与其他物质发生化学反应。
N2
N
N
N
N
+7
2
5
氧化性
还原性
氧化性
纯净的氮化镁
含杂质的氮化镁
离子化合物
在高温、放电等条件下,氮气可以与镁、氢气、氧气等发生反应。
写出镁条在空气中燃烧发生反应的化学方程式。
思考2
氮的固定
概念:将大气中游离态的氮转化为氮的化合物的过程
分类
自然固氮
—
高能固氮
生物固氮(如豆科植物的根瘤菌固氮)
人工固氮
合成氨(工业上合成氨)
仿生固氮(某些金属有机化合物可起到根瘤菌的作用)
3.氮的固定
目标一 氮气与氮的固定
( N2+O2 ==== 2NO )
放电
哈伯
人 工 固 氮
合 成 氨
博施
合成氨是人类科学技术发展史上的一项重大成就。1909年,德国化学家哈伯经过反复的实验研究后发现,在500~600 ℃、17.5 MPa~20.0 MPa和锇为催化剂的条件下,反应后氨的含量可超过6%,具备了工业化生产的可能性。德国工程师博施为了把哈伯合成氨的实验室方法转化为规模化的工业生产也作出了重要贡献。
科 学 史 话
判断正误
(1)N2和O2在高温的条件下会生成NO( )
(2)N2中N元素价态为0价,处于中间价态,因此既有氧化性,又有还原性
( )
(3)氮气常用作焊接金属、填充灯泡、保存食品的保护气( )
(4)氮的固定中氮元素一定被氧化( )
(5)工业上将NH3转化为其他铵态化肥属于人工固氮( )
√
练习1
√
√
×
×
练习2
(2022·浙江高一检测)自然界中时刻存在着氮的转化。实现氮按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图:
下列叙述正确的是
A.N2→NH3,NH3→NO均属于氮
的固定
B.在催化剂a作用下,氮原子发生了氧化反应
C.N2很稳定,不支持任何物质的燃烧
D.使用催化剂a、b均可以提高单位时间内生成物的产量
√
N2→NH3,发生了还原反应
游离态的氮→氮的化合物
(1)氮的固定为将游离态的N2转化为化合态含氮物质的过程,为氧化还原反应。
(2)氮气性质的“一惰性两反应”。氮气化学性质很稳定,通常状况下,很难与其他物质反应,但是在一定条件下,
也能与氢气、氧气等反应。
(3)氮元素是多价态元素。氮气中氮
元素处于中间价态,故氮气既有氧
化性(与H2反应),又有还原性(与O2反应)。
特别提醒
目标二 一氧化氮和二氧化氮
氮的氧化物 N2O(笑气) NO N2O3 NO2 N2O4 N2O5
氮元素化合价 ____ ___ ____ ___ ____ ____
+1
+2
+3
+4
+4
+5
上述氮的氧化物中属于酸性氧化物的是 。
N2O5和N2O3
氮的氧化物都有毒,是大气污染物
1.NO和NO2的物理性质
颜色 状态 气味 水溶性
NO 无色 气态 无味 不溶
NO2 红棕色 气态 有刺激性气味 易溶
2.NO和NO2的化学性质
(1)实验探究
装置
操作 在一支50 mL的注射器里充入20 mL NO,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器 ①打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹
②振荡注射器
现象 __________ ①无色气体变为____
②_________________________
无明显现象
红棕色
红棕色气体逐渐变为无色,注射器活塞向左移动
(2)实验结论及解释
①NO不溶于水,也不与水反应,与O2反应生成红棕色的NO2:
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
②NO2能与水反应生成无色的NO:
如果要将注射器中的NO充分转化为硝酸,可以采取什么措施?上述实验对工业上生产硝酸有什么启示?
提示 采取的措施是继续通入过量的空气。上述实验对工业上生产硝酸的启示是在用水吸收NO2制取硝酸的反应过程中,要不断地补充空气,使NO2尽可能多地转化为硝酸。
思考1
若将充满 NO2 的试管倒置在装满水的水槽里,会有什么现象 若同时向倒置试管中不断地缓慢通入 O2 ,最终现象是什么
①3NO2+H2O===2HNO3+NO
②2NO+O2===2NO2
①×2+②得:
①×2+②×3得:
4NO2+O2+2H2O===4HNO3
4NO+3O2+2H2O===4HNO3
4∶1
4∶3
恰好完全被水吸收
3.NO、NO2溶于水的相关计算
思考2
若将充满 NO2 的试管倒置在装满水的水槽里,会有什么现象 若同时向倒置试管中不断地缓慢通入 O2 ,最终现象是什么
3.NO、NO2溶于水的相关计算
提示 若将充满NO2的试管倒置于水槽中,试管中的红棕色逐渐褪去,水槽里的水倒吸入试管中,最终试管里剩余气体占 若同时向倒置试管中通入O2,则水槽中的液体最终充满整个试管。
思考2
(2)对于连续发生的化学反应,可用化学方程式叠加的方法而得到复合反应,解决问题更简便。
(1) 无论是单一气体 ( NO2 ),还是 NO、NO2、O2 中的两者或三者的混合气体溶于水,若有气体剩余只能是 NO 或 O2 ,不可能是NO2。
归纳总结
4.氮氧化物对环境的污染
(1)NOx在紫外线作用下与碳氢化合物发生一系列光化学反应,产生光化学烟雾。
(2)NOx排入大气中后,与水反应生成HNO3和HNO2,随雨雪降到地面形成酸雨。
(3)破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
(4)NO与血红蛋白结合使人中毒。
目标二 一氧化氮和二氧化氮
判断正误
(1)由于NO极易与O2反应,并且其密度与空气相差不多,因此收集NO只能用排水法( )
(2)由于NO2极易与水反应且密度比空气大,因此收集NO2只能用向上排空气法 ( )
(3)NO2与H2O的反应中,NO2只做氧化剂( )
(4)NO和NO2都是有刺激性气味的有毒气体,它们都是大气污染物( )
√
练习1
√
×
×
练习2
4NO2+O2+2H2O===4HNO3、3NO2+H2O===2HNO3+NO
设原混合气体中O2的体积为V(O2),剩余气体可能是O2,也可能是NO。
现有NO2、O2的混合气体12 mL,通入足量水中,充分反应后剩余气体2 mL(同温同压下),则原混合气体中氧气的体积可能是_______________。
4 mL或1.2 mL
①若剩余O2,则V剩=V(O2)-[12 mL-V(O2)]=2 mL,解得V(O2)=4 mL。
②若剩余NO,则V剩=[12 mL-V(O2)-4V(O2)]=2 mL,解得V(O2)=1.2 mL。
课 堂 小 结
氮气
氮氧化物
氮气
氮的固定
氮的氧化物
(NO NO2)
自然界中氮的循环
氮气的性质
自然固氮
人工固氮
物理性质
化学性质
氮的氧化物溶于水的计算
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
