7.3.1乙醇 课件(共25张PPT)-高一化学人教版必修第二册同步课件
文档属性
| 名称 | 7.3.1乙醇 课件(共25张PPT)-高一化学人教版必修第二册同步课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 34.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-05 11:50:42 | ||
图片预览





文档简介
(共25张PPT)
乙 醇
第1课时
第三节 乙醇与乙酸
1.认识乙醇的结构及其主要性质与应用,培养宏观辨识与微观探析能力。
2.理解烃的衍生物、官能团的概念,结合实例认识官能团与性质的关系,知道
有机物之间在一定条件下是可以转化的,培养变化观念与平衡思想。
1.乙醇的结构与化学性质的关系。
2.官能团的初步认识。
[学习目标]
[重点难点]
情景导入
中国古典传统诗词中关于酒的文化有很多很多,如
诗仙李白:
“花间一壶酒,独酌无相亲。举杯邀明月,对影成三人”
“劝君更尽一杯酒,西出阳关无故人”
诗圣杜甫:
“借问酒家何处有,牧童遥指杏花村”
今天,我们就一起来认识一下“酒”的结构和性质吧
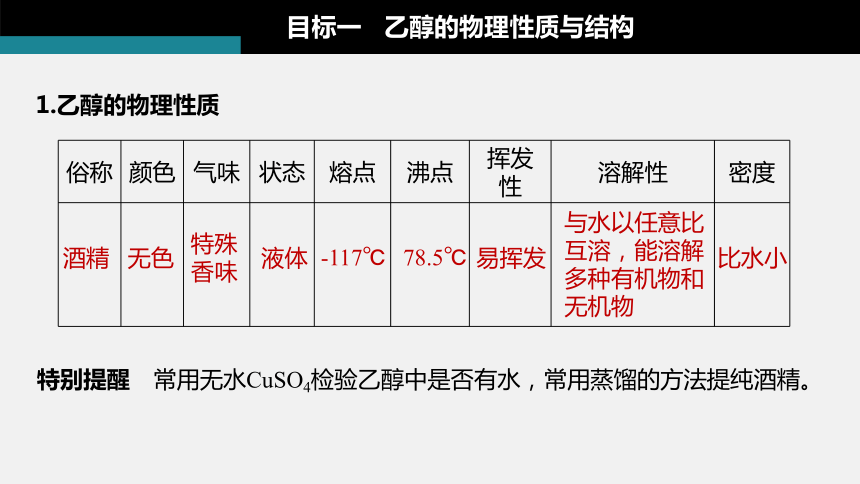
1.乙醇的物理性质
目标一 乙醇的物理性质与结构
俗称 颜色 气味 状态 熔点 沸点 挥发性 溶解性 密度
无色
特殊香味
液体
比水小
与水以任意比互溶,能溶解多种有机物和无机物
酒精
-117℃
78.5℃
易挥发
特别提醒 常用无水CuSO4检验乙醇中是否有水,常用蒸馏的方法提纯酒精。
从下列生活中对乙醇的描述和应用中,你能发现乙醇有哪些物理性质?
(1)病人发烧通常用酒精擦拭全身,用此法降温。
(2)用酒精可以去除衣服上沾有的少许汽油。
(3)酒香不怕巷子深。
(4)白酒的主要成分是乙醇和水。
思考1
(5)酒精灯用完后要盖上灯帽。
(6)用酒泡中药(药酒)——如泡枸杞。
易挥发
良好的有机溶剂
易挥发、有特殊香味
乙醇易溶于水
易挥发
良好的有机溶剂
分子式 结构式 结构简式 球棍模型
2.乙醇的结构
(1)乙醇的表达方式
C2H6O
CH3CH2OH或C2H5OH
羟基
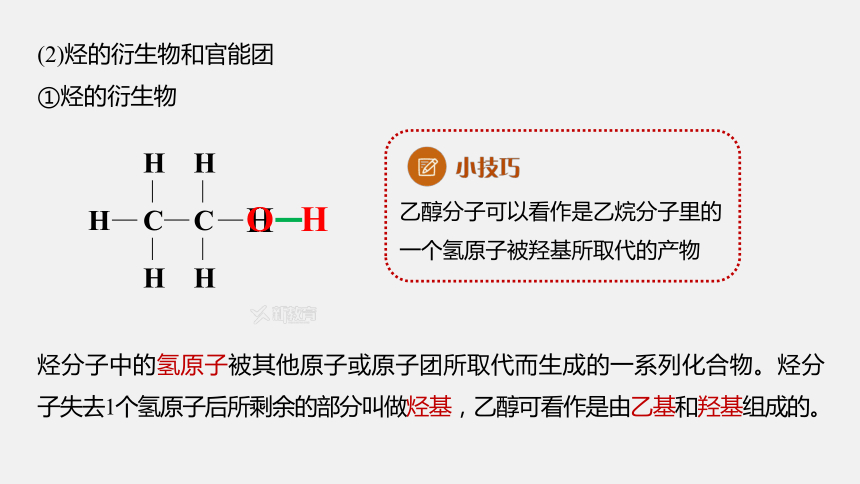
(2)烃的衍生物和官能团
①烃的衍生物
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。烃分子失去1个氢原子后所剩余的部分叫做烃基,乙醇可看作是由乙基和羟基组成的。
乙醇分子可以看作是乙烷分子里的一个氢原子被羟基所取代的产物
C
H
H
C
H
H
H
H
O H
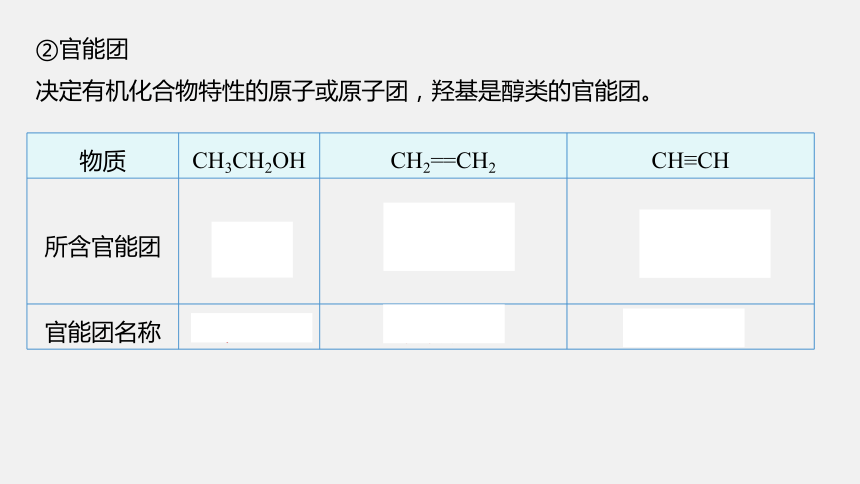
物质 CH3CH2OH CH2==CH2 CH≡CH
所含官能团 —OH —C≡C—
官能团名称 羟基 碳碳双键 碳碳三键
②官能团
决定有机化合物特性的原子或原子团,羟基是醇类的官能团。
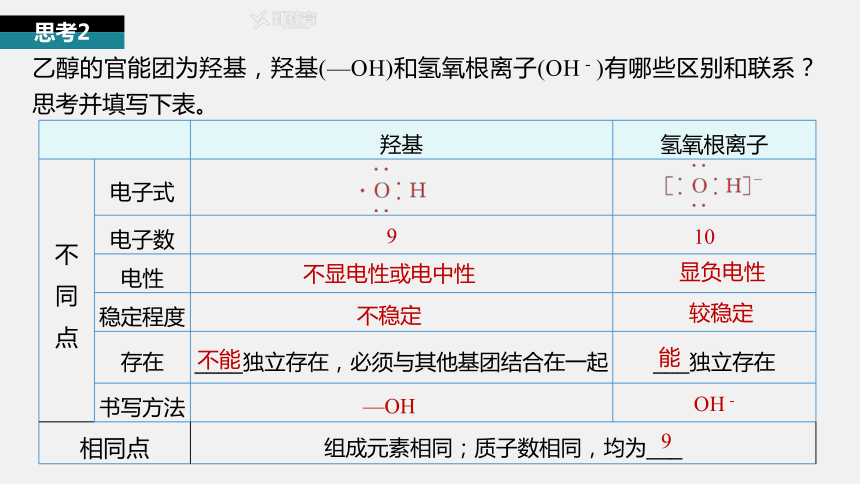
羟基 氢氧根离子
不 同 点 电子式
电子数
电性
稳定程度
存在 ____独立存在,必须与其他基团结合在一起 ___独立存在
书写方法
相同点 组成元素相同;质子数相同,均为___
乙醇的官能团为羟基,羟基(—OH)和氢氧根离子(OH-)有哪些区别和联系?思考并填写下表。
思考2
9
10
不显电性或电中性
显负电性
不稳定
较稳定
不能
能
—OH
OH-
9
判断正误
(1)常用无水CuSO4检验乙醇中是否有水( )
(2)乙醇是一种优良的有机溶剂,能溶解很多有机物和无机物( )
(3)乙醇可以看作乙烷分子中氢原子被氢氧根离子(OH-)取代后的产物,故乙醇水溶液应呈碱性( )
(4)乙烷可看作甲烷中1个氢原子被甲基取代,因此乙烷是烃的衍生物( )
练习1
√
√
×
×
比较乙烷和乙醇的结构,下列说法错误的是
A.分子中的化学键都包括极性键和非极性键
B.分子中都含6个氢原子且6个氢原子的化学环境完全相同
C.乙基与1个氢原子相连就是乙烷分子
D.乙基与1个羟基相连就是乙醇分子
练习2
√
CH3CH3分子中的6个氢原子完全等效,而CH3CH2OH分子中有3种不同化学环境的氢原子(分别为—CH3、—CH2—、—OH上的氢原子)。
1.乙醇的化学性质
(1)乙醇与钠的反应
实验操作
实验现象
实验结论
目标二 乙醇的化学性质及应用
①钠开始沉于试管底部,最终慢慢消失,产生无色无味气体;
②烧杯内壁有水珠产生;
③向烧杯中加入澄清石灰水不变浑浊
乙醇与钠反应生成氢气,
化学方程式为2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
(1)乙醇羟基中的氢原子不如水中的氢原子活泼,什么现象可以说明?
思考1
提示 金属钠与水反应剧烈,与乙醇反应缓慢。
(2)金属钠置换乙醇羟基上的氢原子,而烃基上的氢原子并不反应。试着写出
乙二醇 与金属钠反应的化学方程式。
提示 +2Na―→ +H2↑
(2)乙醇的氧化反应
①燃烧
现象:乙醇在空气中燃烧,产生淡蓝色火焰,放出大量的热。
②乙醇的催化氧化反应
高温焊接银器或铜器时,表面会生成黑色的氧化物,师傅说:把铜或银器具趁热蘸一下酒精,铜或银会光亮如初!这是为什么呢?
实验操作
实验现象
实验结论
②乙醇的催化氧化反应
红色的铜丝 变为黑色 变为红色,闻到刺激性气味
+2H2O
2CH3CHO
乙醇被氧化为乙醛,化学方程式为
结合实验现象,在乙醇和氧气催化氧化反应实验中铜丝是否参与反应?铜丝作用是什么?写出相关反应的化学方程式。
思考2
乙醇的催化氧化反应中,乙醇断开哪些键?
思考3
Cu
乙醇
乙醛
氧原子
水
醛基
③乙醇与强氧化剂的反应
反应原理:CH3CH2OH CH3COOH。
KMnO4(紫色)
MnSO4
(无色)
Cr2(SO4)3
硫酸铬 (绿色)
K2Cr2O7
重铬酸钾(橙色)
2.乙醇的用途
燃料、化工原料和溶剂、医用消毒剂、饮品、有机合成的重要原料等
75%
判断正误
(1)乙醇分子中羟基上的氢原子不如水中的氢原子活泼( )
(2)乙醇分子式为C2H6O,故1 mol乙醇和足量的钠反应,可生成3 mol氢气( )
(3)乙醇、水与钠反应的现象一样,钠都浮在液面上( )
(4)乙醇催化氧化生成乙醛,乙醇能使酸性KMnO4溶液褪色,上述反应乙醇都表现还原性( )
练习1
√
×
×
√
(1) 在铜催化下反应的化学方程式:_____________________
___________________________。
(2) 在上述条件下还能被催化氧化吗?为什么?_____________
______________________________________________________。
练习2
+2H2O
+O2
不能,因为该
分子中和羟基相连的碳原子上没有氢原子,不能被催化氧化
醇的催化氧化反应
(1)凡为R—CH2OH(R代表烃基)结构的醇,在一定条件下都能被氧化成醛
(R—CHO)。
(2)凡为R—CH(OH)—R′结构的醇,在一定条件下也能被氧化,但生成物不
是醛,而是酮( )。
(3)凡为 结构的醇通常情况下不能被催化氧化。
化学与健康
酒类产品标签中的酒精度是指乙醇的体积分数,过量饮酒会加重肝负担,血液中较高浓度的乙醇和乙醛也会对人体产生毒害作用。青少年不应饮酒,机动车驾驶员严禁酒后驾车。
乙醇脱氢酶
乙醇
乙醛
乙醛脱氢酶
乙酸
CO2
肝脏
肝脏
肝脏
课堂小结
乙醇
分子组成和结构
用途
分子式
结构式
官能团
C2H6O
—OH
燃料
化工原料
医用消毒剂
物理性质
无色、有特殊香味的液体
密度小于水
易溶于水和有机溶剂
沸点较低,易挥发
化学性质
与强氧化剂反应
氧化反应
置换反应
使酸性高锰酸钾溶液褪色
与羟基相连的碳上必须有氢原子
淡蓝色火焰
乙醇与钠反应
催化氧应
燃烧
乙 醇
第1课时
第三节 乙醇与乙酸
1.认识乙醇的结构及其主要性质与应用,培养宏观辨识与微观探析能力。
2.理解烃的衍生物、官能团的概念,结合实例认识官能团与性质的关系,知道
有机物之间在一定条件下是可以转化的,培养变化观念与平衡思想。
1.乙醇的结构与化学性质的关系。
2.官能团的初步认识。
[学习目标]
[重点难点]
情景导入
中国古典传统诗词中关于酒的文化有很多很多,如
诗仙李白:
“花间一壶酒,独酌无相亲。举杯邀明月,对影成三人”
“劝君更尽一杯酒,西出阳关无故人”
诗圣杜甫:
“借问酒家何处有,牧童遥指杏花村”
今天,我们就一起来认识一下“酒”的结构和性质吧
1.乙醇的物理性质
目标一 乙醇的物理性质与结构
俗称 颜色 气味 状态 熔点 沸点 挥发性 溶解性 密度
无色
特殊香味
液体
比水小
与水以任意比互溶,能溶解多种有机物和无机物
酒精
-117℃
78.5℃
易挥发
特别提醒 常用无水CuSO4检验乙醇中是否有水,常用蒸馏的方法提纯酒精。
从下列生活中对乙醇的描述和应用中,你能发现乙醇有哪些物理性质?
(1)病人发烧通常用酒精擦拭全身,用此法降温。
(2)用酒精可以去除衣服上沾有的少许汽油。
(3)酒香不怕巷子深。
(4)白酒的主要成分是乙醇和水。
思考1
(5)酒精灯用完后要盖上灯帽。
(6)用酒泡中药(药酒)——如泡枸杞。
易挥发
良好的有机溶剂
易挥发、有特殊香味
乙醇易溶于水
易挥发
良好的有机溶剂
分子式 结构式 结构简式 球棍模型
2.乙醇的结构
(1)乙醇的表达方式
C2H6O
CH3CH2OH或C2H5OH
羟基
(2)烃的衍生物和官能团
①烃的衍生物
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。烃分子失去1个氢原子后所剩余的部分叫做烃基,乙醇可看作是由乙基和羟基组成的。
乙醇分子可以看作是乙烷分子里的一个氢原子被羟基所取代的产物
C
H
H
C
H
H
H
H
O H
物质 CH3CH2OH CH2==CH2 CH≡CH
所含官能团 —OH —C≡C—
官能团名称 羟基 碳碳双键 碳碳三键
②官能团
决定有机化合物特性的原子或原子团,羟基是醇类的官能团。
羟基 氢氧根离子
不 同 点 电子式
电子数
电性
稳定程度
存在 ____独立存在,必须与其他基团结合在一起 ___独立存在
书写方法
相同点 组成元素相同;质子数相同,均为___
乙醇的官能团为羟基,羟基(—OH)和氢氧根离子(OH-)有哪些区别和联系?思考并填写下表。
思考2
9
10
不显电性或电中性
显负电性
不稳定
较稳定
不能
能
—OH
OH-
9
判断正误
(1)常用无水CuSO4检验乙醇中是否有水( )
(2)乙醇是一种优良的有机溶剂,能溶解很多有机物和无机物( )
(3)乙醇可以看作乙烷分子中氢原子被氢氧根离子(OH-)取代后的产物,故乙醇水溶液应呈碱性( )
(4)乙烷可看作甲烷中1个氢原子被甲基取代,因此乙烷是烃的衍生物( )
练习1
√
√
×
×
比较乙烷和乙醇的结构,下列说法错误的是
A.分子中的化学键都包括极性键和非极性键
B.分子中都含6个氢原子且6个氢原子的化学环境完全相同
C.乙基与1个氢原子相连就是乙烷分子
D.乙基与1个羟基相连就是乙醇分子
练习2
√
CH3CH3分子中的6个氢原子完全等效,而CH3CH2OH分子中有3种不同化学环境的氢原子(分别为—CH3、—CH2—、—OH上的氢原子)。
1.乙醇的化学性质
(1)乙醇与钠的反应
实验操作
实验现象
实验结论
目标二 乙醇的化学性质及应用
①钠开始沉于试管底部,最终慢慢消失,产生无色无味气体;
②烧杯内壁有水珠产生;
③向烧杯中加入澄清石灰水不变浑浊
乙醇与钠反应生成氢气,
化学方程式为2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
(1)乙醇羟基中的氢原子不如水中的氢原子活泼,什么现象可以说明?
思考1
提示 金属钠与水反应剧烈,与乙醇反应缓慢。
(2)金属钠置换乙醇羟基上的氢原子,而烃基上的氢原子并不反应。试着写出
乙二醇 与金属钠反应的化学方程式。
提示 +2Na―→ +H2↑
(2)乙醇的氧化反应
①燃烧
现象:乙醇在空气中燃烧,产生淡蓝色火焰,放出大量的热。
②乙醇的催化氧化反应
高温焊接银器或铜器时,表面会生成黑色的氧化物,师傅说:把铜或银器具趁热蘸一下酒精,铜或银会光亮如初!这是为什么呢?
实验操作
实验现象
实验结论
②乙醇的催化氧化反应
红色的铜丝 变为黑色 变为红色,闻到刺激性气味
+2H2O
2CH3CHO
乙醇被氧化为乙醛,化学方程式为
结合实验现象,在乙醇和氧气催化氧化反应实验中铜丝是否参与反应?铜丝作用是什么?写出相关反应的化学方程式。
思考2
乙醇的催化氧化反应中,乙醇断开哪些键?
思考3
Cu
乙醇
乙醛
氧原子
水
醛基
③乙醇与强氧化剂的反应
反应原理:CH3CH2OH CH3COOH。
KMnO4(紫色)
MnSO4
(无色)
Cr2(SO4)3
硫酸铬 (绿色)
K2Cr2O7
重铬酸钾(橙色)
2.乙醇的用途
燃料、化工原料和溶剂、医用消毒剂、饮品、有机合成的重要原料等
75%
判断正误
(1)乙醇分子中羟基上的氢原子不如水中的氢原子活泼( )
(2)乙醇分子式为C2H6O,故1 mol乙醇和足量的钠反应,可生成3 mol氢气( )
(3)乙醇、水与钠反应的现象一样,钠都浮在液面上( )
(4)乙醇催化氧化生成乙醛,乙醇能使酸性KMnO4溶液褪色,上述反应乙醇都表现还原性( )
练习1
√
×
×
√
(1) 在铜催化下反应的化学方程式:_____________________
___________________________。
(2) 在上述条件下还能被催化氧化吗?为什么?_____________
______________________________________________________。
练习2
+2H2O
+O2
不能,因为该
分子中和羟基相连的碳原子上没有氢原子,不能被催化氧化
醇的催化氧化反应
(1)凡为R—CH2OH(R代表烃基)结构的醇,在一定条件下都能被氧化成醛
(R—CHO)。
(2)凡为R—CH(OH)—R′结构的醇,在一定条件下也能被氧化,但生成物不
是醛,而是酮( )。
(3)凡为 结构的醇通常情况下不能被催化氧化。
化学与健康
酒类产品标签中的酒精度是指乙醇的体积分数,过量饮酒会加重肝负担,血液中较高浓度的乙醇和乙醛也会对人体产生毒害作用。青少年不应饮酒,机动车驾驶员严禁酒后驾车。
乙醇脱氢酶
乙醇
乙醛
乙醛脱氢酶
乙酸
CO2
肝脏
肝脏
肝脏
课堂小结
乙醇
分子组成和结构
用途
分子式
结构式
官能团
C2H6O
—OH
燃料
化工原料
医用消毒剂
物理性质
无色、有特殊香味的液体
密度小于水
易溶于水和有机溶剂
沸点较低,易挥发
化学性质
与强氧化剂反应
氧化反应
置换反应
使酸性高锰酸钾溶液褪色
与羟基相连的碳上必须有氢原子
淡蓝色火焰
乙醇与钠反应
催化氧应
燃烧
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
