第五章 章末复习 课件(共28张PPT)-高一化学人教版必修第二册同步课件
文档属性
| 名称 | 第五章 章末复习 课件(共28张PPT)-高一化学人教版必修第二册同步课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-05 11:58:57 | ||
图片预览



文档简介
(共28张PPT)
章末复习
第五章
[学习目标]
1.掌握S、N、Si及其重要化合物的转化关系。
2.掌握无机框图解题思路。
[重点难点]
1.S、N、Si及其重要化合物转化的化学方程式。
2.有关非金属及其化合物的框图推断题。
S、N、Si及其重要化合物的转化关系
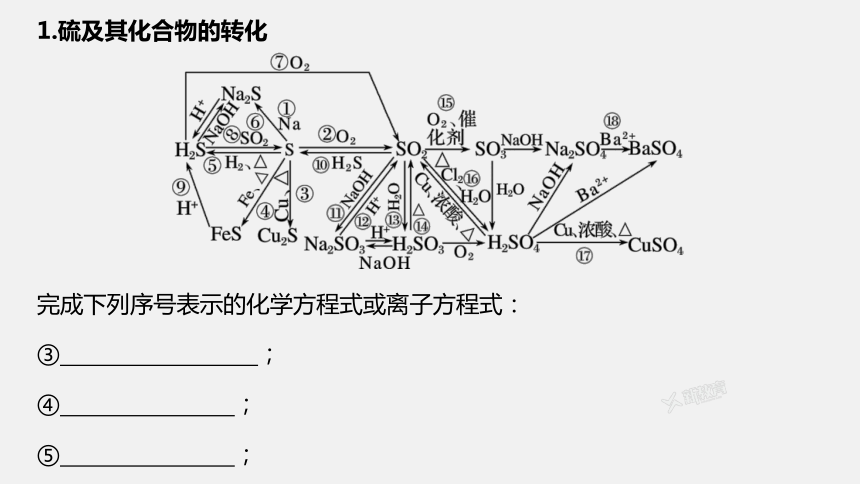
1.硫及其化合物的转化
完成下列序号表示的化学方程式或离子方程式:
③ ;
④ ;
⑤ ;
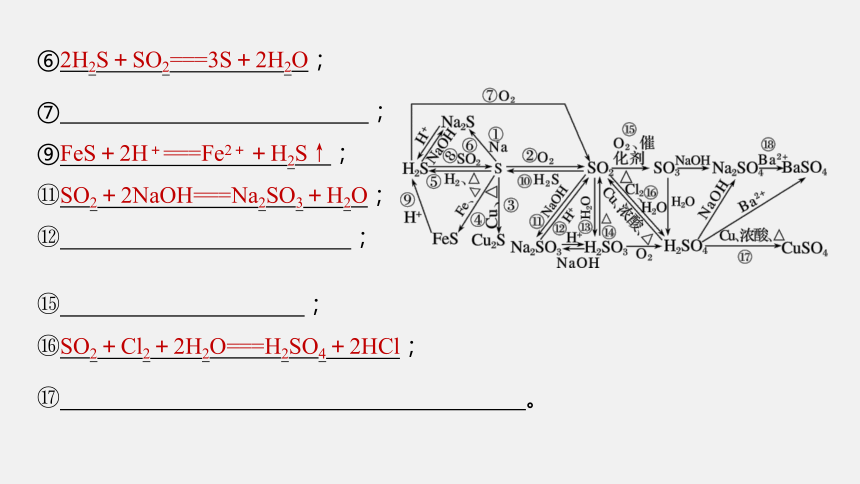
⑥2H2S+SO2===3S+2H2O;
⑦ ;
⑨FeS+2H+===Fe2++H2S↑;
SO2+2NaOH===Na2SO3+H2O;
;
;
SO2+Cl2+2H2O===H2SO4+2HCl;
。
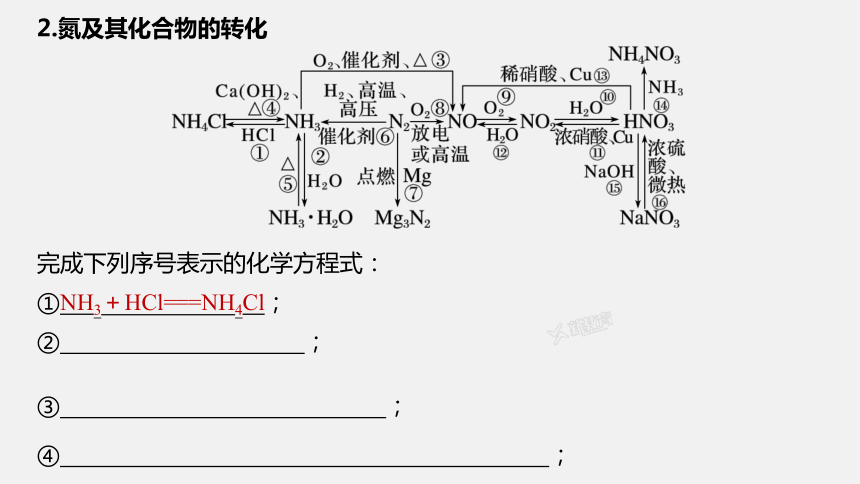
2.氮及其化合物的转化
完成下列序号表示的化学方程式:
①NH3+HCl===NH4Cl;
② ;
③ ;
④ ;
⑤ ;
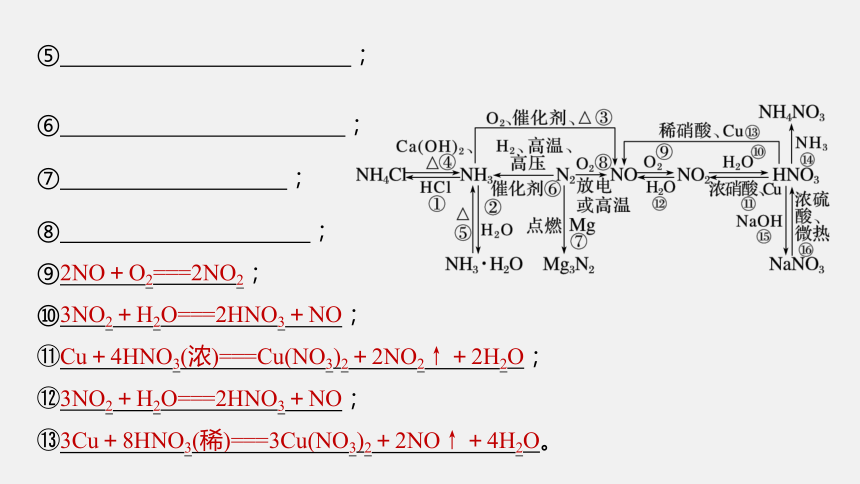
⑥ ;
⑦ ;
⑧ ;
⑨2NO+O2===2NO2;
⑩3NO2+H2O===2HNO3+NO;
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O;
3NO2+H2O===2HNO3+NO;
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。
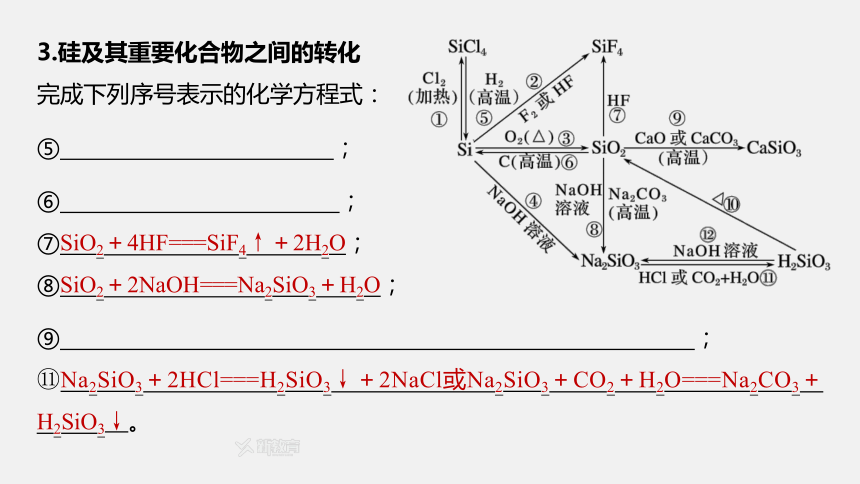
3.硅及其重要化合物之间的转化
完成下列序号表示的化学方程式:
⑤ ;
⑥ ;
⑦SiO2+4HF===SiF4↑+2H2O;
⑧SiO2+2NaOH===Na2SiO3+H2O;
⑨ ;
Na2SiO3+2HCl===H2SiO3↓+2NaCl或Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓。
练习
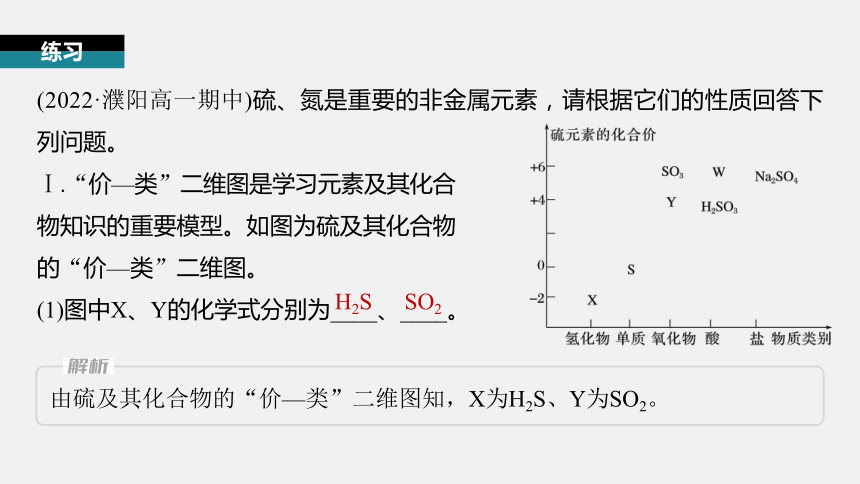
(2022·濮阳高一期中)硫、氮是重要的非金属元素,请根据它们的性质回答下列问题。
Ⅰ.“价—类”二维图是学习元素及其化合
物知识的重要模型。如图为硫及其化合物
的“价—类”二维图。
(1)图中X、Y的化学式分别为____、____。
H2S
SO2
由硫及其化合物的“价—类”二维图知,X为H2S、Y为SO2。
(2)将Y通入如图装置A中,A中盛有X的水溶液,观察到装置A中有淡黄色固体生成,则发生反应的化学方程式为_________________________,该反应中氧化产物与还原产物的质量比为_______。
SO2+2H2S===3S↓+2H2O
2∶1
装置A中淡黄色固体为硫单质,硫化氢和二氧化硫反应生成硫单质和水,反应的化学方程式为SO2+2H2S===3S↓+2H2O;SO2中S的化合价由+4价降低为0价,H2S中的S由-2价升高为0价,根据化合价升降守恒和原子守恒,可知氧化产物和还原产物均为硫单质,氧化产物和还原产物的质量之比为2∶1。
(3)在加热条件下,W的浓溶液能与铜发生反应,则反应的化学方程式为________________________________________。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3
的方案理论上可行的是_____(填字母)。
A.Na2S+S B.Na2SO3+S C.Na2SO4+SO2 D.Na2SO4+Na2SO3
B
Na2S2O3中硫元素化合价为+2价,根据氧化还原反应原理,在反应过程中既要有元素化合价的升高,也要有元素化合价的降低。若Na2S和S反应生成Na2S2O3,Na2S中硫元素由-2价升高到+2价,硫单质中硫元素由0价升高到+2价,只有化合价的升高,A错误;
若Na2SO3和S反应生成Na2S2O3,Na2SO3中硫元素由+4价下降到+2价,硫单质中硫元素由0价升高到+2价,符合氧化还原反应原理,B正确;
若SO2和Na2SO4反应生成Na2S2O3,SO2中硫元素由+4价下降到+2价, Na2SO4中硫元素由+6价下降到+2价,只有化合价的降低,C错误;
若Na2SO3和Na2SO4反应生成Na2S2O3,Na2SO3中硫元素由+4价下降到+2价,Na2SO4中硫元素由+6价下降到+2价,只有化合价的降低,D错误。
Ⅱ.硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如图所示(C为红棕色气体)。
(5)写出上述过程中A到B反应的化学方程式:____________________________。
(6)写出上述过程中C到HNO3反应的化学方程式:________________________。
3NO2+H2O===2HNO3+NO
(7)浓硝酸在常温下可与铜反应并生成气体C,该反应的化学方程式为
_________________________________________。稀硝酸在常温下也可与铜反应并生成B气体。一定浓度的硝酸与铜反应,得到物质的量之比为1∶1的B和C的混合气体2.24 L(标准状况下),则溶解的Cu的质量是_____ g。
Cu+4HNO3(浓)===2NO2↑+Cu(NO3)2+2H2O
6.4
无机框图推断解题技巧——熟记常用“突破口”
解答无机框图推断题的关键是寻找“突破口”(题眼)。如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
1.物质的颜色
淡黄色固体—S、Na2O2;红棕色粉末—Fe2O3;
红褐色沉淀—Fe(OH)3;蓝色沉淀—Cu(OH)2;
黑色固体—Fe3O4、CuO、MnO2等;红色溶液—Fe(SCN)3;
红棕色气体—NO2;黄绿色气体—Cl2。
2.常见物质检验的现象
(1)焰色试验:钠为黄色、钾为紫色(透过蓝色钴玻璃片)。
(2)Fe2+遇碱出现沉淀,颜色变化:白色→灰绿色→红褐色;Fe3+遇SCN-显红色,遇碱生成红褐色沉淀。
(3)高中阶段所学的气体中溶于水显碱性的只有氨气;在空气中迅速由无色变为红棕色的气体只有NO。
3.物质的特殊性质
(1)能使品红溶液褪色的气体:SO2(加热后品红溶液又恢复红色)、Cl2(加热后品红溶液不恢复红色)。
(2)使湿润的红色石蕊试纸变蓝的气体:NH3。
(3)使湿润的淀粉-KI试纸变蓝:NO2、Cl2、Br2、 FeCl3溶液等。
(4)能与SO2、Cl2、O2等气体(或其水溶液)反应析出淡黄色沉淀:H2S。
(5)在一定条件下具有漂白性的物质:Na2O2、H2O2、SO2、氯水、活性炭等。
4.熟悉重要无机物转化关系的常考形式
(2)连续转化型(价态不变)
②含同一元素型
(3)小流程图型
练习1
A~H均为短周期元素,A~F在元素周期表中的相对位置如图1所示。G与其他七种元素不在同一周期,H是短周期中原子半径最大的主族元素。由B、G构成的最简单化合物常作为氮肥工业和纯碱工业的原料。由上述某些元素组成的物质甲~戊的转化关系如图2所示。
已知图2中反应①是复分解反应,生成物中水已略去。请回答下列问题:
(1)上述元素组成的单质中,硬度最大的是________(填物质名称)。
(2)若戊是含有18电子的双原子分子,则丙的电子式为__________;在①中制取气体丙的化学方程式为_____________________________________。
(3)若丙的凝胶经干燥脱水后,常用作干燥剂,写出甲的一种用途___________
_________________________________________________。
金刚石
制备木材
防火剂的原料;制备硅胶的原料;黏合剂(答一条即可)
(4)如果图2中反应①是置换反应,戊是单质,则戊不可能
是____(填字母)。
A.O2 B.Cl2 C.H2 D.N2
D
反应①是置换反应,戊是单质,则若戊为O2,则符合要求的各种物质分别为甲:SiO2(或H2O),乙:C,丙:Si(或H2),丁:CO,戊:O2,选项A符合;
若戊为Cl2,则符合要求的各种物质分别为甲:HCl,乙:Na,丙:H2,丁:NaCl,戊:Cl2,选项B符合;
若戊为H2,则符合要求的各种物质分别为甲:H2S,乙:Cl2(或O2),丙:S,丁:HCl(或H2O),戊:H2,选项C符合;
若戊为N2,则符合要求的各种物质分别为甲:NH3,乙:O2,丙:H2O,丁:NO,不符合转化关系,选项D不符合。
练习2
A、B、C、X是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去):
请回答下列问题:
(1)若X是强氧化性单质O2,则A不可能是____(填字母)。
a.C b.N2 c.S d.Si
d
C、N、S均为变价元素,当X为O2时均符合图示转化关系;Si和氧气反应生成二氧化硅,不符合图示转化关系。
(2)若A能使湿润的红色石蕊试纸变蓝色,C为红棕色气体,则A转化为B的化
学方程式为____________________________,实验室制取A的化学方程式为__________________________________________。
(3)若A、B、C三种化合物的水溶液均呈酸性,写出A和B反应的化学方程式:_______________________,物质B 能使酸性高锰酸钾溶液褪色,体现了B具有_______性。
2H2S+SO2===3S+2H2O
还原
若A、B、C三种化合物的水溶液均呈酸性,符合转化关系的只有S元素化合物,可推知A为H2S,X为O2,B为SO2,C为SO3,A与B反应的化学方程式为2H2S+SO2===3S+2H2O;二氧化硫有还原性,可以被酸性高锰酸钾溶液氧化而使其褪色。
(4)若X是金属单质,向B、C的溶液中分别滴加AgNO3溶液和稀硝酸均产生白色沉淀,则B的化学式是_________,保存C溶液常加少量的X,其目的是______________________。
FeCl3
防止Fe2+被氧化成Fe3+
向B、C溶液中分别滴加AgNO3溶液,均产生不溶于稀硝酸的白色沉淀,则B、C的溶液中均含有Cl-,结合X为变价金属单质Fe,可知B为FeCl3,C为FeCl2,A为Cl2;保存FeCl2溶液时需加铁粉是为了防止Fe2+被氧化成Fe3+。
章末复习
第五章
[学习目标]
1.掌握S、N、Si及其重要化合物的转化关系。
2.掌握无机框图解题思路。
[重点难点]
1.S、N、Si及其重要化合物转化的化学方程式。
2.有关非金属及其化合物的框图推断题。
S、N、Si及其重要化合物的转化关系
1.硫及其化合物的转化
完成下列序号表示的化学方程式或离子方程式:
③ ;
④ ;
⑤ ;
⑥2H2S+SO2===3S+2H2O;
⑦ ;
⑨FeS+2H+===Fe2++H2S↑;
SO2+2NaOH===Na2SO3+H2O;
;
;
SO2+Cl2+2H2O===H2SO4+2HCl;
。
2.氮及其化合物的转化
完成下列序号表示的化学方程式:
①NH3+HCl===NH4Cl;
② ;
③ ;
④ ;
⑤ ;
⑥ ;
⑦ ;
⑧ ;
⑨2NO+O2===2NO2;
⑩3NO2+H2O===2HNO3+NO;
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O;
3NO2+H2O===2HNO3+NO;
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。
3.硅及其重要化合物之间的转化
完成下列序号表示的化学方程式:
⑤ ;
⑥ ;
⑦SiO2+4HF===SiF4↑+2H2O;
⑧SiO2+2NaOH===Na2SiO3+H2O;
⑨ ;
Na2SiO3+2HCl===H2SiO3↓+2NaCl或Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓。
练习
(2022·濮阳高一期中)硫、氮是重要的非金属元素,请根据它们的性质回答下列问题。
Ⅰ.“价—类”二维图是学习元素及其化合
物知识的重要模型。如图为硫及其化合物
的“价—类”二维图。
(1)图中X、Y的化学式分别为____、____。
H2S
SO2
由硫及其化合物的“价—类”二维图知,X为H2S、Y为SO2。
(2)将Y通入如图装置A中,A中盛有X的水溶液,观察到装置A中有淡黄色固体生成,则发生反应的化学方程式为_________________________,该反应中氧化产物与还原产物的质量比为_______。
SO2+2H2S===3S↓+2H2O
2∶1
装置A中淡黄色固体为硫单质,硫化氢和二氧化硫反应生成硫单质和水,反应的化学方程式为SO2+2H2S===3S↓+2H2O;SO2中S的化合价由+4价降低为0价,H2S中的S由-2价升高为0价,根据化合价升降守恒和原子守恒,可知氧化产物和还原产物均为硫单质,氧化产物和还原产物的质量之比为2∶1。
(3)在加热条件下,W的浓溶液能与铜发生反应,则反应的化学方程式为________________________________________。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3
的方案理论上可行的是_____(填字母)。
A.Na2S+S B.Na2SO3+S C.Na2SO4+SO2 D.Na2SO4+Na2SO3
B
Na2S2O3中硫元素化合价为+2价,根据氧化还原反应原理,在反应过程中既要有元素化合价的升高,也要有元素化合价的降低。若Na2S和S反应生成Na2S2O3,Na2S中硫元素由-2价升高到+2价,硫单质中硫元素由0价升高到+2价,只有化合价的升高,A错误;
若Na2SO3和S反应生成Na2S2O3,Na2SO3中硫元素由+4价下降到+2价,硫单质中硫元素由0价升高到+2价,符合氧化还原反应原理,B正确;
若SO2和Na2SO4反应生成Na2S2O3,SO2中硫元素由+4价下降到+2价, Na2SO4中硫元素由+6价下降到+2价,只有化合价的降低,C错误;
若Na2SO3和Na2SO4反应生成Na2S2O3,Na2SO3中硫元素由+4价下降到+2价,Na2SO4中硫元素由+6价下降到+2价,只有化合价的降低,D错误。
Ⅱ.硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如图所示(C为红棕色气体)。
(5)写出上述过程中A到B反应的化学方程式:____________________________。
(6)写出上述过程中C到HNO3反应的化学方程式:________________________。
3NO2+H2O===2HNO3+NO
(7)浓硝酸在常温下可与铜反应并生成气体C,该反应的化学方程式为
_________________________________________。稀硝酸在常温下也可与铜反应并生成B气体。一定浓度的硝酸与铜反应,得到物质的量之比为1∶1的B和C的混合气体2.24 L(标准状况下),则溶解的Cu的质量是_____ g。
Cu+4HNO3(浓)===2NO2↑+Cu(NO3)2+2H2O
6.4
无机框图推断解题技巧——熟记常用“突破口”
解答无机框图推断题的关键是寻找“突破口”(题眼)。如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
1.物质的颜色
淡黄色固体—S、Na2O2;红棕色粉末—Fe2O3;
红褐色沉淀—Fe(OH)3;蓝色沉淀—Cu(OH)2;
黑色固体—Fe3O4、CuO、MnO2等;红色溶液—Fe(SCN)3;
红棕色气体—NO2;黄绿色气体—Cl2。
2.常见物质检验的现象
(1)焰色试验:钠为黄色、钾为紫色(透过蓝色钴玻璃片)。
(2)Fe2+遇碱出现沉淀,颜色变化:白色→灰绿色→红褐色;Fe3+遇SCN-显红色,遇碱生成红褐色沉淀。
(3)高中阶段所学的气体中溶于水显碱性的只有氨气;在空气中迅速由无色变为红棕色的气体只有NO。
3.物质的特殊性质
(1)能使品红溶液褪色的气体:SO2(加热后品红溶液又恢复红色)、Cl2(加热后品红溶液不恢复红色)。
(2)使湿润的红色石蕊试纸变蓝的气体:NH3。
(3)使湿润的淀粉-KI试纸变蓝:NO2、Cl2、Br2、 FeCl3溶液等。
(4)能与SO2、Cl2、O2等气体(或其水溶液)反应析出淡黄色沉淀:H2S。
(5)在一定条件下具有漂白性的物质:Na2O2、H2O2、SO2、氯水、活性炭等。
4.熟悉重要无机物转化关系的常考形式
(2)连续转化型(价态不变)
②含同一元素型
(3)小流程图型
练习1
A~H均为短周期元素,A~F在元素周期表中的相对位置如图1所示。G与其他七种元素不在同一周期,H是短周期中原子半径最大的主族元素。由B、G构成的最简单化合物常作为氮肥工业和纯碱工业的原料。由上述某些元素组成的物质甲~戊的转化关系如图2所示。
已知图2中反应①是复分解反应,生成物中水已略去。请回答下列问题:
(1)上述元素组成的单质中,硬度最大的是________(填物质名称)。
(2)若戊是含有18电子的双原子分子,则丙的电子式为__________;在①中制取气体丙的化学方程式为_____________________________________。
(3)若丙的凝胶经干燥脱水后,常用作干燥剂,写出甲的一种用途___________
_________________________________________________。
金刚石
制备木材
防火剂的原料;制备硅胶的原料;黏合剂(答一条即可)
(4)如果图2中反应①是置换反应,戊是单质,则戊不可能
是____(填字母)。
A.O2 B.Cl2 C.H2 D.N2
D
反应①是置换反应,戊是单质,则若戊为O2,则符合要求的各种物质分别为甲:SiO2(或H2O),乙:C,丙:Si(或H2),丁:CO,戊:O2,选项A符合;
若戊为Cl2,则符合要求的各种物质分别为甲:HCl,乙:Na,丙:H2,丁:NaCl,戊:Cl2,选项B符合;
若戊为H2,则符合要求的各种物质分别为甲:H2S,乙:Cl2(或O2),丙:S,丁:HCl(或H2O),戊:H2,选项C符合;
若戊为N2,则符合要求的各种物质分别为甲:NH3,乙:O2,丙:H2O,丁:NO,不符合转化关系,选项D不符合。
练习2
A、B、C、X是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去):
请回答下列问题:
(1)若X是强氧化性单质O2,则A不可能是____(填字母)。
a.C b.N2 c.S d.Si
d
C、N、S均为变价元素,当X为O2时均符合图示转化关系;Si和氧气反应生成二氧化硅,不符合图示转化关系。
(2)若A能使湿润的红色石蕊试纸变蓝色,C为红棕色气体,则A转化为B的化
学方程式为____________________________,实验室制取A的化学方程式为__________________________________________。
(3)若A、B、C三种化合物的水溶液均呈酸性,写出A和B反应的化学方程式:_______________________,物质B 能使酸性高锰酸钾溶液褪色,体现了B具有_______性。
2H2S+SO2===3S+2H2O
还原
若A、B、C三种化合物的水溶液均呈酸性,符合转化关系的只有S元素化合物,可推知A为H2S,X为O2,B为SO2,C为SO3,A与B反应的化学方程式为2H2S+SO2===3S+2H2O;二氧化硫有还原性,可以被酸性高锰酸钾溶液氧化而使其褪色。
(4)若X是金属单质,向B、C的溶液中分别滴加AgNO3溶液和稀硝酸均产生白色沉淀,则B的化学式是_________,保存C溶液常加少量的X,其目的是______________________。
FeCl3
防止Fe2+被氧化成Fe3+
向B、C溶液中分别滴加AgNO3溶液,均产生不溶于稀硝酸的白色沉淀,则B、C的溶液中均含有Cl-,结合X为变价金属单质Fe,可知B为FeCl3,C为FeCl2,A为Cl2;保存FeCl2溶液时需加铁粉是为了防止Fe2+被氧化成Fe3+。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
