2023-2024学年人教版高中化学必修二 5.1硫及其化合物复习课 课件(共19张PPT)
文档属性
| 名称 | 2023-2024学年人教版高中化学必修二 5.1硫及其化合物复习课 课件(共19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 752.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-05 13:59:22 | ||
图片预览




文档简介
(共19张PPT)
硫及其化合物
--- 复习课
教学目标
教学方法
2、从物质类别角度、氧化还原角度、“位”“构”“性”
角度分析元素化合物,由此建立知识体系,并培养学生的逻辑思维能力,体现和落实“证据推理与模型认知”。
1、分析元素结构与性质的关系,培养学生“宏观辨识与微观探析”的意识和能力。
4、通过性质决定用途,体现求真、求实的科学精神和社会责任。
3、让学生自主进行实验设计,来培养学生的参与意识、创新精神与实验设计能力。
教学目标
每课一题
请写出下列元素及它们化合物之间的转化关系。
单质--氧化物--氧化物的水化物--盐
氢化物--单质--氧化物--氧化物的水化物--盐
Na Na2O NaOH Na2CO3
Al Al2O3 Al(OH)3 Al3+/AlO2-
HCl Cl2--ClO2--HClO/HClO4 ClO-
H2S S SO2/S03 H2SO3/H2SO4 SO42-
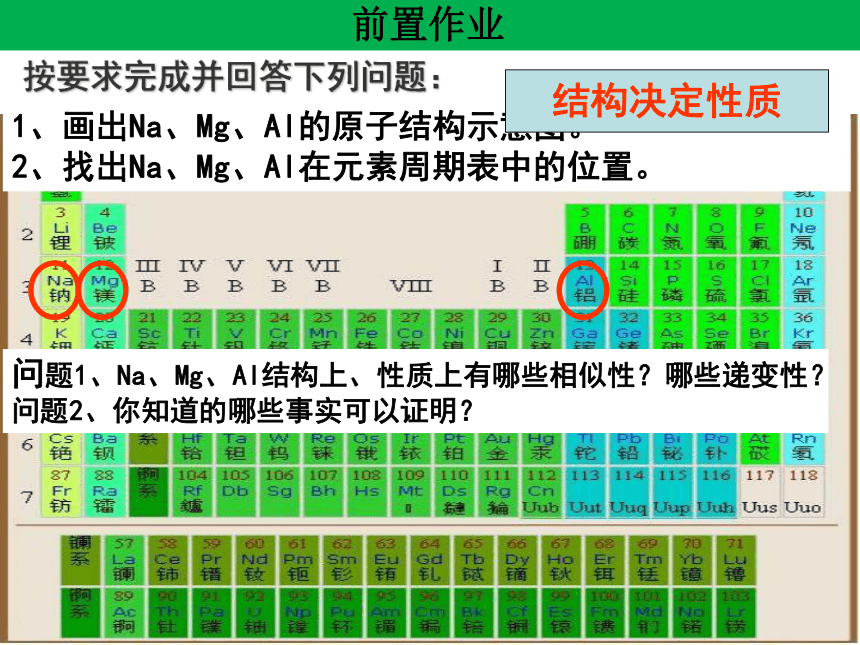
前置作业
按要求完成并回答下列问题:
问题1、Na、Mg、Al结构上、性质上有哪些相似性?哪些递变性?
问题2、你知道的哪些事实可以证明?
1、画出Na、Mg、Al的原子结构示意图。
2、找出Na、Mg、Al在元素周期表中的位置。
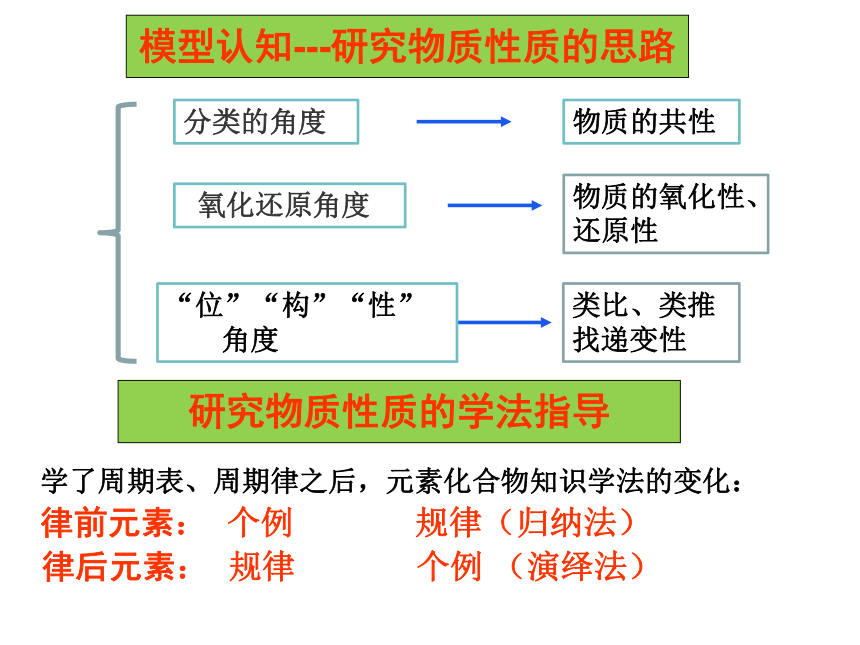
结构决定性质
氧化还原角度
物质的共性
物质的氧化性、
还原性
类比、类推找递变性
分类的角度
“位”“构”“性”
角度
模型认知---研究物质性质的思路
学了周期表、周期律之后,元素化合物知识学法的变化:
律前元素: 个例 规律(归纳法)
律后元素: 规律 个例 (演绎法)
研究物质性质的学法指导
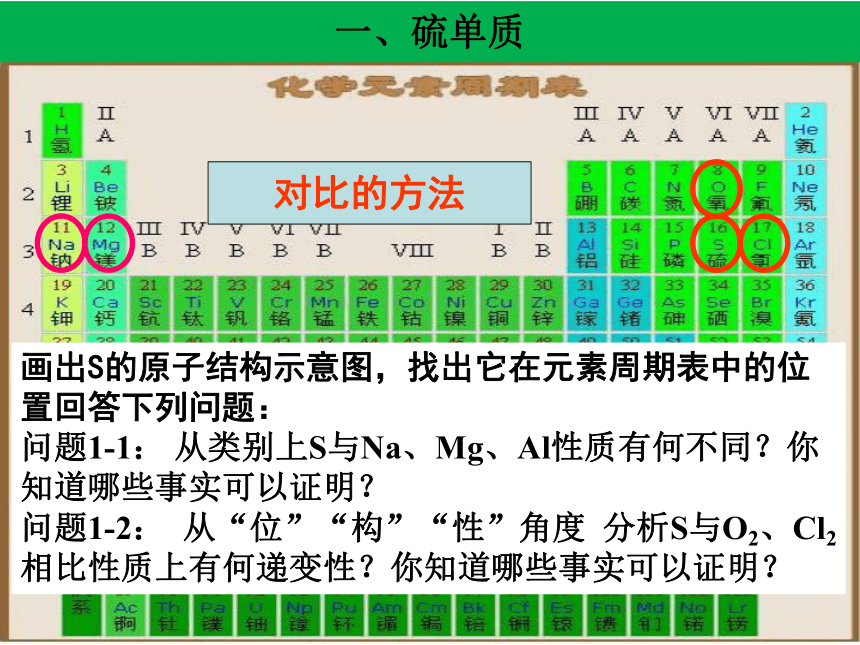
画出S的原子结构示意图,找出它在元素周期表中的位置回答下列问题:
问题1-1: 从类别上S与Na、Mg、Al性质有何不同?你知道哪些事实可以证明?
问题1-2: 从“位”“构”“性”角度 分析S与O2、Cl2相比性质上有何递变性?你知道哪些事实可以证明?
一、硫单质
对比的方法
酸性氧化物的通性
①与水反应
②与碱反应
③与碱性氧化物反应
④与盐反应
SO2+2NaOH=Na2SO3+H2O
SO2+NaOH=NaHSO3
SO2+CaO=CaSO3
SO2+NaHCO3=NaHSO3+CO2
SO2+2NaHCO3=Na2SO3+CO2+H2O
SO2+H2O=H2SO3
二、氧化物 SO2 、 SO3
酸与盐发生反应规律之一:
强酸制弱酸
问题2-1:SO2 、 SO3 从性质上看属于什么氧化物?哪些事实可以证明
问题2-2、如何设计实验证明SO2 的氧化性、还原性?说出你的思路?
1、证明氧化性找还原剂
二、氧化物 SO2 、 SO3
2、证明还原性找氧化剂——有明显的现象
SO2+2H2S===3S↓+2H2O
常见氧化剂:KMnO4、氯水、Fe3+
氧化性强弱:KMnO4>氯水>Fe3+>SO2
氧化还原的强弱规律
氧化性:氧化剂>氧化产物
归中
科学精神
浓硫酸
H2SO4
稀释
自身特性?
主要以分子
形式存在
稀硫酸
H2SO4= 2H++SO42-
酸的通性
完全电离
(强氧化性、吸水性、脱水性)
三、酸 H2SO4 、 H2SO3
问题3-1、哪些事实可以证明硫酸属于酸 浓硫酸的性质为何不同于稀硫酸
问题3-2、如何证明浓硫酸的氧化性 强于稀硫酸?
微观实质
宏观现象
针对练习1:如何除去附着在试管内壁上的硫,简述其方法、原理?
1、用CS2洗涤——物理性质
2、用热的氢氧化钠洗涤——化学性质
学以致用
性质决定用途
歧化
针对练习2:如何鉴别CO2与SO2?简述方法原理?
物理方法:气味
化学方法:品红溶液、
氯水、 溴水 、 碘水、 KMnO4(H+)溶液、FeCl3
H2S溶液 、
如何除去CO2中混有的SO2?
将气体通过盛有饱和NaHCO3溶液的洗气瓶
物质鉴别、除杂利用的是性质的差异
差别用于鉴别
首选特性
相同原理不同现象
不同的原理
镁在CO2中可以燃烧 生成 MgO和C
镁在SO2中可以燃烧 生成 MgO和S
学以致用
针对练习3、如何除去SO2中的SO3?简述其方法原理?
将气体通过盛有饱和的NaHSO3溶液的洗气瓶
学以致用
类比的方法
针对练习4:下列溶液褪色的原理是什么?
①溴水中通入SO2
②品红溶液中滴加氯水
③品红溶液中通入SO2
④品红溶液中加入活性炭
④滴有酚酞的氢氧化钠溶液中通入SO2
学以致用
宏观现象---微观实质
原料
产物
单质铜
硫酸铜
氧化还原反应
化合价变化
1.物质的转化
0价
14
【工业生产】如何以废铜屑为原料制备硫酸铜?说出你的思路
+2价
2.思路:
寻找合适的氧化剂实现化合价的变化
寻找合适的溶液提供硫酸根
绿色化学
实验探究与创新精神
学以致用
从分类、氧化还原、
“位”“构”“性”
的角度,建立元素
化合物与结构理论
体系相结合的思维
模型。
建立模型
探究的方法
化学核
心素养
科学的观念
对比、
类比、
归纳、
演绎
课堂总结
宏观辨识与微观探析
证据推理与模型认知
实验探究与创新精神
知识是素材
原理是关键
素养是追求
能力是目标
不忘初心
为中国人民谋幸福,
砥砺前行
为中华民族谋复兴。
谢谢大家!
1 、浓硫酸具有如下性质: A.酸性 B.强氧化性 C.难挥发性 D.吸水性 E.脱水性,下列实验或事实主要表现了浓硫酸的什么性质
(1)浓硫酸可作气体干燥剂。
(2)浓硫酸不能干燥氨气。
(3)棉布上滴上浓硫酸出现破洞。
(4)浓硫酸不能干燥硫化氢。
(5)浓硫酸可以制取氯化氢气体。
(6)胆矾遇浓硫酸变白色。
(7)铁片投入浓硫酸中不溶解。
(8)热的浓硫酸中投入铜可溶解。
D
A
E
B
C
D
B
AB
反馈检测
2、如图所示的是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将浓硫酸滴入装有亚硫酸钠固体的培养皿中。关于此实验的“现象”、“解释或结论”以及对应关系均正确的是( )
反馈检测
B
B
硫及其化合物
--- 复习课
教学目标
教学方法
2、从物质类别角度、氧化还原角度、“位”“构”“性”
角度分析元素化合物,由此建立知识体系,并培养学生的逻辑思维能力,体现和落实“证据推理与模型认知”。
1、分析元素结构与性质的关系,培养学生“宏观辨识与微观探析”的意识和能力。
4、通过性质决定用途,体现求真、求实的科学精神和社会责任。
3、让学生自主进行实验设计,来培养学生的参与意识、创新精神与实验设计能力。
教学目标
每课一题
请写出下列元素及它们化合物之间的转化关系。
单质--氧化物--氧化物的水化物--盐
氢化物--单质--氧化物--氧化物的水化物--盐
Na Na2O NaOH Na2CO3
Al Al2O3 Al(OH)3 Al3+/AlO2-
HCl Cl2--ClO2--HClO/HClO4 ClO-
H2S S SO2/S03 H2SO3/H2SO4 SO42-
前置作业
按要求完成并回答下列问题:
问题1、Na、Mg、Al结构上、性质上有哪些相似性?哪些递变性?
问题2、你知道的哪些事实可以证明?
1、画出Na、Mg、Al的原子结构示意图。
2、找出Na、Mg、Al在元素周期表中的位置。
结构决定性质
氧化还原角度
物质的共性
物质的氧化性、
还原性
类比、类推找递变性
分类的角度
“位”“构”“性”
角度
模型认知---研究物质性质的思路
学了周期表、周期律之后,元素化合物知识学法的变化:
律前元素: 个例 规律(归纳法)
律后元素: 规律 个例 (演绎法)
研究物质性质的学法指导
画出S的原子结构示意图,找出它在元素周期表中的位置回答下列问题:
问题1-1: 从类别上S与Na、Mg、Al性质有何不同?你知道哪些事实可以证明?
问题1-2: 从“位”“构”“性”角度 分析S与O2、Cl2相比性质上有何递变性?你知道哪些事实可以证明?
一、硫单质
对比的方法
酸性氧化物的通性
①与水反应
②与碱反应
③与碱性氧化物反应
④与盐反应
SO2+2NaOH=Na2SO3+H2O
SO2+NaOH=NaHSO3
SO2+CaO=CaSO3
SO2+NaHCO3=NaHSO3+CO2
SO2+2NaHCO3=Na2SO3+CO2+H2O
SO2+H2O=H2SO3
二、氧化物 SO2 、 SO3
酸与盐发生反应规律之一:
强酸制弱酸
问题2-1:SO2 、 SO3 从性质上看属于什么氧化物?哪些事实可以证明
问题2-2、如何设计实验证明SO2 的氧化性、还原性?说出你的思路?
1、证明氧化性找还原剂
二、氧化物 SO2 、 SO3
2、证明还原性找氧化剂——有明显的现象
SO2+2H2S===3S↓+2H2O
常见氧化剂:KMnO4、氯水、Fe3+
氧化性强弱:KMnO4>氯水>Fe3+>SO2
氧化还原的强弱规律
氧化性:氧化剂>氧化产物
归中
科学精神
浓硫酸
H2SO4
稀释
自身特性?
主要以分子
形式存在
稀硫酸
H2SO4= 2H++SO42-
酸的通性
完全电离
(强氧化性、吸水性、脱水性)
三、酸 H2SO4 、 H2SO3
问题3-1、哪些事实可以证明硫酸属于酸 浓硫酸的性质为何不同于稀硫酸
问题3-2、如何证明浓硫酸的氧化性 强于稀硫酸?
微观实质
宏观现象
针对练习1:如何除去附着在试管内壁上的硫,简述其方法、原理?
1、用CS2洗涤——物理性质
2、用热的氢氧化钠洗涤——化学性质
学以致用
性质决定用途
歧化
针对练习2:如何鉴别CO2与SO2?简述方法原理?
物理方法:气味
化学方法:品红溶液、
氯水、 溴水 、 碘水、 KMnO4(H+)溶液、FeCl3
H2S溶液 、
如何除去CO2中混有的SO2?
将气体通过盛有饱和NaHCO3溶液的洗气瓶
物质鉴别、除杂利用的是性质的差异
差别用于鉴别
首选特性
相同原理不同现象
不同的原理
镁在CO2中可以燃烧 生成 MgO和C
镁在SO2中可以燃烧 生成 MgO和S
学以致用
针对练习3、如何除去SO2中的SO3?简述其方法原理?
将气体通过盛有饱和的NaHSO3溶液的洗气瓶
学以致用
类比的方法
针对练习4:下列溶液褪色的原理是什么?
①溴水中通入SO2
②品红溶液中滴加氯水
③品红溶液中通入SO2
④品红溶液中加入活性炭
④滴有酚酞的氢氧化钠溶液中通入SO2
学以致用
宏观现象---微观实质
原料
产物
单质铜
硫酸铜
氧化还原反应
化合价变化
1.物质的转化
0价
14
【工业生产】如何以废铜屑为原料制备硫酸铜?说出你的思路
+2价
2.思路:
寻找合适的氧化剂实现化合价的变化
寻找合适的溶液提供硫酸根
绿色化学
实验探究与创新精神
学以致用
从分类、氧化还原、
“位”“构”“性”
的角度,建立元素
化合物与结构理论
体系相结合的思维
模型。
建立模型
探究的方法
化学核
心素养
科学的观念
对比、
类比、
归纳、
演绎
课堂总结
宏观辨识与微观探析
证据推理与模型认知
实验探究与创新精神
知识是素材
原理是关键
素养是追求
能力是目标
不忘初心
为中国人民谋幸福,
砥砺前行
为中华民族谋复兴。
谢谢大家!
1 、浓硫酸具有如下性质: A.酸性 B.强氧化性 C.难挥发性 D.吸水性 E.脱水性,下列实验或事实主要表现了浓硫酸的什么性质
(1)浓硫酸可作气体干燥剂。
(2)浓硫酸不能干燥氨气。
(3)棉布上滴上浓硫酸出现破洞。
(4)浓硫酸不能干燥硫化氢。
(5)浓硫酸可以制取氯化氢气体。
(6)胆矾遇浓硫酸变白色。
(7)铁片投入浓硫酸中不溶解。
(8)热的浓硫酸中投入铜可溶解。
D
A
E
B
C
D
B
AB
反馈检测
2、如图所示的是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将浓硫酸滴入装有亚硫酸钠固体的培养皿中。关于此实验的“现象”、“解释或结论”以及对应关系均正确的是( )
反馈检测
B
B
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
