【核心素养目标】人教版(2019)高一化学必修第一册1.1 物质的分类及转化(第1课时 物质的分类)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高一化学必修第一册1.1 物质的分类及转化(第1课时 物质的分类) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-06 09:35:18 | ||
图片预览






文档简介
(共25张PPT)
第一节 物质的分类及转化
第1课时 物质的分类
人教版必修第一册
学习目标
1.能从元素组成(宏观)和构成微粒(微观)的角度分析认识物质,并根据物质的组成和性质对化学物质进行分类。
2.认识交叉分类法和树状分类法,能用不同的分类标准对酸、碱、盐、氧化物进行分类。
学习目标
1.感受分类方法对于化学科学研究和化学学习的重要作用。培养学生“科学精神和社会责任”的学科素养。
2.通过对“物质分类”的学习,培养学生“宏观辨识和微观探析”的学科素养。
素养目标
情境引入
图书馆
药店
超市
快递
举出生活中一些应用分类法的例子,并指出对它们分类的目的和意义。
教学过程
图书馆中数不胜数的图书要分类陈列以便于人们查找, 快递企业对数以千万计的物品要分类处理以提高工作效率。 同样,为了认识和研究的方便,对于数以千万计的物质, 人们常根据物质的组成、结构、性质或用途等进行分类。
教学过程
分类法
一、物质的分类
涵义
标准
意义
分类是根据对象的共同点和差异性,将对象区分为不同的种类,并形成有一定从属关系的不同等级的系统逻辑方法;是研究和学习化学物质及其变化的一种常用科学方法。
在高中化学的学习中,对物质及其变化的分类标准将从物质的组成和性质等宏观视角,拓展到物质的构成、结构和参加化学反应的粒子等微观视角。
发现物质及其变化的规律,预测物质的性质及其可能发生的变化。
1.分类涵义、标准、意义
教学过程
2.物质的分类方法
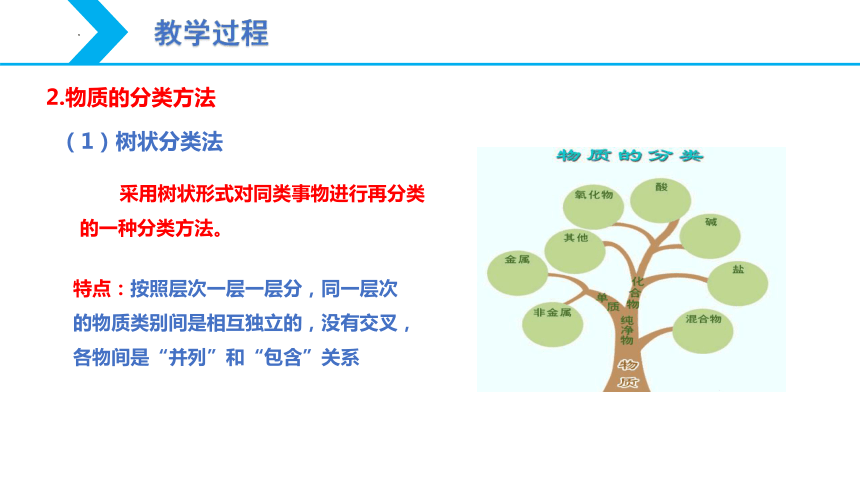
(1)树状分类法
采用树状形式对同类事物进行再分类的一种分类方法。
特点:按照层次一层一层分,同一层次的物质类别间是相互独立的,没有交叉,各物间是“并列”和“包含”关系
教学过程
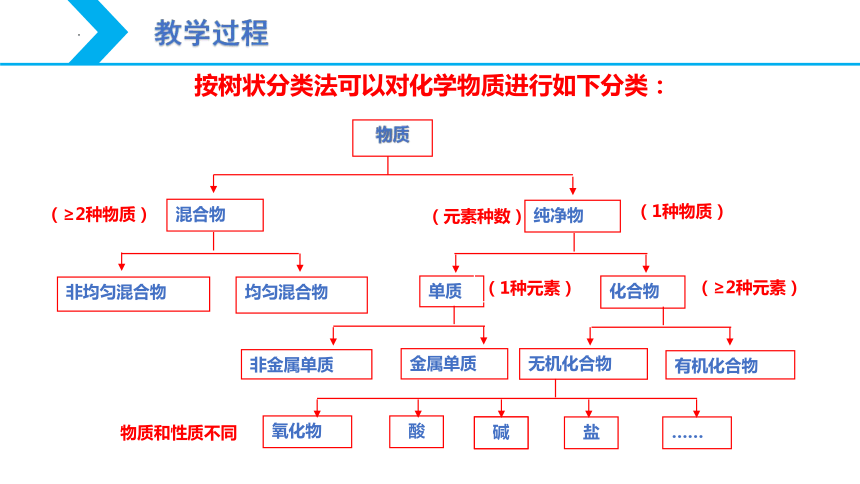
物质
混合物
纯净物
化合物
非均匀混合物
均匀混合物
非金属单质
无机化合物
有机化合物
单质
金属单质
氧化物
酸
酸
碱
盐
……
(元素种数)
(1种物质)
(1种元素)
(≥2种物质)
(组成和性质不同)
(≥2种元素)
物质和性质不同
按树状分类法可以对化学物质进行如下分类:
教学过程
思考:
只由一种元素组成的物质一定是纯净物吗?
解析:只由一种元素组成的物质不一定是纯净物。
例如:碳元素的同素异形体是石墨、金刚石和C60形成的混合物,只由碳元素组成,不是纯净物。
每一种元素都能自身组成单质,有的单质有多种形态,如碳元素形成的单质有金刚石、石墨和C60;氧元素形成的单质有氧气和臭氧;磷元素形成的单质有白磷和红磷等。像这样由同一种元素形成的几种性质不同的单质,叫做同素异形体。
教学过程
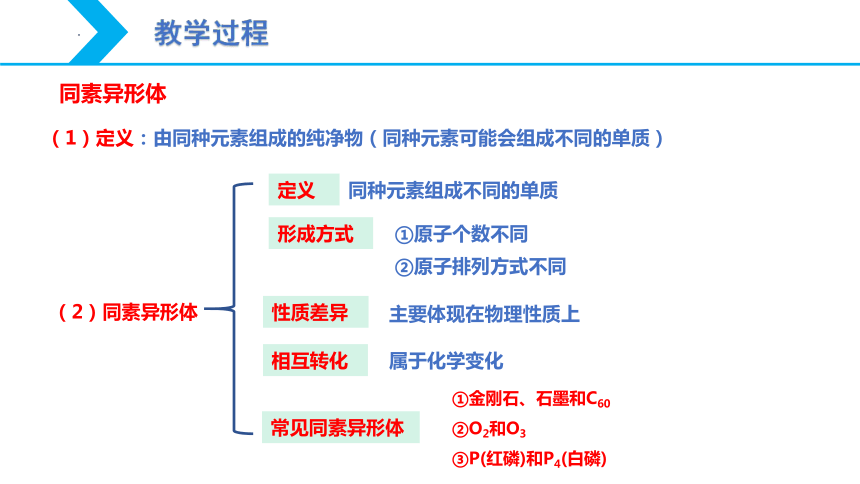
(2)同素异形体
定义
同种元素组成不同的单质
形成方式
①原子个数不同
②原子排列方式不同
性质差异
主要体现在物理性质上
相互转化
属于化学变化
常见同素异形体
(1)定义:由同种元素组成的纯净物(同种元素可能会组成不同的单质)
同素异形体
①金刚石、石墨和C60
②O2和O3
③P(红磷)和P4(白磷)
教学过程
特点:多种物质的分类呈“并列”和“交叉”关系。
(2)交叉分类法
对同一种物质按不同的标准分类的方法。
优点:可从不同角度了解各种物质,对事物了解更全面。
教学过程
3.对酸、碱、盐、氧化物分类
(1)酸
酸
酸性强弱
强酸
中强酸
弱酸
H2SO3、H3PO4 、H2C2O4
H2SO4、HNO3 、HCl、HClO4、HI、HBr
H2CO3、CH3COOH、HClO、HF、H2S
电离出H+数目
一元酸
二元酸
多元酸
HNO3 、HCl、HClO4、HI、HBr、CH3COOH、HClO、HF
H2SO4、H2SO3、H2C2O4、H2CO3
H3PO4
是否含氧元素
含氧酸
无氧酸
HNO3 、HClO4、H2SO3、H3PO4 、H2C2O4、
CH3COOH、HClO、H2CO3、CH3COOH、HClO
HCl、HI、HBr、HF、H2S
教学过程
3.对酸、碱、盐、氧化物分类
(2)碱
碱
碱性强弱
强碱
中强碱
弱碱
Mg(OH)2
NaOH、KOH、Ca(OH)2、Ba(OH)2
NH3·H2O 、Cu(OH)2、Fe(OH)3、 Zn(OH)2
电离出OH-数目
一元碱
二元碱
多元碱
NaOH、KOH、NH3·H2O
Ca(OH)2、Ba(OH)2、Mg(OH)2、Cu(OH)2、Zn(OH)2
Fe(OH)3
溶解性
可溶碱
难溶酸
微溶碱
NaOH、KOH、Ba(OH)2、NH3·H2O
Ca(OH)2
Mg(OH)2、Cu(OH)2、Fe(OH)3、 Zn(OH)2
教学过程
3.对酸、碱、盐、氧化物分类
(3)盐
盐
组成
金属阳离子或铵根离子
酸根离子
硫酸盐、硝酸盐、碳酸盐等
钠盐、钾盐、铵盐等
溶解性
可溶盐
NaCl、K2SO4、AgNO3
CaSO4、Ag2SO4、MgCO3
BaCO3 AgCl BaSO4
性质
微溶盐
难溶盐
正盐
酸式盐
碱式盐
K2SO4、Na2CO3
NaHCO3、NaHSO4
Cu2(OH)2CO3
教学过程
3.对酸、碱、盐、氧化物分类
(4)氧化物
氧化物
组成
金属氧化物
CuO MgO CaO
CO2、SO2、NO
性质
酸性氧化物
碱性氧化物
两性氧化物
非金属氧化物
能与酸反应生成盐和水的氧化物 CO2、SO2、Mn2O7
能与碱反应生成盐和水的氧化物
既能与酸又能与碱起反应,且均生成盐和水的氧化物
CuO MgO CaO
Al2O3
不成盐氧化物 CO、NO
成盐
教学过程
(1)酸性氧化物不一定是非金属氧化物,如Mn2O7。
(2)非金属氧化物不一定都是酸性氧化物,如CO、NO。
(3)碱性氧化物一定是金属氧化物。
(4)金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3 是两性氧化物
酸性氧化物和碱性氧化物的理解
典例1.下列物质分类正确的是( )
选项 酸性氧化物 碱性氧化物 酸 碱 盐
A CO2 Mn2O7 H2SO4 KOH NaHCO3
B CO Na2O HCl NaOH NaCl
C SO2 CuO CH3COOH Na2CO3 CaF2
D SO3 CaO HNO3 Ca(OH)2 CaCO3
【答案】D
【解析】Mn2O7为酸性氧化物,A项错误;CO既不能与酸反应生成盐和水,又不能与碱反应生成盐和水,属于不成盐氧化物,B项错误;Na2CO3是盐,C项错误。
课堂练习
课堂练习
如图表示的一些物质或概念间的从属关系不正确的是( )
A.X为含氧酸、Y为酸、Z为化合物
B.X为氧化物、Y为化合物、Z为纯净物
C.X为强碱、Y为碱、Z为化合物
D.X为非金属氧化物、Y为酸性氧化物、Z为氧化物
典例2.
【答案】D
【解析】化合物可以分为酸、碱、盐、氧化物等,按分子组成中是否含氧元素,酸可分为含氧酸和无氧酸,A项正确;纯净物分为单质和化合物,化合物可以分为酸、碱、盐、氧化物等,B项正确;化合物可以分为酸、碱、盐、氧化物等,按解离程度不同,碱可分为强碱、弱碱等,C项正确;氧化物可以分为酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物,酸性氧化物不一定是非金属氧化物(如Mn2O7等),非金属氧化物也不一定是酸性氧化物(如CO等),酸性氧化物和非金属氧化物属于交叉关系,D项错误。
课堂练习
2019年12月以来,我国部分地区突发的新型冠状病毒肺炎威胁着人们的身体健康。“84”消毒液(主要成分为NaClO)是人们常用的消毒剂。下列关于“84”消毒液及其主要成分的说法正确的是( )
A.“84”消毒液是纯净物
B.NaClO属于氧化物
C.NaClO属于盐
D.NaClO属于碱
典例3.
【答案】C
【解析】“84”消毒液的主要成分为NaClO,NaClO属于盐。
典例4.
按照物质的交叉分类方法判断,HNO3属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸
⑥挥发性酸 ⑦一元酸 ⑧化合物 ⑨混合物
A.②④⑤⑥⑦⑧ B.①④⑥⑦⑧
C.①③⑤⑨ D.①④⑤⑦⑧
课堂练习
【答案】B
【解析】HNO3属于酸、含氧酸、挥发性酸、 一元酸、化合物。
课堂练习
我国科学家预言的T 碳(四个碳原子构成的正四面体分别取代金刚石结构中所有碳原子,如图)已在实验室成功合成。T 碳属于( )
A.混合物
B.化合物
C.氧化物
D.单质
典例5.
【答案】D
【解析】该物质只由一种元素即碳元素组成,属于单质。
课堂练习
科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等,它们之间的关系是( )
A.同一物质 B.同种化合物
C.互为同素异形体 D.无法判断
典例6.
【答案】C
【解析】C50、C70、C120、C540都是由碳元素组成的不同单质,它们互称为同素异形体。
课堂小结
树状分类法
课堂小结
交叉分类法
课后小任务
课后分小组,查阅资料,了解生活垃圾是如何分类的?分类的依据是什么?
感 谢 倾 听
第一节 物质的分类及转化
第1课时 物质的分类
人教版必修第一册
学习目标
1.能从元素组成(宏观)和构成微粒(微观)的角度分析认识物质,并根据物质的组成和性质对化学物质进行分类。
2.认识交叉分类法和树状分类法,能用不同的分类标准对酸、碱、盐、氧化物进行分类。
学习目标
1.感受分类方法对于化学科学研究和化学学习的重要作用。培养学生“科学精神和社会责任”的学科素养。
2.通过对“物质分类”的学习,培养学生“宏观辨识和微观探析”的学科素养。
素养目标
情境引入
图书馆
药店
超市
快递
举出生活中一些应用分类法的例子,并指出对它们分类的目的和意义。
教学过程
图书馆中数不胜数的图书要分类陈列以便于人们查找, 快递企业对数以千万计的物品要分类处理以提高工作效率。 同样,为了认识和研究的方便,对于数以千万计的物质, 人们常根据物质的组成、结构、性质或用途等进行分类。
教学过程
分类法
一、物质的分类
涵义
标准
意义
分类是根据对象的共同点和差异性,将对象区分为不同的种类,并形成有一定从属关系的不同等级的系统逻辑方法;是研究和学习化学物质及其变化的一种常用科学方法。
在高中化学的学习中,对物质及其变化的分类标准将从物质的组成和性质等宏观视角,拓展到物质的构成、结构和参加化学反应的粒子等微观视角。
发现物质及其变化的规律,预测物质的性质及其可能发生的变化。
1.分类涵义、标准、意义
教学过程
2.物质的分类方法
(1)树状分类法
采用树状形式对同类事物进行再分类的一种分类方法。
特点:按照层次一层一层分,同一层次的物质类别间是相互独立的,没有交叉,各物间是“并列”和“包含”关系
教学过程
物质
混合物
纯净物
化合物
非均匀混合物
均匀混合物
非金属单质
无机化合物
有机化合物
单质
金属单质
氧化物
酸
酸
碱
盐
……
(元素种数)
(1种物质)
(1种元素)
(≥2种物质)
(组成和性质不同)
(≥2种元素)
物质和性质不同
按树状分类法可以对化学物质进行如下分类:
教学过程
思考:
只由一种元素组成的物质一定是纯净物吗?
解析:只由一种元素组成的物质不一定是纯净物。
例如:碳元素的同素异形体是石墨、金刚石和C60形成的混合物,只由碳元素组成,不是纯净物。
每一种元素都能自身组成单质,有的单质有多种形态,如碳元素形成的单质有金刚石、石墨和C60;氧元素形成的单质有氧气和臭氧;磷元素形成的单质有白磷和红磷等。像这样由同一种元素形成的几种性质不同的单质,叫做同素异形体。
教学过程
(2)同素异形体
定义
同种元素组成不同的单质
形成方式
①原子个数不同
②原子排列方式不同
性质差异
主要体现在物理性质上
相互转化
属于化学变化
常见同素异形体
(1)定义:由同种元素组成的纯净物(同种元素可能会组成不同的单质)
同素异形体
①金刚石、石墨和C60
②O2和O3
③P(红磷)和P4(白磷)
教学过程
特点:多种物质的分类呈“并列”和“交叉”关系。
(2)交叉分类法
对同一种物质按不同的标准分类的方法。
优点:可从不同角度了解各种物质,对事物了解更全面。
教学过程
3.对酸、碱、盐、氧化物分类
(1)酸
酸
酸性强弱
强酸
中强酸
弱酸
H2SO3、H3PO4 、H2C2O4
H2SO4、HNO3 、HCl、HClO4、HI、HBr
H2CO3、CH3COOH、HClO、HF、H2S
电离出H+数目
一元酸
二元酸
多元酸
HNO3 、HCl、HClO4、HI、HBr、CH3COOH、HClO、HF
H2SO4、H2SO3、H2C2O4、H2CO3
H3PO4
是否含氧元素
含氧酸
无氧酸
HNO3 、HClO4、H2SO3、H3PO4 、H2C2O4、
CH3COOH、HClO、H2CO3、CH3COOH、HClO
HCl、HI、HBr、HF、H2S
教学过程
3.对酸、碱、盐、氧化物分类
(2)碱
碱
碱性强弱
强碱
中强碱
弱碱
Mg(OH)2
NaOH、KOH、Ca(OH)2、Ba(OH)2
NH3·H2O 、Cu(OH)2、Fe(OH)3、 Zn(OH)2
电离出OH-数目
一元碱
二元碱
多元碱
NaOH、KOH、NH3·H2O
Ca(OH)2、Ba(OH)2、Mg(OH)2、Cu(OH)2、Zn(OH)2
Fe(OH)3
溶解性
可溶碱
难溶酸
微溶碱
NaOH、KOH、Ba(OH)2、NH3·H2O
Ca(OH)2
Mg(OH)2、Cu(OH)2、Fe(OH)3、 Zn(OH)2
教学过程
3.对酸、碱、盐、氧化物分类
(3)盐
盐
组成
金属阳离子或铵根离子
酸根离子
硫酸盐、硝酸盐、碳酸盐等
钠盐、钾盐、铵盐等
溶解性
可溶盐
NaCl、K2SO4、AgNO3
CaSO4、Ag2SO4、MgCO3
BaCO3 AgCl BaSO4
性质
微溶盐
难溶盐
正盐
酸式盐
碱式盐
K2SO4、Na2CO3
NaHCO3、NaHSO4
Cu2(OH)2CO3
教学过程
3.对酸、碱、盐、氧化物分类
(4)氧化物
氧化物
组成
金属氧化物
CuO MgO CaO
CO2、SO2、NO
性质
酸性氧化物
碱性氧化物
两性氧化物
非金属氧化物
能与酸反应生成盐和水的氧化物 CO2、SO2、Mn2O7
能与碱反应生成盐和水的氧化物
既能与酸又能与碱起反应,且均生成盐和水的氧化物
CuO MgO CaO
Al2O3
不成盐氧化物 CO、NO
成盐
教学过程
(1)酸性氧化物不一定是非金属氧化物,如Mn2O7。
(2)非金属氧化物不一定都是酸性氧化物,如CO、NO。
(3)碱性氧化物一定是金属氧化物。
(4)金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3 是两性氧化物
酸性氧化物和碱性氧化物的理解
典例1.下列物质分类正确的是( )
选项 酸性氧化物 碱性氧化物 酸 碱 盐
A CO2 Mn2O7 H2SO4 KOH NaHCO3
B CO Na2O HCl NaOH NaCl
C SO2 CuO CH3COOH Na2CO3 CaF2
D SO3 CaO HNO3 Ca(OH)2 CaCO3
【答案】D
【解析】Mn2O7为酸性氧化物,A项错误;CO既不能与酸反应生成盐和水,又不能与碱反应生成盐和水,属于不成盐氧化物,B项错误;Na2CO3是盐,C项错误。
课堂练习
课堂练习
如图表示的一些物质或概念间的从属关系不正确的是( )
A.X为含氧酸、Y为酸、Z为化合物
B.X为氧化物、Y为化合物、Z为纯净物
C.X为强碱、Y为碱、Z为化合物
D.X为非金属氧化物、Y为酸性氧化物、Z为氧化物
典例2.
【答案】D
【解析】化合物可以分为酸、碱、盐、氧化物等,按分子组成中是否含氧元素,酸可分为含氧酸和无氧酸,A项正确;纯净物分为单质和化合物,化合物可以分为酸、碱、盐、氧化物等,B项正确;化合物可以分为酸、碱、盐、氧化物等,按解离程度不同,碱可分为强碱、弱碱等,C项正确;氧化物可以分为酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物,酸性氧化物不一定是非金属氧化物(如Mn2O7等),非金属氧化物也不一定是酸性氧化物(如CO等),酸性氧化物和非金属氧化物属于交叉关系,D项错误。
课堂练习
2019年12月以来,我国部分地区突发的新型冠状病毒肺炎威胁着人们的身体健康。“84”消毒液(主要成分为NaClO)是人们常用的消毒剂。下列关于“84”消毒液及其主要成分的说法正确的是( )
A.“84”消毒液是纯净物
B.NaClO属于氧化物
C.NaClO属于盐
D.NaClO属于碱
典例3.
【答案】C
【解析】“84”消毒液的主要成分为NaClO,NaClO属于盐。
典例4.
按照物质的交叉分类方法判断,HNO3属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸
⑥挥发性酸 ⑦一元酸 ⑧化合物 ⑨混合物
A.②④⑤⑥⑦⑧ B.①④⑥⑦⑧
C.①③⑤⑨ D.①④⑤⑦⑧
课堂练习
【答案】B
【解析】HNO3属于酸、含氧酸、挥发性酸、 一元酸、化合物。
课堂练习
我国科学家预言的T 碳(四个碳原子构成的正四面体分别取代金刚石结构中所有碳原子,如图)已在实验室成功合成。T 碳属于( )
A.混合物
B.化合物
C.氧化物
D.单质
典例5.
【答案】D
【解析】该物质只由一种元素即碳元素组成,属于单质。
课堂练习
科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等,它们之间的关系是( )
A.同一物质 B.同种化合物
C.互为同素异形体 D.无法判断
典例6.
【答案】C
【解析】C50、C70、C120、C540都是由碳元素组成的不同单质,它们互称为同素异形体。
课堂小结
树状分类法
课堂小结
交叉分类法
课后小任务
课后分小组,查阅资料,了解生活垃圾是如何分类的?分类的依据是什么?
感 谢 倾 听
