【核心素养目标】人教版(2019)高二化学选择性必修一 1.1 反应热(第1课时 反应热 焓变)课件
文档属性
| 名称 | 【核心素养目标】人教版(2019)高二化学选择性必修一 1.1 反应热(第1课时 反应热 焓变)课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 42.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-06 09:47:50 | ||
图片预览







文档简介
(共20张PPT)
第一节 反应热
第1课时 反应热 焓变
人教版选择性必修1
学习目标
1.能辨识化学反应中的能量转化形式,能解释化学反应中能量变化的本质。
2.结合真实情境中的应用实例,能从多角度认识放热反应和吸热反应。认识化学反应中能量变化在生活、生产中的应用。
3.能运用反应焓变合理选择和利用化学反应。
学习目标
1.能从宏观和微观相结合的视角分析化学反应中的能量变化。培养学生“宏观辨识与微观探析”的学科素养。
2.知道化学变化需要一定的条件,并遵循一定规律;认识化学变化的本质是有新物质生成,并伴有能量的转化。培养学生“变化观念与平衡思想”的学科素养。
3.通过建立节约资源、保护环境的可持续发展意识。从自身做起,形成简约适度、绿色低碳的生活方式。培养学生“科学态度与社会责任”的学科素养。
素养目标
“神舟”火箭发射精彩瞬间
神舟十六号载人飞船北京时间2023年5月30日发射,执行神舟十六号发射任务的长征二号F遥十六运载火箭
情境引入
情境引入
热量的释放或吸收是化学反应中能量变化的常见形式。化学反应过程中释放或吸收的热量在生活、生产和科学研究中具有广泛的应用。
回顾旧知
③ 酸碱
中和反应
①燃烧
④ 大部分
化合反应
②金属与水
/酸反应
⑤ 铝热
反应
0 1
生活中常见的放热反应
回顾旧知
③Ba(OH)2·8H2O
和NH4Cl反应
① C/CO/H2 还原
金属氧化物
②大多分解反应
KMnO4
0 2
生活中常见的吸热反应
情境引入
KMnO4
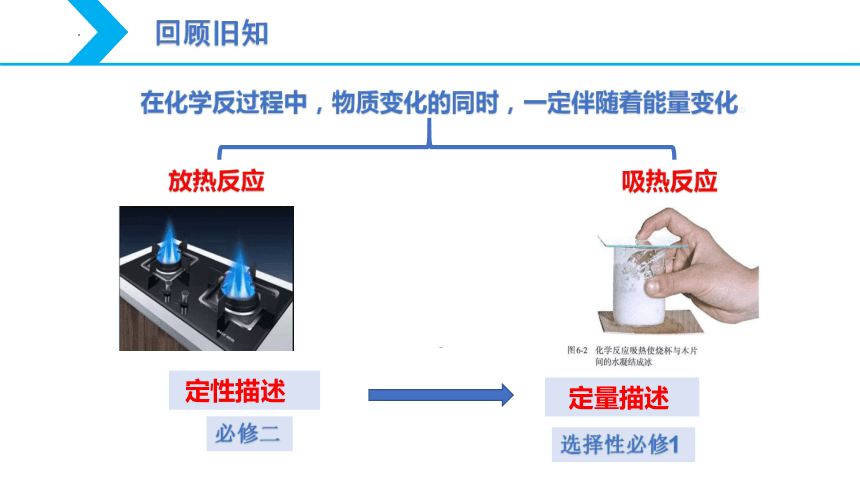
在化学反过程中,物质变化的同时,一定伴随着能量变化。
放热反应
吸热反应
定性描述
定量描述
必修二
选择性必修1
回顾旧知
教学过程
一、反应热与焓变
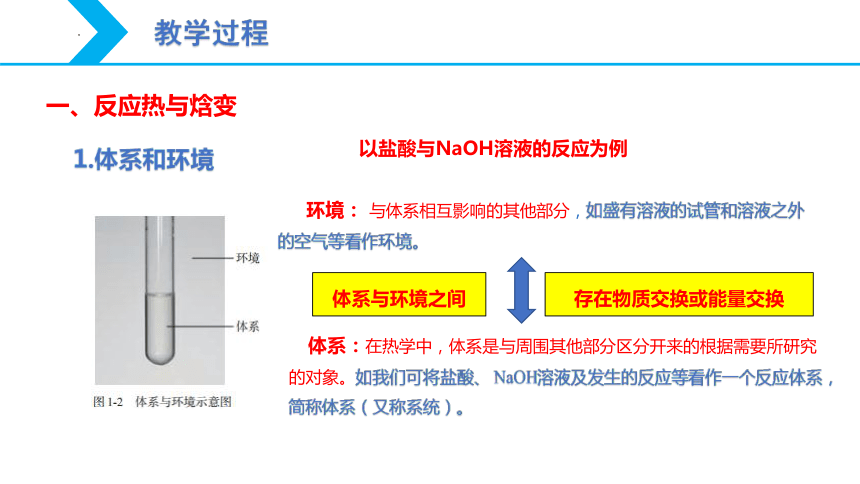
1.体系和环境
以盐酸与NaOH溶液的反应为例
环境: 与体系相互影响的其他部分,如盛有溶液的试管和溶液之外的空气等看作环境。
体系:在热学中,体系是与周围其他部分区分开来的根据需要所研究的对象。如我们可将盐酸、 NaOH溶液及发生的反应等看作一个反应体系,简称体系(又称系统)。
存在物质交换或能量交换
体系与环境之间
教学过程
2.反应热与焓变
(1)反应热
①含义:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
(2)内能、焓、焓变
①内能(符号为U ):体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响。
教学过程
②焓(符号为H ):与物质内能有关的物理量
③焓变:焓变( H):是变化前后物质的焓值差,化学反应的焓变,为生成物的总焓值与反应物的总焓值之差,即:ΔH=H(生成物)-H(反应物)
④在等压条件下进行的化学反应(严格地说,对反应体系做功还有限定,中学阶段一般不考虑),其反应热等于反应的焓变,符号:ΔH,单位:kJ/mol(或kJ·mol-1)
⑤意义:当反应体系放热时其焓减小,ΔH 为负值,即ΔH<0。
当反应体系吸热时其焓增大,ΔH 为正值,即ΔH>0。
教学过程
(3)从反应物与生成物总能量的相对大小分析焓变
① 放热反应(ΔH<0):反应物的总能量大于生成物的总能量。
② 吸热反应(ΔH>0):反应物的总能量小于生成物的总能量。
③计算公式:ΔH = 生成物的总能量-反应物的总能量
教学过程
(4)从反应物与生成物总键能的相对大小分析焓变
教学过程
(4)从反应物与生成物总键能的相对大小分析焓变
以H2(g)+Cl2(g)===2HCl(g)反应的能量变化为例说明:
计算公式:ΔH = 反应物的总键能-生成物的总键能
典例1.
下列说法正确的是( )
A.焓变单位中kJ·mol-1,是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热, ΔH 为“-”
D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH 为“+”
【答案】C
【解析】焓变单位中的kJ·mol-1,是指每摩尔具体的反应,不一定指参加反应的物质,A错;在反应中物质所具有的总能量减少,反应就放热,反之就吸热,C对;化学反应的实质是旧化学键的断裂,新化学键的形成,断键时吸收能量,成键时放出能量,所以D错。
课堂练习
化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是( )
A.每生成2个AB分子吸收(a-b)kJ热量
B.该反应热ΔH=+(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
典例2.
【答案】B
课堂练习
根据键能数据计算CH4(g)+4F2(g) =CF4(g)+4HF(g)的反应热ΔH 为( )
化学键 C—H C—F H—F F—F
键能/kJ·mol-1 414 489 565 155
A.-1 940 kJ·mol-1 B.+1 940 kJ·mol-1
C.-485 kJ·mol-1 D.+485 kJ·mol-1
典例3.
【答案】A
【解析】由“ΔH=反应物键能之和-生成物键能之和”可知:ΔH=(414×4+155×4-489×4-565×4) kJ·mol-1=-1 940 kJ·mol-1。
课堂练习
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如图所示;现提供以下化学键的键能;P—P键键能为198 kJ·mol-1、P—O键键能为360 kJ·mol-1、氧气分子内氧原子间的键能为498 kJ·mol-1,则P4(s)+3O2(g) === P4O6(s)的反应热ΔH为( )
A.+1 638 kJ·mol-1 B.-1 638 kJ·mol-1
C.-126 kJ·mol-1 D.+126 kJ·mol-1
典例4.
【答案】B
【解析】反应热ΔH=反应物总键能-生成物总键能,所以反应P4(s)+3O2(g)===P4O6(s)的反应热ΔH=6×198 kJ·mol-1+3×498 kJ·mol-1-12×360 kJ·mol-1=-1 638 kJ·mol-1。
课堂练习
课堂小结
H=∑H(生成物)- ∑H(反应物
H=∑E (反应物键能)-∑E (生成物键能)
课后小任务
感 谢 倾 听
第一节 反应热
第1课时 反应热 焓变
人教版选择性必修1
学习目标
1.能辨识化学反应中的能量转化形式,能解释化学反应中能量变化的本质。
2.结合真实情境中的应用实例,能从多角度认识放热反应和吸热反应。认识化学反应中能量变化在生活、生产中的应用。
3.能运用反应焓变合理选择和利用化学反应。
学习目标
1.能从宏观和微观相结合的视角分析化学反应中的能量变化。培养学生“宏观辨识与微观探析”的学科素养。
2.知道化学变化需要一定的条件,并遵循一定规律;认识化学变化的本质是有新物质生成,并伴有能量的转化。培养学生“变化观念与平衡思想”的学科素养。
3.通过建立节约资源、保护环境的可持续发展意识。从自身做起,形成简约适度、绿色低碳的生活方式。培养学生“科学态度与社会责任”的学科素养。
素养目标
“神舟”火箭发射精彩瞬间
神舟十六号载人飞船北京时间2023年5月30日发射,执行神舟十六号发射任务的长征二号F遥十六运载火箭
情境引入
情境引入
热量的释放或吸收是化学反应中能量变化的常见形式。化学反应过程中释放或吸收的热量在生活、生产和科学研究中具有广泛的应用。
回顾旧知
③ 酸碱
中和反应
①燃烧
④ 大部分
化合反应
②金属与水
/酸反应
⑤ 铝热
反应
0 1
生活中常见的放热反应
回顾旧知
③Ba(OH)2·8H2O
和NH4Cl反应
① C/CO/H2 还原
金属氧化物
②大多分解反应
KMnO4
0 2
生活中常见的吸热反应
情境引入
KMnO4
在化学反过程中,物质变化的同时,一定伴随着能量变化。
放热反应
吸热反应
定性描述
定量描述
必修二
选择性必修1
回顾旧知
教学过程
一、反应热与焓变
1.体系和环境
以盐酸与NaOH溶液的反应为例
环境: 与体系相互影响的其他部分,如盛有溶液的试管和溶液之外的空气等看作环境。
体系:在热学中,体系是与周围其他部分区分开来的根据需要所研究的对象。如我们可将盐酸、 NaOH溶液及发生的反应等看作一个反应体系,简称体系(又称系统)。
存在物质交换或能量交换
体系与环境之间
教学过程
2.反应热与焓变
(1)反应热
①含义:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
(2)内能、焓、焓变
①内能(符号为U ):体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响。
教学过程
②焓(符号为H ):与物质内能有关的物理量
③焓变:焓变( H):是变化前后物质的焓值差,化学反应的焓变,为生成物的总焓值与反应物的总焓值之差,即:ΔH=H(生成物)-H(反应物)
④在等压条件下进行的化学反应(严格地说,对反应体系做功还有限定,中学阶段一般不考虑),其反应热等于反应的焓变,符号:ΔH,单位:kJ/mol(或kJ·mol-1)
⑤意义:当反应体系放热时其焓减小,ΔH 为负值,即ΔH<0。
当反应体系吸热时其焓增大,ΔH 为正值,即ΔH>0。
教学过程
(3)从反应物与生成物总能量的相对大小分析焓变
① 放热反应(ΔH<0):反应物的总能量大于生成物的总能量。
② 吸热反应(ΔH>0):反应物的总能量小于生成物的总能量。
③计算公式:ΔH = 生成物的总能量-反应物的总能量
教学过程
(4)从反应物与生成物总键能的相对大小分析焓变
教学过程
(4)从反应物与生成物总键能的相对大小分析焓变
以H2(g)+Cl2(g)===2HCl(g)反应的能量变化为例说明:
计算公式:ΔH = 反应物的总键能-生成物的总键能
典例1.
下列说法正确的是( )
A.焓变单位中kJ·mol-1,是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热, ΔH 为“-”
D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH 为“+”
【答案】C
【解析】焓变单位中的kJ·mol-1,是指每摩尔具体的反应,不一定指参加反应的物质,A错;在反应中物质所具有的总能量减少,反应就放热,反之就吸热,C对;化学反应的实质是旧化学键的断裂,新化学键的形成,断键时吸收能量,成键时放出能量,所以D错。
课堂练习
化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是( )
A.每生成2个AB分子吸收(a-b)kJ热量
B.该反应热ΔH=+(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
典例2.
【答案】B
课堂练习
根据键能数据计算CH4(g)+4F2(g) =CF4(g)+4HF(g)的反应热ΔH 为( )
化学键 C—H C—F H—F F—F
键能/kJ·mol-1 414 489 565 155
A.-1 940 kJ·mol-1 B.+1 940 kJ·mol-1
C.-485 kJ·mol-1 D.+485 kJ·mol-1
典例3.
【答案】A
【解析】由“ΔH=反应物键能之和-生成物键能之和”可知:ΔH=(414×4+155×4-489×4-565×4) kJ·mol-1=-1 940 kJ·mol-1。
课堂练习
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如图所示;现提供以下化学键的键能;P—P键键能为198 kJ·mol-1、P—O键键能为360 kJ·mol-1、氧气分子内氧原子间的键能为498 kJ·mol-1,则P4(s)+3O2(g) === P4O6(s)的反应热ΔH为( )
A.+1 638 kJ·mol-1 B.-1 638 kJ·mol-1
C.-126 kJ·mol-1 D.+126 kJ·mol-1
典例4.
【答案】B
【解析】反应热ΔH=反应物总键能-生成物总键能,所以反应P4(s)+3O2(g)===P4O6(s)的反应热ΔH=6×198 kJ·mol-1+3×498 kJ·mol-1-12×360 kJ·mol-1=-1 638 kJ·mol-1。
课堂练习
课堂小结
H=∑H(生成物)- ∑H(反应物
H=∑E (反应物键能)-∑E (生成物键能)
课后小任务
感 谢 倾 听
