第三章 第二节 第4课时 酸碱中和滴定 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1
文档属性
| 名称 | 第三章 第二节 第4课时 酸碱中和滴定 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1 |
|
|
| 格式 | docx | ||
| 文件大小 | 760.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-05 00:00:00 | ||
图片预览





文档简介
第4课时 酸碱中和滴定
[核心素养发展目标]
1.理解中和滴定的原理。会选择中和滴定的指示剂。
2.熟悉中和滴定实验仪器及使用。掌握中和滴定的实验操作方法。
3.能通过酸碱中和滴定测定酸或碱的浓度,掌握数据分析与处理的方法,培养定量研究的意识。
一、酸碱中和滴定实验
1.概念和原理
(1)概念
酸碱中和滴定是依据中和反应,用____________的酸(或碱)来测定____________的碱(或酸)的方法。
(2)原理
在中和反应中,酸提供的H+与碱提供的OH-的____________相等,即c(H+)·V酸=____________,则c(H+)=或c(OH-)=。
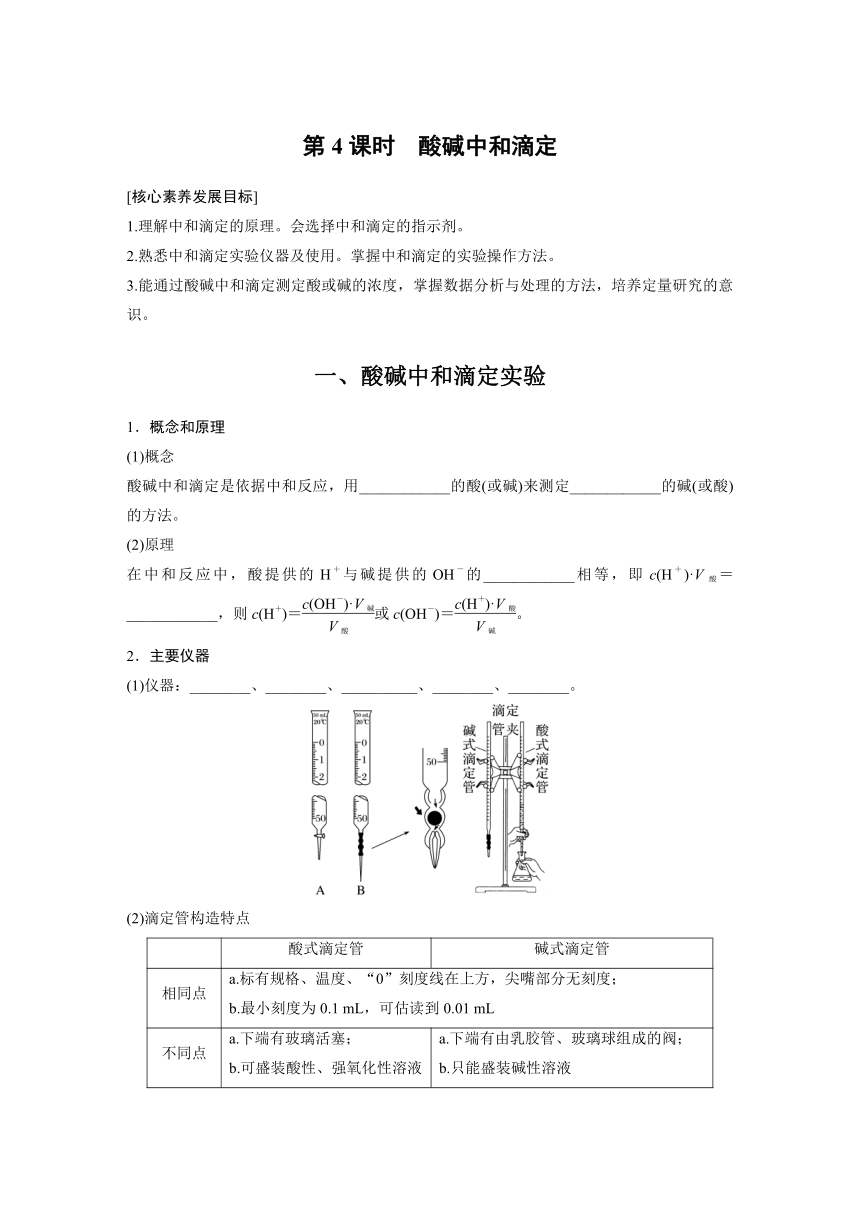
2.主要仪器
(1)仪器:________、________、__________、________、________。
(2)滴定管构造特点
酸式滴定管 碱式滴定管
相同点 a.标有规格、温度、“0”刻度线在上方,尖嘴部分无刻度; b.最小刻度为0.1 mL,可估读到0.01 mL
不同点 a.下端有玻璃活塞; b.可盛装酸性、强氧化性溶液 a.下端有由乳胶管、玻璃球组成的阀; b.只能盛装碱性溶液
注意事项 a.将液面在0 mL处的25 mL的酸式滴定管中的液体全部放出,液体的体积大于25 mL,因为尖嘴部分无刻度。
b.使用聚四氟乙烯活塞的滴定管为酸碱通用滴定管。
3.主要试剂
(1)待测液;(2)标准液;(3)指示剂。
4.指示剂的选择
(1)原理
由曲线可以看出,在酸、碱中和滴定过程中,在接近滴定终点时溶液的pH有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计。
(2)指示剂的选择
若滴定终点为碱性时,选择________;酸性时,选择__________;中性时,酚酞、甲基橙均可以。一般不选择石蕊,变色现象不明显。
指示剂 变色范围(颜色与pH的关系)
石蕊 <5.0____色 5.0~8.0紫色 >8.0____色
酚酞 <8.2____色 8.2~10.0浅红色 >10.0____色
甲基橙 <3.1____色 3.1~4.4橙色 >4.4____色
5.滴定操作
(1)滴定前准备
(2)滴定
注意 滴速:先快后慢,接近终点时,应一滴一摇,甚至半滴一摇,利用锥形瓶内壁承接尖嘴处悬挂的半滴溶液。
(3)终点判断
等到滴入最后半滴标准液,指示剂变色,且在半分钟内__________原来的颜色,视为滴定终点并记录此时滴定管的读数。
6.数据处理
为减少实验误差,重复实验2~3次,根据每次所用标准溶液的体积计算待测液的物质的量浓度,最后求出待测液的物质的量浓度的________。
(1)一支标有“20 ℃、25 mL”字样的滴定管内装液体到刻度1.00 mL时,管内液体的体积大于24.00 mL( )
(2)用50 mL酸式滴定管可准确量取25.00 mL KMnO4溶液( )
(3)“中和滴定”实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,必须润洗后方可使用( )
(4)当观察到锥形瓶中颜色发生变化,立即停止滴定并记下滴定管液面读数( )
(5)量取20.00 mL待测液时可用量筒量取( )
(6)滴定管盛标准溶液时,调液面一定要调到“0”刻度( )
用酸碱中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,不可选用________(填字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视________________________________________________;在铁架台上垫一张白纸,其目的是________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是__________ mol·L-1,烧碱样品的纯度是________。
滴定次数 待测溶液体积/mL 标准酸溶液体积
滴定前的刻度/mL 滴定后的刻度/mL
第一次 10.00 0.40 20.50
第二次 10.00 4.10 24.00
滴定终点的判断答题模板
二、中和滴定误差分析
1.分析依据
c待测·V待测=c标准·V标准,c待测=
c标准、V待测均为代入定值,误差均体现在________的大小。
2.常见的误差分析
(1)以用标准盐酸滴定待测氢氧化钠溶液为例:
步骤 操作 V标准 c待测
洗涤 酸式滴定管未用标准溶液润洗
碱式滴定管未用标准溶液润洗
锥形瓶用待测溶液润洗
锥形瓶洗净后还留有蒸馏水
取液 放出碱液的滴定管开始有气泡,放出液体后气泡消失
滴定 酸式滴定管滴定前有气泡,滴定终点时气泡消失
振荡锥形瓶时部分液体溅出
部分酸液滴出锥形瓶外
溶液颜色较浅时滴入酸液过快,停止滴定后再加一滴NaOH溶液无变化
读数 滴定前读数正确,滴定后俯视读数(或前仰后俯)
滴定前读数正确,滴定后仰视读数(或前俯后仰)
(2)在进行误差分析时,要特别注意弄懂俯视(视线偏高)及仰视(视线偏低)的含义,并会区分俯视、仰视对量筒、滴定管产生误差的不同(如图)。
下列图示读数对滴定结果的影响如下:
①如图Ⅰ,开始仰视读数,滴定完毕俯视读数,滴定结果会偏小。
②如图Ⅱ,开始俯视读数,滴定完毕仰视读数,滴定结果会偏大。
1.称取一定质量的NaOH来测定未知浓度的盐酸时(NaOH放在锥形瓶内,盐酸放在滴定管中)。用A.偏高;B.偏低;C.无影响;D.无法判断,填写下列各项操作会给实验造成的误差。
(1)称量固体NaOH时,未调节天平的零点( )
(2)将NaOH放入锥形瓶中加水溶解时,加入水的体积不准确( )
(3)滴定管装入盐酸前未用盐酸润洗( )
(4)开始滴定时,滴定管尖端处有气泡,滴定完毕气泡排出( )
(5)滴定前未将液面调至刻度线“0”或“0”以下,结束时初始读数按0计算( )
(6)在滴定过程中活塞处漏液( )
(7)摇动锥形瓶时,因用力过猛,使少量溶液溅出( )
(8)滴定前仰视读数,滴定完毕俯视读数( )
2.某同学用中和滴定法测定某烧碱溶液的浓度。
Ⅰ.实验步骤:
(1)用仪器________(填“A”或“B”)量取待测烧碱溶液25.00 mL于锥形瓶中,滴加2滴酚酞作指示剂。
(2)记录盛装0.100 0 mol·L-1标准盐酸的酸式滴定管的初始读数。
如果某时刻液面位置如图所示,则此时的读数为______ mL。
(3)滴定。滴定过程中,眼睛应始终注视______________________________________。
(4)滴定终点的现象是______________________________________________________。
Ⅱ.数据记录:
实验编号 烧碱待测液体积V/mL 标准盐酸体积(消耗)V/mL
1 25.00 18.05
2 25.00 18.00
3 25.00 17.95
4 25.00 18.95
Ⅲ.数据处理:
计算该烧碱溶液的浓度c(NaOH)=________ mol·L-1(精确到小数点后4位)。
Ⅳ.误差分析:
以下操作会导致测定结果偏高的是________(填字母)。
A.未用盐酸标准溶液润洗滴定管
B.装待测液前,锥形瓶中有少量蒸馏水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.读数时,滴定前仰视,滴定后俯视
第4课时 酸碱中和滴定
[核心素养发展目标] 1.理解中和滴定的原理。会选择中和滴定的指示剂。2.熟悉中和滴定实验仪器及使用。掌握中和滴定的实验操作方法。3.能通过酸碱中和滴定测定酸或碱的浓度,掌握数据分析与处理的方法,培养定量研究的意识。
一、酸碱中和滴定实验
1.概念和原理
(1)概念
酸碱中和滴定是依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。
(2)原理
在中和反应中,酸提供的H+与碱提供的OH-的物质的量相等,即c(H+)·V酸=c(OH-)·V碱,则c(H+)=或c(OH-)=。
2.主要仪器
(1)仪器:滴定管、铁架台、滴定管夹、锥形瓶、烧杯。
(2)滴定管构造特点
酸式滴定管 碱式滴定管
相同点 a.标有规格、温度、“0”刻度线在上方,尖嘴部分无刻度; b.最小刻度为0.1 mL,可估读到0.01 mL
不同点 a.下端有玻璃活塞; b.可盛装酸性、强氧化性溶液 a.下端有由乳胶管、玻璃球组成的阀; b.只能盛装碱性溶液
注意事项 a.将液面在0 mL处的25 mL的酸式滴定管中的液体全部放出,液体的体积大于25 mL,因为尖嘴部分无刻度。
b.使用聚四氟乙烯活塞的滴定管为酸碱通用滴定管。
3.主要试剂
(1)待测液;(2)标准液;(3)指示剂。
4.指示剂的选择
(1)原理
由曲线可以看出,在酸、碱中和滴定过程中,在接近滴定终点时溶液的pH有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计。
(2)指示剂的选择
若滴定终点为碱性时,选择酚酞;酸性时,选择甲基橙;中性时,酚酞、甲基橙均可以。一般不选择石蕊,变色现象不明显。
指示剂 变色范围(颜色与pH的关系)
石蕊 <5.0红色 5.0~8.0紫色 >8.0蓝色
酚酞 <8.2无色 8.2~10.0浅红色 >10.0红色
甲基橙 <3.1红色 3.1~4.4橙色 >4.4黄色
5.滴定操作
(1)滴定前准备
(2)滴定
注意 滴速:先快后慢,接近终点时,应一滴一摇,甚至半滴一摇,利用锥形瓶内壁承接尖嘴处悬挂的半滴溶液。
(3)终点判断
等到滴入最后半滴标准液,指示剂变色,且在半分钟内不恢复原来的颜色,视为滴定终点并记录此时滴定管的读数。
6.数据处理
为减少实验误差,重复实验2~3次,根据每次所用标准溶液的体积计算待测液的物质的量浓度,最后求出待测液的物质的量浓度的平均值。
(1)一支标有“20 ℃、25 mL”字样的滴定管内装液体到刻度1.00 mL时,管内液体的体积大于24.00 mL( )
(2)用50 mL酸式滴定管可准确量取25.00 mL KMnO4溶液( )
(3)“中和滴定”实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,必须润洗后方可使用( )
(4)当观察到锥形瓶中颜色发生变化,立即停止滴定并记下滴定管液面读数( )
(5)量取20.00 mL待测液时可用量筒量取( )
(6)滴定管盛标准溶液时,调液面一定要调到“0”刻度( )
答案 (1)√ (2)√ (3)√ (4)× (5)× (6)×
用酸碱中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在__________________________________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,不可选用________(填字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视________________________________________________;在铁架台上垫一张白纸,其目的是_________________________________________________________
_______________________________________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是__________ mol·L-1,烧碱样品的纯度是________。
滴定次数 待测溶液体积/mL 标准酸溶液体积
滴定前的刻度/mL 滴定后的刻度/mL
第一次 10.00 0.40 20.50
第二次 10.00 4.10 24.00
答案 (1)A (2)B (3)锥形瓶内溶液颜色的变化 便于观察锥形瓶内液体颜色的变化,减小滴定误差 (4)0.400 0 97.56%
解析 (1)称量氢氧化钠等易潮解、腐蚀性强的试剂时,样品应放在小烧杯中。(2)酸碱中和滴定时,一般选甲基橙、酚酞等颜色变化较明显的指示剂,石蕊在酸或碱溶液中颜色变化不明显,易造成误差。(4)根据c(NaOH)=分别求第一、二次的值,再求平均值,解得c(NaOH)=0.400 0 mol·L-1,w(NaOH)=×100%≈97.56%。
滴定终点的判断答题模板
二、中和滴定误差分析
1.分析依据
c待测·V待测=c标准·V标准,c待测=
c标准、V待测均为代入定值,误差均体现在V标准的大小。
2.常见的误差分析
(1)以用标准盐酸滴定待测氢氧化钠溶液为例:
步骤 操作 V标准 c待测
洗涤 酸式滴定管未用标准溶液润洗 变大 偏高
碱式滴定管未用标准溶液润洗 变小 偏低
锥形瓶用待测溶液润洗 变大 偏高
锥形瓶洗净后还留有蒸馏水 不变 无影响
取液 放出碱液的滴定管开始有气泡,放出液体后气泡消失 变小 偏低
滴定 酸式滴定管滴定前有气泡,滴定终点时气泡消失 变大 偏高
振荡锥形瓶时部分液体溅出 变小 偏低
部分酸液滴出锥形瓶外 变大 偏高
溶液颜色较浅时滴入酸液过快,停止滴定后再加一滴NaOH溶液无变化 变大 偏高
读数 滴定前读数正确,滴定后俯视读数(或前仰后俯) 变小 偏低
滴定前读数正确,滴定后仰视读数(或前俯后仰) 变大 偏高
(2)在进行误差分析时,要特别注意弄懂俯视(视线偏高)及仰视(视线偏低)的含义,并会区分俯视、仰视对量筒、滴定管产生误差的不同(如图)。
下列图示读数对滴定结果的影响如下:
①如图Ⅰ,开始仰视读数,滴定完毕俯视读数,滴定结果会偏小。
②如图Ⅱ,开始俯视读数,滴定完毕仰视读数,滴定结果会偏大。
1.称取一定质量的NaOH来测定未知浓度的盐酸时(NaOH放在锥形瓶内,盐酸放在滴定管中)。用A.偏高;B.偏低;C.无影响;D.无法判断,填写下列各项操作会给实验造成的误差。
(1)称量固体NaOH时,未调节天平的零点( )
(2)将NaOH放入锥形瓶中加水溶解时,加入水的体积不准确( )
(3)滴定管装入盐酸前未用盐酸润洗( )
(4)开始滴定时,滴定管尖端处有气泡,滴定完毕气泡排出( )
(5)滴定前未将液面调至刻度线“0”或“0”以下,结束时初始读数按0计算( )
(6)在滴定过程中活塞处漏液( )
(7)摇动锥形瓶时,因用力过猛,使少量溶液溅出( )
(8)滴定前仰视读数,滴定完毕俯视读数( )
答案 (1)D (2)C (3)B (4)B (5)A (6)B (7)A (8)A
解析 (1)称量固体NaOH时,未调节天平零点,不能确定称量结果是偏高还是偏低。(2)锥形瓶内是否含水或加多少水并不影响NaOH与HCl的中和反应。(3)滴定管中装盐酸前未润洗相当于将待测液稀释了,导致测定结果偏低。(4)滴定前有气泡,滴定后无气泡,相当于待测液比实际用量多了,导致结果偏低。(5)读出的数据比实际值小,导致结果偏高。(6)滴定过程中漏液使读出的待测液的体积比实际消耗量多,导致结果偏低。(7)摇动锥形瓶时,用力过猛,使少量液体溅出,致使一部分NaOH未被中和,消耗待测液体积减小,使测定结果偏高。
(8)读出的数据比实际值偏小,使结果偏高。
2.某同学用中和滴定法测定某烧碱溶液的浓度。
Ⅰ.实验步骤:
(1)用仪器________(填“A”或“B”)量取待测烧碱溶液25.00 mL于锥形瓶中,滴加2滴酚酞作指示剂。
(2)记录盛装0.100 0 mol·L-1标准盐酸的酸式滴定管的初始读数。
如果某时刻液面位置如图所示,则此时的读数为______ mL。
(3)滴定。滴定过程中,眼睛应始终注视______________________________________。
(4)滴定终点的现象是______________________________________________________。
Ⅱ.数据记录:
实验编号 烧碱待测液体积V/mL 标准盐酸体积(消耗)V/mL
1 25.00 18.05
2 25.00 18.00
3 25.00 17.95
4 25.00 18.95
Ⅲ.数据处理:
计算该烧碱溶液的浓度c(NaOH)=____ mol·L-1(精确到小数点后4位)。
Ⅳ.误差分析:
以下操作会导致测定结果偏高的是________(填字母)。
A.未用盐酸标准溶液润洗滴定管
B.装待测液前,锥形瓶中有少量蒸馏水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.读数时,滴定前仰视,滴定后俯视
答案 Ⅰ.(1)A (2)0.70 (3)锥形瓶中溶液的颜色变化 (4)滴入最后半滴标准溶液后溶液由红色恰好变为无色且半分钟内不恢复原色
Ⅲ.0.072 0 Ⅳ.AC
解析 Ⅲ.在四组数据中,第4组数据有明显误差,故舍弃。c1(NaOH)==0.072 2 mol·L-1,同理可得c2(NaOH)=0.072 0 mol·L-1,c3(NaOH)=0.071 8 mol·L-1,则c(NaOH)==0.072 0 mol·L-1。Ⅳ.A项,未用盐酸标准溶液润洗滴定管,造成盐酸浓度偏小,所用盐酸体积偏大,测定结果偏高;B项,装待测液前,锥形瓶中有少量蒸馏水,无影响;C项,滴定前滴定管尖嘴部分有气泡,滴定后气泡消失,所用盐酸体积偏大,测定结果偏高;D项,读数时,滴定前仰视,滴定后俯视,造成盐酸读数偏小,结果偏低。
[核心素养发展目标]
1.理解中和滴定的原理。会选择中和滴定的指示剂。
2.熟悉中和滴定实验仪器及使用。掌握中和滴定的实验操作方法。
3.能通过酸碱中和滴定测定酸或碱的浓度,掌握数据分析与处理的方法,培养定量研究的意识。
一、酸碱中和滴定实验
1.概念和原理
(1)概念
酸碱中和滴定是依据中和反应,用____________的酸(或碱)来测定____________的碱(或酸)的方法。
(2)原理
在中和反应中,酸提供的H+与碱提供的OH-的____________相等,即c(H+)·V酸=____________,则c(H+)=或c(OH-)=。
2.主要仪器
(1)仪器:________、________、__________、________、________。
(2)滴定管构造特点
酸式滴定管 碱式滴定管
相同点 a.标有规格、温度、“0”刻度线在上方,尖嘴部分无刻度; b.最小刻度为0.1 mL,可估读到0.01 mL
不同点 a.下端有玻璃活塞; b.可盛装酸性、强氧化性溶液 a.下端有由乳胶管、玻璃球组成的阀; b.只能盛装碱性溶液
注意事项 a.将液面在0 mL处的25 mL的酸式滴定管中的液体全部放出,液体的体积大于25 mL,因为尖嘴部分无刻度。
b.使用聚四氟乙烯活塞的滴定管为酸碱通用滴定管。
3.主要试剂
(1)待测液;(2)标准液;(3)指示剂。
4.指示剂的选择
(1)原理
由曲线可以看出,在酸、碱中和滴定过程中,在接近滴定终点时溶液的pH有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计。
(2)指示剂的选择
若滴定终点为碱性时,选择________;酸性时,选择__________;中性时,酚酞、甲基橙均可以。一般不选择石蕊,变色现象不明显。
指示剂 变色范围(颜色与pH的关系)
石蕊 <5.0____色 5.0~8.0紫色 >8.0____色
酚酞 <8.2____色 8.2~10.0浅红色 >10.0____色
甲基橙 <3.1____色 3.1~4.4橙色 >4.4____色
5.滴定操作
(1)滴定前准备
(2)滴定
注意 滴速:先快后慢,接近终点时,应一滴一摇,甚至半滴一摇,利用锥形瓶内壁承接尖嘴处悬挂的半滴溶液。
(3)终点判断
等到滴入最后半滴标准液,指示剂变色,且在半分钟内__________原来的颜色,视为滴定终点并记录此时滴定管的读数。
6.数据处理
为减少实验误差,重复实验2~3次,根据每次所用标准溶液的体积计算待测液的物质的量浓度,最后求出待测液的物质的量浓度的________。
(1)一支标有“20 ℃、25 mL”字样的滴定管内装液体到刻度1.00 mL时,管内液体的体积大于24.00 mL( )
(2)用50 mL酸式滴定管可准确量取25.00 mL KMnO4溶液( )
(3)“中和滴定”实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,必须润洗后方可使用( )
(4)当观察到锥形瓶中颜色发生变化,立即停止滴定并记下滴定管液面读数( )
(5)量取20.00 mL待测液时可用量筒量取( )
(6)滴定管盛标准溶液时,调液面一定要调到“0”刻度( )
用酸碱中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,不可选用________(填字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视________________________________________________;在铁架台上垫一张白纸,其目的是________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是__________ mol·L-1,烧碱样品的纯度是________。
滴定次数 待测溶液体积/mL 标准酸溶液体积
滴定前的刻度/mL 滴定后的刻度/mL
第一次 10.00 0.40 20.50
第二次 10.00 4.10 24.00
滴定终点的判断答题模板
二、中和滴定误差分析
1.分析依据
c待测·V待测=c标准·V标准,c待测=
c标准、V待测均为代入定值,误差均体现在________的大小。
2.常见的误差分析
(1)以用标准盐酸滴定待测氢氧化钠溶液为例:
步骤 操作 V标准 c待测
洗涤 酸式滴定管未用标准溶液润洗
碱式滴定管未用标准溶液润洗
锥形瓶用待测溶液润洗
锥形瓶洗净后还留有蒸馏水
取液 放出碱液的滴定管开始有气泡,放出液体后气泡消失
滴定 酸式滴定管滴定前有气泡,滴定终点时气泡消失
振荡锥形瓶时部分液体溅出
部分酸液滴出锥形瓶外
溶液颜色较浅时滴入酸液过快,停止滴定后再加一滴NaOH溶液无变化
读数 滴定前读数正确,滴定后俯视读数(或前仰后俯)
滴定前读数正确,滴定后仰视读数(或前俯后仰)
(2)在进行误差分析时,要特别注意弄懂俯视(视线偏高)及仰视(视线偏低)的含义,并会区分俯视、仰视对量筒、滴定管产生误差的不同(如图)。
下列图示读数对滴定结果的影响如下:
①如图Ⅰ,开始仰视读数,滴定完毕俯视读数,滴定结果会偏小。
②如图Ⅱ,开始俯视读数,滴定完毕仰视读数,滴定结果会偏大。
1.称取一定质量的NaOH来测定未知浓度的盐酸时(NaOH放在锥形瓶内,盐酸放在滴定管中)。用A.偏高;B.偏低;C.无影响;D.无法判断,填写下列各项操作会给实验造成的误差。
(1)称量固体NaOH时,未调节天平的零点( )
(2)将NaOH放入锥形瓶中加水溶解时,加入水的体积不准确( )
(3)滴定管装入盐酸前未用盐酸润洗( )
(4)开始滴定时,滴定管尖端处有气泡,滴定完毕气泡排出( )
(5)滴定前未将液面调至刻度线“0”或“0”以下,结束时初始读数按0计算( )
(6)在滴定过程中活塞处漏液( )
(7)摇动锥形瓶时,因用力过猛,使少量溶液溅出( )
(8)滴定前仰视读数,滴定完毕俯视读数( )
2.某同学用中和滴定法测定某烧碱溶液的浓度。
Ⅰ.实验步骤:
(1)用仪器________(填“A”或“B”)量取待测烧碱溶液25.00 mL于锥形瓶中,滴加2滴酚酞作指示剂。
(2)记录盛装0.100 0 mol·L-1标准盐酸的酸式滴定管的初始读数。
如果某时刻液面位置如图所示,则此时的读数为______ mL。
(3)滴定。滴定过程中,眼睛应始终注视______________________________________。
(4)滴定终点的现象是______________________________________________________。
Ⅱ.数据记录:
实验编号 烧碱待测液体积V/mL 标准盐酸体积(消耗)V/mL
1 25.00 18.05
2 25.00 18.00
3 25.00 17.95
4 25.00 18.95
Ⅲ.数据处理:
计算该烧碱溶液的浓度c(NaOH)=________ mol·L-1(精确到小数点后4位)。
Ⅳ.误差分析:
以下操作会导致测定结果偏高的是________(填字母)。
A.未用盐酸标准溶液润洗滴定管
B.装待测液前,锥形瓶中有少量蒸馏水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.读数时,滴定前仰视,滴定后俯视
第4课时 酸碱中和滴定
[核心素养发展目标] 1.理解中和滴定的原理。会选择中和滴定的指示剂。2.熟悉中和滴定实验仪器及使用。掌握中和滴定的实验操作方法。3.能通过酸碱中和滴定测定酸或碱的浓度,掌握数据分析与处理的方法,培养定量研究的意识。
一、酸碱中和滴定实验
1.概念和原理
(1)概念
酸碱中和滴定是依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。
(2)原理
在中和反应中,酸提供的H+与碱提供的OH-的物质的量相等,即c(H+)·V酸=c(OH-)·V碱,则c(H+)=或c(OH-)=。
2.主要仪器
(1)仪器:滴定管、铁架台、滴定管夹、锥形瓶、烧杯。
(2)滴定管构造特点
酸式滴定管 碱式滴定管
相同点 a.标有规格、温度、“0”刻度线在上方,尖嘴部分无刻度; b.最小刻度为0.1 mL,可估读到0.01 mL
不同点 a.下端有玻璃活塞; b.可盛装酸性、强氧化性溶液 a.下端有由乳胶管、玻璃球组成的阀; b.只能盛装碱性溶液
注意事项 a.将液面在0 mL处的25 mL的酸式滴定管中的液体全部放出,液体的体积大于25 mL,因为尖嘴部分无刻度。
b.使用聚四氟乙烯活塞的滴定管为酸碱通用滴定管。
3.主要试剂
(1)待测液;(2)标准液;(3)指示剂。
4.指示剂的选择
(1)原理
由曲线可以看出,在酸、碱中和滴定过程中,在接近滴定终点时溶液的pH有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计。
(2)指示剂的选择
若滴定终点为碱性时,选择酚酞;酸性时,选择甲基橙;中性时,酚酞、甲基橙均可以。一般不选择石蕊,变色现象不明显。
指示剂 变色范围(颜色与pH的关系)
石蕊 <5.0红色 5.0~8.0紫色 >8.0蓝色
酚酞 <8.2无色 8.2~10.0浅红色 >10.0红色
甲基橙 <3.1红色 3.1~4.4橙色 >4.4黄色
5.滴定操作
(1)滴定前准备
(2)滴定
注意 滴速:先快后慢,接近终点时,应一滴一摇,甚至半滴一摇,利用锥形瓶内壁承接尖嘴处悬挂的半滴溶液。
(3)终点判断
等到滴入最后半滴标准液,指示剂变色,且在半分钟内不恢复原来的颜色,视为滴定终点并记录此时滴定管的读数。
6.数据处理
为减少实验误差,重复实验2~3次,根据每次所用标准溶液的体积计算待测液的物质的量浓度,最后求出待测液的物质的量浓度的平均值。
(1)一支标有“20 ℃、25 mL”字样的滴定管内装液体到刻度1.00 mL时,管内液体的体积大于24.00 mL( )
(2)用50 mL酸式滴定管可准确量取25.00 mL KMnO4溶液( )
(3)“中和滴定”实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,必须润洗后方可使用( )
(4)当观察到锥形瓶中颜色发生变化,立即停止滴定并记下滴定管液面读数( )
(5)量取20.00 mL待测液时可用量筒量取( )
(6)滴定管盛标准溶液时,调液面一定要调到“0”刻度( )
答案 (1)√ (2)√ (3)√ (4)× (5)× (6)×
用酸碱中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在__________________________________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,不可选用________(填字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视________________________________________________;在铁架台上垫一张白纸,其目的是_________________________________________________________
_______________________________________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是__________ mol·L-1,烧碱样品的纯度是________。
滴定次数 待测溶液体积/mL 标准酸溶液体积
滴定前的刻度/mL 滴定后的刻度/mL
第一次 10.00 0.40 20.50
第二次 10.00 4.10 24.00
答案 (1)A (2)B (3)锥形瓶内溶液颜色的变化 便于观察锥形瓶内液体颜色的变化,减小滴定误差 (4)0.400 0 97.56%
解析 (1)称量氢氧化钠等易潮解、腐蚀性强的试剂时,样品应放在小烧杯中。(2)酸碱中和滴定时,一般选甲基橙、酚酞等颜色变化较明显的指示剂,石蕊在酸或碱溶液中颜色变化不明显,易造成误差。(4)根据c(NaOH)=分别求第一、二次的值,再求平均值,解得c(NaOH)=0.400 0 mol·L-1,w(NaOH)=×100%≈97.56%。
滴定终点的判断答题模板
二、中和滴定误差分析
1.分析依据
c待测·V待测=c标准·V标准,c待测=
c标准、V待测均为代入定值,误差均体现在V标准的大小。
2.常见的误差分析
(1)以用标准盐酸滴定待测氢氧化钠溶液为例:
步骤 操作 V标准 c待测
洗涤 酸式滴定管未用标准溶液润洗 变大 偏高
碱式滴定管未用标准溶液润洗 变小 偏低
锥形瓶用待测溶液润洗 变大 偏高
锥形瓶洗净后还留有蒸馏水 不变 无影响
取液 放出碱液的滴定管开始有气泡,放出液体后气泡消失 变小 偏低
滴定 酸式滴定管滴定前有气泡,滴定终点时气泡消失 变大 偏高
振荡锥形瓶时部分液体溅出 变小 偏低
部分酸液滴出锥形瓶外 变大 偏高
溶液颜色较浅时滴入酸液过快,停止滴定后再加一滴NaOH溶液无变化 变大 偏高
读数 滴定前读数正确,滴定后俯视读数(或前仰后俯) 变小 偏低
滴定前读数正确,滴定后仰视读数(或前俯后仰) 变大 偏高
(2)在进行误差分析时,要特别注意弄懂俯视(视线偏高)及仰视(视线偏低)的含义,并会区分俯视、仰视对量筒、滴定管产生误差的不同(如图)。
下列图示读数对滴定结果的影响如下:
①如图Ⅰ,开始仰视读数,滴定完毕俯视读数,滴定结果会偏小。
②如图Ⅱ,开始俯视读数,滴定完毕仰视读数,滴定结果会偏大。
1.称取一定质量的NaOH来测定未知浓度的盐酸时(NaOH放在锥形瓶内,盐酸放在滴定管中)。用A.偏高;B.偏低;C.无影响;D.无法判断,填写下列各项操作会给实验造成的误差。
(1)称量固体NaOH时,未调节天平的零点( )
(2)将NaOH放入锥形瓶中加水溶解时,加入水的体积不准确( )
(3)滴定管装入盐酸前未用盐酸润洗( )
(4)开始滴定时,滴定管尖端处有气泡,滴定完毕气泡排出( )
(5)滴定前未将液面调至刻度线“0”或“0”以下,结束时初始读数按0计算( )
(6)在滴定过程中活塞处漏液( )
(7)摇动锥形瓶时,因用力过猛,使少量溶液溅出( )
(8)滴定前仰视读数,滴定完毕俯视读数( )
答案 (1)D (2)C (3)B (4)B (5)A (6)B (7)A (8)A
解析 (1)称量固体NaOH时,未调节天平零点,不能确定称量结果是偏高还是偏低。(2)锥形瓶内是否含水或加多少水并不影响NaOH与HCl的中和反应。(3)滴定管中装盐酸前未润洗相当于将待测液稀释了,导致测定结果偏低。(4)滴定前有气泡,滴定后无气泡,相当于待测液比实际用量多了,导致结果偏低。(5)读出的数据比实际值小,导致结果偏高。(6)滴定过程中漏液使读出的待测液的体积比实际消耗量多,导致结果偏低。(7)摇动锥形瓶时,用力过猛,使少量液体溅出,致使一部分NaOH未被中和,消耗待测液体积减小,使测定结果偏高。
(8)读出的数据比实际值偏小,使结果偏高。
2.某同学用中和滴定法测定某烧碱溶液的浓度。
Ⅰ.实验步骤:
(1)用仪器________(填“A”或“B”)量取待测烧碱溶液25.00 mL于锥形瓶中,滴加2滴酚酞作指示剂。
(2)记录盛装0.100 0 mol·L-1标准盐酸的酸式滴定管的初始读数。
如果某时刻液面位置如图所示,则此时的读数为______ mL。
(3)滴定。滴定过程中,眼睛应始终注视______________________________________。
(4)滴定终点的现象是______________________________________________________。
Ⅱ.数据记录:
实验编号 烧碱待测液体积V/mL 标准盐酸体积(消耗)V/mL
1 25.00 18.05
2 25.00 18.00
3 25.00 17.95
4 25.00 18.95
Ⅲ.数据处理:
计算该烧碱溶液的浓度c(NaOH)=____ mol·L-1(精确到小数点后4位)。
Ⅳ.误差分析:
以下操作会导致测定结果偏高的是________(填字母)。
A.未用盐酸标准溶液润洗滴定管
B.装待测液前,锥形瓶中有少量蒸馏水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.读数时,滴定前仰视,滴定后俯视
答案 Ⅰ.(1)A (2)0.70 (3)锥形瓶中溶液的颜色变化 (4)滴入最后半滴标准溶液后溶液由红色恰好变为无色且半分钟内不恢复原色
Ⅲ.0.072 0 Ⅳ.AC
解析 Ⅲ.在四组数据中,第4组数据有明显误差,故舍弃。c1(NaOH)==0.072 2 mol·L-1,同理可得c2(NaOH)=0.072 0 mol·L-1,c3(NaOH)=0.071 8 mol·L-1,则c(NaOH)==0.072 0 mol·L-1。Ⅳ.A项,未用盐酸标准溶液润洗滴定管,造成盐酸浓度偏小,所用盐酸体积偏大,测定结果偏高;B项,装待测液前,锥形瓶中有少量蒸馏水,无影响;C项,滴定前滴定管尖嘴部分有气泡,滴定后气泡消失,所用盐酸体积偏大,测定结果偏高;D项,读数时,滴定前仰视,滴定后俯视,造成盐酸读数偏小,结果偏低。
