第三章 第三节 第6课时 溶液中粒子浓度图像分析 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1
文档属性
| 名称 | 第三章 第三节 第6课时 溶液中粒子浓度图像分析 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 801.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-05 22:41:18 | ||
图片预览




文档简介
第6课时 溶液中粒子浓度图像分析
[核心素养发展目标]
1.通过酸碱中和滴定图像分析,进一步掌握滴定过程中各种量的变化关系,并能从微观层面理解酸碱中和滴定的本质。
2.会根据混合后的图像分析粒子浓度的关系。
一、利用中和滴定曲线分析粒子浓度的关系
抓“五点”破解中和滴定图像
室温下,向20 mL 0.1 mol·L-1HA溶液中逐滴加入0.1 mol·L-1 NaOH溶液,溶液pH的变化如图所示:
利用中和滴定曲线分析离子浓度思路,三看:一看谁滴定谁,二看坐标,三看特殊点(起点、恰好反应点和中性点)。
1.25 ℃时,向20.00 mL的NaOH溶液中逐滴加入某浓度的CH3COOH溶液,滴定过程中,溶液的pH与滴入CH3COOH溶液的体积关系如图所示,点②时NaOH溶液恰好被中和。则下列说法错误的是( )
A.CH3COOH溶液的浓度为0.1 mol·L-1
B.图中点①到点③所示溶液中,水的电离程度先增大后减小
C.点④所示溶液中存在:c(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-)
D.滴定过程中会存在:c(Na+)>c(CH3COO-)=c(OH-)>c(H+)
2.NH4HSO4在分析试剂、医药、电子工业中用途广泛。室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液的pH与NaOH溶液体积的关系曲线如图所示(滴加过程中无气体逸出)。下列说法正确的是( )
A.a点溶液中:c(NH)+c(NH3·H2O)=c(SO)+c(OH-)
B.b点溶液中:2c(SO)=c(NH)+c(Na+)
C.c点溶液中:c(SO)>c(Na+)>c(OH-)>c(NH)
D.a、b、c、d四个点中,b点水的电离程度最大
(1)恰好中和=酸碱恰好完全反应≠滴定终点≠溶液呈中性。
(2)滴定曲线分析思路
3.常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是( )
A.常温下,0.1 mol·L-1氨水中NH3·H2O的电离常数Kb约为1×10-5
B.a、b之间的点一定满足:c(NH)>c(Cl-)>c(OH-)>c(H+)
C.c点溶液中c(NH)D.b点代表溶液呈中性
水电离的c(H+)或c(OH-)与酸或碱体积(V)的关系图
常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。
①a点表示未加盐酸,碱抑制水的电离。
②b点溶液中氯化铵和氨水共存,溶液呈中性,水电离的抑制程度与促进程度相当。
③c点酸碱恰好完全中和,溶液中只有氯化铵,促进水的电离,水电离出的氢离子浓度最大。
④d点氯化铵和盐酸共存,溶液呈酸性,盐酸抑制水的电离。
二、分布系数图像
1.分布系数曲线
是指以pH为横坐标,分布系数即组分的平衡浓度占总浓度的分数为纵坐标,即分布系数与溶液pH之间的关系曲线。
举例 一元弱酸 (以CH3COOH为例) 二元弱酸 (以草酸为例)
弱电解质分布系数图
δn δ0、δ1分别为CH3COOH、CH3COO-的分布系数 δ0为H2C2O4的分布系数、δ1为HC2O的分布系数、δ2为C2O的分布系数
微粒存在 形式 当pHpKa时,主要存在形式是CH3COO-。δ0与δ1曲线相交在δ0=δ1=0.5处,此时c(CH3COOH)=c(CH3COO-),即pH=pKa 当溶液的pH=1.2时δ0=δ1,pH=4.2时δ1=δ2;当pH<1.2时,H2C2O4为主要存在形式;当1.24.2时,C2O为主要存在形式
求Ka Ka(CH3COOH)=,从图可知,c(CH3COO-)=c(CH3COOH)时,pH=pKa=4.76,Ka(CH3COOH)=c(H+)=10-4.76 Ka2( H2C2O4)=,从图可知,c(C2O)=c(HC2O)时,pH=4.2,Ka2=c(H+)=10-4.2,同理求得Ka1=10-1.2
2.解题要点
(1)明确每条曲线所代表的粒子及变化趋势。
(2)通过做横坐标的垂线,可判断某pH时的粒子浓度相对大小。
(3)交点是某两种粒子浓度相等的点,可计算电离常数。
1.某弱酸HA溶液中主要成分的分布系数随pH的变化如图所示。下列说法错误的是( )
A.该酸-lgKa≈4.7
B.NaA的水解平衡常数Kh=
C.当该溶液的pH=7.0时,c(HA)<c(A-)
D.某c(HA)∶c(A-)=4∶1的缓冲溶液,pH≈4
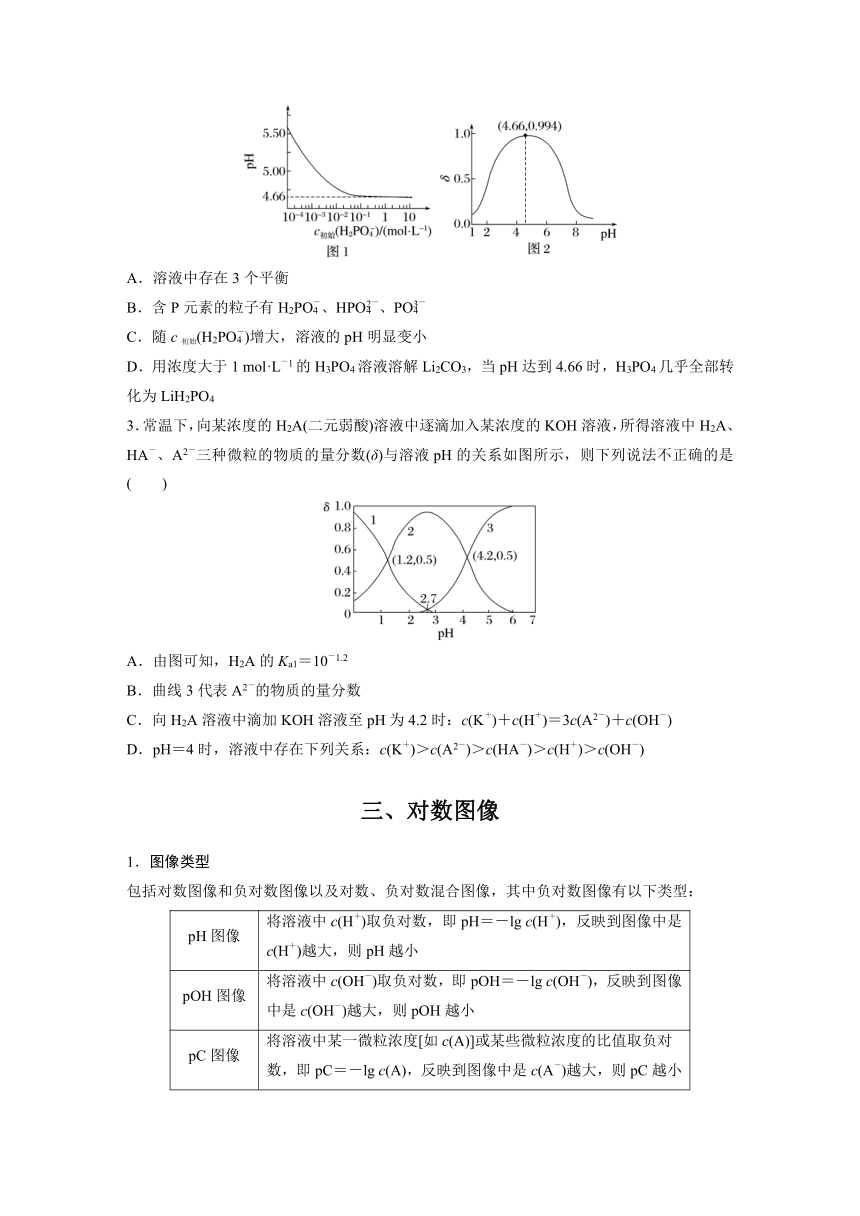
2.LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO)的变化如图1所示,H3PO4溶液中H2PO的分布系数δ随pH的变化如图2所示,下列有关LiH2PO4溶液的叙述正确的是( )
A.溶液中存在3个平衡
B.含P元素的粒子有H2PO、HPO、PO
C.随c初始(H2PO)增大,溶液的pH明显变小
D.用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
3.常温下,向某浓度的H2A(二元弱酸)溶液中逐滴加入某浓度的KOH溶液,所得溶液中H2A、HA-、A2-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法不正确的是( )
A.由图可知,H2A的Ka1=10-1.2
B.曲线3代表A2-的物质的量分数
C.向H2A溶液中滴加KOH溶液至pH为4.2时:c(K+)+c(H+)=3c(A2-)+c(OH-)
D.pH=4时,溶液中存在下列关系:c(K+)>c(A2-)>c(HA-)>c(H+)>c(OH-)
三、对数图像
1.图像类型
包括对数图像和负对数图像以及对数、负对数混合图像,其中负对数图像有以下类型:
pH图像 将溶液中c(H+)取负对数,即pH=-lg c(H+),反映到图像中是c(H+)越大,则pH越小
pOH图像 将溶液中c(OH-)取负对数,即pOH=-lg c(OH-),反映到图像中是c(OH-)越大,则pOH越小
pC图像 将溶液中某一微粒浓度[如c(A)]或某些微粒浓度的比值取负对数,即pC=-lg c(A),反映到图像中是c(A-)越大,则pC越小
2.解题策略
(1)先确定图像的类型是对数图像还是负对数图像。
(2)再弄清楚图像中横坐标和纵坐标的含义,是浓度对数还是比值对数。
(3)理清图像中曲线的变化趋势及含义,根据含义判断线上、线下的点所表示的意义。
(4)抓住图像中特殊点:如lg =0的点有c(A)=c(B);lg c(D)=0的点有c(D)=1 mol·L-1
熟记运算法则:lg ab=lg a+lg b、lg =lg a-lg b、lg 1=0,若K=c·c(K只与温度有关),得lg K=mlg c1+nlg c2。
(5)将图像中数据或曲线的变化与所学知识对接,作出正确判断。
1.某温度下,向一定体积0.1 mol·L-1的氨水中逐滴加入等浓度的盐酸,溶液中pOH[pOH=
-lg c(OH-)]与pH的变化关系如图所示。下列说法不正确的是( )
A.M点和N点溶液中H2O的电离程度相同
B.Q点溶液中,c(NH)+c(NH3·H2O)=c(Cl-)
C.M点溶液的导电性小于Q点溶液的导电性
D.N点溶液加水稀释,变小
2.常温下,向某二元弱酸H2Y溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为或]与pH的变化关系如图所示。下列说法正确的是( )
A.曲线Ⅰ表示lg 随pH变化的关系曲线
B.由图可知,H2Y的二级电离常数Ka2(H2Y)数量级为10-10
C.从a点到b点过程中,水的电离程度先增大后减小
D.NaHY溶液中的离子浓度大小为c(Na+)>c(HY-)>c(OH-)>c(H+)>c(Y2-)
3.(2021·湖南1月适应性考试,14改编)常温下,向20.00 mL 0.100 0 mol·L-1的CH3COOH溶液中滴加0.100 0 mol·L-1的NaOH溶液,溶液中,lg 随pH的变化关系如图所示(取lg 5=0.7)。
下列说法正确的是( )
A.常温下,CH3COOH的电离常数为10-4
B.当溶液的pH=7时,消耗NaOH溶液20.00 mL
C.溶液中水的电离程度大小:a>b>c
D.c点溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
第6课时 溶液中粒子浓度图像分析
[核心素养发展目标] 1.通过酸碱中和滴定图像分析,进一步掌握滴定过程中各种量的变化关系,并能从微观层面理解酸碱中和滴定的本质。2.会根据混合后的图像分析粒子浓度的关系。
一、利用中和滴定曲线分析粒子浓度的关系
抓“五点”破解中和滴定图像
室温下,向20 mL 0.1 mol·L-1HA溶液中逐滴加入0.1 mol·L-1 NaOH溶液,溶液pH的变化如图所示:
利用中和滴定曲线分析离子浓度思路,三看:
一看谁滴定谁,二看坐标,三看特殊点(起点、恰好反应点和中性点)。
1.25 ℃时,向20.00 mL的NaOH溶液中逐滴加入某浓度的CH3COOH溶液,滴定过程中,溶液的pH与滴入CH3COOH溶液的体积关系如图所示,点②时NaOH溶液恰好被中和。则下列说法错误的是( )
A.CH3COOH溶液的浓度为0.1 mol·L-1
B.图中点①到点③所示溶液中,水的电离程度先增大后减小
C.点④所示溶液中存在:c(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-)
D.滴定过程中会存在:c(Na+)>c(CH3COO-)=c(OH-)>c(H+)
答案 C
解析 根据图像分析,滴定前NaOH溶液的pH=13,则NaOH溶液的浓度为0.1 mol·L-1,点②时氢氧化钠恰好被中和,消耗醋酸溶液20 mL,则醋酸溶液的浓度为0.1 mol·L-1,故A正确;图中点①到点②所示溶液中,随着滴入醋酸溶液,水电离被抑制的程度减小,即水的电离程度增大,恰好反应后继续滴加醋酸,对水的电离起到抑制作用,即图中点①到点③所示溶液中水的电离程度先增大后减小,故B正确;点④所示溶液是等浓度的醋酸和醋酸钠混合溶液,根据元素守恒:c(CH3COOH)+c(CH3COO-)=2c(Na+),根据电荷守恒:c(Na+)+
c(H+)=c(CH3COO-)+c(OH-),则c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),C错误;滴定过程中,醋酸钠和氢氧化钠混合溶液中会有c(Na+)>c(CH3COO-)=c(OH-)>c(H+),D正确。
2.NH4HSO4在分析试剂、医药、电子工业中用途广泛。室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液的pH与NaOH溶液体积的关系曲线如图所示(滴加过程中无气体逸出)。下列说法正确的是( )
A.a点溶液中:c(NH)+c(NH3·H2O)=c(SO)+c(OH-)
B.b点溶液中:2c(SO)=c(NH)+c(Na+)
C.c点溶液中:c(SO)>c(Na+)>c(OH-)>c(NH)
D.a、b、c、d四个点中,b点水的电离程度最大
答案 B
解析 分析图中曲线,在a点,NaOH与NH4HSO4等物质的量发生反应,生成Na2SO4、(NH4)2SO4和水;在b、c点,溶液均为Na2SO4、(NH4)2SO4、一水合氨的混合溶液;在d点,反应后的溶液为等物质的量的Na2SO4和一水合氨的混合溶液。由以上分析知,在a点,生成物为Na2SO4、(NH4)2SO4和H2O,依据元素守恒,溶液中:c(NH)+c(NH3·H2O)=c(SO),A不正确;b点溶液中,依据电荷守恒:2c(SO)+c(OH-)=c(NH)+c(Na+)+c(H+),溶液呈中性,c(H+)=c(OH-),所以2c(SO)=c(NH)+c(Na+),B正确;c点溶液中,一水合氨发生电离,溶液呈碱性,但溶液中c(Na+)最大,所以离子浓度关系为c(Na+)>c(SO)>c(NH)>c(OH-),C不正确;a、b、c、d四个点中,a点发生NH水解,促进水的电离,而其他点,水的电离都受到抑制,所以a点水的电离程度最大,D不正确。
(1)恰好中和=酸碱恰好完全反应≠滴定终点≠溶液呈中性。
(2)滴定曲线分析思路
3.常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是( )
A.常温下,0.1 mol·L-1氨水中NH3·H2O的电离常数Kb约为1×10-5
B.a、b之间的点一定满足:c(NH)>c(Cl-)>c(OH-)>c(H+)
C.c点溶液中c(NH)D.b点代表溶液呈中性
答案 B
解析 常温下,0.1 mol·L-1氨水中c水(H+)=10-11 mol·L-1,则c(OH-)= mol·L-1=
10-3 mol·L-1,Kb=≈=1×10-5,A正确;a、b之间的任意一点,溶液都呈碱性,则c(H+)水电离的c(H+)或c(OH-)与酸或碱体积(V)的关系图
常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。
①a点表示未加盐酸,碱抑制水的电离。
②b点溶液中氯化铵和氨水共存,溶液呈中性,水电离的抑制程度与促进程度相当。
③c点酸碱恰好完全中和,溶液中只有氯化铵,促进水的电离,水电离出的氢离子浓度最大。
④d点氯化铵和盐酸共存,溶液呈酸性,盐酸抑制水的电离。
二、分布系数图像
1.分布系数曲线
是指以pH为横坐标,分布系数即组分的平衡浓度占总浓度的分数为纵坐标,即分布系数与溶液pH之间的关系曲线。
举例 一元弱酸 (以CH3COOH为例) 二元弱酸 (以草酸为例)
弱电解质 分布系数图
δn δ0、δ1分别为CH3COOH、CH3COO-的分布系数 δ0为H2C2O4的分布系数、δ1为HC2O的分布系数、δ2为C2O的分布系数
微粒存 在形式 当pHpKa时,主要存在形式是CH3COO-。δ0与δ1曲线相交在δ0=δ1=0.5处,此时c(CH3COOH)=c(CH3COO-),即pH=pKa 当溶液的pH=1.2时δ0=δ1,pH=4.2时δ1=δ2;当pH<1.2时,H2C2O4为主要存在形式;当1.24.2时,C2O为主要存在形式
求Ka Ka(CH3COOH)=,从图可知,c(CH3COO-)=c(CH3COOH)时,pH=pKa=4.76,Ka(CH3COOH)=c(H+)=10-4.76 Ka2( H2C2O4)=,从图可知,c(C2O)=c(HC2O)时,pH=4.2,Ka2=c(H+)=10-4.2,同理求得Ka1=10-1.2
2.解题要点
(1)明确每条曲线所代表的粒子及变化趋势。
(2)通过做横坐标的垂线,可判断某pH时的粒子浓度相对大小。
(3)交点是某两种粒子浓度相等的点,可计算电离常数。
1.某弱酸HA溶液中主要成分的分布系数随pH的变化如图所示。下列说法错误的是( )
A.该酸-lgKa≈4.7
B.NaA的水解平衡常数Kh=
C.当该溶液的pH=7.0时,c(HA)<c(A-)
D.某c(HA)∶c(A-)=4∶1的缓冲溶液,pH≈4
答案 B
解析 由图可知,c(HA)=c(A-)时,pH≈4.7,该酸Ka==10-4.7,故-lgKa≈4.7,A正确;NaA的水解平衡常数Kh=,B错误;根据图像可知,当该溶液的pH=7.0时,c(HA)<c(A-),C正确;根据图像可知,c(HA)为0.8,c(A-)为0.2时,pH约为4,故c(HA)∶c(A-)
=4∶1的缓冲溶液,pH≈4,D正确。
2.LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO)的变化如图1所示,H3PO4溶液中H2PO的分布系数δ随pH的变化如图2所示,下列有关LiH2PO4溶液的叙述正确的是( )
A.溶液中存在3个平衡
B.含P元素的粒子有H2PO、HPO、PO
C.随c初始(H2PO)增大,溶液的pH明显变小
D.用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
答案 D
解析 溶液中存在H2PO的电离平衡和水解平衡,存在HPO的电离平衡,存在水的电离平衡,所以至少存在4个平衡,A项错误;含P元素的粒子有H2PO、HPO、PO和H3PO4,B项错误;从图1中得到随着c初始(H2PO)增大,溶液的pH从5.50减小到4.66,变小并不明显,同时pH达到4.66以后不随c初始(H2PO)增大而变化,C项错误;由图2得到,pH=4.66时,δ=0.994,即溶液中所有含P的成分中H2PO占99.4%,所以此时H3PO4几乎全部转化为LiH2PO4,D项正确。
3.常温下,向某浓度的 H2A(二元弱酸)溶液中逐滴加入某浓度的KOH溶液,所得溶液中H2A、HA-、A2-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法不正确的是( )
A.由图可知,H2A的Ka1=10-1.2
B.曲线3代表A2-的物质的量分数
C.向H2A溶液中滴加KOH溶液至pH为4.2时:c(K+)+c(H+)=3c(A2-)+c(OH-)
D.pH=4时,溶液中存在下列关系:c(K+)>c(A2-)>c(HA-)>c(H+)>c(OH-)
答案 D
解析 根据题干信息结合图像中H2A、HA-、A2-三种微粒的物质的量分数(δ)与溶液pH的关系分析可知,曲线1表示H2A的物质的量分数,曲线2表示HA-的物质的量分数,曲线3表示A2-的物质的量分数。根据图像可知,点(1.2,0.5)表明当pH=1.2时,c(H2A)=c(HA-),所以H2A的电离平衡常数Ka1==c(H+)=10-1.2,A正确;pH=4.2时,c(HA-)=c(A2-),溶液中存在电荷守恒c(K+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),所以c(K+)+c(H+)=3c(A2-)+c(OH-),C正确;pH=4时,由图像可知c(HA-)>c(A2-),D错误。
三、对数图像
1.图像类型
包括对数图像和负对数图像以及对数、负对数混合图像,其中负对数图像有以下类型:
pH图像 将溶液中c(H+)取负对数,即pH=-lg c(H+),反映到图像中是c(H+)越大,则pH越小
pOH图像 将溶液中c(OH-)取负对数,即pOH=-lg c(OH-),反映到图像中是c(OH-)越大,则pOH越小
pC图像 将溶液中某一微粒浓度[如c(A)]或某些微粒浓度的比值取负对数,即pC=-lg c(A),反映到图像中是c(A-)越大,则pC越小
2.解题策略
(1)先确定图像的类型是对数图像还是负对数图像。
(2)再弄清楚图像中横坐标和纵坐标的含义,是浓度对数还是比值对数。
(3)理清图像中曲线的变化趋势及含义,根据含义判断线上、线下的点所表示的意义。
(4)抓住图像中特殊点:如lg =0的点有c(A)=c(B);lg c(D)=0的点有c(D)=1 mol·L-1
熟记运算法则:lg ab=lg a+lg b、lg =lg a-lg b、lg 1=0,若K=c·c(K只与温度有关),得lg K=mlg c1+nlg c2。
(5)将图像中数据或曲线的变化与所学知识对接,作出正确判断。
1.某温度下,向一定体积0.1 mol·L-1的氨水中逐滴加入等浓度的盐酸,溶液中pOH[pOH=
-lg c(OH-)]与pH的变化关系如图所示。下列说法不正确的是( )
A.M点和N点溶液中H2O的电离程度相同
B.Q点溶液中,c(NH)+c(NH3·H2O)=c(Cl-)
C.M点溶液的导电性小于Q点溶液的导电性
D.N点溶液加水稀释,变小
答案 B
解析 由于M点碱过量,N点酸过量,M点溶液中氢氧根离子浓度与N点溶液中氢离子浓度相同,对水的电离抑制程度相同,故两点水的电离程度相同,A正确;Q点时pH=pOH,说明溶液呈中性,根据电荷守恒:c(NH)+c(H+)=c(Cl-)+c(OH-),则c(NH)=c(Cl-),B错误;M点溶液中主要溶质为一水合氨,为弱电解质,在溶液中部分电离,溶液中离子浓度较小,Q点溶液中溶质主要为氯化铵,为强电解质,在溶液中全部电离,溶液中离子浓度较大,故M点溶液的导电能力小于Q点,C正确;N点溶液加水稀释,Kb=,温度不变,Kb不变,加水稀释氢离子浓度减小,c(OH-)增大,所以变小,D正确。
2.常温下,向某二元弱酸H2Y溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为或]与pH的变化关系如图所示。下列说法正确的是( )
A.曲线Ⅰ表示lg 随pH变化的关系曲线
B.由图可知,H2Y的二级电离常数Ka2(H2Y)数量级为10-10
C.从a点到b点过程中,水的电离程度先增大后减小
D.NaHY溶液中的离子浓度大小为c(Na+)>c(HY-)>c(OH-)>c(H+)>c(Y2-)
答案 D
解析 二元弱酸H2Y的Ka1(H2Y)=>Ka2(H2Y)=,当溶液的pH相同时,c(H+)相同,lgX:Ⅰ>Ⅱ,则Ⅰ表示lg 与pH的变化关系,Ⅱ表示lg 与pH的变化关系,A错误;Ka2(H2Y)=,b点时,则=1,pH=10.35,则c(H+)=10-10.35,故Ka2(H2Y)=10-10.35,数量级为10-11,B错误;从H2Y→NaHY→Na2Y的转化过程中,水的电离程度逐渐增大,在b点c(HY-)=c(Y2-),还未完全转化为Na2Y,故水的电离程度逐渐增大,C错误;因HY-的水解常数Kh===10-7.65>Ka2(H2Y)=10-10.35,故NaHY溶液呈碱性,离子浓度:c(Na+)>c(HY-)>c(OH-)>c(H+)>c(Y2-),D正确。
3.(2021·湖南1月适应性考试,14改编)常温下,向20.00 mL 0.100 0 mol·L-1的CH3COOH溶液中滴加0.100 0 mol·L-1的NaOH溶液,溶液中,lg 随pH的变化关系如图所示(取lg 5=0.7)。
下列说法正确的是( )
A.常温下,CH3COOH的电离常数为10-4
B.当溶液的pH=7时,消耗NaOH溶液20.00 mL
C.溶液中水的电离程度大小:a>b>c
D.c点溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
答案 D
解析 常温下,CH3COOH的电离常数Ka=,b点pH=4.76时,lg =0,c(CH3COOH)=c(CH3COO-),CH3COOH的电离常数等于c(H+)=10-4.76,故A不符合题意;向20.00 mL 0.100 0 mol·L-1的CH3COOH溶液中滴加0.100 0 mol·L-1的NaOH溶液20 mL,溶质为CH3COONa,为强碱弱酸盐,水解显碱性,此时溶液的pH>7,故B不符合题意;酸、碱抑制水的电离,强碱弱酸盐水解显碱性,促进水的电离,a点pH=2.88,c(H+)=10-2.88 mol·L-1,由Ka===10-4.76,解得c(H+)=
10-2.88 mol·L-1,与a点对应,故a点溶质为CH3COOH,抑制水的电离,CH3COO-的水解常数Kh===10-9.24,CH3COONa溶液中存在水解平衡,促进水的电离,c点pH=8.73时,c(OH-)= mol·L-1=10-5.27 mol·L-1,lg =3.97,=10-3.97,Kh′==10-3.97×10-5.27=10-9.24=Kh,则c点为CH3COONa溶液,b点为CH3COOH和CH3COONa的混合溶液,溶液中水的电离程度大小:c>b>a,故C不符合题意;CH3COONa溶液中,由于醋酸根离子水解,c(Na+)>c(CH3COO-),但水解较微弱,c(CH3COO-)>c(OH-),所以c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D符合题意。
[核心素养发展目标]
1.通过酸碱中和滴定图像分析,进一步掌握滴定过程中各种量的变化关系,并能从微观层面理解酸碱中和滴定的本质。
2.会根据混合后的图像分析粒子浓度的关系。
一、利用中和滴定曲线分析粒子浓度的关系
抓“五点”破解中和滴定图像
室温下,向20 mL 0.1 mol·L-1HA溶液中逐滴加入0.1 mol·L-1 NaOH溶液,溶液pH的变化如图所示:
利用中和滴定曲线分析离子浓度思路,三看:一看谁滴定谁,二看坐标,三看特殊点(起点、恰好反应点和中性点)。
1.25 ℃时,向20.00 mL的NaOH溶液中逐滴加入某浓度的CH3COOH溶液,滴定过程中,溶液的pH与滴入CH3COOH溶液的体积关系如图所示,点②时NaOH溶液恰好被中和。则下列说法错误的是( )
A.CH3COOH溶液的浓度为0.1 mol·L-1
B.图中点①到点③所示溶液中,水的电离程度先增大后减小
C.点④所示溶液中存在:c(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-)
D.滴定过程中会存在:c(Na+)>c(CH3COO-)=c(OH-)>c(H+)
2.NH4HSO4在分析试剂、医药、电子工业中用途广泛。室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液的pH与NaOH溶液体积的关系曲线如图所示(滴加过程中无气体逸出)。下列说法正确的是( )
A.a点溶液中:c(NH)+c(NH3·H2O)=c(SO)+c(OH-)
B.b点溶液中:2c(SO)=c(NH)+c(Na+)
C.c点溶液中:c(SO)>c(Na+)>c(OH-)>c(NH)
D.a、b、c、d四个点中,b点水的电离程度最大
(1)恰好中和=酸碱恰好完全反应≠滴定终点≠溶液呈中性。
(2)滴定曲线分析思路
3.常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是( )
A.常温下,0.1 mol·L-1氨水中NH3·H2O的电离常数Kb约为1×10-5
B.a、b之间的点一定满足:c(NH)>c(Cl-)>c(OH-)>c(H+)
C.c点溶液中c(NH)
水电离的c(H+)或c(OH-)与酸或碱体积(V)的关系图
常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。
①a点表示未加盐酸,碱抑制水的电离。
②b点溶液中氯化铵和氨水共存,溶液呈中性,水电离的抑制程度与促进程度相当。
③c点酸碱恰好完全中和,溶液中只有氯化铵,促进水的电离,水电离出的氢离子浓度最大。
④d点氯化铵和盐酸共存,溶液呈酸性,盐酸抑制水的电离。
二、分布系数图像
1.分布系数曲线
是指以pH为横坐标,分布系数即组分的平衡浓度占总浓度的分数为纵坐标,即分布系数与溶液pH之间的关系曲线。
举例 一元弱酸 (以CH3COOH为例) 二元弱酸 (以草酸为例)
弱电解质分布系数图
δn δ0、δ1分别为CH3COOH、CH3COO-的分布系数 δ0为H2C2O4的分布系数、δ1为HC2O的分布系数、δ2为C2O的分布系数
微粒存在 形式 当pH
求Ka Ka(CH3COOH)=,从图可知,c(CH3COO-)=c(CH3COOH)时,pH=pKa=4.76,Ka(CH3COOH)=c(H+)=10-4.76 Ka2( H2C2O4)=,从图可知,c(C2O)=c(HC2O)时,pH=4.2,Ka2=c(H+)=10-4.2,同理求得Ka1=10-1.2
2.解题要点
(1)明确每条曲线所代表的粒子及变化趋势。
(2)通过做横坐标的垂线,可判断某pH时的粒子浓度相对大小。
(3)交点是某两种粒子浓度相等的点,可计算电离常数。
1.某弱酸HA溶液中主要成分的分布系数随pH的变化如图所示。下列说法错误的是( )
A.该酸-lgKa≈4.7
B.NaA的水解平衡常数Kh=
C.当该溶液的pH=7.0时,c(HA)<c(A-)
D.某c(HA)∶c(A-)=4∶1的缓冲溶液,pH≈4
2.LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO)的变化如图1所示,H3PO4溶液中H2PO的分布系数δ随pH的变化如图2所示,下列有关LiH2PO4溶液的叙述正确的是( )
A.溶液中存在3个平衡
B.含P元素的粒子有H2PO、HPO、PO
C.随c初始(H2PO)增大,溶液的pH明显变小
D.用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
3.常温下,向某浓度的H2A(二元弱酸)溶液中逐滴加入某浓度的KOH溶液,所得溶液中H2A、HA-、A2-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法不正确的是( )
A.由图可知,H2A的Ka1=10-1.2
B.曲线3代表A2-的物质的量分数
C.向H2A溶液中滴加KOH溶液至pH为4.2时:c(K+)+c(H+)=3c(A2-)+c(OH-)
D.pH=4时,溶液中存在下列关系:c(K+)>c(A2-)>c(HA-)>c(H+)>c(OH-)
三、对数图像
1.图像类型
包括对数图像和负对数图像以及对数、负对数混合图像,其中负对数图像有以下类型:
pH图像 将溶液中c(H+)取负对数,即pH=-lg c(H+),反映到图像中是c(H+)越大,则pH越小
pOH图像 将溶液中c(OH-)取负对数,即pOH=-lg c(OH-),反映到图像中是c(OH-)越大,则pOH越小
pC图像 将溶液中某一微粒浓度[如c(A)]或某些微粒浓度的比值取负对数,即pC=-lg c(A),反映到图像中是c(A-)越大,则pC越小
2.解题策略
(1)先确定图像的类型是对数图像还是负对数图像。
(2)再弄清楚图像中横坐标和纵坐标的含义,是浓度对数还是比值对数。
(3)理清图像中曲线的变化趋势及含义,根据含义判断线上、线下的点所表示的意义。
(4)抓住图像中特殊点:如lg =0的点有c(A)=c(B);lg c(D)=0的点有c(D)=1 mol·L-1
熟记运算法则:lg ab=lg a+lg b、lg =lg a-lg b、lg 1=0,若K=c·c(K只与温度有关),得lg K=mlg c1+nlg c2。
(5)将图像中数据或曲线的变化与所学知识对接,作出正确判断。
1.某温度下,向一定体积0.1 mol·L-1的氨水中逐滴加入等浓度的盐酸,溶液中pOH[pOH=
-lg c(OH-)]与pH的变化关系如图所示。下列说法不正确的是( )
A.M点和N点溶液中H2O的电离程度相同
B.Q点溶液中,c(NH)+c(NH3·H2O)=c(Cl-)
C.M点溶液的导电性小于Q点溶液的导电性
D.N点溶液加水稀释,变小
2.常温下,向某二元弱酸H2Y溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为或]与pH的变化关系如图所示。下列说法正确的是( )
A.曲线Ⅰ表示lg 随pH变化的关系曲线
B.由图可知,H2Y的二级电离常数Ka2(H2Y)数量级为10-10
C.从a点到b点过程中,水的电离程度先增大后减小
D.NaHY溶液中的离子浓度大小为c(Na+)>c(HY-)>c(OH-)>c(H+)>c(Y2-)
3.(2021·湖南1月适应性考试,14改编)常温下,向20.00 mL 0.100 0 mol·L-1的CH3COOH溶液中滴加0.100 0 mol·L-1的NaOH溶液,溶液中,lg 随pH的变化关系如图所示(取lg 5=0.7)。
下列说法正确的是( )
A.常温下,CH3COOH的电离常数为10-4
B.当溶液的pH=7时,消耗NaOH溶液20.00 mL
C.溶液中水的电离程度大小:a>b>c
D.c点溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
第6课时 溶液中粒子浓度图像分析
[核心素养发展目标] 1.通过酸碱中和滴定图像分析,进一步掌握滴定过程中各种量的变化关系,并能从微观层面理解酸碱中和滴定的本质。2.会根据混合后的图像分析粒子浓度的关系。
一、利用中和滴定曲线分析粒子浓度的关系
抓“五点”破解中和滴定图像
室温下,向20 mL 0.1 mol·L-1HA溶液中逐滴加入0.1 mol·L-1 NaOH溶液,溶液pH的变化如图所示:
利用中和滴定曲线分析离子浓度思路,三看:
一看谁滴定谁,二看坐标,三看特殊点(起点、恰好反应点和中性点)。
1.25 ℃时,向20.00 mL的NaOH溶液中逐滴加入某浓度的CH3COOH溶液,滴定过程中,溶液的pH与滴入CH3COOH溶液的体积关系如图所示,点②时NaOH溶液恰好被中和。则下列说法错误的是( )
A.CH3COOH溶液的浓度为0.1 mol·L-1
B.图中点①到点③所示溶液中,水的电离程度先增大后减小
C.点④所示溶液中存在:c(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-)
D.滴定过程中会存在:c(Na+)>c(CH3COO-)=c(OH-)>c(H+)
答案 C
解析 根据图像分析,滴定前NaOH溶液的pH=13,则NaOH溶液的浓度为0.1 mol·L-1,点②时氢氧化钠恰好被中和,消耗醋酸溶液20 mL,则醋酸溶液的浓度为0.1 mol·L-1,故A正确;图中点①到点②所示溶液中,随着滴入醋酸溶液,水电离被抑制的程度减小,即水的电离程度增大,恰好反应后继续滴加醋酸,对水的电离起到抑制作用,即图中点①到点③所示溶液中水的电离程度先增大后减小,故B正确;点④所示溶液是等浓度的醋酸和醋酸钠混合溶液,根据元素守恒:c(CH3COOH)+c(CH3COO-)=2c(Na+),根据电荷守恒:c(Na+)+
c(H+)=c(CH3COO-)+c(OH-),则c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),C错误;滴定过程中,醋酸钠和氢氧化钠混合溶液中会有c(Na+)>c(CH3COO-)=c(OH-)>c(H+),D正确。
2.NH4HSO4在分析试剂、医药、电子工业中用途广泛。室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液的pH与NaOH溶液体积的关系曲线如图所示(滴加过程中无气体逸出)。下列说法正确的是( )
A.a点溶液中:c(NH)+c(NH3·H2O)=c(SO)+c(OH-)
B.b点溶液中:2c(SO)=c(NH)+c(Na+)
C.c点溶液中:c(SO)>c(Na+)>c(OH-)>c(NH)
D.a、b、c、d四个点中,b点水的电离程度最大
答案 B
解析 分析图中曲线,在a点,NaOH与NH4HSO4等物质的量发生反应,生成Na2SO4、(NH4)2SO4和水;在b、c点,溶液均为Na2SO4、(NH4)2SO4、一水合氨的混合溶液;在d点,反应后的溶液为等物质的量的Na2SO4和一水合氨的混合溶液。由以上分析知,在a点,生成物为Na2SO4、(NH4)2SO4和H2O,依据元素守恒,溶液中:c(NH)+c(NH3·H2O)=c(SO),A不正确;b点溶液中,依据电荷守恒:2c(SO)+c(OH-)=c(NH)+c(Na+)+c(H+),溶液呈中性,c(H+)=c(OH-),所以2c(SO)=c(NH)+c(Na+),B正确;c点溶液中,一水合氨发生电离,溶液呈碱性,但溶液中c(Na+)最大,所以离子浓度关系为c(Na+)>c(SO)>c(NH)>c(OH-),C不正确;a、b、c、d四个点中,a点发生NH水解,促进水的电离,而其他点,水的电离都受到抑制,所以a点水的电离程度最大,D不正确。
(1)恰好中和=酸碱恰好完全反应≠滴定终点≠溶液呈中性。
(2)滴定曲线分析思路
3.常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是( )
A.常温下,0.1 mol·L-1氨水中NH3·H2O的电离常数Kb约为1×10-5
B.a、b之间的点一定满足:c(NH)>c(Cl-)>c(OH-)>c(H+)
C.c点溶液中c(NH)
答案 B
解析 常温下,0.1 mol·L-1氨水中c水(H+)=10-11 mol·L-1,则c(OH-)= mol·L-1=
10-3 mol·L-1,Kb=≈=1×10-5,A正确;a、b之间的任意一点,溶液都呈碱性,则c(H+)
常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。
①a点表示未加盐酸,碱抑制水的电离。
②b点溶液中氯化铵和氨水共存,溶液呈中性,水电离的抑制程度与促进程度相当。
③c点酸碱恰好完全中和,溶液中只有氯化铵,促进水的电离,水电离出的氢离子浓度最大。
④d点氯化铵和盐酸共存,溶液呈酸性,盐酸抑制水的电离。
二、分布系数图像
1.分布系数曲线
是指以pH为横坐标,分布系数即组分的平衡浓度占总浓度的分数为纵坐标,即分布系数与溶液pH之间的关系曲线。
举例 一元弱酸 (以CH3COOH为例) 二元弱酸 (以草酸为例)
弱电解质 分布系数图
δn δ0、δ1分别为CH3COOH、CH3COO-的分布系数 δ0为H2C2O4的分布系数、δ1为HC2O的分布系数、δ2为C2O的分布系数
微粒存 在形式 当pH
求Ka Ka(CH3COOH)=,从图可知,c(CH3COO-)=c(CH3COOH)时,pH=pKa=4.76,Ka(CH3COOH)=c(H+)=10-4.76 Ka2( H2C2O4)=,从图可知,c(C2O)=c(HC2O)时,pH=4.2,Ka2=c(H+)=10-4.2,同理求得Ka1=10-1.2
2.解题要点
(1)明确每条曲线所代表的粒子及变化趋势。
(2)通过做横坐标的垂线,可判断某pH时的粒子浓度相对大小。
(3)交点是某两种粒子浓度相等的点,可计算电离常数。
1.某弱酸HA溶液中主要成分的分布系数随pH的变化如图所示。下列说法错误的是( )
A.该酸-lgKa≈4.7
B.NaA的水解平衡常数Kh=
C.当该溶液的pH=7.0时,c(HA)<c(A-)
D.某c(HA)∶c(A-)=4∶1的缓冲溶液,pH≈4
答案 B
解析 由图可知,c(HA)=c(A-)时,pH≈4.7,该酸Ka==10-4.7,故-lgKa≈4.7,A正确;NaA的水解平衡常数Kh=,B错误;根据图像可知,当该溶液的pH=7.0时,c(HA)<c(A-),C正确;根据图像可知,c(HA)为0.8,c(A-)为0.2时,pH约为4,故c(HA)∶c(A-)
=4∶1的缓冲溶液,pH≈4,D正确。
2.LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO)的变化如图1所示,H3PO4溶液中H2PO的分布系数δ随pH的变化如图2所示,下列有关LiH2PO4溶液的叙述正确的是( )
A.溶液中存在3个平衡
B.含P元素的粒子有H2PO、HPO、PO
C.随c初始(H2PO)增大,溶液的pH明显变小
D.用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
答案 D
解析 溶液中存在H2PO的电离平衡和水解平衡,存在HPO的电离平衡,存在水的电离平衡,所以至少存在4个平衡,A项错误;含P元素的粒子有H2PO、HPO、PO和H3PO4,B项错误;从图1中得到随着c初始(H2PO)增大,溶液的pH从5.50减小到4.66,变小并不明显,同时pH达到4.66以后不随c初始(H2PO)增大而变化,C项错误;由图2得到,pH=4.66时,δ=0.994,即溶液中所有含P的成分中H2PO占99.4%,所以此时H3PO4几乎全部转化为LiH2PO4,D项正确。
3.常温下,向某浓度的 H2A(二元弱酸)溶液中逐滴加入某浓度的KOH溶液,所得溶液中H2A、HA-、A2-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法不正确的是( )
A.由图可知,H2A的Ka1=10-1.2
B.曲线3代表A2-的物质的量分数
C.向H2A溶液中滴加KOH溶液至pH为4.2时:c(K+)+c(H+)=3c(A2-)+c(OH-)
D.pH=4时,溶液中存在下列关系:c(K+)>c(A2-)>c(HA-)>c(H+)>c(OH-)
答案 D
解析 根据题干信息结合图像中H2A、HA-、A2-三种微粒的物质的量分数(δ)与溶液pH的关系分析可知,曲线1表示H2A的物质的量分数,曲线2表示HA-的物质的量分数,曲线3表示A2-的物质的量分数。根据图像可知,点(1.2,0.5)表明当pH=1.2时,c(H2A)=c(HA-),所以H2A的电离平衡常数Ka1==c(H+)=10-1.2,A正确;pH=4.2时,c(HA-)=c(A2-),溶液中存在电荷守恒c(K+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),所以c(K+)+c(H+)=3c(A2-)+c(OH-),C正确;pH=4时,由图像可知c(HA-)>c(A2-),D错误。
三、对数图像
1.图像类型
包括对数图像和负对数图像以及对数、负对数混合图像,其中负对数图像有以下类型:
pH图像 将溶液中c(H+)取负对数,即pH=-lg c(H+),反映到图像中是c(H+)越大,则pH越小
pOH图像 将溶液中c(OH-)取负对数,即pOH=-lg c(OH-),反映到图像中是c(OH-)越大,则pOH越小
pC图像 将溶液中某一微粒浓度[如c(A)]或某些微粒浓度的比值取负对数,即pC=-lg c(A),反映到图像中是c(A-)越大,则pC越小
2.解题策略
(1)先确定图像的类型是对数图像还是负对数图像。
(2)再弄清楚图像中横坐标和纵坐标的含义,是浓度对数还是比值对数。
(3)理清图像中曲线的变化趋势及含义,根据含义判断线上、线下的点所表示的意义。
(4)抓住图像中特殊点:如lg =0的点有c(A)=c(B);lg c(D)=0的点有c(D)=1 mol·L-1
熟记运算法则:lg ab=lg a+lg b、lg =lg a-lg b、lg 1=0,若K=c·c(K只与温度有关),得lg K=mlg c1+nlg c2。
(5)将图像中数据或曲线的变化与所学知识对接,作出正确判断。
1.某温度下,向一定体积0.1 mol·L-1的氨水中逐滴加入等浓度的盐酸,溶液中pOH[pOH=
-lg c(OH-)]与pH的变化关系如图所示。下列说法不正确的是( )
A.M点和N点溶液中H2O的电离程度相同
B.Q点溶液中,c(NH)+c(NH3·H2O)=c(Cl-)
C.M点溶液的导电性小于Q点溶液的导电性
D.N点溶液加水稀释,变小
答案 B
解析 由于M点碱过量,N点酸过量,M点溶液中氢氧根离子浓度与N点溶液中氢离子浓度相同,对水的电离抑制程度相同,故两点水的电离程度相同,A正确;Q点时pH=pOH,说明溶液呈中性,根据电荷守恒:c(NH)+c(H+)=c(Cl-)+c(OH-),则c(NH)=c(Cl-),B错误;M点溶液中主要溶质为一水合氨,为弱电解质,在溶液中部分电离,溶液中离子浓度较小,Q点溶液中溶质主要为氯化铵,为强电解质,在溶液中全部电离,溶液中离子浓度较大,故M点溶液的导电能力小于Q点,C正确;N点溶液加水稀释,Kb=,温度不变,Kb不变,加水稀释氢离子浓度减小,c(OH-)增大,所以变小,D正确。
2.常温下,向某二元弱酸H2Y溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为或]与pH的变化关系如图所示。下列说法正确的是( )
A.曲线Ⅰ表示lg 随pH变化的关系曲线
B.由图可知,H2Y的二级电离常数Ka2(H2Y)数量级为10-10
C.从a点到b点过程中,水的电离程度先增大后减小
D.NaHY溶液中的离子浓度大小为c(Na+)>c(HY-)>c(OH-)>c(H+)>c(Y2-)
答案 D
解析 二元弱酸H2Y的Ka1(H2Y)=>Ka2(H2Y)=,当溶液的pH相同时,c(H+)相同,lgX:Ⅰ>Ⅱ,则Ⅰ表示lg 与pH的变化关系,Ⅱ表示lg 与pH的变化关系,A错误;Ka2(H2Y)=,b点时,则=1,pH=10.35,则c(H+)=10-10.35,故Ka2(H2Y)=10-10.35,数量级为10-11,B错误;从H2Y→NaHY→Na2Y的转化过程中,水的电离程度逐渐增大,在b点c(HY-)=c(Y2-),还未完全转化为Na2Y,故水的电离程度逐渐增大,C错误;因HY-的水解常数Kh===10-7.65>Ka2(H2Y)=10-10.35,故NaHY溶液呈碱性,离子浓度:c(Na+)>c(HY-)>c(OH-)>c(H+)>c(Y2-),D正确。
3.(2021·湖南1月适应性考试,14改编)常温下,向20.00 mL 0.100 0 mol·L-1的CH3COOH溶液中滴加0.100 0 mol·L-1的NaOH溶液,溶液中,lg 随pH的变化关系如图所示(取lg 5=0.7)。
下列说法正确的是( )
A.常温下,CH3COOH的电离常数为10-4
B.当溶液的pH=7时,消耗NaOH溶液20.00 mL
C.溶液中水的电离程度大小:a>b>c
D.c点溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
答案 D
解析 常温下,CH3COOH的电离常数Ka=,b点pH=4.76时,lg =0,c(CH3COOH)=c(CH3COO-),CH3COOH的电离常数等于c(H+)=10-4.76,故A不符合题意;向20.00 mL 0.100 0 mol·L-1的CH3COOH溶液中滴加0.100 0 mol·L-1的NaOH溶液20 mL,溶质为CH3COONa,为强碱弱酸盐,水解显碱性,此时溶液的pH>7,故B不符合题意;酸、碱抑制水的电离,强碱弱酸盐水解显碱性,促进水的电离,a点pH=2.88,c(H+)=10-2.88 mol·L-1,由Ka===10-4.76,解得c(H+)=
10-2.88 mol·L-1,与a点对应,故a点溶质为CH3COOH,抑制水的电离,CH3COO-的水解常数Kh===10-9.24,CH3COONa溶液中存在水解平衡,促进水的电离,c点pH=8.73时,c(OH-)= mol·L-1=10-5.27 mol·L-1,lg =3.97,=10-3.97,Kh′==10-3.97×10-5.27=10-9.24=Kh,则c点为CH3COONa溶液,b点为CH3COOH和CH3COONa的混合溶液,溶液中水的电离程度大小:c>b>a,故C不符合题意;CH3COONa溶液中,由于醋酸根离子水解,c(Na+)>c(CH3COO-),但水解较微弱,c(CH3COO-)>c(OH-),所以c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D符合题意。
