第三章 第四节 第4课时 难溶电解质沉淀溶解平衡图像分析 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1
文档属性
| 名称 | 第三章 第四节 第4课时 难溶电解质沉淀溶解平衡图像分析 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 644.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-05 22:53:39 | ||
图片预览




文档简介
第4课时 难溶电解质沉淀溶解平衡图像分析
[核心素养发展目标]
1.理解难溶电解质沉淀溶解平衡并会应用解决相关问题。
2.学会沉淀溶解平衡图像的分析方法。
一、曲线型图像
1.沉淀溶解平衡Ksp曲线
(1)典型示例
(2)点的变化
①a→c:曲线上变化,增大c(SO);
②b→c:加入1×10-5 mol·L-1 Na2SO4溶液(加水不行);
③d→c:加入BaCl2固体(忽略溶液的体积变化);
④c→a:曲线上变化,增大c(Ba2+);
⑤曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液。
2.c(Mn+)—pH图像
Fe(OH)3和Cu(OH)2的c—pH关系如图(温度一定):图中曲线为相应金属阳离子氢氧化物的沉淀溶解平衡曲线,可利用图像判断有关氢氧化物的Ksp的大小以及离子分离方法的选择。
1.(2022·青岛高二检测)一定温度下,AgCl(s)Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法不正确的是( )
A.在AgCl溶于水形成的饱和溶液中:c(Ag+)=c(Cl-)
B.b点的溶液中加入少量AgNO3固体,会析出白色沉淀
C.d点溶液中加入少量AgCl固体,c(Ag+)和c(Cl-)均增大
D.a、b、c三点对应的AgCl的Ksp和溶解度皆不相等
2.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
A.KspB.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c与c乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
3.如图所示,有两条T1、T2两种温度下的BaSO4在水中的沉淀溶解平衡曲线,下列说法不正确的是( )
A.加入Na2SO4固体可使溶液由a点变到b点
B.T1温度下,在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
二、对数型图像
1.pH(或pOH)—pC图
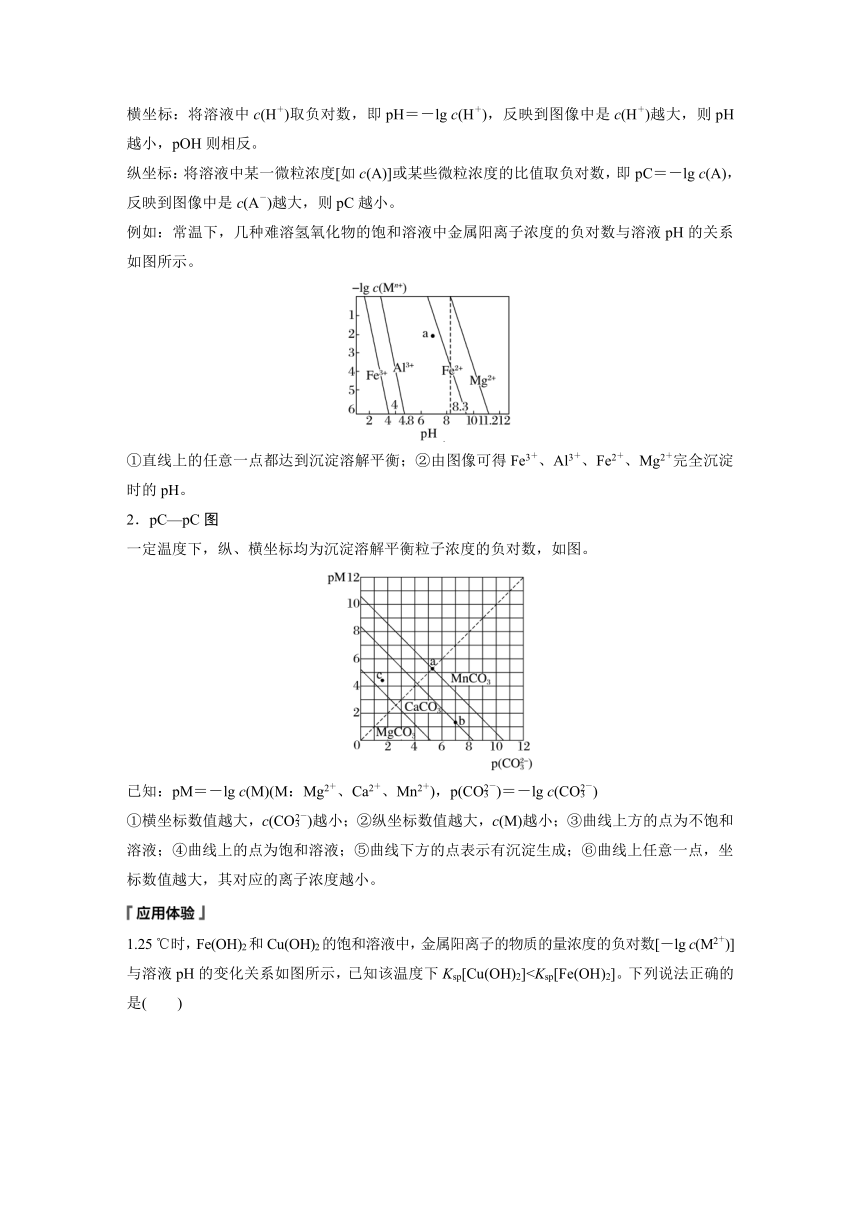
横坐标:将溶液中c(H+)取负对数,即pH=-lg c(H+),反映到图像中是c(H+)越大,则pH越小,pOH则相反。
纵坐标:将溶液中某一微粒浓度[如c(A)]或某些微粒浓度的比值取负对数,即pC=-lg c(A),反映到图像中是c(A-)越大,则pC越小。
例如:常温下,几种难溶氢氧化物的饱和溶液中金属阳离子浓度的负对数与溶液pH的关系如图所示。
①直线上的任意一点都达到沉淀溶解平衡;②由图像可得Fe3+、Al3+、Fe2+、Mg2+完全沉淀时的pH。
2.pC—pC图
一定温度下,纵、横坐标均为沉淀溶解平衡粒子浓度的负对数,如图。
已知:pM=-lg c(M)(M:Mg2+、Ca2+、Mn2+),p(CO)=-lg c(CO)
①横坐标数值越大,c(CO)越小;②纵坐标数值越大,c(M)越小;③曲线上方的点为不饱和溶液;④曲线上的点为饱和溶液;⑤曲线下方的点表示有沉淀生成;⑥曲线上任意一点,坐标数值越大,其对应的离子浓度越小。
1.25 ℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]A.曲线a表示Fe(OH)2饱和溶液中的变化关系
B.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
C.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1
D.向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
2.某硫酸盐在水中的沉淀溶解平衡曲线如下(M2+代表+2价金属离子)。下列说法正确的是( )
A.363 K时,该硫酸盐的溶度积Ksp的数量级为10-3
B.温度一定时溶度积Ksp随c(SO)的增大而减小
C.313 K下的该盐饱和溶液升温到363 K时有固体析出
D.283 K下的该盐饱和溶液升温到313 K时有固体析出
三、沉淀溶解平衡滴定曲线
沉淀溶解平衡滴定曲线,一般横坐标为滴加溶液的体积,纵坐标为随溶液体积增加,相应离子浓度的变化。突跃点表示恰好完全反应,曲线上的点都处于沉淀溶解平衡状态。利用突跃点对应的数据可计算对应沉淀的Ksp。
例 用0.100 mol·L-1 AgNO3滴定50.0 mL 0.050 0 mol·L-1 Cl-溶液的滴定曲线如图所示。回答下列问题:
(1)根据曲线数据计算可知Ksp(AgCl)的数量级为____________。
(2)滴定终点c点为饱和AgCl溶液,c(Ag+)________(填“>”“<”或“=”)c(Cl-)。
(3)相同实验条件下,若改为0.040 0 mol·L-1 Cl-,反应终点c向________(填“a”或“b”,下同)方向移动。
(4)相同实验条件下,若改为0.050 0 mol·L-1 Br-,反应终点c向______________方向移动。
1.某温度下,向10 mL 0.1 mol·L-1 NaCl溶液和10 mL 0.1 mol·L-1 K2CrO4溶液中分别滴加0.1 mol·L-1 AgNO3溶液,滴加过程中pM[pM=-lgM,M为c(Cl-)或c(CrO)]与所加AgNO3溶液体积之间的关系如图所示。下列说法错误的是( )
A.L1线代表AgCl的沉淀溶解平衡曲线
B.a1、b两点所示溶液中c(Ag+):b>a1
C.若将上述K2CrO4溶液的浓度改为0.05 mol·L-1,则b点会移动到c点
D.将a1与b点溶液混合,无Ag2CrO4固体析出
2.常温下,分别向体积均为10 mL、浓度均为0.1 mol·L-1的FeCl2和MnCl2溶液中滴加0.1 mol·
L-1的K2S溶液,滴加过程中溶液-lg c(Fe2+)和-lg c(Mn2+)与滴入K2S溶液体积(V)的关系如图所示。[已知:Ksp(MnS)>Ksp(FeS),lg 3≈0.5,忽略溶液混合时温度和体积的变化],下列说法错误的是( )
A.加入过量难溶FeS可除去FeCl2溶液中混有的Mn2+
B.e点纵坐标约为13.5
C.d点钾离子的物质的量浓度c(K+)=0.13 mol·L-1
D.溶液的pH:d>c>a
解答沉淀溶解平衡图像题的三步骤
第一步:明确图像中横、纵坐标的含义
横坐标通常是浓度或pH或体积,纵坐标通常是难溶物溶解后电离出的离子浓度(或离子浓度的负对数)。例如:
第二步:理解图像中线上点、线外点的含义(以氯化银为例)
(1)曲线上任意一点都达到了沉淀溶解平衡状态,此时Q=Ksp。
(2)曲线上方区域的点均为过饱和溶液,此时Q>Ksp。
(3)曲线下方区域的点均为不饱和溶液,此时Q第三步:抓住Ksp的特点,结合选项分析判断
(1)溶液在蒸发时,离子浓度的变化分两种情况:
①原溶液不饱和时,离子浓度都增大;
②原溶液饱和时,离子浓度都不变。
(2)溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同一曲线上的点,溶度积常数相同。
第4课时 难溶电解质沉淀溶解平衡图像分析
[核心素养发展目标] 1.理解难溶电解质沉淀溶解平衡并会应用解决相关问题。2.学会沉淀溶解平衡图像的分析方法。
一、曲线型图像
1.沉淀溶解平衡Ksp曲线
(1)典型示例
(2)点的变化
①a→c:曲线上变化,增大c(SO);
②b→c:加入1×10-5 mol·L-1 Na2SO4溶液(加水不行);
③d→c:加入BaCl2固体(忽略溶液的体积变化);
④c→a:曲线上变化,增大c(Ba2+);
⑤曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液。
2.c(Mn+)—pH图像
Fe(OH)3和Cu(OH)2的c—pH关系如图(温度一定):
图中曲线为相应金属阳离子氢氧化物的沉淀溶解平衡曲线,可利用图像判断有关氢氧化物的Ksp的大小以及离子分离方法的选择。
1.(2022·青岛高二检测)一定温度下,AgCl(s)Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法不正确的是( )
A.在AgCl溶于水形成的饱和溶液中:c(Ag+)=c(Cl-)
B.b点的溶液中加入少量AgNO3固体,会析出白色沉淀
C.d点溶液中加入少量AgCl固体,c(Ag+)和c(Cl-)均增大
D.a、b、c三点对应的AgCl的Ksp和溶解度皆不相等
答案 D
解析 在AgCl溶于水形成的饱和溶液中存在沉淀溶解平衡:AgCl(s)??Ag+(aq)+Cl-(aq),AgCl溶解生成的c(Cl-)=c(Ag+),故A正确;b点溶液为饱和溶液,加入少量的AgNO3固体,使c(Ag+)增大,沉淀溶解平衡逆向移动,会析出白色沉淀,故B正确;d点溶液为不饱和溶液,加入少量AgCl固体会继续溶解,则c(Cl-)和c(Ag+)都增大,故C正确;a、b、c三点都在沉淀溶解平衡曲线上,且温度不变,则Ksp不变,AgCl的溶解度也只与温度有关,则a、b、c三点对应的AgCl的Ksp和溶解度均相等,故D错误。
2.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
A.KspB.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c与c乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
答案 B
解析 比较b、c两点,金属离子的浓度相同,对应的pH分别为1.3、4.4,即前者c小,根据Ksp的计算公式可得Ksp3.如图所示,有两条T1、T2两种温度下的BaSO4在水中的沉淀溶解平衡曲线,下列说法不正确的是( )
A.加入Na2SO4固体可使溶液由a点变到b点
B.T1温度下,在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
答案 D
解析 加入Na2SO4固体,c(SO)增大,Ksp不变,c(Ba2+)减小,A项正确;在T1曲线上方任意一点,由于Q>Ksp,所以均有BaSO4沉淀生成,B项正确;不饱和溶液蒸发溶剂,c(SO)、c(Ba2+)均增大,C项正确;升温,Ksp增大,c(SO)、c(Ba2+)均增大,D项错误。
二、对数型图像
1.pH(或pOH)—pC图
横坐标:将溶液中c(H+)取负对数,即pH=-lg c(H+),反映到图像中是c(H+)越大,则pH越小,pOH则相反。
纵坐标:将溶液中某一微粒浓度[如c(A)]或某些微粒浓度的比值取负对数,即pC=-lg c(A),反映到图像中是c(A-)越大,则pC越小。
例如:常温下,几种难溶氢氧化物的饱和溶液中金属阳离子浓度的负对数与溶液pH的关系如图所示。
①直线上的任意一点都达到沉淀溶解平衡;②由图像可得Fe3+、Al3+、Fe2+、Mg2+完全沉淀时的pH。
2.pC—pC图
一定温度下,纵、横坐标均为沉淀溶解平衡粒子浓度的负对数,如图。
已知:pM=-lg c(M)(M:Mg2+、Ca2+、Mn2+),p(CO)=-lg c(CO)
①横坐标数值越大,c(CO)越小;②纵坐标数值越大,c(M)越小;③曲线上方的点为不饱和溶液;④曲线上的点为饱和溶液;⑤曲线下方的点表示有沉淀生成;⑥曲线上任意一点,坐标数值越大,其对应的离子浓度越小。
1.25 ℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]A.曲线a表示Fe(OH)2饱和溶液中的变化关系
B.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
C.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1
D.向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
答案 C
解析 根据图示,pH相同时,曲线a对应的c(M2+)小,因Fe(OH)2与Cu(OH)2属于同类型沉淀,一定温度下,Ksp越大,c(M2+)越大,故曲线a表示Cu(OH)2饱和溶液中的变化关系,A项错误;Ksp[Cu(OH)2](10-4)2=10-19.7,Ksp[Fe(OH)2]=10-7.1×(10-4)2=10-15.1,当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=∶=Ksp[Fe(OH)2]∶Ksp[Cu(OH)2]=104.6∶1,C项正确;X点转化为Y点时,c(Cu2+)不变,c(OH-)增大,但当加入少量NaOH固体后,c(OH-)增大,Cu(OH)2的沉淀溶解平衡向逆反应方向移动,c(Cu2+)减小,故X点不能转化为Y点,D项错误。
2.某硫酸盐在水中的沉淀溶解平衡曲线如下(M2+代表+2价金属离子)。下列说法正确的是( )
A.363 K时,该硫酸盐的溶度积Ksp的数量级为10-3
B.温度一定时溶度积Ksp随c(SO)的增大而减小
C.313 K下的该盐饱和溶液升温到363 K时有固体析出
D.283 K下的该盐饱和溶液升温到313 K时有固体析出
答案 C
解析 363 K时,Ksp=c(M2+)·c(SO)=10-1.70×10-1.50=10-3.20,即Ksp的数量级为10-4,A错误;溶度积常数只与温度有关,与物质的浓度无关,B错误;由题图知,363 K时Ksp最小,313 K时Ksp最大,故313 K下的该盐饱和溶液升温到363 K时有固体析出,C正确;由题图可知:温度由283 K升温到313 K时,物质的溶解度增大,溶液由饱和溶液变为不饱和溶液,因此不会有固体析出,D错误。
三、沉淀溶解平衡滴定曲线
沉淀溶解平衡滴定曲线,一般横坐标为滴加溶液的体积,纵坐标为随溶液体积增加,相应离子浓度的变化。突跃点表示恰好完全反应,曲线上的点都处于沉淀溶解平衡状态。利用突跃点对应的数据可计算对应沉淀的Ksp。
例 用0.100 mol·L-1 AgNO3滴定50.0 mL 0.050 0 mol·L-1 Cl-溶液的滴定曲线如图所示。回答下列问题:
(1)根据曲线数据计算可知Ksp(AgCl)的数量级为____________。
(2)滴定终点c点为饱和AgCl溶液,c(Ag+)________(填“>”“<”或“=”)c(Cl-)。
(3)相同实验条件下,若改为0.040 0 mol·L-1 Cl-,反应终点c向________(填“a”或“b”,下同)方向移动。
(4)相同实验条件下,若改为0.050 0 mol·L-1 Br-,反应终点c向______________方向移动。
答案 (1)10-10 (2)= (3)a (4)b
解析 (1)由题图可知,当AgNO3溶液的体积为50.0 mL时,溶液中的c(Cl-)略小于10-8 mol·
L-1,此时混合溶液中c(Ag+)==2.5×
10-2 mol·L-1,故Ksp(AgCl)=c(Ag+)·c(Cl-)≈2.5×10-2×10-8=2.5×10-10。(3)根据Ag++Cl-===AgCl↓可知,达到滴定终点时,消耗AgNO3溶液的体积为=
20.0 mL,反应终点c向a方向移动。(4)相同实验条件下,沉淀相同物质的量的Cl-和Br-消耗的AgNO3的物质的量相同,由于Ksp(AgBr)1.某温度下,向10 mL 0.1 mol·L-1 NaCl溶液和10 mL 0.1 mol·L-1 K2CrO4溶液中分别滴加0.1 mol·L-1 AgNO3溶液,滴加过程中pM[pM=-lgM,M为c(Cl-)或c(CrO)]与所加AgNO3溶液体积之间的关系如图所示。下列说法错误的是( )
A.L1线代表AgCl的沉淀溶解平衡曲线
B.a1、b两点所示溶液中c(Ag+):b>a1
C.若将上述K2CrO4溶液的浓度改为0.05 mol·L-1,则b点会移动到c点
D.将a1与b点溶液混合,无Ag2CrO4固体析出
答案 C
解析 由图像可知,当加10 mL AgNO3溶液时,Cl-恰好反应完,加20 mL AgNO3溶液时CrO恰好反应完,故L1表示AgCl的沉淀溶解平衡曲线,L2表示Ag2CrO4的沉淀溶解平衡曲线,A正确;a1点恰好完全反应,-lg c(Cl-)=5.0,c(Cl-)=10-5.0 mol·L-1,c(Ag+)=c(Cl-)=
10-5.0 mol·L-1,b点K2CrO4恰好完全反应,-lg c(CrO)=4.0,c(CrO)=10-4.0 mol·L-1,c(Ag+)=2c(CrO)=2×10-4.0 mol·L-1,故c(Ag+):b>a1,B正确;将K2CrO4浓度改为0.05 mol·
L-1,则完全反应时V(AgNO3)==10 mL,但温度不变,Ksp(Ag2CrO4)不变,平衡时-lg c(CrO)=4.0,不是c点,C错误;将a1和b点溶液混合后,c(Ag+)==1.24×10-4.0 mol·L-1,c(CrO)==6×10-5 mol·L-1,由b点溶液可得Ksp(Ag2CrO4)=c2(Ag+)·c(CrO)=(2×10-4.0)2×10-4.0=4×10-12。混合后c2(Ag+)·c(CrO)=(1.24×10-4)2×6×10-5=9.225 6
×10-13<Ksp(Ag2CrO4),故无Ag2CrO4固体析出,D正确。
2.常温下,分别向体积均为10 mL、浓度均为0.1 mol·L-1的FeCl2和MnCl2溶液中滴加0.1 mol·
L-1的K2S溶液,滴加过程中溶液-lg c(Fe2+)和-lg c(Mn2+)与滴入K2S溶液体积(V)的关系如图所示。[已知:Ksp(MnS)>Ksp(FeS),lg 3≈0.5,忽略溶液混合时温度和体积的变化],下列说法错误的是( )
A.加入过量难溶FeS可除去FeCl2溶液中混有的Mn2+
B.e点纵坐标约为13.5
C.d点钾离子的物质的量浓度c(K+)=0.13 mol·L-1
D.溶液的pH:d>c>a
答案 A
解析 图中纵坐标为金属离子浓度的负对数,数值越大,离子浓度越小,根据已知Ksp(MnS)>Ksp(FeS),即硫离子浓度相等时,c(Fe2+)Ksp(FeS)可知,FeS比MnS更难溶,所以加入过量难溶FeS不能除去FeCl2溶液中混有的Mn2+,故A错误;a—b—e为MnCl2溶液的滴定曲线,向10 mL浓度为0.1 mol·L-1 MnCl2溶液中滴加0.1 mol·L-1 K2S溶液,b点达到滴定终点,c(S2-)≈c(Mn2+),-lg c(Mn2+)=7.5,Ksp(MnS)=10-15,e点时,c(S2-)=×
0.1 mol·L-1,c(Mn2+)= mol·L-1=3×10-14 mol·L-1,故e点纵坐标为-lg c(Mn2+)=
-lg (3×10-14)≈13.5,故B正确;a—c—d为FeCl2溶液的滴定曲线,d点时,加入0.1 mol·
L-1 K2S溶液的体积为20 mL,此时溶液总体积为30 mL,则钾离子的物质的量浓度c(K+)= mol·L-1≈0.13 mol·L-1,故C正确;a点溶液中Mn2+和Fe2+水解,溶液显酸性,分别加入硫化钾生成沉淀,c点Fe2+恰好完全沉淀,溶质为氯化钾,溶液呈中性,d点硫化钾过量,溶液的主要成分为氯化钾和硫化钾,硫离子水解,溶液显碱性,则溶液的pH:d>c>a,故D正确。
解答沉淀溶解平衡图像题的三步骤
第一步:明确图像中横、纵坐标的含义
横坐标通常是浓度或pH或体积,纵坐标通常是难溶物溶解后电离出的离子浓度(或离子浓度的负对数)。例如:
第二步:理解图像中线上点、线外点的含义 以氯化银为例
1 曲线上任意一点都达到了沉淀溶解平衡状态,此时Q=Ksp。
2 曲线上方区域的点均为过饱和溶液,此时Q>Ksp。
3 曲线下方区域的点均为不饱和溶液,此时Q第三步:抓住Ksp的特点,结合选项分析判断
1 溶液在蒸发时,离子浓度的变化分两种情况:
①原溶液不饱和时,离子浓度都增大;
②原溶液饱和时,离子浓度都不变。
2 溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同一曲线上的点,溶度积常数相同。
[核心素养发展目标]
1.理解难溶电解质沉淀溶解平衡并会应用解决相关问题。
2.学会沉淀溶解平衡图像的分析方法。
一、曲线型图像
1.沉淀溶解平衡Ksp曲线
(1)典型示例
(2)点的变化
①a→c:曲线上变化,增大c(SO);
②b→c:加入1×10-5 mol·L-1 Na2SO4溶液(加水不行);
③d→c:加入BaCl2固体(忽略溶液的体积变化);
④c→a:曲线上变化,增大c(Ba2+);
⑤曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液。
2.c(Mn+)—pH图像
Fe(OH)3和Cu(OH)2的c—pH关系如图(温度一定):图中曲线为相应金属阳离子氢氧化物的沉淀溶解平衡曲线,可利用图像判断有关氢氧化物的Ksp的大小以及离子分离方法的选择。
1.(2022·青岛高二检测)一定温度下,AgCl(s)Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法不正确的是( )
A.在AgCl溶于水形成的饱和溶液中:c(Ag+)=c(Cl-)
B.b点的溶液中加入少量AgNO3固体,会析出白色沉淀
C.d点溶液中加入少量AgCl固体,c(Ag+)和c(Cl-)均增大
D.a、b、c三点对应的AgCl的Ksp和溶解度皆不相等
2.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
A.Ksp
C.c、d两点代表的溶液中c与c乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
3.如图所示,有两条T1、T2两种温度下的BaSO4在水中的沉淀溶解平衡曲线,下列说法不正确的是( )
A.加入Na2SO4固体可使溶液由a点变到b点
B.T1温度下,在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
二、对数型图像
1.pH(或pOH)—pC图
横坐标:将溶液中c(H+)取负对数,即pH=-lg c(H+),反映到图像中是c(H+)越大,则pH越小,pOH则相反。
纵坐标:将溶液中某一微粒浓度[如c(A)]或某些微粒浓度的比值取负对数,即pC=-lg c(A),反映到图像中是c(A-)越大,则pC越小。
例如:常温下,几种难溶氢氧化物的饱和溶液中金属阳离子浓度的负对数与溶液pH的关系如图所示。
①直线上的任意一点都达到沉淀溶解平衡;②由图像可得Fe3+、Al3+、Fe2+、Mg2+完全沉淀时的pH。
2.pC—pC图
一定温度下,纵、横坐标均为沉淀溶解平衡粒子浓度的负对数,如图。
已知:pM=-lg c(M)(M:Mg2+、Ca2+、Mn2+),p(CO)=-lg c(CO)
①横坐标数值越大,c(CO)越小;②纵坐标数值越大,c(M)越小;③曲线上方的点为不饱和溶液;④曲线上的点为饱和溶液;⑤曲线下方的点表示有沉淀生成;⑥曲线上任意一点,坐标数值越大,其对应的离子浓度越小。
1.25 ℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]
B.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
C.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1
D.向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
2.某硫酸盐在水中的沉淀溶解平衡曲线如下(M2+代表+2价金属离子)。下列说法正确的是( )
A.363 K时,该硫酸盐的溶度积Ksp的数量级为10-3
B.温度一定时溶度积Ksp随c(SO)的增大而减小
C.313 K下的该盐饱和溶液升温到363 K时有固体析出
D.283 K下的该盐饱和溶液升温到313 K时有固体析出
三、沉淀溶解平衡滴定曲线
沉淀溶解平衡滴定曲线,一般横坐标为滴加溶液的体积,纵坐标为随溶液体积增加,相应离子浓度的变化。突跃点表示恰好完全反应,曲线上的点都处于沉淀溶解平衡状态。利用突跃点对应的数据可计算对应沉淀的Ksp。
例 用0.100 mol·L-1 AgNO3滴定50.0 mL 0.050 0 mol·L-1 Cl-溶液的滴定曲线如图所示。回答下列问题:
(1)根据曲线数据计算可知Ksp(AgCl)的数量级为____________。
(2)滴定终点c点为饱和AgCl溶液,c(Ag+)________(填“>”“<”或“=”)c(Cl-)。
(3)相同实验条件下,若改为0.040 0 mol·L-1 Cl-,反应终点c向________(填“a”或“b”,下同)方向移动。
(4)相同实验条件下,若改为0.050 0 mol·L-1 Br-,反应终点c向______________方向移动。
1.某温度下,向10 mL 0.1 mol·L-1 NaCl溶液和10 mL 0.1 mol·L-1 K2CrO4溶液中分别滴加0.1 mol·L-1 AgNO3溶液,滴加过程中pM[pM=-lgM,M为c(Cl-)或c(CrO)]与所加AgNO3溶液体积之间的关系如图所示。下列说法错误的是( )
A.L1线代表AgCl的沉淀溶解平衡曲线
B.a1、b两点所示溶液中c(Ag+):b>a1
C.若将上述K2CrO4溶液的浓度改为0.05 mol·L-1,则b点会移动到c点
D.将a1与b点溶液混合,无Ag2CrO4固体析出
2.常温下,分别向体积均为10 mL、浓度均为0.1 mol·L-1的FeCl2和MnCl2溶液中滴加0.1 mol·
L-1的K2S溶液,滴加过程中溶液-lg c(Fe2+)和-lg c(Mn2+)与滴入K2S溶液体积(V)的关系如图所示。[已知:Ksp(MnS)>Ksp(FeS),lg 3≈0.5,忽略溶液混合时温度和体积的变化],下列说法错误的是( )
A.加入过量难溶FeS可除去FeCl2溶液中混有的Mn2+
B.e点纵坐标约为13.5
C.d点钾离子的物质的量浓度c(K+)=0.13 mol·L-1
D.溶液的pH:d>c>a
解答沉淀溶解平衡图像题的三步骤
第一步:明确图像中横、纵坐标的含义
横坐标通常是浓度或pH或体积,纵坐标通常是难溶物溶解后电离出的离子浓度(或离子浓度的负对数)。例如:
第二步:理解图像中线上点、线外点的含义(以氯化银为例)
(1)曲线上任意一点都达到了沉淀溶解平衡状态,此时Q=Ksp。
(2)曲线上方区域的点均为过饱和溶液,此时Q>Ksp。
(3)曲线下方区域的点均为不饱和溶液,此时Q
(1)溶液在蒸发时,离子浓度的变化分两种情况:
①原溶液不饱和时,离子浓度都增大;
②原溶液饱和时,离子浓度都不变。
(2)溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同一曲线上的点,溶度积常数相同。
第4课时 难溶电解质沉淀溶解平衡图像分析
[核心素养发展目标] 1.理解难溶电解质沉淀溶解平衡并会应用解决相关问题。2.学会沉淀溶解平衡图像的分析方法。
一、曲线型图像
1.沉淀溶解平衡Ksp曲线
(1)典型示例
(2)点的变化
①a→c:曲线上变化,增大c(SO);
②b→c:加入1×10-5 mol·L-1 Na2SO4溶液(加水不行);
③d→c:加入BaCl2固体(忽略溶液的体积变化);
④c→a:曲线上变化,增大c(Ba2+);
⑤曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液。
2.c(Mn+)—pH图像
Fe(OH)3和Cu(OH)2的c—pH关系如图(温度一定):
图中曲线为相应金属阳离子氢氧化物的沉淀溶解平衡曲线,可利用图像判断有关氢氧化物的Ksp的大小以及离子分离方法的选择。
1.(2022·青岛高二检测)一定温度下,AgCl(s)Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法不正确的是( )
A.在AgCl溶于水形成的饱和溶液中:c(Ag+)=c(Cl-)
B.b点的溶液中加入少量AgNO3固体,会析出白色沉淀
C.d点溶液中加入少量AgCl固体,c(Ag+)和c(Cl-)均增大
D.a、b、c三点对应的AgCl的Ksp和溶解度皆不相等
答案 D
解析 在AgCl溶于水形成的饱和溶液中存在沉淀溶解平衡:AgCl(s)??Ag+(aq)+Cl-(aq),AgCl溶解生成的c(Cl-)=c(Ag+),故A正确;b点溶液为饱和溶液,加入少量的AgNO3固体,使c(Ag+)增大,沉淀溶解平衡逆向移动,会析出白色沉淀,故B正确;d点溶液为不饱和溶液,加入少量AgCl固体会继续溶解,则c(Cl-)和c(Ag+)都增大,故C正确;a、b、c三点都在沉淀溶解平衡曲线上,且温度不变,则Ksp不变,AgCl的溶解度也只与温度有关,则a、b、c三点对应的AgCl的Ksp和溶解度均相等,故D错误。
2.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
A.Ksp
C.c、d两点代表的溶液中c与c乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
答案 B
解析 比较b、c两点,金属离子的浓度相同,对应的pH分别为1.3、4.4,即前者c小,根据Ksp的计算公式可得Ksp
A.加入Na2SO4固体可使溶液由a点变到b点
B.T1温度下,在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
答案 D
解析 加入Na2SO4固体,c(SO)增大,Ksp不变,c(Ba2+)减小,A项正确;在T1曲线上方任意一点,由于Q>Ksp,所以均有BaSO4沉淀生成,B项正确;不饱和溶液蒸发溶剂,c(SO)、c(Ba2+)均增大,C项正确;升温,Ksp增大,c(SO)、c(Ba2+)均增大,D项错误。
二、对数型图像
1.pH(或pOH)—pC图
横坐标:将溶液中c(H+)取负对数,即pH=-lg c(H+),反映到图像中是c(H+)越大,则pH越小,pOH则相反。
纵坐标:将溶液中某一微粒浓度[如c(A)]或某些微粒浓度的比值取负对数,即pC=-lg c(A),反映到图像中是c(A-)越大,则pC越小。
例如:常温下,几种难溶氢氧化物的饱和溶液中金属阳离子浓度的负对数与溶液pH的关系如图所示。
①直线上的任意一点都达到沉淀溶解平衡;②由图像可得Fe3+、Al3+、Fe2+、Mg2+完全沉淀时的pH。
2.pC—pC图
一定温度下,纵、横坐标均为沉淀溶解平衡粒子浓度的负对数,如图。
已知:pM=-lg c(M)(M:Mg2+、Ca2+、Mn2+),p(CO)=-lg c(CO)
①横坐标数值越大,c(CO)越小;②纵坐标数值越大,c(M)越小;③曲线上方的点为不饱和溶液;④曲线上的点为饱和溶液;⑤曲线下方的点表示有沉淀生成;⑥曲线上任意一点,坐标数值越大,其对应的离子浓度越小。
1.25 ℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]
B.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
C.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1
D.向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
答案 C
解析 根据图示,pH相同时,曲线a对应的c(M2+)小,因Fe(OH)2与Cu(OH)2属于同类型沉淀,一定温度下,Ksp越大,c(M2+)越大,故曲线a表示Cu(OH)2饱和溶液中的变化关系,A项错误;Ksp[Cu(OH)2]
2.某硫酸盐在水中的沉淀溶解平衡曲线如下(M2+代表+2价金属离子)。下列说法正确的是( )
A.363 K时,该硫酸盐的溶度积Ksp的数量级为10-3
B.温度一定时溶度积Ksp随c(SO)的增大而减小
C.313 K下的该盐饱和溶液升温到363 K时有固体析出
D.283 K下的该盐饱和溶液升温到313 K时有固体析出
答案 C
解析 363 K时,Ksp=c(M2+)·c(SO)=10-1.70×10-1.50=10-3.20,即Ksp的数量级为10-4,A错误;溶度积常数只与温度有关,与物质的浓度无关,B错误;由题图知,363 K时Ksp最小,313 K时Ksp最大,故313 K下的该盐饱和溶液升温到363 K时有固体析出,C正确;由题图可知:温度由283 K升温到313 K时,物质的溶解度增大,溶液由饱和溶液变为不饱和溶液,因此不会有固体析出,D错误。
三、沉淀溶解平衡滴定曲线
沉淀溶解平衡滴定曲线,一般横坐标为滴加溶液的体积,纵坐标为随溶液体积增加,相应离子浓度的变化。突跃点表示恰好完全反应,曲线上的点都处于沉淀溶解平衡状态。利用突跃点对应的数据可计算对应沉淀的Ksp。
例 用0.100 mol·L-1 AgNO3滴定50.0 mL 0.050 0 mol·L-1 Cl-溶液的滴定曲线如图所示。回答下列问题:
(1)根据曲线数据计算可知Ksp(AgCl)的数量级为____________。
(2)滴定终点c点为饱和AgCl溶液,c(Ag+)________(填“>”“<”或“=”)c(Cl-)。
(3)相同实验条件下,若改为0.040 0 mol·L-1 Cl-,反应终点c向________(填“a”或“b”,下同)方向移动。
(4)相同实验条件下,若改为0.050 0 mol·L-1 Br-,反应终点c向______________方向移动。
答案 (1)10-10 (2)= (3)a (4)b
解析 (1)由题图可知,当AgNO3溶液的体积为50.0 mL时,溶液中的c(Cl-)略小于10-8 mol·
L-1,此时混合溶液中c(Ag+)==2.5×
10-2 mol·L-1,故Ksp(AgCl)=c(Ag+)·c(Cl-)≈2.5×10-2×10-8=2.5×10-10。(3)根据Ag++Cl-===AgCl↓可知,达到滴定终点时,消耗AgNO3溶液的体积为=
20.0 mL,反应终点c向a方向移动。(4)相同实验条件下,沉淀相同物质的量的Cl-和Br-消耗的AgNO3的物质的量相同,由于Ksp(AgBr)
A.L1线代表AgCl的沉淀溶解平衡曲线
B.a1、b两点所示溶液中c(Ag+):b>a1
C.若将上述K2CrO4溶液的浓度改为0.05 mol·L-1,则b点会移动到c点
D.将a1与b点溶液混合,无Ag2CrO4固体析出
答案 C
解析 由图像可知,当加10 mL AgNO3溶液时,Cl-恰好反应完,加20 mL AgNO3溶液时CrO恰好反应完,故L1表示AgCl的沉淀溶解平衡曲线,L2表示Ag2CrO4的沉淀溶解平衡曲线,A正确;a1点恰好完全反应,-lg c(Cl-)=5.0,c(Cl-)=10-5.0 mol·L-1,c(Ag+)=c(Cl-)=
10-5.0 mol·L-1,b点K2CrO4恰好完全反应,-lg c(CrO)=4.0,c(CrO)=10-4.0 mol·L-1,c(Ag+)=2c(CrO)=2×10-4.0 mol·L-1,故c(Ag+):b>a1,B正确;将K2CrO4浓度改为0.05 mol·
L-1,则完全反应时V(AgNO3)==10 mL,但温度不变,Ksp(Ag2CrO4)不变,平衡时-lg c(CrO)=4.0,不是c点,C错误;将a1和b点溶液混合后,c(Ag+)==1.24×10-4.0 mol·L-1,c(CrO)==6×10-5 mol·L-1,由b点溶液可得Ksp(Ag2CrO4)=c2(Ag+)·c(CrO)=(2×10-4.0)2×10-4.0=4×10-12。混合后c2(Ag+)·c(CrO)=(1.24×10-4)2×6×10-5=9.225 6
×10-13<Ksp(Ag2CrO4),故无Ag2CrO4固体析出,D正确。
2.常温下,分别向体积均为10 mL、浓度均为0.1 mol·L-1的FeCl2和MnCl2溶液中滴加0.1 mol·
L-1的K2S溶液,滴加过程中溶液-lg c(Fe2+)和-lg c(Mn2+)与滴入K2S溶液体积(V)的关系如图所示。[已知:Ksp(MnS)>Ksp(FeS),lg 3≈0.5,忽略溶液混合时温度和体积的变化],下列说法错误的是( )
A.加入过量难溶FeS可除去FeCl2溶液中混有的Mn2+
B.e点纵坐标约为13.5
C.d点钾离子的物质的量浓度c(K+)=0.13 mol·L-1
D.溶液的pH:d>c>a
答案 A
解析 图中纵坐标为金属离子浓度的负对数,数值越大,离子浓度越小,根据已知Ksp(MnS)>Ksp(FeS),即硫离子浓度相等时,c(Fe2+)
0.1 mol·L-1,c(Mn2+)= mol·L-1=3×10-14 mol·L-1,故e点纵坐标为-lg c(Mn2+)=
-lg (3×10-14)≈13.5,故B正确;a—c—d为FeCl2溶液的滴定曲线,d点时,加入0.1 mol·
L-1 K2S溶液的体积为20 mL,此时溶液总体积为30 mL,则钾离子的物质的量浓度c(K+)= mol·L-1≈0.13 mol·L-1,故C正确;a点溶液中Mn2+和Fe2+水解,溶液显酸性,分别加入硫化钾生成沉淀,c点Fe2+恰好完全沉淀,溶质为氯化钾,溶液呈中性,d点硫化钾过量,溶液的主要成分为氯化钾和硫化钾,硫离子水解,溶液显碱性,则溶液的pH:d>c>a,故D正确。
解答沉淀溶解平衡图像题的三步骤
第一步:明确图像中横、纵坐标的含义
横坐标通常是浓度或pH或体积,纵坐标通常是难溶物溶解后电离出的离子浓度(或离子浓度的负对数)。例如:
第二步:理解图像中线上点、线外点的含义 以氯化银为例
1 曲线上任意一点都达到了沉淀溶解平衡状态,此时Q=Ksp。
2 曲线上方区域的点均为过饱和溶液,此时Q>Ksp。
3 曲线下方区域的点均为不饱和溶液,此时Q
1 溶液在蒸发时,离子浓度的变化分两种情况:
①原溶液不饱和时,离子浓度都增大;
②原溶液饱和时,离子浓度都不变。
2 溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同一曲线上的点,溶度积常数相同。
