化学人教版(2019)选择性必修第一册 4.1.1原电池的工作原理 课件(共32张PPT)
文档属性
| 名称 | 化学人教版(2019)选择性必修第一册 4.1.1原电池的工作原理 课件(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 52.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-06 08:20:09 | ||
图片预览








文档简介
(共32张PPT)
第四章 化学反应与电能
第一节 原电池
第1课时 原电池的工作原理
汽车等机动车往往需要配备电池,人造卫星、宇宙飞船等必须携带电池,人们在日常生活中也经常要使用电池……这些足以说明电池的重要作用。
现在,为满足人们生产和生活水平不断提高的需要,性能优异的新型电池相继出现,如锌银电池、锂电池、燃料电池等。那么,电池究竟是一种什么样的装置?他们在工作时,装置中发生了什么变化?
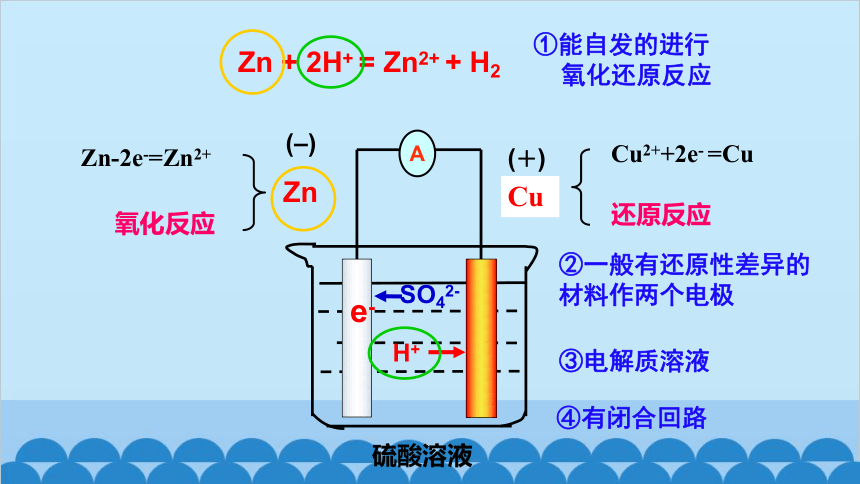
1.原电池:利用氧化还原反应原理将化学能转化为电能的装置,其反应本质是氧化还原反应。
一、原电池的工作原理
注:原电池中的化学能并非全部转化为电能,有一部分转化成热能等其他形式的能量
氧化反应
还原反应
④有闭合回路
(–)
(+)
Zn-2e-=Zn2+
Cu2++2e- =Cu
硫酸溶液
Zn
Cu
e-
SO42-
H+
A
Zn + 2H+ = Zn2+ + H2
①能自发的进行
氧化还原反应
③电解质溶液
②一般有还原性差异的材料作两个电极
Cu
2.原电池的构成条件
(1)具有两个活泼性不同的电极。
(2)合适的电解质溶液。
(3)形成闭合回路(两电极用导线相连或互相接触并插入电解质溶液中)。
(4)能自发地发生氧化还原反应。
两极一液一回路先自发
负极:较活泼的金属
正极:较不活泼的金属、 石墨等
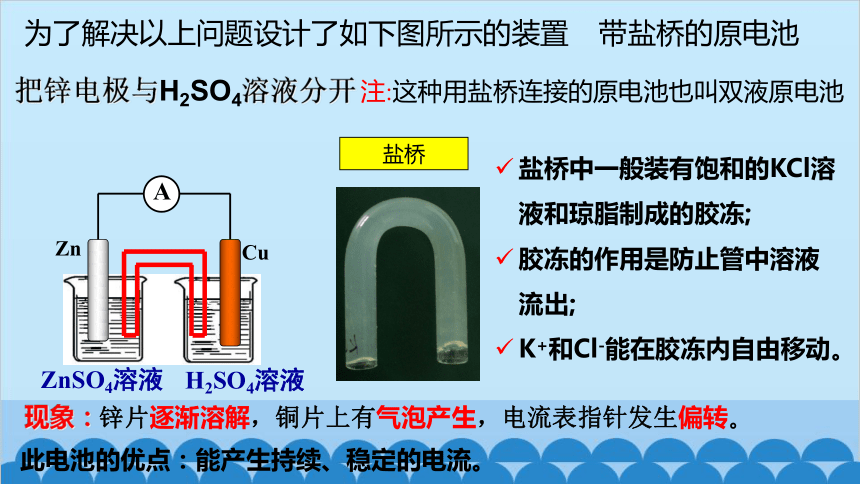
上图是我们在必修2中学习过的将锌片和铜片置于稀硫酸的原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?有没有什么改进措施?
随着时间的延续, 铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通。这种作用称为极化作用。
ZnSO4溶液
H2SO4溶液
Zn
Cu
A
盐桥中一般装有饱和的KCl溶液和琼脂制成的胶冻;
胶冻的作用是防止管中溶液流出;
K+和Cl-能在胶冻内自由移动。
盐桥
为了解决以上问题设计了如下图所示的装置
带盐桥的原电池
把锌电极与H2SO4溶液分开
注:这种用盐桥连接的原电池也叫双液原电池
现象:锌片逐渐溶解,铜片上有气泡产生,电流表指针发生偏转。
此电池的优点:能产生持续、稳定的电流。
盐桥
盐桥制法:1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。2)将KCl或NH4NO3的饱和溶液装入U形管,用棉花都住管口即可。
琼胶也称琼脂,是一种从海洋植物提取出来的胶体。
盐桥的作用:a.连接内电路,形成闭合回路;b.平衡两侧的电荷,K+→正极,Cl-→负极 ,使原电池不断产生电流。
优点:隔离氧化剂和还原剂,不同区域实现电子定向移动,产生持续、稳定的电流
加入盐桥后由两个半电池组成的原电池工作原理:
半电池中:还原性强的材料作负极,失电子被氧化
外电路中:电子由负极经导线流向正极
另半电池:电解质溶液中氧化性强的离子在正极得电子被还原
内电路中:溶液中电解质电离出的阴阳离子定向移动与两极之间通过盐桥构成闭合回路。
注:电子只能在两极和外电路中流动,不可能进入溶液中。即“电子不下水,离子不上岸”
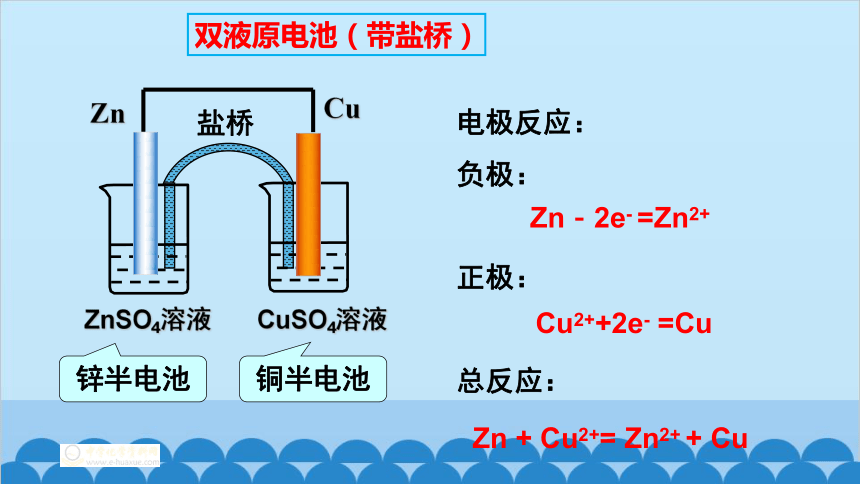
锌半电池
铜半电池
电极反应:
负极:
正极:
总反应:
Cu2++2e- =Cu
Zn-2e- =Zn2+
Zn + Cu2+= Zn2+ + Cu
ZnSO4溶液
Cu
Zn
CuSO4溶液
盐桥
双液原电池(带盐桥)
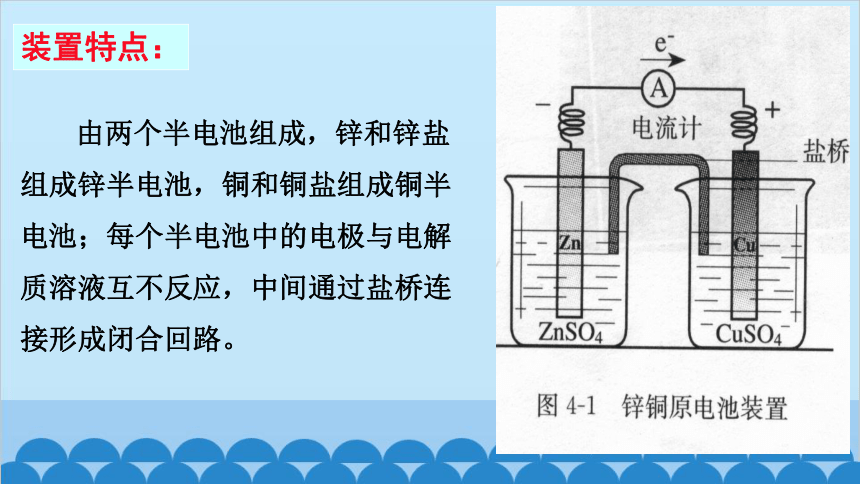
装置特点:
由两个半电池组成,锌和锌盐组成锌半电池,铜和铜盐组成铜半电池;每个半电池中的电极与电解质溶液互不反应,中间通过盐桥连接形成闭合回路。
SO42-
Zn2+
e-
e-
SO42-
Cu2+
K+
Cu
Zn
K+
Cl-
K+
Cl-
K+
Cl-
K+
Cl-
K+
Cl-
Cl-
K+
K+
Cl-
K+
K+
K+
Cl-
Cl-
K+
Cl-
Cl-
Cl-
有盐桥的原电池工作示意图
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到锌片全部溶解或CuSO4溶液中的Cu2+几乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀,可用NH4NO3代替KCl作盐桥。
在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完成的。取出盐桥,Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+变为Cu,使得SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻止电子从锌片流向铜片,造成电流中断。
改进后的原电池装置有哪些优点?
2、提高了能量转化率(化学能→电能);
3、有效避免了电极材料与电解质溶液的直接反应, 能够防止装置中化学能的自动释放(自放电),增加了原电池的使用寿命。
1、离子在盐桥中作定向移动,减少了离子的混乱,使离子移动更加有序,能够产生持续稳定的电流;
【启示】氧化剂和还原剂不直接接触也能发生反应。
答:(1)锌铜原电池工作时,电子由锌片沿导线移向铜片,阴离子(Cl-、SO42-)在电解质溶液中移向锌片,阳离子(K+、Cu2+)移向铜片。
(2)负极:Zn-2e-=Zn2+
正极:Cu2++2e-=Cu
总反应:Zn+Cu2+=Cu+Zn2+
电极:Zn—负极,Cu—正极
工作原理:负极→失电子→发生氧化反应→电子通过导线流向正极→正极→得电子→发生还原反应
电极反应:
总反应: Zn+Cu2+=Zn2++Cu
溶液中:阴离子→负极,阳离子→正极
外电路—电子导电,内电路—离子导电
4.原电池的工作原理(以Zn-Cu原电池为例)
电极 Zn电极 Cu电极
电极名称 负极 正极
得失电子 失电子 得电子
电子流向 流出 流入
反应类型 氧化反应 还原反应
电极反应式 Zn-2e-=Zn2+ Cu2++2e-=Cu
总反应式 Zn+Cu2+=Zn2++Cu
判断依据 正极 负极
电极材料
电子流向
电极反应
电极现象
离子移向 阳离子移向 阴离子移向
电极减轻
不活泼金属或非金属导体
活泼金属
电子流入
电子流出
还原反应
氧化反应
电极增重或产生气体
原电池电极(正极、负极)的判断依据
小结:
原电池原理是将氧化反应和还原反应分开进行,还原剂在负极上失去电子发生氧化反应,电子通过导线流向正极,氧化剂在正极上得到电子发生还原反应。
正极得电子数目=负极失电子数目
5.能否构成原电池的判断——四看
①看电极——两极为导体且存在活泼性差异(燃料电池的电极一般为惰性电极)
②看溶液——两极插入电解质溶液中(或接触)
③看回路——形成闭合回路或两极直接接触
④看本质——有无自发的氧化还原反应发生
6.原电池的电极法反应式的书写
1、分析电极反应:
负极 氧化产物 正极 还原产物
氧化反应,失电子
还原反应,得电子
2、注意电解质溶液环境:电极产物在电解质溶液中应稳定存在
①酸性介质中,若生成OH-,结合H+→H2O
②碱性介质中,若生成H+,结合OH-→H2O
③碱性介质中,若生成CO2,结合OH-→CO32-
④碱性介质中,若生成金属阳离子,则可能会结合OH-→沉淀M(OH)n
3、遵守三大守恒:质量守恒、电荷守恒、 转移电子守恒
4、两极反应式叠加得总反应式,总反应式减去其中一个电极反应式,可得另一个电极的反应式
5、规律:①一般来说,金属作负极的原电池
负极:
酸性或中性介质中:M—ne-=Mnn+
碱性介质中:M—ne-+nOH-=M(OH)n
正极:酸性介质中:2H++2e-=H2↑
阳离子与金属反应的介质中:NX++xe-=N
阳离子不与金属反应的介质中:O2+4e-+2H2O=4OH-
②特殊:铝镁氢氧化钠电解质,铝铜浓硝酸电解质
注:电极反应式中若有气体生成,需加“↑”;若有固体生成,一般不标“↓”
1.盐桥在原电池装置中的作用是什么 若撤去盐桥,电流表的指针如何变化?
答案:①连接两个“半电池”,形成闭合回路;②盐桥中,阳离子移向正极区电解质溶液中,阴离子移向负极区电解质溶液中,使氧化还原反应持续进行,不断产生电流。若撤去盐桥、电流表的指针会不发生偏转。
答案:原电池的电解质溶液中,阴离子向负极移动,阳离子向正极移动。可简记为:正正负负[解释:正(指阳离子)→正(指正极)、负(指阴离子)→负(指负极)]。
【思考与讨论】
2.原电池工作时,阴、阳离子在电解质溶液中的运动方向是怎样的
1.判断下列装置能构成原电池的是( )
1.判断下列那些装置可以构成原电池
H2SO4
Zn Zn
(1)
石墨
石墨
H2SO4
(2)
H2SO4
Zn 石墨
(3)
Zn Cu
H2SO4
(4)
CuSO4
Zn Cu
(5)
C2H5OH
Zn Cu
(6)
Zn Cu
ZnSO4 CuSO4
(7)
2.某原电池装置如图所示。下列有关叙述中正确的是( )
(盐桥中装有含琼胶的KCl饱和溶液)
A.Fe作正极,发生氧化反应
B.工作一段时间后,两烧杯中溶液pH均不变
C.负极反应:2H++2e-===H2↑
D.工作一段时间后,NaCl溶液中c(Cl-)增大
解析:该装置是原电池。A项,在该原电池中Fe作负极,发生氧化反应;B项,工作一段时间后,左边的烧杯中会含有大量的Fe2+,溶液的pH减小,右边烧杯中的H+不断放电产生氢气,因此烧杯中溶液pH会逐渐增大;C项,负极反应是Fe-2e-===Fe2+;D项,工作一段时间后,左侧烧杯中由于Fe2+不断进入溶液,根据溶液呈电中性原则,盐桥中的Cl-会进入该烧杯溶液中,则该烧杯溶液中c(Cl-)增大。
D
3.下列装置中,哪些能构成原电池?其他不能构成原电池的原因是什么?
解析:装置D能构成原电池;装置A不能构成原电池,原因是酒精为非电解质;装置B不能构成原电池,原因是没有形成闭合回路;装置C不能构成原电池,原因是两个金属电极的活泼性相同。
D
4.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是( )
A B C D
解析:B、C选项均无化学反应;D选项Zn与稀硫酸反应,但装置不能形成闭合回路,只有A符合要求。
A
5.下列有关电化学知识的描述正确的是( )
A.行人踩踏发电瓷砖(原理是利用行人踩踏地板产生的振动来发电)是将化学能转化为电能
B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥可以装有含琼胶的KCl饱和溶液
C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极、铜作正极
D.理论上,任何能自发进行的且能放出能量的氧化还原反应都可设计成原电池
解析:行人踩踏地板产生的振动不属于化学能, A错误;在原电池的正极端氯离子和银离子反应,所以不可以用KCl饱和溶液制得的琼脂, B错误; Fe在浓硝酸中发生钝化,Cu能与浓硝酸反应,可组成原电池,但铁作正极、铜作负极,C错误;原电池是将化学能转化为电能,需要自发进行的释放能量的氧化还原反应, D正确。
D
第四章 化学反应与电能
第一节 原电池
第1课时 原电池的工作原理
汽车等机动车往往需要配备电池,人造卫星、宇宙飞船等必须携带电池,人们在日常生活中也经常要使用电池……这些足以说明电池的重要作用。
现在,为满足人们生产和生活水平不断提高的需要,性能优异的新型电池相继出现,如锌银电池、锂电池、燃料电池等。那么,电池究竟是一种什么样的装置?他们在工作时,装置中发生了什么变化?
1.原电池:利用氧化还原反应原理将化学能转化为电能的装置,其反应本质是氧化还原反应。
一、原电池的工作原理
注:原电池中的化学能并非全部转化为电能,有一部分转化成热能等其他形式的能量
氧化反应
还原反应
④有闭合回路
(–)
(+)
Zn-2e-=Zn2+
Cu2++2e- =Cu
硫酸溶液
Zn
Cu
e-
SO42-
H+
A
Zn + 2H+ = Zn2+ + H2
①能自发的进行
氧化还原反应
③电解质溶液
②一般有还原性差异的材料作两个电极
Cu
2.原电池的构成条件
(1)具有两个活泼性不同的电极。
(2)合适的电解质溶液。
(3)形成闭合回路(两电极用导线相连或互相接触并插入电解质溶液中)。
(4)能自发地发生氧化还原反应。
两极一液一回路先自发
负极:较活泼的金属
正极:较不活泼的金属、 石墨等
上图是我们在必修2中学习过的将锌片和铜片置于稀硫酸的原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?有没有什么改进措施?
随着时间的延续, 铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通。这种作用称为极化作用。
ZnSO4溶液
H2SO4溶液
Zn
Cu
A
盐桥中一般装有饱和的KCl溶液和琼脂制成的胶冻;
胶冻的作用是防止管中溶液流出;
K+和Cl-能在胶冻内自由移动。
盐桥
为了解决以上问题设计了如下图所示的装置
带盐桥的原电池
把锌电极与H2SO4溶液分开
注:这种用盐桥连接的原电池也叫双液原电池
现象:锌片逐渐溶解,铜片上有气泡产生,电流表指针发生偏转。
此电池的优点:能产生持续、稳定的电流。
盐桥
盐桥制法:1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。2)将KCl或NH4NO3的饱和溶液装入U形管,用棉花都住管口即可。
琼胶也称琼脂,是一种从海洋植物提取出来的胶体。
盐桥的作用:a.连接内电路,形成闭合回路;b.平衡两侧的电荷,K+→正极,Cl-→负极 ,使原电池不断产生电流。
优点:隔离氧化剂和还原剂,不同区域实现电子定向移动,产生持续、稳定的电流
加入盐桥后由两个半电池组成的原电池工作原理:
半电池中:还原性强的材料作负极,失电子被氧化
外电路中:电子由负极经导线流向正极
另半电池:电解质溶液中氧化性强的离子在正极得电子被还原
内电路中:溶液中电解质电离出的阴阳离子定向移动与两极之间通过盐桥构成闭合回路。
注:电子只能在两极和外电路中流动,不可能进入溶液中。即“电子不下水,离子不上岸”
锌半电池
铜半电池
电极反应:
负极:
正极:
总反应:
Cu2++2e- =Cu
Zn-2e- =Zn2+
Zn + Cu2+= Zn2+ + Cu
ZnSO4溶液
Cu
Zn
CuSO4溶液
盐桥
双液原电池(带盐桥)
装置特点:
由两个半电池组成,锌和锌盐组成锌半电池,铜和铜盐组成铜半电池;每个半电池中的电极与电解质溶液互不反应,中间通过盐桥连接形成闭合回路。
SO42-
Zn2+
e-
e-
SO42-
Cu2+
K+
Cu
Zn
K+
Cl-
K+
Cl-
K+
Cl-
K+
Cl-
K+
Cl-
Cl-
K+
K+
Cl-
K+
K+
K+
Cl-
Cl-
K+
Cl-
Cl-
Cl-
有盐桥的原电池工作示意图
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到锌片全部溶解或CuSO4溶液中的Cu2+几乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀,可用NH4NO3代替KCl作盐桥。
在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完成的。取出盐桥,Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+变为Cu,使得SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻止电子从锌片流向铜片,造成电流中断。
改进后的原电池装置有哪些优点?
2、提高了能量转化率(化学能→电能);
3、有效避免了电极材料与电解质溶液的直接反应, 能够防止装置中化学能的自动释放(自放电),增加了原电池的使用寿命。
1、离子在盐桥中作定向移动,减少了离子的混乱,使离子移动更加有序,能够产生持续稳定的电流;
【启示】氧化剂和还原剂不直接接触也能发生反应。
答:(1)锌铜原电池工作时,电子由锌片沿导线移向铜片,阴离子(Cl-、SO42-)在电解质溶液中移向锌片,阳离子(K+、Cu2+)移向铜片。
(2)负极:Zn-2e-=Zn2+
正极:Cu2++2e-=Cu
总反应:Zn+Cu2+=Cu+Zn2+
电极:Zn—负极,Cu—正极
工作原理:负极→失电子→发生氧化反应→电子通过导线流向正极→正极→得电子→发生还原反应
电极反应:
总反应: Zn+Cu2+=Zn2++Cu
溶液中:阴离子→负极,阳离子→正极
外电路—电子导电,内电路—离子导电
4.原电池的工作原理(以Zn-Cu原电池为例)
电极 Zn电极 Cu电极
电极名称 负极 正极
得失电子 失电子 得电子
电子流向 流出 流入
反应类型 氧化反应 还原反应
电极反应式 Zn-2e-=Zn2+ Cu2++2e-=Cu
总反应式 Zn+Cu2+=Zn2++Cu
判断依据 正极 负极
电极材料
电子流向
电极反应
电极现象
离子移向 阳离子移向 阴离子移向
电极减轻
不活泼金属或非金属导体
活泼金属
电子流入
电子流出
还原反应
氧化反应
电极增重或产生气体
原电池电极(正极、负极)的判断依据
小结:
原电池原理是将氧化反应和还原反应分开进行,还原剂在负极上失去电子发生氧化反应,电子通过导线流向正极,氧化剂在正极上得到电子发生还原反应。
正极得电子数目=负极失电子数目
5.能否构成原电池的判断——四看
①看电极——两极为导体且存在活泼性差异(燃料电池的电极一般为惰性电极)
②看溶液——两极插入电解质溶液中(或接触)
③看回路——形成闭合回路或两极直接接触
④看本质——有无自发的氧化还原反应发生
6.原电池的电极法反应式的书写
1、分析电极反应:
负极 氧化产物 正极 还原产物
氧化反应,失电子
还原反应,得电子
2、注意电解质溶液环境:电极产物在电解质溶液中应稳定存在
①酸性介质中,若生成OH-,结合H+→H2O
②碱性介质中,若生成H+,结合OH-→H2O
③碱性介质中,若生成CO2,结合OH-→CO32-
④碱性介质中,若生成金属阳离子,则可能会结合OH-→沉淀M(OH)n
3、遵守三大守恒:质量守恒、电荷守恒、 转移电子守恒
4、两极反应式叠加得总反应式,总反应式减去其中一个电极反应式,可得另一个电极的反应式
5、规律:①一般来说,金属作负极的原电池
负极:
酸性或中性介质中:M—ne-=Mnn+
碱性介质中:M—ne-+nOH-=M(OH)n
正极:酸性介质中:2H++2e-=H2↑
阳离子与金属反应的介质中:NX++xe-=N
阳离子不与金属反应的介质中:O2+4e-+2H2O=4OH-
②特殊:铝镁氢氧化钠电解质,铝铜浓硝酸电解质
注:电极反应式中若有气体生成,需加“↑”;若有固体生成,一般不标“↓”
1.盐桥在原电池装置中的作用是什么 若撤去盐桥,电流表的指针如何变化?
答案:①连接两个“半电池”,形成闭合回路;②盐桥中,阳离子移向正极区电解质溶液中,阴离子移向负极区电解质溶液中,使氧化还原反应持续进行,不断产生电流。若撤去盐桥、电流表的指针会不发生偏转。
答案:原电池的电解质溶液中,阴离子向负极移动,阳离子向正极移动。可简记为:正正负负[解释:正(指阳离子)→正(指正极)、负(指阴离子)→负(指负极)]。
【思考与讨论】
2.原电池工作时,阴、阳离子在电解质溶液中的运动方向是怎样的
1.判断下列装置能构成原电池的是( )
1.判断下列那些装置可以构成原电池
H2SO4
Zn Zn
(1)
石墨
石墨
H2SO4
(2)
H2SO4
Zn 石墨
(3)
Zn Cu
H2SO4
(4)
CuSO4
Zn Cu
(5)
C2H5OH
Zn Cu
(6)
Zn Cu
ZnSO4 CuSO4
(7)
2.某原电池装置如图所示。下列有关叙述中正确的是( )
(盐桥中装有含琼胶的KCl饱和溶液)
A.Fe作正极,发生氧化反应
B.工作一段时间后,两烧杯中溶液pH均不变
C.负极反应:2H++2e-===H2↑
D.工作一段时间后,NaCl溶液中c(Cl-)增大
解析:该装置是原电池。A项,在该原电池中Fe作负极,发生氧化反应;B项,工作一段时间后,左边的烧杯中会含有大量的Fe2+,溶液的pH减小,右边烧杯中的H+不断放电产生氢气,因此烧杯中溶液pH会逐渐增大;C项,负极反应是Fe-2e-===Fe2+;D项,工作一段时间后,左侧烧杯中由于Fe2+不断进入溶液,根据溶液呈电中性原则,盐桥中的Cl-会进入该烧杯溶液中,则该烧杯溶液中c(Cl-)增大。
D
3.下列装置中,哪些能构成原电池?其他不能构成原电池的原因是什么?
解析:装置D能构成原电池;装置A不能构成原电池,原因是酒精为非电解质;装置B不能构成原电池,原因是没有形成闭合回路;装置C不能构成原电池,原因是两个金属电极的活泼性相同。
D
4.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是( )
A B C D
解析:B、C选项均无化学反应;D选项Zn与稀硫酸反应,但装置不能形成闭合回路,只有A符合要求。
A
5.下列有关电化学知识的描述正确的是( )
A.行人踩踏发电瓷砖(原理是利用行人踩踏地板产生的振动来发电)是将化学能转化为电能
B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥可以装有含琼胶的KCl饱和溶液
C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极、铜作正极
D.理论上,任何能自发进行的且能放出能量的氧化还原反应都可设计成原电池
解析:行人踩踏地板产生的振动不属于化学能, A错误;在原电池的正极端氯离子和银离子反应,所以不可以用KCl饱和溶液制得的琼脂, B错误; Fe在浓硝酸中发生钝化,Cu能与浓硝酸反应,可组成原电池,但铁作正极、铜作负极,C错误;原电池是将化学能转化为电能,需要自发进行的释放能量的氧化还原反应, D正确。
D
