【核心素养目标】人教版(2019)高二化学选择性必修一 2.1 化学反应速率(第3课时 化学反应历程 活化能)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高二化学选择性必修一 2.1 化学反应速率(第3课时 化学反应历程 活化能) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-06 10:02:20 | ||
图片预览







文档简介
(共31张PPT)
第一节 化学反应速率
第3课时 化学反应历程 活化能
人教版选择性必修1
学习目标
1.了解基元反应及反应历程。
2.了解有效碰撞理论,并能用有效碰撞原理解释条件对化学反应速率的影响。
3.知道活化能的含义及其对化学反应速率的影响。
4.了解催化剂在生产、生活和科学研究领域中的重大作用。
学习目标
1.通过理解微观分子对反应速率的影响,培养学生“宏观辨识与微观探析”的学科素养。
2.通过有效碰撞理论,理解影响化学反应速率的因素,培养学生“证据推理与模型认知”的学科素养。
素养目标
情境引入
通过生活经验和之前所学知识,我们知道,不同化学反应速率不同,浓度、温度、压强、催化剂也会影响化学反应速率。这些从宏观上都已得到证实,从微观上我们怎么理解这些反应速率不同?
活化能和简单碰撞理论
教学过程
一、基元反应和反应历程
1.基元反应
大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。每一步反应都称为基元反应。
第一步: 2HI → 2I (自由基)+ H2
第二步: 2I → I2
如:总反应:2HI =H2 + I2 实际上是经过下列两步反应完成的
这其中的每一步反应都称为基元反应。这两个先后进行的基元反应反映了2HI=H2+I2的反应历程。反应历程又称反应机理。
自由基:带有单电子的原子或原子团。自由基的反应活性很强。
教学过程
2.反应历程(反应机理)
基元反应构成的反应序列称为反应历程,基元反应的总和称为总反应。
基元反应发生的先决条件是反应物的分子必须发生碰撞
注意
1.反应不同,反应历程也不相同
2.同一反应,在不同条件下,反应历程也可能不同
3.反应历程的差别造成了化学反应速率的不同
4.对于由多个基元反应组成的化学反应,其反应的快慢由最慢的一步基元反应决定
教学过程
二、有效碰撞理论
以气体为例,任何气体中分子间的碰撞次数都是非常巨大的。通常情况下,当气体的浓度为1 mol/L时,在每立方厘米、每秒内反应物分子间的碰撞可达到1028次。
如果反应物分子间的任何一次碰撞都能发生反应的话,任何气体的反应均可以瞬间完成。但实际并非如此。这说明并不是反应物分子的每一次碰撞都能发生反应。
教学过程
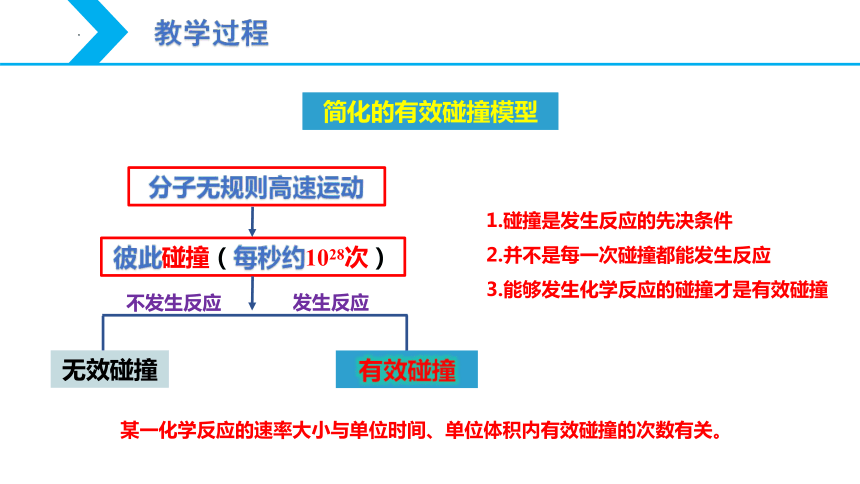
分子无规则高速运动
彼此碰撞(每秒约1028次)
有效碰撞
无效碰撞
发生反应
不发生反应
1.碰撞是发生反应的先决条件
2.并不是每一次碰撞都能发生反应
3.能够发生化学反应的碰撞才是有效碰撞
某一化学反应的速率大小与单位时间、单位体积内有效碰撞的次数有关。
简化的有效碰撞模型
教学过程
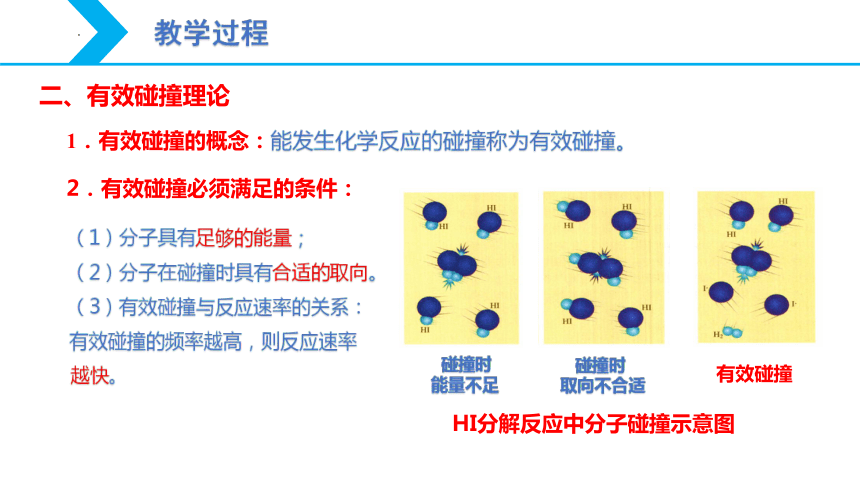
1.有效碰撞的概念:能发生化学反应的碰撞称为有效碰撞。
二、有效碰撞理论
碰撞时
能量不足
碰撞时
取向不合适
有效碰撞
HI分解反应中分子碰撞示意图
(1)分子具有足够的能量;
(2)分子在碰撞时具有合适的取向。
(3)有效碰撞与反应速率的关系:有效碰撞的频率越高,则反应速率越快。
2.有效碰撞必须满足的条件:
教学过程
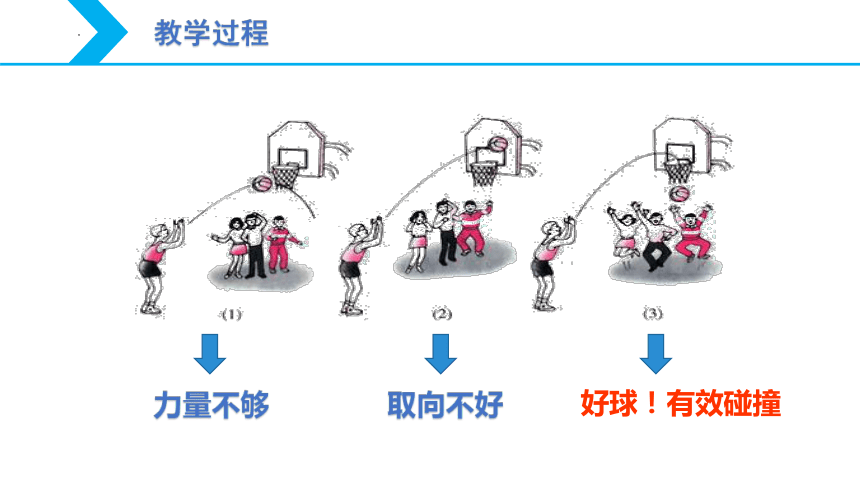
力量不够
取向不好
好球!有效碰撞
教学过程
三、活化分子 活化能
1. 活化分子:具有足够能量、能够发生有效碰撞的分子。
注意
活化分子的碰撞不一定是有效碰撞,还与碰撞的角度有关。(碰撞时的取向合适不合适)
反应速率与活化分子的百分率(活%)成正比
教学过程
基元反应发生经历的过程
教学过程
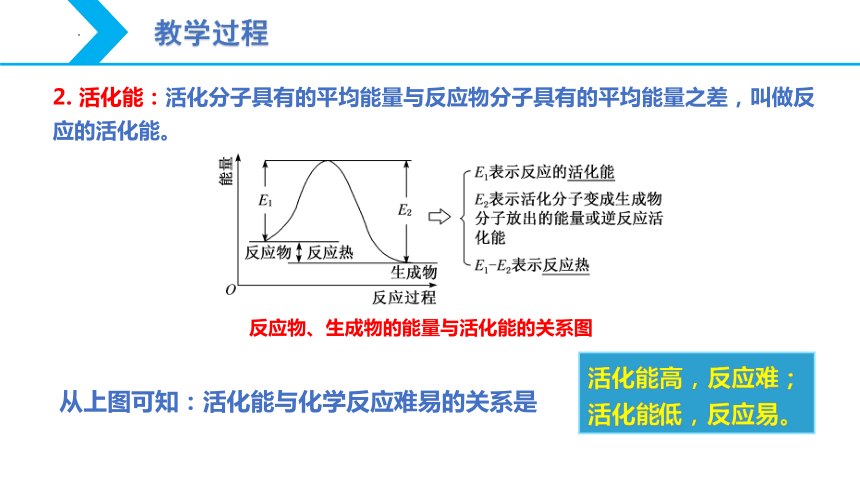
2. 活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。
反应物、生成物的能量与活化能的关系图
从上图可知:活化能与化学反应难易的关系是
活化能高,反应难;
活化能低,反应易。
教学过程
四、有效碰撞理论对影响化学反应速率因素的解释
反应物本身的性质
活化能的大小
单位体积内活化分子的多少
单位时间内有效碰撞次数的多少
化学反应速率的快慢
决定
决定
决定
决定
结合碰撞理论,探讨外因的改变影响化学反应速率的原因:
教学过程
1、浓度对反应速率的影响
反应物浓度增大,即单位体积内反应物分子总数增大
单位时间有效碰撞次数增多
反应速率加快
分子总数:20
活化分子数:6
活化分子百分数:30%
分子总数:10
活化分子数:3
活化分子百分数:30%
单位体积内活化分子数增加
活化分子
百分比不变
教学过程
2、温度对反应速率的影响
升温
升高温度
单位时间有效碰撞次数增多
反应速率加快
单位体积内活化分子数和活化分子百分数增加
分子运动加快,碰撞频率增加
教学过程
分子总数:10
活化分子数:3
活化分子百分数:30%
分子总数:10
活化分子数:3
活化分子百分数:30%
3、压强对反应速率的影响
活化分子
百分比不变
增大压强
单位时间有效碰撞次数增多
反应速率加快
单位体积内活化分子数增加
增大浓度
教学过程
4、催化剂对反应速率的影响
(1)催化剂参与化学反应,改变反应途径,但反应前后质量和化学性质不变的物质。
(2)催化剂作用:可以降低化学反应所需的活化能,也就等于提高了活化分子的百分数,从而提高了有效碰撞的频率,反应速率大幅提高。
催化剂
单位时间有效碰撞次数增多
反应速率加快
活化分子百分数增加
降低反应所需的活化能
【小结】
影响 外因 单位体积内 活化分子百分数 有效碰撞次数 化学反应速率
分子总数 活化分子数 增大反应物浓度
增大压强
升高温度
正催化剂
增加
增加
增加
加快
增加
增加
增加
加快
不变
增加
增加
加快
不变
增加
增加
加快
不变
不变
增加
增加
教学过程
典例1.
课堂练习
已知反应2NO(g)+2H2(g) N2(g)+2H2O(g) ΔH=-752 kJ·mol-1的反应机理如下:
①2NO(g) N2O2(g) (快)
②N2O2(g)+H2(g) N2O(g)+H2O(g) (慢)
③N2O(g)+H2(g) N2(g)+H2O(g) (快)
下列有关说法错误的是( )
A.①的逆反应速率大于②的正反应速率
B.②中N2O2与H2的碰撞仅部分有效
C.N2O2和N2O是该反应的催化剂
D.总反应中逆反应的活化能比正反应的活化能大
【答案】C
【解析】①为快反应,说明正反应的活化能和逆反应的活化能都较小,反应更容易发生;②为慢反应,说明正反应的活化能和逆反应的活化能都较大,②中正反应的活化能大于①中逆反应的活化能,因此①的逆反应速率大于②的正反应速率,A项正确;②为慢反应,反应慢说明反应的活化能大,物质微粒发生碰撞时,许多碰撞都不能发生化学反应,因此碰撞仅部分有效,B项正确;反应过程中N2O2和N2O是中间产物,不是催化剂,C项错误;总反应为放热反应,则总反应中逆反应的活化能比正反应的活化能大,D项正确。
课堂练习
典例2.
课堂练习
我们把能够发生化学反应的碰撞叫做有效碰撞;发生有效碰撞的分子必须具有足够的能量,这种分子叫做活化分子;活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。下列说法不正确的是( )
A.图甲中曲线Ⅱ可以表示催化剂降低了反应的活化能
B.图乙中HI分子发生了有效碰撞
C.盐酸和氢氧化钠溶液的反应活化能接近于零
D.增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加
【答案】B
【解析】催化剂可降低反应的活化能,A正确;能够发生化学反应的碰撞才是有效碰撞,由图乙可知碰撞后没有生成新物质,即没有发生化学反应,不是有效碰撞,B错误;盐酸和氢氧化钠溶液反应的实质是氢离子与氢氧根离子反应生成水,在溶液中氢离子与氢氧根离子已经处于活跃状态,因此盐酸和氢氧化钠溶液反应的活化能接近于零,C正确;增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加,D正确。
课堂练习
典例2.
课堂练习
我们把能够发生化学反应的碰撞叫做有效碰撞;发生有效碰撞的分子必须具有足够的能量,这种分子叫做活化分子;活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。下列说法不正确的是( )
A.图甲中曲线Ⅱ可以表示催化剂降低了反应的活化能
B.图乙中HI分子发生了有效碰撞
C.盐酸和氢氧化钠溶液的反应活化能接近于零
D.增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加
课堂练习
N2分子在催化剂的作用下发生的一系列转化如图所示。下列叙述正确的是( )
A.在反应过程中作催化剂
B.催化剂a表面发生了分解反应和化合反应
C.催化剂a、b增大了该历程中的最大能垒(活化能)
D.催化剂b表面发生的反应为4NH3+5O2 4NO+6H2O
【答案】D
【解析】由题图可知,在催化剂a表面氮气和氢气发生化合反应生成氨气,氨气做生成物,在催化剂b表面氨气和氧气反应生成一氧化氮和水,氨气做反应物,则氨气在反应过程中做中间产物,A错误;在催化剂a表面氮气和氢气发生化合反应生成氨气,没有发生分解反应,B错误;催化剂a、b,降低了反应的活化能,从而提高反应速率,C错误;在催化剂b表面氨气和氧气反应生成一氧化氮和水,反应的化学方程式为4NH3+5O2 4NO+6H2O,D正确。
典例3.
课堂练习
某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程如图所示(图中只画出了HAP的部分结构,用18O标记羟基磷灰石中的羟基氧原子)。下列说法正确的是( )
A.反应物的键能之和大于生成物的键能之和
B.HAP改变了该反应的历程和焓变,加快了反应速率
C.经过该催化氧化过程后18O仍然在HAP中
D.HAP降低了反应的活化能,提高活化分子百分数
【答案】D
【解析】根据甲醛的燃烧反应可知甲醛与氧气生成CO2和H2O的反应为放热反应,则反应物的键能之和小于生成物的键能之和,A项错误;催化剂能够改变反应的历程,但是不能改变反应的焓变,B项错误;从题图可知,反应结束后18O在H2O中,C项错误。
典例4.
“接触法制硫酸”的主要反应是2SO2+O2 2SO3,在催化剂表面的反应历程如下:
下列说法正确的是( )
A.使用催化剂只能加快正反应速率
B.反应②的活化能比反应①大
C.该反应的催化剂是V2O4
D.过程中既有V—O的断裂,又有V—O的形成
【答案】D
【解析】催化剂能同等幅度地改变正、逆反应速率,加快正反应速率的同时也加快逆反应速率,故A错误;一般情况下,反应的活化能越小,反应速率越快,故反应②的活化能比反应①的小,故B错误;催化剂是反应前后质量和化学性质都没有发生变化的物质,从反应历程图中可知,该反应的催化剂为V2O5,故C错误;历程中反应①有V—O的断裂,反应②有V—O的形成,故D正确。
典例5.
课堂练习
Shyam Kattle等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,吸附在Pt/SiO2催化剂表面上的物种用“·”标注,Ts表示过渡态。下列有关说法错误的是( )
A.物质被吸附在催化剂表面形成过渡态的过程是吸热的
B.形成过渡态Ts1的活化能为1.05 eV
C.前三步总反应的ΔH<0
D.反应历程中能量变化最大的反应方程式为·HOCO+7/2H2(g)=·CO+·OH+7/2H2(g)
典例6.
课堂练习
【答案】D
【解析】A项,从图示可看出形成过渡态物质的能量都是升高的,正确;B项,从图中能量差可知,过渡态Ts1的能量为0.15 eV,则该步的活化能为[0.15-(-0.9)] eV=1.05 eV,正确;D项,前三步中能量变化最大的是第二步,该步骤分两步形成稳定的微粒,反应方程式为·HOCO+(7/2)H2(g)=·CO+·OH+·H+3H2(g),错误。
课堂练习
课堂小结
【思维建模】活化分子、有效碰撞与反应速率的关系
课后小任务
课后分小组,通过网络、书籍等渠道进一步了解飞秒化学及其应用。
感 谢 倾 听
第一节 化学反应速率
第3课时 化学反应历程 活化能
人教版选择性必修1
学习目标
1.了解基元反应及反应历程。
2.了解有效碰撞理论,并能用有效碰撞原理解释条件对化学反应速率的影响。
3.知道活化能的含义及其对化学反应速率的影响。
4.了解催化剂在生产、生活和科学研究领域中的重大作用。
学习目标
1.通过理解微观分子对反应速率的影响,培养学生“宏观辨识与微观探析”的学科素养。
2.通过有效碰撞理论,理解影响化学反应速率的因素,培养学生“证据推理与模型认知”的学科素养。
素养目标
情境引入
通过生活经验和之前所学知识,我们知道,不同化学反应速率不同,浓度、温度、压强、催化剂也会影响化学反应速率。这些从宏观上都已得到证实,从微观上我们怎么理解这些反应速率不同?
活化能和简单碰撞理论
教学过程
一、基元反应和反应历程
1.基元反应
大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。每一步反应都称为基元反应。
第一步: 2HI → 2I (自由基)+ H2
第二步: 2I → I2
如:总反应:2HI =H2 + I2 实际上是经过下列两步反应完成的
这其中的每一步反应都称为基元反应。这两个先后进行的基元反应反映了2HI=H2+I2的反应历程。反应历程又称反应机理。
自由基:带有单电子的原子或原子团。自由基的反应活性很强。
教学过程
2.反应历程(反应机理)
基元反应构成的反应序列称为反应历程,基元反应的总和称为总反应。
基元反应发生的先决条件是反应物的分子必须发生碰撞
注意
1.反应不同,反应历程也不相同
2.同一反应,在不同条件下,反应历程也可能不同
3.反应历程的差别造成了化学反应速率的不同
4.对于由多个基元反应组成的化学反应,其反应的快慢由最慢的一步基元反应决定
教学过程
二、有效碰撞理论
以气体为例,任何气体中分子间的碰撞次数都是非常巨大的。通常情况下,当气体的浓度为1 mol/L时,在每立方厘米、每秒内反应物分子间的碰撞可达到1028次。
如果反应物分子间的任何一次碰撞都能发生反应的话,任何气体的反应均可以瞬间完成。但实际并非如此。这说明并不是反应物分子的每一次碰撞都能发生反应。
教学过程
分子无规则高速运动
彼此碰撞(每秒约1028次)
有效碰撞
无效碰撞
发生反应
不发生反应
1.碰撞是发生反应的先决条件
2.并不是每一次碰撞都能发生反应
3.能够发生化学反应的碰撞才是有效碰撞
某一化学反应的速率大小与单位时间、单位体积内有效碰撞的次数有关。
简化的有效碰撞模型
教学过程
1.有效碰撞的概念:能发生化学反应的碰撞称为有效碰撞。
二、有效碰撞理论
碰撞时
能量不足
碰撞时
取向不合适
有效碰撞
HI分解反应中分子碰撞示意图
(1)分子具有足够的能量;
(2)分子在碰撞时具有合适的取向。
(3)有效碰撞与反应速率的关系:有效碰撞的频率越高,则反应速率越快。
2.有效碰撞必须满足的条件:
教学过程
力量不够
取向不好
好球!有效碰撞
教学过程
三、活化分子 活化能
1. 活化分子:具有足够能量、能够发生有效碰撞的分子。
注意
活化分子的碰撞不一定是有效碰撞,还与碰撞的角度有关。(碰撞时的取向合适不合适)
反应速率与活化分子的百分率(活%)成正比
教学过程
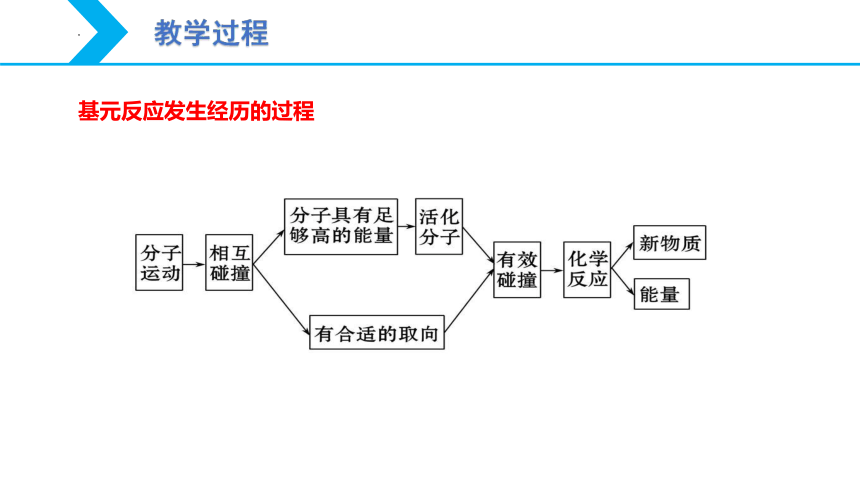
基元反应发生经历的过程
教学过程
2. 活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。
反应物、生成物的能量与活化能的关系图
从上图可知:活化能与化学反应难易的关系是
活化能高,反应难;
活化能低,反应易。
教学过程
四、有效碰撞理论对影响化学反应速率因素的解释
反应物本身的性质
活化能的大小
单位体积内活化分子的多少
单位时间内有效碰撞次数的多少
化学反应速率的快慢
决定
决定
决定
决定
结合碰撞理论,探讨外因的改变影响化学反应速率的原因:
教学过程
1、浓度对反应速率的影响
反应物浓度增大,即单位体积内反应物分子总数增大
单位时间有效碰撞次数增多
反应速率加快
分子总数:20
活化分子数:6
活化分子百分数:30%
分子总数:10
活化分子数:3
活化分子百分数:30%
单位体积内活化分子数增加
活化分子
百分比不变
教学过程
2、温度对反应速率的影响
升温
升高温度
单位时间有效碰撞次数增多
反应速率加快
单位体积内活化分子数和活化分子百分数增加
分子运动加快,碰撞频率增加
教学过程
分子总数:10
活化分子数:3
活化分子百分数:30%
分子总数:10
活化分子数:3
活化分子百分数:30%
3、压强对反应速率的影响
活化分子
百分比不变
增大压强
单位时间有效碰撞次数增多
反应速率加快
单位体积内活化分子数增加
增大浓度
教学过程
4、催化剂对反应速率的影响
(1)催化剂参与化学反应,改变反应途径,但反应前后质量和化学性质不变的物质。
(2)催化剂作用:可以降低化学反应所需的活化能,也就等于提高了活化分子的百分数,从而提高了有效碰撞的频率,反应速率大幅提高。
催化剂
单位时间有效碰撞次数增多
反应速率加快
活化分子百分数增加
降低反应所需的活化能
【小结】
影响 外因 单位体积内 活化分子百分数 有效碰撞次数 化学反应速率
分子总数 活化分子数 增大反应物浓度
增大压强
升高温度
正催化剂
增加
增加
增加
加快
增加
增加
增加
加快
不变
增加
增加
加快
不变
增加
增加
加快
不变
不变
增加
增加
教学过程
典例1.
课堂练习
已知反应2NO(g)+2H2(g) N2(g)+2H2O(g) ΔH=-752 kJ·mol-1的反应机理如下:
①2NO(g) N2O2(g) (快)
②N2O2(g)+H2(g) N2O(g)+H2O(g) (慢)
③N2O(g)+H2(g) N2(g)+H2O(g) (快)
下列有关说法错误的是( )
A.①的逆反应速率大于②的正反应速率
B.②中N2O2与H2的碰撞仅部分有效
C.N2O2和N2O是该反应的催化剂
D.总反应中逆反应的活化能比正反应的活化能大
【答案】C
【解析】①为快反应,说明正反应的活化能和逆反应的活化能都较小,反应更容易发生;②为慢反应,说明正反应的活化能和逆反应的活化能都较大,②中正反应的活化能大于①中逆反应的活化能,因此①的逆反应速率大于②的正反应速率,A项正确;②为慢反应,反应慢说明反应的活化能大,物质微粒发生碰撞时,许多碰撞都不能发生化学反应,因此碰撞仅部分有效,B项正确;反应过程中N2O2和N2O是中间产物,不是催化剂,C项错误;总反应为放热反应,则总反应中逆反应的活化能比正反应的活化能大,D项正确。
课堂练习
典例2.
课堂练习
我们把能够发生化学反应的碰撞叫做有效碰撞;发生有效碰撞的分子必须具有足够的能量,这种分子叫做活化分子;活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。下列说法不正确的是( )
A.图甲中曲线Ⅱ可以表示催化剂降低了反应的活化能
B.图乙中HI分子发生了有效碰撞
C.盐酸和氢氧化钠溶液的反应活化能接近于零
D.增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加
【答案】B
【解析】催化剂可降低反应的活化能,A正确;能够发生化学反应的碰撞才是有效碰撞,由图乙可知碰撞后没有生成新物质,即没有发生化学反应,不是有效碰撞,B错误;盐酸和氢氧化钠溶液反应的实质是氢离子与氢氧根离子反应生成水,在溶液中氢离子与氢氧根离子已经处于活跃状态,因此盐酸和氢氧化钠溶液反应的活化能接近于零,C正确;增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加,D正确。
课堂练习
典例2.
课堂练习
我们把能够发生化学反应的碰撞叫做有效碰撞;发生有效碰撞的分子必须具有足够的能量,这种分子叫做活化分子;活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。下列说法不正确的是( )
A.图甲中曲线Ⅱ可以表示催化剂降低了反应的活化能
B.图乙中HI分子发生了有效碰撞
C.盐酸和氢氧化钠溶液的反应活化能接近于零
D.增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加
课堂练习
N2分子在催化剂的作用下发生的一系列转化如图所示。下列叙述正确的是( )
A.在反应过程中作催化剂
B.催化剂a表面发生了分解反应和化合反应
C.催化剂a、b增大了该历程中的最大能垒(活化能)
D.催化剂b表面发生的反应为4NH3+5O2 4NO+6H2O
【答案】D
【解析】由题图可知,在催化剂a表面氮气和氢气发生化合反应生成氨气,氨气做生成物,在催化剂b表面氨气和氧气反应生成一氧化氮和水,氨气做反应物,则氨气在反应过程中做中间产物,A错误;在催化剂a表面氮气和氢气发生化合反应生成氨气,没有发生分解反应,B错误;催化剂a、b,降低了反应的活化能,从而提高反应速率,C错误;在催化剂b表面氨气和氧气反应生成一氧化氮和水,反应的化学方程式为4NH3+5O2 4NO+6H2O,D正确。
典例3.
课堂练习
某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程如图所示(图中只画出了HAP的部分结构,用18O标记羟基磷灰石中的羟基氧原子)。下列说法正确的是( )
A.反应物的键能之和大于生成物的键能之和
B.HAP改变了该反应的历程和焓变,加快了反应速率
C.经过该催化氧化过程后18O仍然在HAP中
D.HAP降低了反应的活化能,提高活化分子百分数
【答案】D
【解析】根据甲醛的燃烧反应可知甲醛与氧气生成CO2和H2O的反应为放热反应,则反应物的键能之和小于生成物的键能之和,A项错误;催化剂能够改变反应的历程,但是不能改变反应的焓变,B项错误;从题图可知,反应结束后18O在H2O中,C项错误。
典例4.
“接触法制硫酸”的主要反应是2SO2+O2 2SO3,在催化剂表面的反应历程如下:
下列说法正确的是( )
A.使用催化剂只能加快正反应速率
B.反应②的活化能比反应①大
C.该反应的催化剂是V2O4
D.过程中既有V—O的断裂,又有V—O的形成
【答案】D
【解析】催化剂能同等幅度地改变正、逆反应速率,加快正反应速率的同时也加快逆反应速率,故A错误;一般情况下,反应的活化能越小,反应速率越快,故反应②的活化能比反应①的小,故B错误;催化剂是反应前后质量和化学性质都没有发生变化的物质,从反应历程图中可知,该反应的催化剂为V2O5,故C错误;历程中反应①有V—O的断裂,反应②有V—O的形成,故D正确。
典例5.
课堂练习
Shyam Kattle等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,吸附在Pt/SiO2催化剂表面上的物种用“·”标注,Ts表示过渡态。下列有关说法错误的是( )
A.物质被吸附在催化剂表面形成过渡态的过程是吸热的
B.形成过渡态Ts1的活化能为1.05 eV
C.前三步总反应的ΔH<0
D.反应历程中能量变化最大的反应方程式为·HOCO+7/2H2(g)=·CO+·OH+7/2H2(g)
典例6.
课堂练习
【答案】D
【解析】A项,从图示可看出形成过渡态物质的能量都是升高的,正确;B项,从图中能量差可知,过渡态Ts1的能量为0.15 eV,则该步的活化能为[0.15-(-0.9)] eV=1.05 eV,正确;D项,前三步中能量变化最大的是第二步,该步骤分两步形成稳定的微粒,反应方程式为·HOCO+(7/2)H2(g)=·CO+·OH+·H+3H2(g),错误。
课堂练习
课堂小结
【思维建模】活化分子、有效碰撞与反应速率的关系
课后小任务
课后分小组,通过网络、书籍等渠道进一步了解飞秒化学及其应用。
感 谢 倾 听
