【核心素养目标】人教版(2019)高一化学必修第一册1.2 离子反应(第3课时 离子反应应用)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高一化学必修第一册1.2 离子反应(第3课时 离子反应应用) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-06 10:08:19 | ||
图片预览








文档简介
(共21张PPT)
第二节 离子反应
第3课时 离子反应应用
人教版必修第一册
学习目标
1.应用离子发生的条件,正确判断常见离子在溶液中能否大量共存。
2.利用离子的特征反应能鉴别离子以及进行综合推断。
学习目标
通过掌握离子推断的方法,培养学生“宏观辨识与微观探析“证据推理与模型认知”的核心素养。
素养目标
情境引入
近期,环境保护组织对某市相邻甲、乙两企业排出的废水进行了检测,发现甲企业的废水中含有下列几种离子:K+、SO42-、CO32-、Cl-。乙企业的废水中含有大量H+、Ba2+、NO3-,若将这两种废水混合,废水的污染性明显降低,这是什么原因呢?
甲厂
乙厂
SO42-、Ba2+两种离子不能共存,会生成BaSO4白色沉淀,可有效降低重金属Ba2+的浓度:Ba2++SO42-=BaSO4↓;CO32-与H+不能共存,反应生成了CO2气体:CO32-+2H+=CO2↑+H2O,可有效降低H+的浓度(酸污染)。因此,甲、乙两企业排出的废水混合,可以降低或消除环境污染。
【结论】
情境引入
教学过程
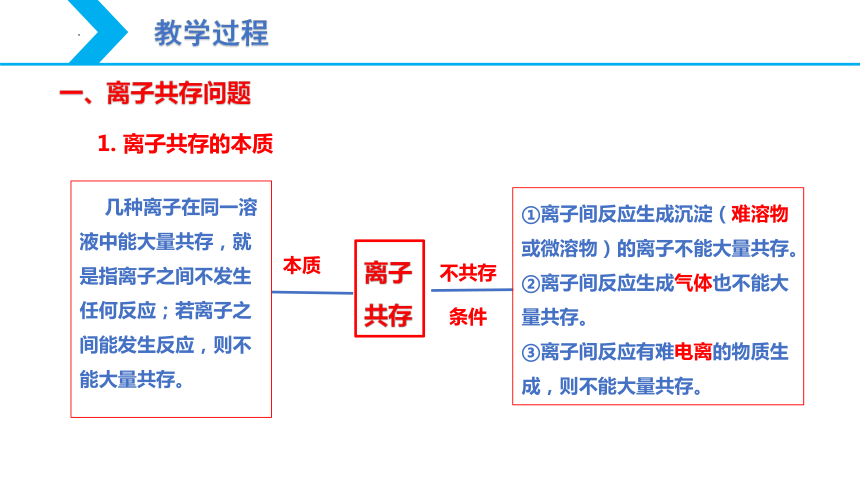
一、离子共存问题
离子共存
本质
不共存
条件
几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
①离子间反应生成沉淀(难溶物或微溶物)的离子不能大量共存。
②离子间反应生成气体也不能大量共存。
③离子间反应有难电离的物质生成,则不能大量共存。
1. 离子共存的本质
教学过程
(1)在溶液中某些离子能相互反应生成难溶性物质时,这些离子就不能大量共存。
①生成难溶性的盐:Ca2+与CO32-,Ba2+与CO32-、SO42-,Ag+与Cl-等。
②生成难溶性的碱:OH-与Cu2+、Fe2+、Fe3+、Mg2+、Al3+等。
③生成微溶物质:如Ag+与SO42-,Ca2+与SO42-、OH-,Mg2+与CO32-等。
(2)生成气体的离子不能大量共存:H+与CO32-、HCO3-等。
(3)生成水或其他难电离物质的离子不能大量共存:H+与OH-、CH3COO-等。
常见难电离的物质:H2O;弱酸:CH3COOH、H2CO3、HClO、H2S、H2SO3等;弱碱:Al(OH)3、Cu(OH)2、Fe(OH)3、Fe(OH)2等。
2. 离子不能共存的条件
教学过程
(1)注意判断离子共存的情况:“能、不能”,“一定、可能、一定不能”。
(2)注意题干中提示的溶液酸碱性:酸性溶液应考虑H+的存在,碱性溶液应考虑OH-的存在。
(3)注意题干中提示的溶液颜色:溶液无色时,有色离子不能存在。
(4)注意正确理解“透明溶液”,如:NaCl溶液、KOH溶液为无色透明溶液,CuSO4溶液、FeCl3溶液是有色透明溶液,不能认为“有色”就不透明。
离子共存问题审题技巧
教学过程
3. 其他限定条件
(1)无色溶液限定条件
几种常见离子的颜色
离子 Cu2+ Fe3+ Fe2+ MnO4- Cr2O72- CrO42- Cr3+
溶液颜色 蓝色 棕黄色 浅绿色 紫红色 橙红色 黄色 绿色
注意:透明不代表无色,即透明溶液中有色离子可以大量共存
教学过程
(2)限制酸性溶液的条件(隐含有H+)
①常温下pH< 7的溶液;
②使紫色石蕊溶液呈红色(或蓝色石蕊试纸变红);
③使pH试纸变红;
④使甲基橙呈红色;
⑤加镁粉放氢气;
⑥c(H+)>c(OH-)的溶液;
教学过程
①常温下pH>7的溶液;
②使pH试纸变蓝;
③使红色石蕊试纸变蓝(紫色石蕊溶液呈蓝色);
④使酚酞呈红色;
⑤c(OH-)>c(H+)的溶液
(3)限制碱性溶液的条件(隐含有OH-)
典例1.
课堂练习
【答案】C
在无色透明的强酸性溶液中,下列各组离子能大量共存的是( )
A.Cu2+、K+、Cl-、 NO3-
B.Ag+、Na+、 NO3- 、Cl-
C.Mg2+、Na+、 SO42- 、Cl-
D.Na+、K+、Cl-、CO32-
典例2.
课堂练习
【答案】D
甲、乙、丙、丁四位同学分别进行实验,测定四份不同澄清溶液的成分,记录结果如下,其中记录结果合理的是( )
甲:K2SO4、BaCl2、NaCl
乙:NaCl、Ba(OH)2、K2CO3
丙:HCl、K2CO3、NaCl
丁:K2SO4、Na2CO3、KCl
A.甲 B.乙 C.丙 D.丁
教学过程
二、离子推断问题
思考讨论:假设我们要确定溶液中是否存在某种离子,你认为在设计方案时应注意哪些问题(原则)?
离子推断四原则
①肯定原则:根据实验现象推出溶液中肯定存在或肯定不存在的离子
②互斥原则:在肯定某些离子存在的同时,结合离子共存规律,否定一些离子的存在 (肯定的同时看否定)
③电中性原则:溶液呈电中性,溶液中有阳离子,必有阴离子,且溶液中阳离子所带正电荷总数与阴离子所带负电荷总数相等。
④进出原则:通常是在实验过程中使用,是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰。
教学过程
依据物理性质、化学性质的差异—颜色的变化、是否有气体产生、能否溶解、有无沉淀、能否产生某个现象(或产生某个现象的快慢)、有无吸热或放热等现象来判断。
依据
步骤
观察物理性质→取少量样品→加入某种试剂→加热、振荡等→现象→结论
思路
根据实验操作和现象,判断一定含有的离子→根据离子共存,判断一定不含的离子→根据电荷守恒,判断还含有的离子或可能含有的离子。
思维模型
离子推断
典例3.
课堂练习
某Y形河流上游两旁有甲、乙两个化工厂,其位置如图所示。经某化学课外活动小组检测,已知它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。
(1)经该小组检测,甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是 。
(2)该小组认为,乙厂的废水中含有另外三种离子,如果加一定量的 (填“活性炭”“硫酸亚铁”或“铁粉”),可以回收其中的金属 (填元素符号),达到变废为宝的目的。
(3)该小组有一个设想,建议甲厂和乙厂联合起来,把废水按适当比例混合,可以使废水中的
(填离子符号)转化为沉淀。在丙地建立一个灌溉站,河水可用来直接浇灌农田,他们的理由是经过滤后的废水主要含 ,有利于农作物的生长。你认为他们的方案是否可行,并写出理由: 。
课堂练习
【答案】 (1)K+ Cl- OH-
(2)铁粉 Ag 2 Ag+ + Fe = 2 Ag + Fe2+
(3)Ag+、Cl-、Fe3+、OH- K+、NO3-
【解析】(1)甲厂排放的工业废水明显呈碱性,一定含有OH-,与OH-可共存的离子有K+、Cl-、NO3-,考虑到Ag+与Cl-、OH-不能共存,所以甲厂废水中含OH-、K+、Cl-,乙厂废水中含Ag+、Fe3+、NO3-。
(2)在乙厂废水中加入一定量的铁粉可以回收银。
(3)若将两厂废水按适当比例混合,可将Ag+与Cl-、Fe3+与OH-分别转化为AgCl、Fe(OH)3沉淀,经过滤后溶液中主要含有KNO3,KNO3是含钾元素、氮元素的复合肥料。
课堂练习
某溶液的溶质可能由下列离子组成:Cl-、SO42-、 CO32- 、H+、Ba2+、Na+,某同学进行了如下实验:
(1)向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
(2)向(1)中滤液里加入AgNO3溶液,有白色沉淀产生;
(3)将(1)中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生。依据以上实验可以推断,原溶液中一定含有 ;一定没有 ;可能含有________。
典例4.
SO42-、 CO32- 、Na+
H+、Ba2+
Cl-
【答案】
课堂小结
课后小任务
海水中得到的粗盐中含有Ca2+、Mg2+、SO42-,为了进一步提纯,设计实验方案、写出实验步骤、所加试剂及离子方程式。
粗盐
精盐
第①步:加NaOH溶液过滤 :Mg2++2OH-=Mg(OH)2↓ ;
第②步:加BaCl2溶液过滤:SO42-+Ba2+=BaSO4↓;
第③步:加Na2CO3溶液过滤:CO32-+Ba2+=BaCO3↓,CO32-+Ba2+=BaCO3↓;
第④步:加盐酸:CO32-+2H+=CO2↑+H2O、H++OH- = H2O。
① 除杂试剂应过量;
②过量试剂要在后续步骤中除去,不能引入新杂质;
③BaCl2溶液应加在Na2CO3溶液之前,盐酸最后加。
【基本思路】
【基本原则】
课后小任务
感 谢 倾 听
第二节 离子反应
第3课时 离子反应应用
人教版必修第一册
学习目标
1.应用离子发生的条件,正确判断常见离子在溶液中能否大量共存。
2.利用离子的特征反应能鉴别离子以及进行综合推断。
学习目标
通过掌握离子推断的方法,培养学生“宏观辨识与微观探析“证据推理与模型认知”的核心素养。
素养目标
情境引入
近期,环境保护组织对某市相邻甲、乙两企业排出的废水进行了检测,发现甲企业的废水中含有下列几种离子:K+、SO42-、CO32-、Cl-。乙企业的废水中含有大量H+、Ba2+、NO3-,若将这两种废水混合,废水的污染性明显降低,这是什么原因呢?
甲厂
乙厂
SO42-、Ba2+两种离子不能共存,会生成BaSO4白色沉淀,可有效降低重金属Ba2+的浓度:Ba2++SO42-=BaSO4↓;CO32-与H+不能共存,反应生成了CO2气体:CO32-+2H+=CO2↑+H2O,可有效降低H+的浓度(酸污染)。因此,甲、乙两企业排出的废水混合,可以降低或消除环境污染。
【结论】
情境引入
教学过程
一、离子共存问题
离子共存
本质
不共存
条件
几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
①离子间反应生成沉淀(难溶物或微溶物)的离子不能大量共存。
②离子间反应生成气体也不能大量共存。
③离子间反应有难电离的物质生成,则不能大量共存。
1. 离子共存的本质
教学过程
(1)在溶液中某些离子能相互反应生成难溶性物质时,这些离子就不能大量共存。
①生成难溶性的盐:Ca2+与CO32-,Ba2+与CO32-、SO42-,Ag+与Cl-等。
②生成难溶性的碱:OH-与Cu2+、Fe2+、Fe3+、Mg2+、Al3+等。
③生成微溶物质:如Ag+与SO42-,Ca2+与SO42-、OH-,Mg2+与CO32-等。
(2)生成气体的离子不能大量共存:H+与CO32-、HCO3-等。
(3)生成水或其他难电离物质的离子不能大量共存:H+与OH-、CH3COO-等。
常见难电离的物质:H2O;弱酸:CH3COOH、H2CO3、HClO、H2S、H2SO3等;弱碱:Al(OH)3、Cu(OH)2、Fe(OH)3、Fe(OH)2等。
2. 离子不能共存的条件
教学过程
(1)注意判断离子共存的情况:“能、不能”,“一定、可能、一定不能”。
(2)注意题干中提示的溶液酸碱性:酸性溶液应考虑H+的存在,碱性溶液应考虑OH-的存在。
(3)注意题干中提示的溶液颜色:溶液无色时,有色离子不能存在。
(4)注意正确理解“透明溶液”,如:NaCl溶液、KOH溶液为无色透明溶液,CuSO4溶液、FeCl3溶液是有色透明溶液,不能认为“有色”就不透明。
离子共存问题审题技巧
教学过程
3. 其他限定条件
(1)无色溶液限定条件
几种常见离子的颜色
离子 Cu2+ Fe3+ Fe2+ MnO4- Cr2O72- CrO42- Cr3+
溶液颜色 蓝色 棕黄色 浅绿色 紫红色 橙红色 黄色 绿色
注意:透明不代表无色,即透明溶液中有色离子可以大量共存
教学过程
(2)限制酸性溶液的条件(隐含有H+)
①常温下pH< 7的溶液;
②使紫色石蕊溶液呈红色(或蓝色石蕊试纸变红);
③使pH试纸变红;
④使甲基橙呈红色;
⑤加镁粉放氢气;
⑥c(H+)>c(OH-)的溶液;
教学过程
①常温下pH>7的溶液;
②使pH试纸变蓝;
③使红色石蕊试纸变蓝(紫色石蕊溶液呈蓝色);
④使酚酞呈红色;
⑤c(OH-)>c(H+)的溶液
(3)限制碱性溶液的条件(隐含有OH-)
典例1.
课堂练习
【答案】C
在无色透明的强酸性溶液中,下列各组离子能大量共存的是( )
A.Cu2+、K+、Cl-、 NO3-
B.Ag+、Na+、 NO3- 、Cl-
C.Mg2+、Na+、 SO42- 、Cl-
D.Na+、K+、Cl-、CO32-
典例2.
课堂练习
【答案】D
甲、乙、丙、丁四位同学分别进行实验,测定四份不同澄清溶液的成分,记录结果如下,其中记录结果合理的是( )
甲:K2SO4、BaCl2、NaCl
乙:NaCl、Ba(OH)2、K2CO3
丙:HCl、K2CO3、NaCl
丁:K2SO4、Na2CO3、KCl
A.甲 B.乙 C.丙 D.丁
教学过程
二、离子推断问题
思考讨论:假设我们要确定溶液中是否存在某种离子,你认为在设计方案时应注意哪些问题(原则)?
离子推断四原则
①肯定原则:根据实验现象推出溶液中肯定存在或肯定不存在的离子
②互斥原则:在肯定某些离子存在的同时,结合离子共存规律,否定一些离子的存在 (肯定的同时看否定)
③电中性原则:溶液呈电中性,溶液中有阳离子,必有阴离子,且溶液中阳离子所带正电荷总数与阴离子所带负电荷总数相等。
④进出原则:通常是在实验过程中使用,是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰。
教学过程
依据物理性质、化学性质的差异—颜色的变化、是否有气体产生、能否溶解、有无沉淀、能否产生某个现象(或产生某个现象的快慢)、有无吸热或放热等现象来判断。
依据
步骤
观察物理性质→取少量样品→加入某种试剂→加热、振荡等→现象→结论
思路
根据实验操作和现象,判断一定含有的离子→根据离子共存,判断一定不含的离子→根据电荷守恒,判断还含有的离子或可能含有的离子。
思维模型
离子推断
典例3.
课堂练习
某Y形河流上游两旁有甲、乙两个化工厂,其位置如图所示。经某化学课外活动小组检测,已知它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。
(1)经该小组检测,甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是 。
(2)该小组认为,乙厂的废水中含有另外三种离子,如果加一定量的 (填“活性炭”“硫酸亚铁”或“铁粉”),可以回收其中的金属 (填元素符号),达到变废为宝的目的。
(3)该小组有一个设想,建议甲厂和乙厂联合起来,把废水按适当比例混合,可以使废水中的
(填离子符号)转化为沉淀。在丙地建立一个灌溉站,河水可用来直接浇灌农田,他们的理由是经过滤后的废水主要含 ,有利于农作物的生长。你认为他们的方案是否可行,并写出理由: 。
课堂练习
【答案】 (1)K+ Cl- OH-
(2)铁粉 Ag 2 Ag+ + Fe = 2 Ag + Fe2+
(3)Ag+、Cl-、Fe3+、OH- K+、NO3-
【解析】(1)甲厂排放的工业废水明显呈碱性,一定含有OH-,与OH-可共存的离子有K+、Cl-、NO3-,考虑到Ag+与Cl-、OH-不能共存,所以甲厂废水中含OH-、K+、Cl-,乙厂废水中含Ag+、Fe3+、NO3-。
(2)在乙厂废水中加入一定量的铁粉可以回收银。
(3)若将两厂废水按适当比例混合,可将Ag+与Cl-、Fe3+与OH-分别转化为AgCl、Fe(OH)3沉淀,经过滤后溶液中主要含有KNO3,KNO3是含钾元素、氮元素的复合肥料。
课堂练习
某溶液的溶质可能由下列离子组成:Cl-、SO42-、 CO32- 、H+、Ba2+、Na+,某同学进行了如下实验:
(1)向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
(2)向(1)中滤液里加入AgNO3溶液,有白色沉淀产生;
(3)将(1)中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生。依据以上实验可以推断,原溶液中一定含有 ;一定没有 ;可能含有________。
典例4.
SO42-、 CO32- 、Na+
H+、Ba2+
Cl-
【答案】
课堂小结
课后小任务
海水中得到的粗盐中含有Ca2+、Mg2+、SO42-,为了进一步提纯,设计实验方案、写出实验步骤、所加试剂及离子方程式。
粗盐
精盐
第①步:加NaOH溶液过滤 :Mg2++2OH-=Mg(OH)2↓ ;
第②步:加BaCl2溶液过滤:SO42-+Ba2+=BaSO4↓;
第③步:加Na2CO3溶液过滤:CO32-+Ba2+=BaCO3↓,CO32-+Ba2+=BaCO3↓;
第④步:加盐酸:CO32-+2H+=CO2↑+H2O、H++OH- = H2O。
① 除杂试剂应过量;
②过量试剂要在后续步骤中除去,不能引入新杂质;
③BaCl2溶液应加在Na2CO3溶液之前,盐酸最后加。
【基本思路】
【基本原则】
课后小任务
感 谢 倾 听
