化学人教版(2019)必修第一册 第三章复习 课件(共29张PPT)
文档属性
| 名称 | 化学人教版(2019)必修第一册 第三章复习 课件(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 220.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-06 12:03:44 | ||
图片预览






文档简介
(共29张PPT)
第三章 铁 金属材料
章末复习
1.铁在地壳中含量仅次于氧、硅和 ,居第 位,主要以 价和 价化合物的形式存在。
铝
四
+2
+3
3Fe+2O2 Fe3O4
2Fe+3Cl2 2FeCl3
Fe+S FeS
点燃
====
点燃
====
△
====
一、铁的单质
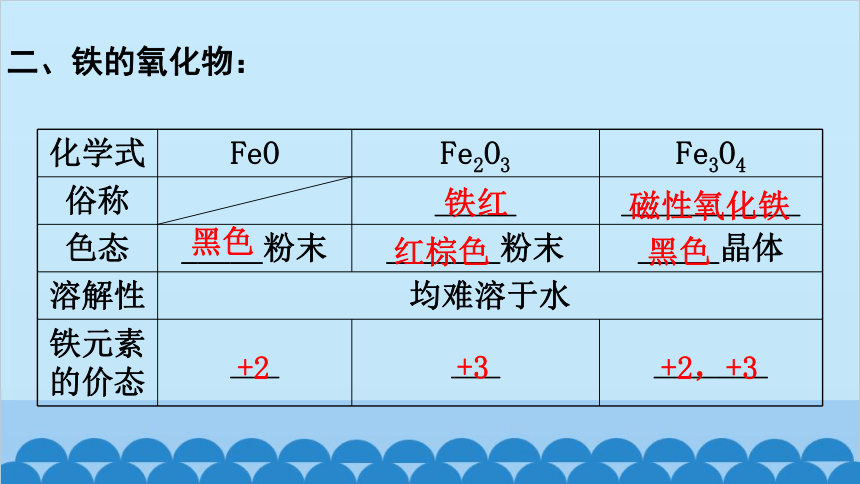
二、铁的氧化物:
化学式 FeO Fe2O3 Fe3O4
俗称 _____ ___________
色态 _____粉末 _______粉末 _____晶体
溶解性 均难溶于水
铁元素 的价态 ___ ___ _______
铁红
磁性氧化铁
黑色
红棕色
黑色
+2
+3
+2,+3
化学式 FeO Fe2O3 Fe3O4
与盐酸反应的离子方程式 ___________ ________ _____________ __________ Fe3O4+8H+==== Fe2++2Fe3++4H2O
FeO+2H+====
Fe2++H2O
Fe2O3+6H+====
2Fe3++3H2O
1、(1)Fe3O4中的铁元素有+2价和+3价,Fe3O4______(填“是”或“不是”)混合物,因为___________________。
(2)分离Fe2O3和Fe3O4的混合物的方法是________。
(3)FeO转化为Fe3O4的化学方程式为:___________。
针对练习:
Fe(OH)2 Fe(OH)3
色态
水溶性
制法
加热分解 _____________
与盐酸反应
转化
白色固体
红褐色固体
不溶
不溶
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)2+2H+=
Fe2++2H2O
Fe(OH)3+3H+=
Fe3++3H2O
Fe3++3OH-=Fe(OH)3↓
2Fe(OH)3==
Fe2O3+3H2O
△
三、铁的氢氧化物:
2、下列实验操作能够制取Fe(OH)2并能较长时间观察到白色沉淀的是 ( )。
3、某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶
液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰
绿色,最后变成红褐色,下列结论正确的是
( )。
A.一定有Fe2+,一定没有Fe3+、Mg2+
B.一定有Fe3+,一定没有Fe2+、Mg2+
C.一定有Fe3+,可能有Fe2+,一定没有Mg2+
D.一定有Fe2+,可能有Mg2+,一定没有Fe3+
四、铁盐和亚铁盐
一:Fe2+ 、Fe3+常用的检验方法
(1)Fe3+的检验:
a.观察颜色: Fe3+的溶液呈棕黄色
b.加碱液: Fe3+ + 3OH = Fe(OH)3
c.加KSCN溶液:Fe3 + 3SCN = Fe(SCN)3
(红褐色沉淀)
(红色溶液)
Fe2+
Fe3+
Cl2 、 O2 、 HNO3、 *KMnO4
Fe、Cu、*I-、 *S2-
浅绿色
棕黄色
Fe(OH)3
Fe(OH)2
红褐色
白色
碱
酸
碱
酸
空气中放置
五、Fe2+和Fe3+的转化
4、已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。
(1)写出A、C、F、G的化学式
A.________ C.________ F.________ G.________。
(2)保存C溶液时要加固体A的原因_________________。
(3)写出下列转化的离子方程式或化学方程式。
①E―→F:_____________________________________。
②C―→D:_________________________________________。
5、下列物质反应后一定有+3价铁生成的是 ( )。
①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应
③FeCl2溶液中通入少量Cl2 ④Fe和Fe2O3的混合物溶于盐酸中
A.①② B.①③
C.①②③ D.①②③④
6、向某溶液中加入含Fe2+的溶液后,无明显变化。当再滴入几滴新制氯水后,混合溶液变成红色,则下列结论错误的是 ( )。
A.该溶液中一定含有SCN-
B.氧化性:Fe3+>Cl2
C.Fe2+与SCN-不能形成红色物质
D.Fe2+被氧化为Fe3+
2Al+2NaOH+2H2O ==2NaAlO2+3H2 ↑
2Al + 6HCl == 2AlCl3 + 3H2 ↑
铝是两性金属
六、铝单质的化学性质
七、氧化铝的化学性质
Al2O3是 氧化物,与 或 溶液都能反应生成盐和水。
(1)与强酸反应的离子方程式:
。
(2)与强碱反应的离子方程式:
。
两性
酸
强碱
Al2O3+6H+===2Al3++3H2O
7、下列各种物质既能与强酸反应,又能与强碱反应的是 ( )。
①Al ②AlCl3 ③Na2CO3 ④Al2O3 ⑤NaHCO3
A.①③⑤ B.②③④
C.①③④ D.①④⑤
8、下列说法正确的是 ( )。
A.Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3能跟所有的酸碱溶液反应
D.Al2O3能跟强的酸碱溶液反应
八、物质的量在化学方程式计算中的应用
计算的依据:
2Na + 2H2O= 2NaOH + H2↑
化学计量数之比:2 : 2 : 2 : 1
扩大NA倍 2×6.02×1023 : 2×6.02×1023 : 2×6.02×1023 : 1×6.02×1023
物质的量之比 2mol : 2mol : 2mol : 1mol
结 论:
化学方程式中各物质的化学计量之比等于各物质的粒子数之比,因而也等于各物质的物质的量之比。
物质的量与其它物理量之间的联系
结论:物质的量是联系各物理量的纽带,可以简便的进行各量之间的转换。
物质的量n
物质质量m
微粒数N
物质的量浓度CB
标况下气体体积V
X NA
÷ NA
X M
÷ M
X V
÷ V
X 22.4L/mol
÷22.4L/mol
9、医疗上颇为流行的“理疗特效热”,就是利用铁缓慢氧化放出均匀、稳定的热,使患处保持温热状态。若56 g铁粉完全氧化成氧化铁,需要消耗氧气的质量为( )。
A.24 g B.32 g
C.21 g D.16 g
10、把1.1 g铁、铝混合物溶于200 mL 5 mol·L-1盐酸中,反应后盐酸的浓度变为4.6 mol·L-1(溶液体积变化忽略不计)。求:
(1)反应中消耗HCl的物质的量。
(2)该混合物中铝、铁的物质的量。
11、把足量的铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO42-的物质的量浓度之比为 ( )。
A.1∶4 B.2∶7
C.1∶2 D.3∶8
根据含碳量
生铁
钢
(含碳量在2%~4.3%之间,还含硅、锰及少量硫、磷 )
碳素钢
低碳钢
(含碳0.3%~0.6%)
高碳钢
(含碳0.03%~0.3%)
中碳钢
(含碳0.6%~2% )
合金钢:在碳素钢中加入铬、锰、钨、镍、钼、钴等合金元素(如不锈钢)
钢的含碳量越低,韧性越好,硬度越低;
含碳量越高,韧性越差,硬度越高。
钢:用量最大,用途最广的合金
九、合金
铝合金、其他合金
名称 组成 主要性质 主要用途
铝合金 含有10%-30%的镁 硬度和强度都比纯铝和纯镁大 火箭、飞机、轮船等制造业
硬铝 含铜4%、镁0.5%、锰0.5%、硅0.7% 硬度和强度都比纯铝和纯镁大 火箭、飞机、轮船等制造业
钛合金 含铝6%、钒4% 耐高温、耐腐蚀、高强度 用于飞机、宇航、化学工业
金合金 加入银、铜、稀土元素等 有光泽、易加工、耐磨耐腐蚀 金饰品、电子元件、钱币、笔尖
11、铁和铁合金是生活中常用的材料, 下列说法正确的是( )
A.不锈钢是铁合金, 只含金属元素
B.一定条件下, 铁粉可与水蒸气反应
C.铁与盐酸反应, 铁合金不与盐酸反应
D.铁合金的硬度和强度均低于铁
12、有关合金的叙述不正确的是 ( )
A、合金的熔点比它的各成分金属的熔点低
B、合金的硬度和强度一般比纯金属高
C、合金一定是金属熔合而成的物质
D、硬铝、黄铜和钢均为合金
13、关于合金的说法正确的是( )
A.合金是一种纯净物
B.合金中只含有金属元素
C.合金的强度、硬度一般比组成它们的纯金属更 高,抗腐蚀性能等也更好
D.铁锈是一种合金
第三章 铁 金属材料
章末复习
1.铁在地壳中含量仅次于氧、硅和 ,居第 位,主要以 价和 价化合物的形式存在。
铝
四
+2
+3
3Fe+2O2 Fe3O4
2Fe+3Cl2 2FeCl3
Fe+S FeS
点燃
====
点燃
====
△
====
一、铁的单质
二、铁的氧化物:
化学式 FeO Fe2O3 Fe3O4
俗称 _____ ___________
色态 _____粉末 _______粉末 _____晶体
溶解性 均难溶于水
铁元素 的价态 ___ ___ _______
铁红
磁性氧化铁
黑色
红棕色
黑色
+2
+3
+2,+3
化学式 FeO Fe2O3 Fe3O4
与盐酸反应的离子方程式 ___________ ________ _____________ __________ Fe3O4+8H+==== Fe2++2Fe3++4H2O
FeO+2H+====
Fe2++H2O
Fe2O3+6H+====
2Fe3++3H2O
1、(1)Fe3O4中的铁元素有+2价和+3价,Fe3O4______(填“是”或“不是”)混合物,因为___________________。
(2)分离Fe2O3和Fe3O4的混合物的方法是________。
(3)FeO转化为Fe3O4的化学方程式为:___________。
针对练习:
Fe(OH)2 Fe(OH)3
色态
水溶性
制法
加热分解 _____________
与盐酸反应
转化
白色固体
红褐色固体
不溶
不溶
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)2+2H+=
Fe2++2H2O
Fe(OH)3+3H+=
Fe3++3H2O
Fe3++3OH-=Fe(OH)3↓
2Fe(OH)3==
Fe2O3+3H2O
△
三、铁的氢氧化物:
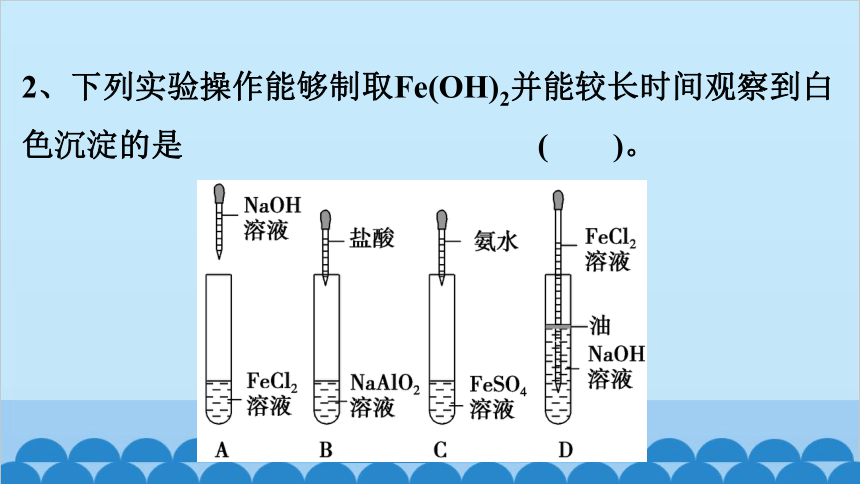
2、下列实验操作能够制取Fe(OH)2并能较长时间观察到白色沉淀的是 ( )。
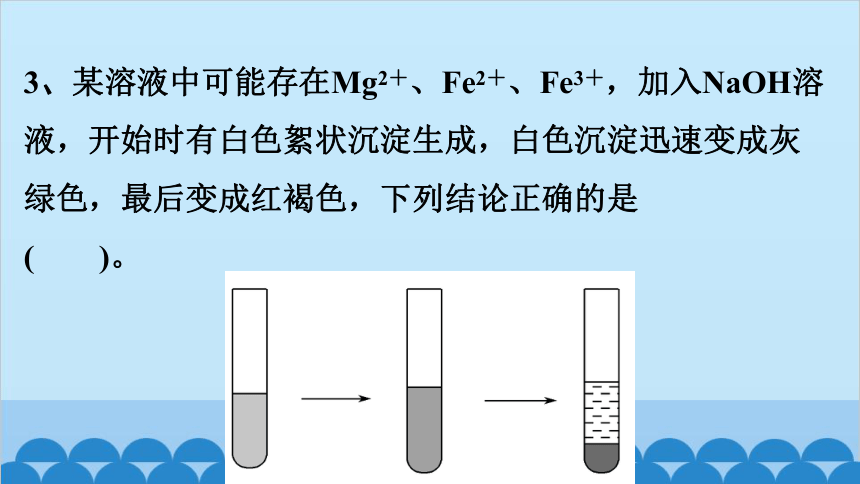
3、某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶
液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰
绿色,最后变成红褐色,下列结论正确的是
( )。
A.一定有Fe2+,一定没有Fe3+、Mg2+
B.一定有Fe3+,一定没有Fe2+、Mg2+
C.一定有Fe3+,可能有Fe2+,一定没有Mg2+
D.一定有Fe2+,可能有Mg2+,一定没有Fe3+
四、铁盐和亚铁盐
一:Fe2+ 、Fe3+常用的检验方法
(1)Fe3+的检验:
a.观察颜色: Fe3+的溶液呈棕黄色
b.加碱液: Fe3+ + 3OH = Fe(OH)3
c.加KSCN溶液:Fe3 + 3SCN = Fe(SCN)3
(红褐色沉淀)
(红色溶液)
Fe2+
Fe3+
Cl2 、 O2 、 HNO3、 *KMnO4
Fe、Cu、*I-、 *S2-
浅绿色
棕黄色
Fe(OH)3
Fe(OH)2
红褐色
白色
碱
酸
碱
酸
空气中放置
五、Fe2+和Fe3+的转化
4、已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。
(1)写出A、C、F、G的化学式
A.________ C.________ F.________ G.________。
(2)保存C溶液时要加固体A的原因_________________。
(3)写出下列转化的离子方程式或化学方程式。
①E―→F:_____________________________________。
②C―→D:_________________________________________。
5、下列物质反应后一定有+3价铁生成的是 ( )。
①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应
③FeCl2溶液中通入少量Cl2 ④Fe和Fe2O3的混合物溶于盐酸中
A.①② B.①③
C.①②③ D.①②③④
6、向某溶液中加入含Fe2+的溶液后,无明显变化。当再滴入几滴新制氯水后,混合溶液变成红色,则下列结论错误的是 ( )。
A.该溶液中一定含有SCN-
B.氧化性:Fe3+>Cl2
C.Fe2+与SCN-不能形成红色物质
D.Fe2+被氧化为Fe3+
2Al+2NaOH+2H2O ==2NaAlO2+3H2 ↑
2Al + 6HCl == 2AlCl3 + 3H2 ↑
铝是两性金属
六、铝单质的化学性质
七、氧化铝的化学性质
Al2O3是 氧化物,与 或 溶液都能反应生成盐和水。
(1)与强酸反应的离子方程式:
。
(2)与强碱反应的离子方程式:
。
两性
酸
强碱
Al2O3+6H+===2Al3++3H2O
7、下列各种物质既能与强酸反应,又能与强碱反应的是 ( )。
①Al ②AlCl3 ③Na2CO3 ④Al2O3 ⑤NaHCO3
A.①③⑤ B.②③④
C.①③④ D.①④⑤
8、下列说法正确的是 ( )。
A.Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3能跟所有的酸碱溶液反应
D.Al2O3能跟强的酸碱溶液反应
八、物质的量在化学方程式计算中的应用
计算的依据:
2Na + 2H2O= 2NaOH + H2↑
化学计量数之比:2 : 2 : 2 : 1
扩大NA倍 2×6.02×1023 : 2×6.02×1023 : 2×6.02×1023 : 1×6.02×1023
物质的量之比 2mol : 2mol : 2mol : 1mol
结 论:
化学方程式中各物质的化学计量之比等于各物质的粒子数之比,因而也等于各物质的物质的量之比。
物质的量与其它物理量之间的联系
结论:物质的量是联系各物理量的纽带,可以简便的进行各量之间的转换。
物质的量n
物质质量m
微粒数N
物质的量浓度CB
标况下气体体积V
X NA
÷ NA
X M
÷ M
X V
÷ V
X 22.4L/mol
÷22.4L/mol
9、医疗上颇为流行的“理疗特效热”,就是利用铁缓慢氧化放出均匀、稳定的热,使患处保持温热状态。若56 g铁粉完全氧化成氧化铁,需要消耗氧气的质量为( )。
A.24 g B.32 g
C.21 g D.16 g
10、把1.1 g铁、铝混合物溶于200 mL 5 mol·L-1盐酸中,反应后盐酸的浓度变为4.6 mol·L-1(溶液体积变化忽略不计)。求:
(1)反应中消耗HCl的物质的量。
(2)该混合物中铝、铁的物质的量。
11、把足量的铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO42-的物质的量浓度之比为 ( )。
A.1∶4 B.2∶7
C.1∶2 D.3∶8
根据含碳量
生铁
钢
(含碳量在2%~4.3%之间,还含硅、锰及少量硫、磷 )
碳素钢
低碳钢
(含碳0.3%~0.6%)
高碳钢
(含碳0.03%~0.3%)
中碳钢
(含碳0.6%~2% )
合金钢:在碳素钢中加入铬、锰、钨、镍、钼、钴等合金元素(如不锈钢)
钢的含碳量越低,韧性越好,硬度越低;
含碳量越高,韧性越差,硬度越高。
钢:用量最大,用途最广的合金
九、合金
铝合金、其他合金
名称 组成 主要性质 主要用途
铝合金 含有10%-30%的镁 硬度和强度都比纯铝和纯镁大 火箭、飞机、轮船等制造业
硬铝 含铜4%、镁0.5%、锰0.5%、硅0.7% 硬度和强度都比纯铝和纯镁大 火箭、飞机、轮船等制造业
钛合金 含铝6%、钒4% 耐高温、耐腐蚀、高强度 用于飞机、宇航、化学工业
金合金 加入银、铜、稀土元素等 有光泽、易加工、耐磨耐腐蚀 金饰品、电子元件、钱币、笔尖
11、铁和铁合金是生活中常用的材料, 下列说法正确的是( )
A.不锈钢是铁合金, 只含金属元素
B.一定条件下, 铁粉可与水蒸气反应
C.铁与盐酸反应, 铁合金不与盐酸反应
D.铁合金的硬度和强度均低于铁
12、有关合金的叙述不正确的是 ( )
A、合金的熔点比它的各成分金属的熔点低
B、合金的硬度和强度一般比纯金属高
C、合金一定是金属熔合而成的物质
D、硬铝、黄铜和钢均为合金
13、关于合金的说法正确的是( )
A.合金是一种纯净物
B.合金中只含有金属元素
C.合金的强度、硬度一般比组成它们的纯金属更 高,抗腐蚀性能等也更好
D.铁锈是一种合金
