山东省滨州市2023-2024学年高三上学期开学摸底联考化学试题(含答案)
文档属性
| 名称 | 山东省滨州市2023-2024学年高三上学期开学摸底联考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 851.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-06 15:30:19 | ||
图片预览




文档简介
滨州市2023-2024学年高三上学期开学摸底联考
化 学
注意事项:
1.本试卷满分100分,考试时间90分钟。
2.答卷前,考生务必将自己的姓名、座号、考生号填写在答题卡上,并将条形码横贴在答题卡的“贴条形码区”。
3.作答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑;如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
4.非选择题必须用直径0.5毫米黑色字迹钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液,不按以上要求作答的答案无效。
5.考生必须保持答题卡的整洁。考试结束后,将试卷和答题卡一并交回
可能用到的相对原子质量:H-1 C-12 O-16 Si-28 Cl-35.5 Ti-48
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.中国古代文房四宝笔墨纸砚中,据其主要化学成分不能与其他三种归为一类的是( )
A.做笔用的狼毫 B.墨条 C.宣纸 D.竹砚
2.下列物质的性质与用途具有对应关系的是( )
A.石墨能导电,可用作润滑剂 B.具有还原性,可用于去除水体中
C.青铜比纯铜熔点低、硬度大,古代用青铜铸剑 D.浓硫酸具有脱水性,可干燥氧气
3.下列分子属于非极性分子的是( )
A. B. C. D.
4.下列化学教材的实验操作中,主要不是从安全因素考虑的是( )
A.实验中,剩余钠或白磷要放回原试剂瓶
B.浓硫酸稀释时,将浓硫酸沿烧杯壁倒入水中,并用玻璃棒不断搅拌
C.用胶头滴管向试管中滴加试剂,滴管不能伸入试管内部
D.把固体颗粒放入试管时,使固体颗粒缓缓沿壁滑下
5.硅、二氧化硅是现代信息技术的基础材料,和晶体硅晶胞结构如图所示,下列叙述正确的是( )
A.基态Si原子的原子核外的电子有14种空间运动状态
B.中Si—O的键长比晶体硅中Si—Si的长
C.1mol 中和1mol晶体硅中均含有2mol共价键
D.晶胞中A为O原子,每个晶胞拥有6个O原子
6.下列鉴别的方法中,所用试剂、操作或方法不正确的是( )
A.用溶液鉴别溶液和溶液
B.用酚酞或氯水可鉴别NaI溶液和溶液
C.鉴别溶液和溶液;进行焰色试验
D.鉴别胶体和溶液;利用丁达尔效应
7.阿魏酸乙酯(结构如图)是用于生产治疗心脑血管疾病药品的基本原料,下列说法错误的是( )
A.阿魏酸乙酯含有3种含氧官能团 B.阿魏酸乙酯存在顺反异构
C.阿魏酸乙酯的加聚产物不能使溴水褪色 D.阿魏酸乙酯与氢气完全加成后的产物含手性碳原子
8.实验是化学的基础,是化学的灵魂。下列有关操作中,正确的是( )
A.容量瓶用蒸馏水洗净,必须烘干后才能用于溶液的配制
B.蒸发操作时,蒸发皿必须放在石棉网上,并用酒精灯的外焰加热
C.测氯水的pH,用玻璃棒蘸取氯水点在pH试纸上,待其变色后,与标准比色卡比较
D.测定中和反应反应热的实验中测量终止温度时,应当记录混合溶液的最高温度
9.某化学小组要配制500mL 0.6mol/L的NaOH溶液,下列实验操作会使所得溶液浓度偏低的是( )
A.用托盘天平称取12.0g NaOH固体时所用时间较长
B.向小烧杯中加水使氢氧化钠溶解并冷却至室温
C.把溶液转移到洗净但未干燥的容量瓶中,洗涤烧杯和玻璃棒3次并将洗涤液也转移到容量瓶中
D.定容过程观察容量瓶内液面是,俯视刻度线
10.钛白粉()广泛用于颜料、油漆和造纸等,实验测定样品中纯度步骤如下:①称取m g样品,在酸性条件下充分溶解,加入适量铝粉将还原为。②过滤并洗涤,将所得滤液和洗涤液合并配制成250mL溶液。取25.00mL所配溶液于锥形瓶中,滴加几滴KSCN溶液,用浓度为c mol/L的标准溶液滴定,将转化成,重复操作3次,平均消耗V mL标准溶液。下列有关说法正确的是( )
A.步骤①中加入铝粉的离子方程式为:
B.步骤②中用碱式滴定管盛放标准溶液
C.步骤②中,滴入半滴标准液,溶液由无色变红色,即可判定达滴定终点
D.样品中的质量分数为:
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求全部选对得4分,选对但不全的得2分有选错的得0分。
11.利用库仑测硫仪测定气体中的体积分数,其原理如图所示。待测气体进入电解池后,将还原,测硫仪便自动电解,溶液中保持不变。若有标准状况下V mL气体通入电解池(其它气体不反应),反应结束后消耗x库仑电量(已知:电解转移1mol电子所消耗的电量为96500库仑)。
下列说法正确的是( )
A.N接电源的负极 B.阳极反应式为
C.反应结束后溶液的pH增大 D.混合气体中的体积分数为
12.作为“血迹检测小王子”,鲁米诺反应在刑侦中扮演了重要的角色,其一种合成原理如图所示。下列有关说法错误的是( )
A.一定条件下物质A可与乙二醇发生缩聚反应
B.依据红外光谱可确证B、鲁米诺存在不同的官能团
C.等物质的量的A和B与足量NaOH溶液反应,消耗的NaOH一样多
D.物质B分子中处于同一平面的原子最多为12个
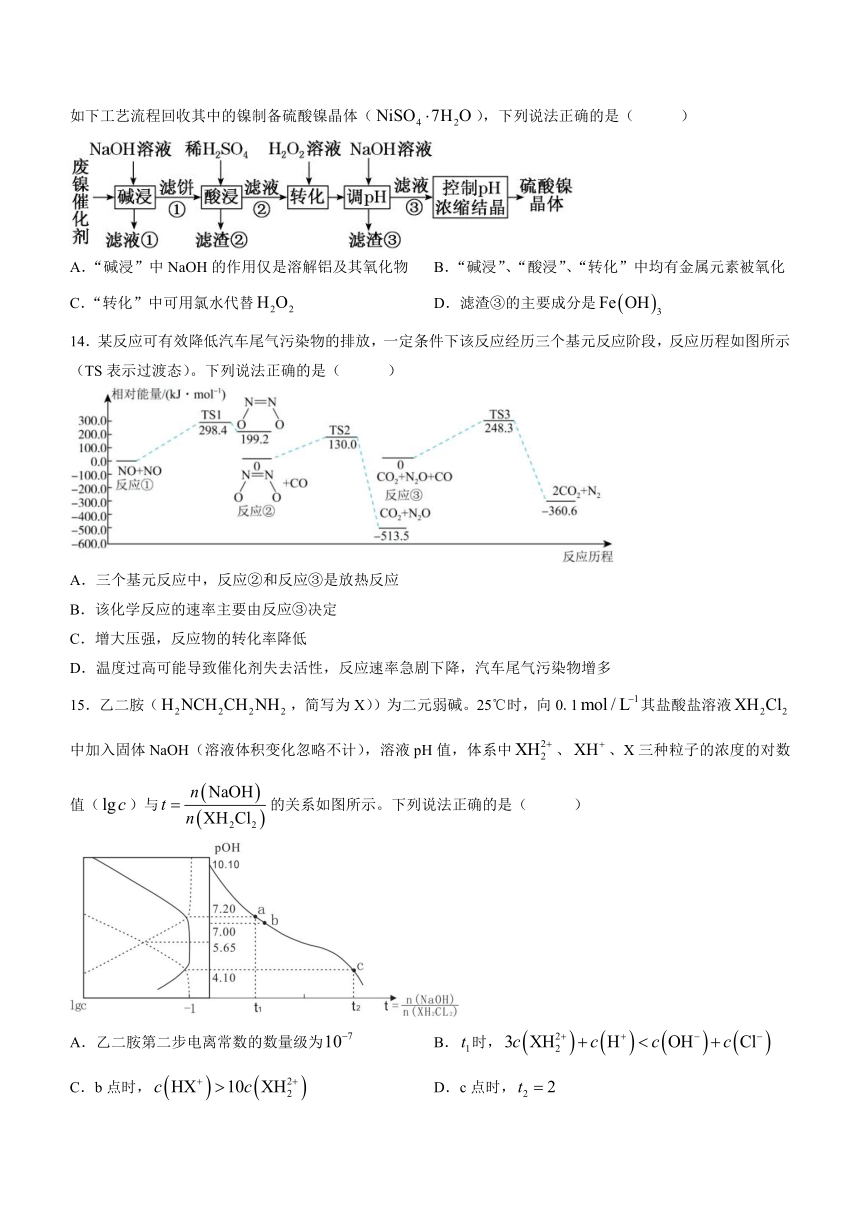
13.某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(),下列说法正确的是( )
A.“碱浸”中NaOH的作用仅是溶解铝及其氧化物 B.“碱浸”、“酸浸”、“转化”中均有金属元素被氧化
C.“转化”中可用氯水代替 D.滤渣③的主要成分是
14.某反应可有效降低汽车尾气污染物的排放,一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。下列说法正确的是( )
A.三个基元反应中,反应②和反应③是放热反应
B.该化学反应的速率主要由反应③决定
C.增大压强,反应物的转化率降低
D.温度过高可能导致催化剂失去活性,反应速率急剧下降,汽车尾气污染物增多
15.乙二胺(,简写为X))为二元弱碱。25℃时,向0.1其盐酸盐溶液中加入固体NaOH(溶液体积变化忽略不计),溶液pH值,体系中、、X三种粒子的浓度的对数值()与的关系如图所示。下列说法正确的是( )
A.乙二胺第二步电离常数的数量级为 B.时,
C.b点时, D.c点时,
三、非选择题:本题共5小题,共60分。
16.(12分)
硅材料和铝材料在生产生活中应用广泛。回答下列问题:
(1)一种磷酸硅铝分子筛常用于催化甲醇制烯烃的反应。由硅原子核形成的三种微粒:a.()、b.()、c.(),半径由大到小的顺序为 (填标号);第三周期元素中,第一电离能介于Al和P之间的元素有 种。
(2)是一种高介电常数材料。已知:中Si-N-Si键角120°,中C-N-C键角111°。共价键的极性Si—N C-N(填“>”、“=”或“<”)。下列划线原子与中N原子杂化类型相同的是 (填标号)。
A. B. C. D.
(3)铝硼中间合金在铝生产中应用广泛。金属铝熔点为660.3℃,晶体硼熔点为2300℃,晶体硼熔点高于铝的原因是 。
(4)已知合金的立方晶胞结构如图1,Na原子以金刚石方式堆积,八面体空隙和半数的四面体空隙中填入四面体;图2为沿x轴投影晶胞中所有Na原子的分布图。
图1 图2
每个Na周围距离其最近的Na有 个;以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点的分数坐标为,则B点的分数坐标为 ;设为阿伏加德罗常数的值,的摩尔质量为M ,晶体的密度为,则A、C两原子间的距离为 pm(列出计算表达式)。
17.(12分)
工业上用磷铁渣(主要含FeP、,以及少量、等杂质)制备(磷酸铁)。
已知:难溶于水,能溶于无机强酸。
(1)“浸取”时磷铁渣粉碎并搅拌目的是 ;加入硫酸的目的是 。
(2)“浸取”时发生反应的离子方程式为 。
(3)滤渣的主要成分是 ,制备操作中需要适当加热,但温度不宜过高的原因是
。
(4)“制备”过程中溶液的pH对磷酸铁产品中铁和磷的含量及比值的影响如图所示[考虑到微量金属杂质,在pH=1时,为0.973最接近理论值。]
在pH范围为1~1.5时,随pH增大,明显增大,其原因是 。
(5)工业上也可以用电解磷铁渣的方法制备。
①FeP在阳极放电的电极反应式为 。
②常温电解一段时间,测得溶液中浓度约为0.32,为了避免生成沉淀,应控制溶液的pH不大于 (已知:,)。
18.(12分)
乙酸硅是白色至米色晶体。某校同学设计实验先制备,再由与乙酸酐反应制备乙酸硅。已知部分物质性质如表:
物质 化学式 熔点 沸点 性质
乙酸硅 110℃ 148℃ 白色至米色晶体
四氯化硅 -70℃ 57.6℃ 极易水解
乙酸酐 -73℃ 140℃
回答下列问题:
Ⅰ.制备装置(部分夹持仪器已省略)如图:
(1)装置D中发生的是置换反应,其化学方程式为 。
(2)装置E用冰水浴的目的是 。
(3)上述设计的装置有一处明显不妥,改进的方法是 。
Ⅱ.制备的反应装置如图所示。
(4)仪器①的名称是 ,图中装置组装完毕后,首先进行的操作是 。
(5)取255g 放入仪器①中,在电磁搅拌下,由分液漏斗滴入稍过量的乙酸酐,关闭旋塞⑥,反应为放热反应,反应后反应混合物带色,不久仪器①底部析出大颗粒晶体。该过程中,玻璃管③的管口必须保持在液面上方的原因是 。
(6)待放置一段时间,用干冰―丙酮冷冻剂冷却,然后将③的管口插入到液体中(或“插入到烧瓶底部"”),再慢慢打开旋塞,小心缓慢地除去仪器①中的残留液体,接着再分两次由分液漏斗各滴入75mL左右的乙酸酐,再缓慢除去,最后得到335g精制的四乙酸硅,则四乙酸硅的产率为 %(保留到小数点后一位)。
19.(12分)
2,5-二甲基苯乙酰氯(E)是合成划时代杀虫剂螺虫乙酯的重要中间体,根据2,5-二甲基苯乙酰氯的两条合成路线,回答下列问题。
已知:
①
②
路线一:
(1)A的系统命名法名称是 ;B中含氧官能团名称为 。
(2)X的分子式为,则X的结构简式为 ,B→C反应的化学方程式为 。
路线二:
(3)F中有 种化学环境的氢,G中碳原子的杂化方式有 种,F→G属于 (填反应类型)。
20.(12分)
甲醚是重要的有机合成原料,甲醇制备甲醚的反应: ;工业上常用或CO催化氢化法合成。回答下列问题:
(1)和在某催化剂表面合成: ﹐反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为 。已知(、随温度的变化不大),随温度的变化关系如图乙所示,图中表示该反应的直线是 (填代号)。
图甲 图乙
(2)CO催化加氢法合成,进而制备的过程中涉及如下反应:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
①在298K,101kPa时,CO(g)、(g)、(g)燃烧热分别为a 、b 、c ,则 。
②一定温度下,向2L恒容密闭容器中充入2mol CO(g)和4mol (g)制备(g),初始压强为Pa,5min达到平衡时CO(g)的转化率为70%,,且。则0~5min内, ;反应Ⅰ的平衡常数 (用表示);平衡后,保持温度和容器体积不变,向容器中再充入1mol (g)和2mol (g),重新达到平衡后,(g)的物质的量分数 (填“增大”、“减小”或“不变”)。
③工业生产中,需要在260℃、压强恒为4.0MPa的反应釜中进行上述反应。初始时向反应釜中加入0.01mol CO(g)和0.02mol (g),为确保反应的连续性,需向反应釜中以、进气流量0.03持续通入原料,同时控制出气流量为0.02,单位时间内CO(g)的转化率为60%,则流出气体中(g)的百分含量为 ;控制出气流量小于进气流量的原因为
。
滨州市2023-2024学年高三上学期开学摸底联考
化学-参考答案
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.B 2.C 3.B 4.C 5.D 6.A 7.C 8.D 9.A 10.D
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求全部选对得4分,选对但不全的得2分有选错的得0分。
11.AD 12.D 13.BD 14.AD 15.B
三、非选择题:本题共5小题,共60分。
16.(12分)
(1)cab 3
(2)> AD
(3)晶体硼为共价晶体,铝为金属晶体
(4)4 (,,)
17.(12分)
(1)增大接触面积,加速溶解 为了保持体系的酸度,防止生成FePO4
(2)3Fe2P+29H++11=6Fe3++11NO↑+3H3PO4+10H2O
(3)SiO2 温度过高,氨易挥发
(4)pH增大,促进促进Fe3+水解,生成了难溶性的氢氧化铁混入产品
(5)FeP+4H2O-8e-=FePO4+8H+ 1.7
18.(12分)
(1)SiC+2Cl2SiCl4+C
(2)冷凝SiCl4使其液化,减少挥发损失
(3)装置E、F之间需连接一个干燥装置
(4)三颈烧瓶 检验装置气密性
(5)防止结晶析出的四乙酸硅堵塞③的导气管口
(6)84.6
19.(12分)
(1)1,4-二甲苯酮羰基
(2)
(3)6 3 取代反应
20.(12分)
(1)CH2O*+OH*+3H*=CH3O*+OH*+2H*(或CH2O*+H*=CH3O*)c
(2)①a+2b-c
②0.14 增大
③5% 反应釜要求压强恒定,而反应Ⅰ为气体分子数减小的反应
化 学
注意事项:
1.本试卷满分100分,考试时间90分钟。
2.答卷前,考生务必将自己的姓名、座号、考生号填写在答题卡上,并将条形码横贴在答题卡的“贴条形码区”。
3.作答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑;如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
4.非选择题必须用直径0.5毫米黑色字迹钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液,不按以上要求作答的答案无效。
5.考生必须保持答题卡的整洁。考试结束后,将试卷和答题卡一并交回
可能用到的相对原子质量:H-1 C-12 O-16 Si-28 Cl-35.5 Ti-48
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.中国古代文房四宝笔墨纸砚中,据其主要化学成分不能与其他三种归为一类的是( )
A.做笔用的狼毫 B.墨条 C.宣纸 D.竹砚
2.下列物质的性质与用途具有对应关系的是( )
A.石墨能导电,可用作润滑剂 B.具有还原性,可用于去除水体中
C.青铜比纯铜熔点低、硬度大,古代用青铜铸剑 D.浓硫酸具有脱水性,可干燥氧气
3.下列分子属于非极性分子的是( )
A. B. C. D.
4.下列化学教材的实验操作中,主要不是从安全因素考虑的是( )
A.实验中,剩余钠或白磷要放回原试剂瓶
B.浓硫酸稀释时,将浓硫酸沿烧杯壁倒入水中,并用玻璃棒不断搅拌
C.用胶头滴管向试管中滴加试剂,滴管不能伸入试管内部
D.把固体颗粒放入试管时,使固体颗粒缓缓沿壁滑下
5.硅、二氧化硅是现代信息技术的基础材料,和晶体硅晶胞结构如图所示,下列叙述正确的是( )
A.基态Si原子的原子核外的电子有14种空间运动状态
B.中Si—O的键长比晶体硅中Si—Si的长
C.1mol 中和1mol晶体硅中均含有2mol共价键
D.晶胞中A为O原子,每个晶胞拥有6个O原子
6.下列鉴别的方法中,所用试剂、操作或方法不正确的是( )
A.用溶液鉴别溶液和溶液
B.用酚酞或氯水可鉴别NaI溶液和溶液
C.鉴别溶液和溶液;进行焰色试验
D.鉴别胶体和溶液;利用丁达尔效应
7.阿魏酸乙酯(结构如图)是用于生产治疗心脑血管疾病药品的基本原料,下列说法错误的是( )
A.阿魏酸乙酯含有3种含氧官能团 B.阿魏酸乙酯存在顺反异构
C.阿魏酸乙酯的加聚产物不能使溴水褪色 D.阿魏酸乙酯与氢气完全加成后的产物含手性碳原子
8.实验是化学的基础,是化学的灵魂。下列有关操作中,正确的是( )
A.容量瓶用蒸馏水洗净,必须烘干后才能用于溶液的配制
B.蒸发操作时,蒸发皿必须放在石棉网上,并用酒精灯的外焰加热
C.测氯水的pH,用玻璃棒蘸取氯水点在pH试纸上,待其变色后,与标准比色卡比较
D.测定中和反应反应热的实验中测量终止温度时,应当记录混合溶液的最高温度
9.某化学小组要配制500mL 0.6mol/L的NaOH溶液,下列实验操作会使所得溶液浓度偏低的是( )
A.用托盘天平称取12.0g NaOH固体时所用时间较长
B.向小烧杯中加水使氢氧化钠溶解并冷却至室温
C.把溶液转移到洗净但未干燥的容量瓶中,洗涤烧杯和玻璃棒3次并将洗涤液也转移到容量瓶中
D.定容过程观察容量瓶内液面是,俯视刻度线
10.钛白粉()广泛用于颜料、油漆和造纸等,实验测定样品中纯度步骤如下:①称取m g样品,在酸性条件下充分溶解,加入适量铝粉将还原为。②过滤并洗涤,将所得滤液和洗涤液合并配制成250mL溶液。取25.00mL所配溶液于锥形瓶中,滴加几滴KSCN溶液,用浓度为c mol/L的标准溶液滴定,将转化成,重复操作3次,平均消耗V mL标准溶液。下列有关说法正确的是( )
A.步骤①中加入铝粉的离子方程式为:
B.步骤②中用碱式滴定管盛放标准溶液
C.步骤②中,滴入半滴标准液,溶液由无色变红色,即可判定达滴定终点
D.样品中的质量分数为:
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求全部选对得4分,选对但不全的得2分有选错的得0分。
11.利用库仑测硫仪测定气体中的体积分数,其原理如图所示。待测气体进入电解池后,将还原,测硫仪便自动电解,溶液中保持不变。若有标准状况下V mL气体通入电解池(其它气体不反应),反应结束后消耗x库仑电量(已知:电解转移1mol电子所消耗的电量为96500库仑)。
下列说法正确的是( )
A.N接电源的负极 B.阳极反应式为
C.反应结束后溶液的pH增大 D.混合气体中的体积分数为
12.作为“血迹检测小王子”,鲁米诺反应在刑侦中扮演了重要的角色,其一种合成原理如图所示。下列有关说法错误的是( )
A.一定条件下物质A可与乙二醇发生缩聚反应
B.依据红外光谱可确证B、鲁米诺存在不同的官能团
C.等物质的量的A和B与足量NaOH溶液反应,消耗的NaOH一样多
D.物质B分子中处于同一平面的原子最多为12个
13.某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(),下列说法正确的是( )
A.“碱浸”中NaOH的作用仅是溶解铝及其氧化物 B.“碱浸”、“酸浸”、“转化”中均有金属元素被氧化
C.“转化”中可用氯水代替 D.滤渣③的主要成分是
14.某反应可有效降低汽车尾气污染物的排放,一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。下列说法正确的是( )
A.三个基元反应中,反应②和反应③是放热反应
B.该化学反应的速率主要由反应③决定
C.增大压强,反应物的转化率降低
D.温度过高可能导致催化剂失去活性,反应速率急剧下降,汽车尾气污染物增多
15.乙二胺(,简写为X))为二元弱碱。25℃时,向0.1其盐酸盐溶液中加入固体NaOH(溶液体积变化忽略不计),溶液pH值,体系中、、X三种粒子的浓度的对数值()与的关系如图所示。下列说法正确的是( )
A.乙二胺第二步电离常数的数量级为 B.时,
C.b点时, D.c点时,
三、非选择题:本题共5小题,共60分。
16.(12分)
硅材料和铝材料在生产生活中应用广泛。回答下列问题:
(1)一种磷酸硅铝分子筛常用于催化甲醇制烯烃的反应。由硅原子核形成的三种微粒:a.()、b.()、c.(),半径由大到小的顺序为 (填标号);第三周期元素中,第一电离能介于Al和P之间的元素有 种。
(2)是一种高介电常数材料。已知:中Si-N-Si键角120°,中C-N-C键角111°。共价键的极性Si—N C-N(填“>”、“=”或“<”)。下列划线原子与中N原子杂化类型相同的是 (填标号)。
A. B. C. D.
(3)铝硼中间合金在铝生产中应用广泛。金属铝熔点为660.3℃,晶体硼熔点为2300℃,晶体硼熔点高于铝的原因是 。
(4)已知合金的立方晶胞结构如图1,Na原子以金刚石方式堆积,八面体空隙和半数的四面体空隙中填入四面体;图2为沿x轴投影晶胞中所有Na原子的分布图。
图1 图2
每个Na周围距离其最近的Na有 个;以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点的分数坐标为,则B点的分数坐标为 ;设为阿伏加德罗常数的值,的摩尔质量为M ,晶体的密度为,则A、C两原子间的距离为 pm(列出计算表达式)。
17.(12分)
工业上用磷铁渣(主要含FeP、,以及少量、等杂质)制备(磷酸铁)。
已知:难溶于水,能溶于无机强酸。
(1)“浸取”时磷铁渣粉碎并搅拌目的是 ;加入硫酸的目的是 。
(2)“浸取”时发生反应的离子方程式为 。
(3)滤渣的主要成分是 ,制备操作中需要适当加热,但温度不宜过高的原因是
。
(4)“制备”过程中溶液的pH对磷酸铁产品中铁和磷的含量及比值的影响如图所示[考虑到微量金属杂质,在pH=1时,为0.973最接近理论值。]
在pH范围为1~1.5时,随pH增大,明显增大,其原因是 。
(5)工业上也可以用电解磷铁渣的方法制备。
①FeP在阳极放电的电极反应式为 。
②常温电解一段时间,测得溶液中浓度约为0.32,为了避免生成沉淀,应控制溶液的pH不大于 (已知:,)。
18.(12分)
乙酸硅是白色至米色晶体。某校同学设计实验先制备,再由与乙酸酐反应制备乙酸硅。已知部分物质性质如表:
物质 化学式 熔点 沸点 性质
乙酸硅 110℃ 148℃ 白色至米色晶体
四氯化硅 -70℃ 57.6℃ 极易水解
乙酸酐 -73℃ 140℃
回答下列问题:
Ⅰ.制备装置(部分夹持仪器已省略)如图:
(1)装置D中发生的是置换反应,其化学方程式为 。
(2)装置E用冰水浴的目的是 。
(3)上述设计的装置有一处明显不妥,改进的方法是 。
Ⅱ.制备的反应装置如图所示。
(4)仪器①的名称是 ,图中装置组装完毕后,首先进行的操作是 。
(5)取255g 放入仪器①中,在电磁搅拌下,由分液漏斗滴入稍过量的乙酸酐,关闭旋塞⑥,反应为放热反应,反应后反应混合物带色,不久仪器①底部析出大颗粒晶体。该过程中,玻璃管③的管口必须保持在液面上方的原因是 。
(6)待放置一段时间,用干冰―丙酮冷冻剂冷却,然后将③的管口插入到液体中(或“插入到烧瓶底部"”),再慢慢打开旋塞,小心缓慢地除去仪器①中的残留液体,接着再分两次由分液漏斗各滴入75mL左右的乙酸酐,再缓慢除去,最后得到335g精制的四乙酸硅,则四乙酸硅的产率为 %(保留到小数点后一位)。
19.(12分)
2,5-二甲基苯乙酰氯(E)是合成划时代杀虫剂螺虫乙酯的重要中间体,根据2,5-二甲基苯乙酰氯的两条合成路线,回答下列问题。
已知:
①
②
路线一:
(1)A的系统命名法名称是 ;B中含氧官能团名称为 。
(2)X的分子式为,则X的结构简式为 ,B→C反应的化学方程式为 。
路线二:
(3)F中有 种化学环境的氢,G中碳原子的杂化方式有 种,F→G属于 (填反应类型)。
20.(12分)
甲醚是重要的有机合成原料,甲醇制备甲醚的反应: ;工业上常用或CO催化氢化法合成。回答下列问题:
(1)和在某催化剂表面合成: ﹐反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为 。已知(、随温度的变化不大),随温度的变化关系如图乙所示,图中表示该反应的直线是 (填代号)。
图甲 图乙
(2)CO催化加氢法合成,进而制备的过程中涉及如下反应:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
①在298K,101kPa时,CO(g)、(g)、(g)燃烧热分别为a 、b 、c ,则 。
②一定温度下,向2L恒容密闭容器中充入2mol CO(g)和4mol (g)制备(g),初始压强为Pa,5min达到平衡时CO(g)的转化率为70%,,且。则0~5min内, ;反应Ⅰ的平衡常数 (用表示);平衡后,保持温度和容器体积不变,向容器中再充入1mol (g)和2mol (g),重新达到平衡后,(g)的物质的量分数 (填“增大”、“减小”或“不变”)。
③工业生产中,需要在260℃、压强恒为4.0MPa的反应釜中进行上述反应。初始时向反应釜中加入0.01mol CO(g)和0.02mol (g),为确保反应的连续性,需向反应釜中以、进气流量0.03持续通入原料,同时控制出气流量为0.02,单位时间内CO(g)的转化率为60%,则流出气体中(g)的百分含量为 ;控制出气流量小于进气流量的原因为
。
滨州市2023-2024学年高三上学期开学摸底联考
化学-参考答案
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.B 2.C 3.B 4.C 5.D 6.A 7.C 8.D 9.A 10.D
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求全部选对得4分,选对但不全的得2分有选错的得0分。
11.AD 12.D 13.BD 14.AD 15.B
三、非选择题:本题共5小题,共60分。
16.(12分)
(1)cab 3
(2)> AD
(3)晶体硼为共价晶体,铝为金属晶体
(4)4 (,,)
17.(12分)
(1)增大接触面积,加速溶解 为了保持体系的酸度,防止生成FePO4
(2)3Fe2P+29H++11=6Fe3++11NO↑+3H3PO4+10H2O
(3)SiO2 温度过高,氨易挥发
(4)pH增大,促进促进Fe3+水解,生成了难溶性的氢氧化铁混入产品
(5)FeP+4H2O-8e-=FePO4+8H+ 1.7
18.(12分)
(1)SiC+2Cl2SiCl4+C
(2)冷凝SiCl4使其液化,减少挥发损失
(3)装置E、F之间需连接一个干燥装置
(4)三颈烧瓶 检验装置气密性
(5)防止结晶析出的四乙酸硅堵塞③的导气管口
(6)84.6
19.(12分)
(1)1,4-二甲苯酮羰基
(2)
(3)6 3 取代反应
20.(12分)
(1)CH2O*+OH*+3H*=CH3O*+OH*+2H*(或CH2O*+H*=CH3O*)c
(2)①a+2b-c
②0.14 增大
③5% 反应釜要求压强恒定,而反应Ⅰ为气体分子数减小的反应
同课章节目录
