化学人教版(2019)必修第一册2.1.1活泼的金属单质——钠 课件(共29张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.1活泼的金属单质——钠 课件(共29张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 41.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-06 19:39:52 | ||
图片预览








文档简介
(共29张PPT)
第一节 钠及其化合物
第二章 海水中的重要元素—钠和氯
第1课时:活泼的金属单质——钠
目 录
CONTENTS
01
钠的物理性质及结构
02
钠的化学性质
03
钠的制取及用途
学习目标
1.能从钠原子结构角度认识钠是一种活泼金属。
2.能用实验的方法探究钠与氧气、水的反应,能正确描述反应现象,会书写有关反应的化学方程式。
新课导入
海洋占地表表面积的71%,浩瀚的大海美丽且富饶。海洋是一个巨大的化学资源宝库,含有80多种元素,钠元素和氯元素是海水含量中较高的元素,也是典型的金属元素和非金属元素。
【课本P34实验2-1 】
用镊子取一小块钠,用滤纸吸干表明的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表明所发生的的变化。
现象:切口处可观察到银白色的金属光泽,在空气中很快变暗。
思考:以上实验,体现了金属钠哪些物理性质和化学性质?
实验探究
1
钠的物理性质及结构
结构
性质
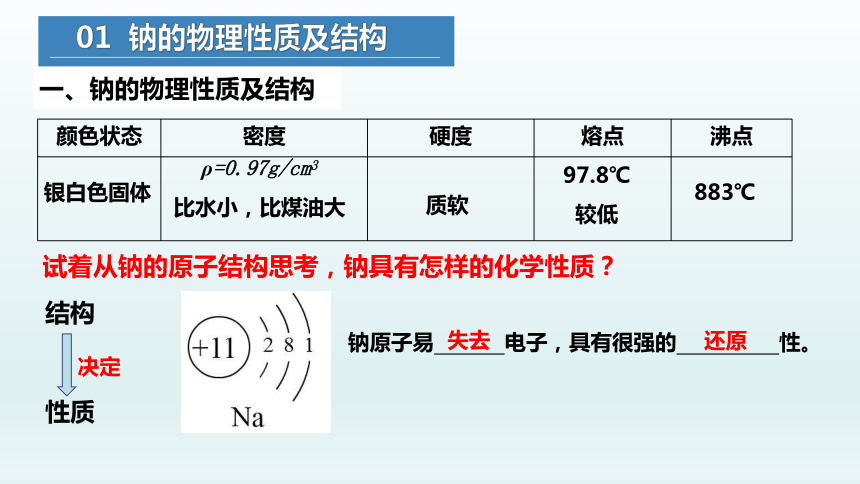
一、钠的物理性质及结构
质软
颜色状态 密度 硬度 熔点 沸点
银白色固体
ρ=0.97g/cm3
比水小,比煤油大
97.8℃
较低
883℃
钠原子易 电子,具有很强的 性。
失去
还原
决定
试着从钠的原子结构思考,钠具有怎样的化学性质?
01 钠的物理性质及结构
2
钠的化学性质
二、钠的化学性质
1.与非金属单质的反应
(1)与氧气的反应
常温下: 4Na + O2 === 2Na2O (新切开的钠光亮的表面很快变暗)
在实验室中,要把钠保存在石蜡油或煤油中以隔绝空气。
思考:如果加热,钠又会发生什么变化呢?
02 钠的化学性质
【实验2—2】将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
02 钠的化学性质
实验现象:钠先熔成一个闪亮的小球,随后燃烧,火焰呈黄色,生成淡黄色固体。
2Na + O2 == Na2O2
【实验2—2】将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
02 钠的化学性质
二、钠的化学性质
常温下: 4Na + O2 === 2Na2O (白色固体)
加热条件下: 2Na + O2 ==== Na2O2 (淡黄色固体 )
2Na + Cl2 ====2NaCl (黄色火焰,有白烟产生)
点燃
2Na + S ====Na2S (反应剧烈,有浓烟)
1.与非金属单质的反应
(1)与氧气的反应
(2)与Cl2、S 等非金属单质的反应
点燃
02 钠的化学性质
条件不同 产物不同
加热钠,伸入盛有氯气的集气瓶中
在研钵中加入金属钠和硫粉,用力研磨
02 钠的化学性质
白色粉末状物质
银白色金属
表面变暗
出现白色固体
表面变成溶液
形成白色块状物质
①
②
④
③
①4Na + O2 = 2Na2O
②Na2O + H2O = 2NaOH
④2NaOH + CO2 = Na2CO3+ H2O , Na2CO3+ 10H2O=Na2CO3 10H2O
⑤风化: Na2CO3 10H2O=Na2CO3+ 10H2O
③NaOH固体具有潮解性
O2
H2O
H2O
CO2 、H2O
风化
金属钠在空气中的变化过程
02 钠的化学性质
⑤最终
①
②
④
③
二、钠的化学性质
2.与水的反应
02 钠的化学性质
【P36实验探究】将绿豆大的钠放入含有酚酞的水中
金属钠和水的反应:
浮
游
熔
响
红
钠浮于水面
小球向四处游动
钠熔化成小球
发出嘶嘶响声
反应后的溶液遇酚酞变红
2Na + 2H2O = 2NaOH + H2 ↑
实 验 现 象
——金属钠的密度小于水
——反应放热,钠的熔点较低
——产生的气体推动金属钠来回游动
——与水剧烈反应,产生气体
——有碱性物质生成
02 钠的化学性质
思考2:金属钠引起的火灾,能不能用水直接浇灭?怎样灭火?
2Na + 2H2O == 2NaOH + H2
02 钠的化学性质
不能用水,也不能用泡沫灭火器;可用干燥的沙土盖灭。
思考1:实验中所取钠块一般如绿豆大小即可,能否取较大块的钠进行实验?
不能。因钠与水的反应放热,钠块较大会发生危险。
离子方程式:2Na + 2H2O == 2Na+ + OH- + H2
钠与水反应的实质:与水电离出的H+反应。
二、钠的化学性质
3.与酸的反应
02 钠的化学性质
(1)实验现象:剧烈反应,在水面快速游动并放出大量气体;
(2)离子方程式: 2Na + 2H+ = 2Na+ + H2↑
2 Na+2 HCl == 2NaCl+H2↑
(3)反应剧烈原因:反应本质是Na与溶液中的H+,由于HCl是强电解质,盐酸溶液中H+的数目大于纯水中的,故反应更加剧烈;
(4)若钠过量,先于酸反应 ,剩余的钠与水继续反应。
二、钠的化学性质
3.与酸的反应
02 钠的化学性质
先酸后水!
二、钠的化学性质
4.与盐溶液的反应
02 钠的化学性质
实验:在烧杯中加入约20mL的CuSO4溶液,将切好的钠投入到其中,观察现象。
浮、熔、游、响、蓝色沉淀
钠与盐溶液反应时,先与水反应,不能置换盐中的金属。
钠与CuSO4溶液反应现象:
2Na +2 H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
二、钠的化学性质
4.与盐溶液的反应
02 钠的化学性质
注意:一般活泼金属K、Ca、Na与盐溶液的反应,先考虑与水的反应,
再考虑与水反应的产物(碱)能否和该盐溶液发生复分解反应。
3
钠的制取及用途
英国化学家戴维坚持不懈地从事于利用电池分解各种物质的实验研究。1807年发现了金属钾,几天之后,他又从电解碳酸钠中获得了金属钠。
(汉弗里·戴维 1778-1829)
03 钠的制取及用途
三、钠的制取及用途
2.钠的用途:
03 钠的制取及用途
2NaCl(熔融)==== 2Na + Cl2
电解
(1)制备过氧化钠
(2)冶炼钛等贵重金属
(3)制高压钠灯
4Na+TiCl4(熔融)= 4NaCl+Ti
高压钠灯使用时发出黄色光,具有发光效率高、透雾能力强等优点,广泛应用于室外照明。
1.钠的制取
1.判断正误,正确的打“√”,错误的打“×”。
(1)钠与O2反应时条件不同,产物也不相同。( )
(2)等质量的钠无论生成氧化钠、过氧化钠还是它们的混合物,转移的电子数均相同。( )
(3)钠块可以直接用手取用。( )
(4)钠失火时不能用水扑灭,应该用干燥的沙土盖灭。( )
(5)钠与水反应的离子方程式为Na+H2O===Na++OH-+H2↑。( )
答案 (1)√ (2)√ (3)× (4)√ (5)×
03 对 点 训 练
2.取一小块金属钠,放在燃烧匙里加热,下列实验现象描述正确的是( )
①金属钠先熔化
②在空气中燃烧,发出黄色火花
③燃烧后得到白色固体
④燃烧时火焰为黄色
⑤燃烧后生成淡黄色固体物质
A.①② B.①②③ C.①④⑤ D.④⑤
C
C
03 对 点 训 练
3.将一块金属钠投入盛有冷水的滴有紫色石蕊溶液的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生
③反应后溶液变红
④钠熔化成闪亮的小球
⑤小球在水面上四处游动
⑥有“嘶嘶”的响声发出
A.①②③④ B.②③④⑤ C.②④⑤⑥ D.③④⑥
C
03 对 点 训 练
03 对 点 训 练
4.将少量金属钠分别投人下列物质的水溶液中,既有气体又有沉淀产生的是( )
A. BaCl2溶液 B. K2SO4溶液
C. FeCl3溶液 D. KNO3溶液
C
谢谢观赏
第一节 钠及其化合物
第二章 海水中的重要元素—钠和氯
第1课时:活泼的金属单质——钠
目 录
CONTENTS
01
钠的物理性质及结构
02
钠的化学性质
03
钠的制取及用途
学习目标
1.能从钠原子结构角度认识钠是一种活泼金属。
2.能用实验的方法探究钠与氧气、水的反应,能正确描述反应现象,会书写有关反应的化学方程式。
新课导入
海洋占地表表面积的71%,浩瀚的大海美丽且富饶。海洋是一个巨大的化学资源宝库,含有80多种元素,钠元素和氯元素是海水含量中较高的元素,也是典型的金属元素和非金属元素。
【课本P34实验2-1 】
用镊子取一小块钠,用滤纸吸干表明的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表明所发生的的变化。
现象:切口处可观察到银白色的金属光泽,在空气中很快变暗。
思考:以上实验,体现了金属钠哪些物理性质和化学性质?
实验探究
1
钠的物理性质及结构
结构
性质
一、钠的物理性质及结构
质软
颜色状态 密度 硬度 熔点 沸点
银白色固体
ρ=0.97g/cm3
比水小,比煤油大
97.8℃
较低
883℃
钠原子易 电子,具有很强的 性。
失去
还原
决定
试着从钠的原子结构思考,钠具有怎样的化学性质?
01 钠的物理性质及结构
2
钠的化学性质
二、钠的化学性质
1.与非金属单质的反应
(1)与氧气的反应
常温下: 4Na + O2 === 2Na2O (新切开的钠光亮的表面很快变暗)
在实验室中,要把钠保存在石蜡油或煤油中以隔绝空气。
思考:如果加热,钠又会发生什么变化呢?
02 钠的化学性质
【实验2—2】将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
02 钠的化学性质
实验现象:钠先熔成一个闪亮的小球,随后燃烧,火焰呈黄色,生成淡黄色固体。
2Na + O2 == Na2O2
【实验2—2】将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
02 钠的化学性质
二、钠的化学性质
常温下: 4Na + O2 === 2Na2O (白色固体)
加热条件下: 2Na + O2 ==== Na2O2 (淡黄色固体 )
2Na + Cl2 ====2NaCl (黄色火焰,有白烟产生)
点燃
2Na + S ====Na2S (反应剧烈,有浓烟)
1.与非金属单质的反应
(1)与氧气的反应
(2)与Cl2、S 等非金属单质的反应
点燃
02 钠的化学性质
条件不同 产物不同
加热钠,伸入盛有氯气的集气瓶中
在研钵中加入金属钠和硫粉,用力研磨
02 钠的化学性质
白色粉末状物质
银白色金属
表面变暗
出现白色固体
表面变成溶液
形成白色块状物质
①
②
④
③
①4Na + O2 = 2Na2O
②Na2O + H2O = 2NaOH
④2NaOH + CO2 = Na2CO3+ H2O , Na2CO3+ 10H2O=Na2CO3 10H2O
⑤风化: Na2CO3 10H2O=Na2CO3+ 10H2O
③NaOH固体具有潮解性
O2
H2O
H2O
CO2 、H2O
风化
金属钠在空气中的变化过程
02 钠的化学性质
⑤最终
①
②
④
③
二、钠的化学性质
2.与水的反应
02 钠的化学性质
【P36实验探究】将绿豆大的钠放入含有酚酞的水中
金属钠和水的反应:
浮
游
熔
响
红
钠浮于水面
小球向四处游动
钠熔化成小球
发出嘶嘶响声
反应后的溶液遇酚酞变红
2Na + 2H2O = 2NaOH + H2 ↑
实 验 现 象
——金属钠的密度小于水
——反应放热,钠的熔点较低
——产生的气体推动金属钠来回游动
——与水剧烈反应,产生气体
——有碱性物质生成
02 钠的化学性质
思考2:金属钠引起的火灾,能不能用水直接浇灭?怎样灭火?
2Na + 2H2O == 2NaOH + H2
02 钠的化学性质
不能用水,也不能用泡沫灭火器;可用干燥的沙土盖灭。
思考1:实验中所取钠块一般如绿豆大小即可,能否取较大块的钠进行实验?
不能。因钠与水的反应放热,钠块较大会发生危险。
离子方程式:2Na + 2H2O == 2Na+ + OH- + H2
钠与水反应的实质:与水电离出的H+反应。
二、钠的化学性质
3.与酸的反应
02 钠的化学性质
(1)实验现象:剧烈反应,在水面快速游动并放出大量气体;
(2)离子方程式: 2Na + 2H+ = 2Na+ + H2↑
2 Na+2 HCl == 2NaCl+H2↑
(3)反应剧烈原因:反应本质是Na与溶液中的H+,由于HCl是强电解质,盐酸溶液中H+的数目大于纯水中的,故反应更加剧烈;
(4)若钠过量,先于酸反应 ,剩余的钠与水继续反应。
二、钠的化学性质
3.与酸的反应
02 钠的化学性质
先酸后水!
二、钠的化学性质
4.与盐溶液的反应
02 钠的化学性质
实验:在烧杯中加入约20mL的CuSO4溶液,将切好的钠投入到其中,观察现象。
浮、熔、游、响、蓝色沉淀
钠与盐溶液反应时,先与水反应,不能置换盐中的金属。
钠与CuSO4溶液反应现象:
2Na +2 H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
二、钠的化学性质
4.与盐溶液的反应
02 钠的化学性质
注意:一般活泼金属K、Ca、Na与盐溶液的反应,先考虑与水的反应,
再考虑与水反应的产物(碱)能否和该盐溶液发生复分解反应。
3
钠的制取及用途
英国化学家戴维坚持不懈地从事于利用电池分解各种物质的实验研究。1807年发现了金属钾,几天之后,他又从电解碳酸钠中获得了金属钠。
(汉弗里·戴维 1778-1829)
03 钠的制取及用途
三、钠的制取及用途
2.钠的用途:
03 钠的制取及用途
2NaCl(熔融)==== 2Na + Cl2
电解
(1)制备过氧化钠
(2)冶炼钛等贵重金属
(3)制高压钠灯
4Na+TiCl4(熔融)= 4NaCl+Ti
高压钠灯使用时发出黄色光,具有发光效率高、透雾能力强等优点,广泛应用于室外照明。
1.钠的制取
1.判断正误,正确的打“√”,错误的打“×”。
(1)钠与O2反应时条件不同,产物也不相同。( )
(2)等质量的钠无论生成氧化钠、过氧化钠还是它们的混合物,转移的电子数均相同。( )
(3)钠块可以直接用手取用。( )
(4)钠失火时不能用水扑灭,应该用干燥的沙土盖灭。( )
(5)钠与水反应的离子方程式为Na+H2O===Na++OH-+H2↑。( )
答案 (1)√ (2)√ (3)× (4)√ (5)×
03 对 点 训 练
2.取一小块金属钠,放在燃烧匙里加热,下列实验现象描述正确的是( )
①金属钠先熔化
②在空气中燃烧,发出黄色火花
③燃烧后得到白色固体
④燃烧时火焰为黄色
⑤燃烧后生成淡黄色固体物质
A.①② B.①②③ C.①④⑤ D.④⑤
C
C
03 对 点 训 练
3.将一块金属钠投入盛有冷水的滴有紫色石蕊溶液的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生
③反应后溶液变红
④钠熔化成闪亮的小球
⑤小球在水面上四处游动
⑥有“嘶嘶”的响声发出
A.①②③④ B.②③④⑤ C.②④⑤⑥ D.③④⑥
C
03 对 点 训 练
03 对 点 训 练
4.将少量金属钠分别投人下列物质的水溶液中,既有气体又有沉淀产生的是( )
A. BaCl2溶液 B. K2SO4溶液
C. FeCl3溶液 D. KNO3溶液
C
谢谢观赏
