化学人教版(2019)必修第一册氢3.2.3氧化铝、铝盐 课件(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册氢3.2.3氧化铝、铝盐 课件(共24张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 39.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-06 19:58:56 | ||
图片预览






文档简介
(共24张PPT)
第三章 铁 金属材料
第二节 金属材料
课时3 氢氧化铝 铝盐
壹
贰
叁
氢氧化铝性质
铝盐的性质
氢氧化铝的制备
知识导航
本节重点
本节难点
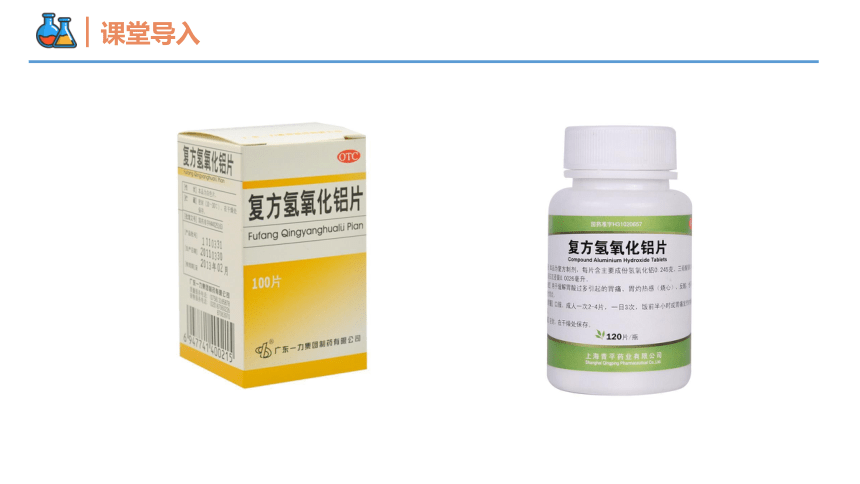
课堂导入
探究课堂
氢氧化铝的物理性质
白色胶状不溶于水的固体,有较强的吸附性。
1. 氢氧化铝胶体有较强吸附性,可用于净水。
氢氧化铝的用途
探究课堂
十二水硫酸铝钾是一种无机物,又称明矾,化学式为KAl(SO4)2·12H2O,是一种含有结晶水的硫酸钾和硫酸铝的复盐。
明矾可溶于水,发生电离:KAl(SO4)2=K++Al3++2SO42-,电离出的Al3+在水中生成氢氧化铝胶体,可以和悬浮在水中的泥沙形成絮状不溶物沉降下来,生活中常用于净水。
生活中常用明矾来净水
探究课堂
2. 氢氧化铝碱性不强,可以用作胃酸中和剂。
推测:氢氧化铝的化学性质?
氢氧化铝的用途
氢氧化铝可与酸溶液反应生成盐和水
探究课堂
氢氧化铝的化学性质
探究课堂
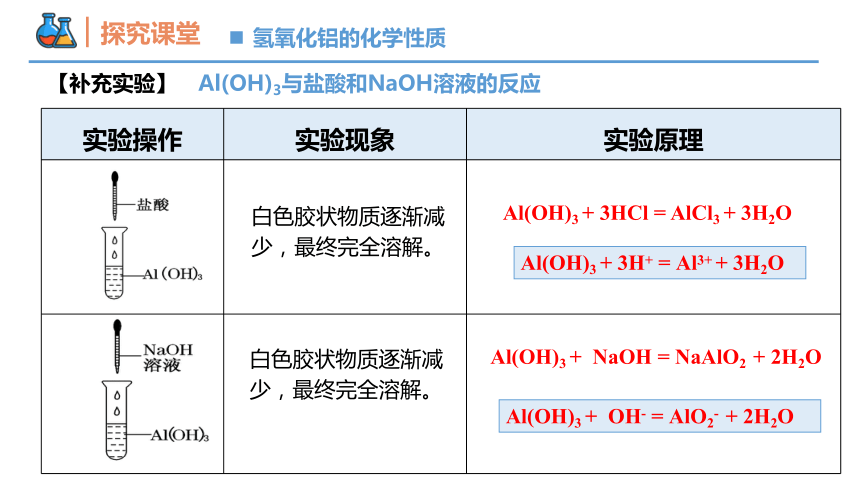
【补充实验】 Al(OH)3与盐酸和NaOH溶液的反应
实验操作 实验现象 实验原理
白色胶状物质逐渐减少,最终完全溶解。
白色胶状物质逐渐减少,最终完全溶解。
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
氢氧化铝的化学性质
Al(OH)3 + NaOH = NaAlO2 + 2H2O
探究课堂
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,
叫做两性氢氧化物。
碱式电离,与酸溶液反应生成盐和水
酸式电离,与碱溶液反应生成盐和水
氢氧化铝的化学性质
Al(OH)3
Al(OH)3可以发生两种电离:
H+ + AlO2- + H2O
Al3+ + 3OH-
探究课堂
氢氧化铝的化学性质
注意:Al(OH)3易溶于强酸、强碱,
不溶于弱酸(碳酸)弱碱(氨水)。
探究课堂
热稳定性
Al(OH)3不稳定,受热易分解:_________________________________。
氢氧化铝的化学性质
2Al(OH)3 3Al2O3+3H2O
探究课堂
【总结】铝、氧化铝、氢氧化铝与酸或碱的反应
1. 铝
2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2. 氧化铝(两性氧化物)
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+H2O
3. 氢氧化铝(两性氢氧化物)
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
探究课堂
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
铝盐与碱的反应
Al3+ + 3OH- = Al(OH)3↓
和氢氧化钠
和氨水
铝盐的化学性质
氢氧化铝可继续和氢氧化钠反应:
Al(OH)3 + OH- = AlO2- + 2H2O
探究课堂
偏铝酸盐的化学性质
H+ + AlO2- + H2O = Al(OH)3↓
AlO2- + CO2 + 2H2O = Al(OH)3↓ + HCO3-
和盐酸
和碳酸
偏铝酸盐与酸的反应
氢氧化铝可继续和盐酸反应:
Al(OH)3 + 3H+ = Al3+ + 3H2O
探究课堂
Al3+ + 3OH- = Al(OH)3↓
Al(OH)3 + OH- = AlO2- + 2H2O
Al3+ + 4OH- = AlO2- + 2H2O
H+ + AlO2- + H2O = Al(OH)3↓
Al(OH)3 + 3H+ = Al3+ + 3H2O
AlO2- + 4H+ = Al3+ + 2H2O
探究课堂
讨论:制备氢氧化铝你有哪些方法?酸或碱的选择应注意什么?
方法一:铝盐和弱碱反应。
方法二:偏铝酸盐和弱酸的反应
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
AlO2- + CO2 + 2H2O = Al(OH)3↓ + HCO3-
探究课堂
探究课堂
“铝三角”转化关系
探究课堂
阿尔兹海默病
记忆力下降,思维能力迟钝。
拓展延伸——铝对我们生活的影响
探究课堂
纯铝的硬度和强度较小,不适合制造机器零件等。
铝合金的性质及用途:
铝合金具有密度小、强度高、塑性好、易于成型、制造工艺简单、成本低廉等特点。
主要用于建筑业、容器制造、交通运输及电子行业。是制造飞机和宇宙飞船的理想材料。
铝合金
探究课堂
【例1】下列条件下最终能得到氢氧化铝的是( )
A. 将铝粉溶于冷水中
B. 氧化铝与水混合加热
C. 过量的氧化铝溶液加到一定量的氢氧化钠溶液中
D. 过量的氢氧化钠溶液加到一定量的氧化铝溶液中
C
课堂小结
氢氧化铝
物理性质
化学性质
制备
白色胶状不溶于水的固体,有较强的吸附性
用途
氢氧化铝胶体有较强吸附性,可用于净水
氢氧化铝碱性不强,可以用作胃酸中和剂
酸性:
碱性:
不稳定性:
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
2Al(OH)3 3Al2O3+3H2O
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
AlO2- + CO2 + 2H2O = Al(OH)3↓ + HCO3-
课堂小结
铝盐
铝盐
偏铝酸盐
和盐酸:
和碳酸:
和氢氧化钠:
和氨水:
少碱:Al3+ + 3OH- = Al(OH)3↓
过量碱:Al3+ + 4OH- = AlO2- + 2H2O
少酸:H+ + AlO2- + H2O = Al(OH)3↓
过量酸:AlO2- + 4H+ = Al3+ + 2H2O
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
AlO2- + CO2 + 2H2O = Al(OH)3↓ + HCO3-
谢谢观看
THANKS
第三章 铁 金属材料
第二节 金属材料
课时3 氢氧化铝 铝盐
壹
贰
叁
氢氧化铝性质
铝盐的性质
氢氧化铝的制备
知识导航
本节重点
本节难点
课堂导入
探究课堂
氢氧化铝的物理性质
白色胶状不溶于水的固体,有较强的吸附性。
1. 氢氧化铝胶体有较强吸附性,可用于净水。
氢氧化铝的用途
探究课堂
十二水硫酸铝钾是一种无机物,又称明矾,化学式为KAl(SO4)2·12H2O,是一种含有结晶水的硫酸钾和硫酸铝的复盐。
明矾可溶于水,发生电离:KAl(SO4)2=K++Al3++2SO42-,电离出的Al3+在水中生成氢氧化铝胶体,可以和悬浮在水中的泥沙形成絮状不溶物沉降下来,生活中常用于净水。
生活中常用明矾来净水
探究课堂
2. 氢氧化铝碱性不强,可以用作胃酸中和剂。
推测:氢氧化铝的化学性质?
氢氧化铝的用途
氢氧化铝可与酸溶液反应生成盐和水
探究课堂
氢氧化铝的化学性质
探究课堂
【补充实验】 Al(OH)3与盐酸和NaOH溶液的反应
实验操作 实验现象 实验原理
白色胶状物质逐渐减少,最终完全溶解。
白色胶状物质逐渐减少,最终完全溶解。
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
氢氧化铝的化学性质
Al(OH)3 + NaOH = NaAlO2 + 2H2O
探究课堂
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,
叫做两性氢氧化物。
碱式电离,与酸溶液反应生成盐和水
酸式电离,与碱溶液反应生成盐和水
氢氧化铝的化学性质
Al(OH)3
Al(OH)3可以发生两种电离:
H+ + AlO2- + H2O
Al3+ + 3OH-
探究课堂
氢氧化铝的化学性质
注意:Al(OH)3易溶于强酸、强碱,
不溶于弱酸(碳酸)弱碱(氨水)。
探究课堂
热稳定性
Al(OH)3不稳定,受热易分解:_________________________________。
氢氧化铝的化学性质
2Al(OH)3 3Al2O3+3H2O
探究课堂
【总结】铝、氧化铝、氢氧化铝与酸或碱的反应
1. 铝
2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2. 氧化铝(两性氧化物)
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+H2O
3. 氢氧化铝(两性氢氧化物)
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
探究课堂
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
铝盐与碱的反应
Al3+ + 3OH- = Al(OH)3↓
和氢氧化钠
和氨水
铝盐的化学性质
氢氧化铝可继续和氢氧化钠反应:
Al(OH)3 + OH- = AlO2- + 2H2O
探究课堂
偏铝酸盐的化学性质
H+ + AlO2- + H2O = Al(OH)3↓
AlO2- + CO2 + 2H2O = Al(OH)3↓ + HCO3-
和盐酸
和碳酸
偏铝酸盐与酸的反应
氢氧化铝可继续和盐酸反应:
Al(OH)3 + 3H+ = Al3+ + 3H2O
探究课堂
Al3+ + 3OH- = Al(OH)3↓
Al(OH)3 + OH- = AlO2- + 2H2O
Al3+ + 4OH- = AlO2- + 2H2O
H+ + AlO2- + H2O = Al(OH)3↓
Al(OH)3 + 3H+ = Al3+ + 3H2O
AlO2- + 4H+ = Al3+ + 2H2O
探究课堂
讨论:制备氢氧化铝你有哪些方法?酸或碱的选择应注意什么?
方法一:铝盐和弱碱反应。
方法二:偏铝酸盐和弱酸的反应
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
AlO2- + CO2 + 2H2O = Al(OH)3↓ + HCO3-
探究课堂
探究课堂
“铝三角”转化关系
探究课堂
阿尔兹海默病
记忆力下降,思维能力迟钝。
拓展延伸——铝对我们生活的影响
探究课堂
纯铝的硬度和强度较小,不适合制造机器零件等。
铝合金的性质及用途:
铝合金具有密度小、强度高、塑性好、易于成型、制造工艺简单、成本低廉等特点。
主要用于建筑业、容器制造、交通运输及电子行业。是制造飞机和宇宙飞船的理想材料。
铝合金
探究课堂
【例1】下列条件下最终能得到氢氧化铝的是( )
A. 将铝粉溶于冷水中
B. 氧化铝与水混合加热
C. 过量的氧化铝溶液加到一定量的氢氧化钠溶液中
D. 过量的氢氧化钠溶液加到一定量的氧化铝溶液中
C
课堂小结
氢氧化铝
物理性质
化学性质
制备
白色胶状不溶于水的固体,有较强的吸附性
用途
氢氧化铝胶体有较强吸附性,可用于净水
氢氧化铝碱性不强,可以用作胃酸中和剂
酸性:
碱性:
不稳定性:
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
2Al(OH)3 3Al2O3+3H2O
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
AlO2- + CO2 + 2H2O = Al(OH)3↓ + HCO3-
课堂小结
铝盐
铝盐
偏铝酸盐
和盐酸:
和碳酸:
和氢氧化钠:
和氨水:
少碱:Al3+ + 3OH- = Al(OH)3↓
过量碱:Al3+ + 4OH- = AlO2- + 2H2O
少酸:H+ + AlO2- + H2O = Al(OH)3↓
过量酸:AlO2- + 4H+ = Al3+ + 2H2O
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
AlO2- + CO2 + 2H2O = Al(OH)3↓ + HCO3-
谢谢观看
THANKS
