第二章 第二节 第3课时 浓度、压强对化学平衡的影响 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1
文档属性
| 名称 | 第二章 第二节 第3课时 浓度、压强对化学平衡的影响 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 703.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-06 22:57:14 | ||
图片预览




文档简介
第3课时 浓度、压强对化学平衡的影响
[核心素养发展目标]
1.从变化的角度认识化学平衡的移动,即可逆反应达到平衡后,浓度、压强改变,平衡将会发生移动而建立新的平衡。
2.从Q与K的关系及浓度、压强对可逆反应速率的影响,分析理解化学平衡的移动。
3.通过实验论证说明浓度、压强的改变对化学平衡移动的影响。
一、浓度对化学平衡的影响
1.实验探究浓度对化学平衡的影响
按表中实验操作步骤完成实验,观察实验现象,将有关实验现象及其结论填入表中:
实验原理 Fe3++3SCN-Fe(SCN)3 (浅黄色) (无色) (红色)
实验操作
现象与结论 b溶液颜色 ,平衡向 移动 c溶液颜色 ,平衡向 移动
理论解释 改变条件 发生反应:Fe+2Fe3+===3Fe2+,c(Fe3+)减小,即反应物浓度减小 c(SCN-)增大,即反应物浓度增大
从Q、K关系角度 Q= 增大,Q>K,平衡向逆反应方向移动 Q= 减小,Q<K,平衡向正反应方向移动
从v正、v逆关系角度 t1时刻,c(Fe3+)浓度减小,使v正′减小,而v逆′不变,则___________________,平衡向____________方向移动 t1时刻,c(SCN-)增大,使v正′增大,而v逆′不变,则__________,平衡向 方向移动
2.化学平衡的移动
(1)概念:在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着____,直至达到新的平衡状态。这种由________________达到____________的过程叫做化学平衡的移动。
(2)移动过程分析
①从Q、K关系角度
②从v正、v逆关系角度
(3)移动方向判断
当Q=K时,可逆反应处于________状态,v正________v逆;
当Q<K时,化学平衡向______________移动,v正________v逆,直至达到新的平衡状态;
当Q>K时,化学平衡向______________移动,v正________v逆,直至达到新的平衡状态。
3.浓度对化学平衡移动的规律总结
当其他条件不变时
(1)c(反应物)增大或c(生成物)减小,平衡向________方向移动。
(2)c(反应物)减小或c(生成物)增大,平衡向________方向移动。
4.工业生产应用
适当增大________的反应物的浓度,使化学平衡向________方向移动,可提高价格较高的原料的________,从而降低生产成本。
(1)合成氨反应中,增加N2的浓度,可使平衡正向移动,提高H2的转化率,降低成本( )
(2)C(s)+H2O(g)CO(g)+H2(g)在某温度下达到平衡后,增加一部分C(s),v正增大,平衡正向移动( )
(3)化学平衡向正反应方向移动,v逆一定比v正小( )
(4)反应混合物各组分百分含量发生改变,化学平衡一定发生了移动( )
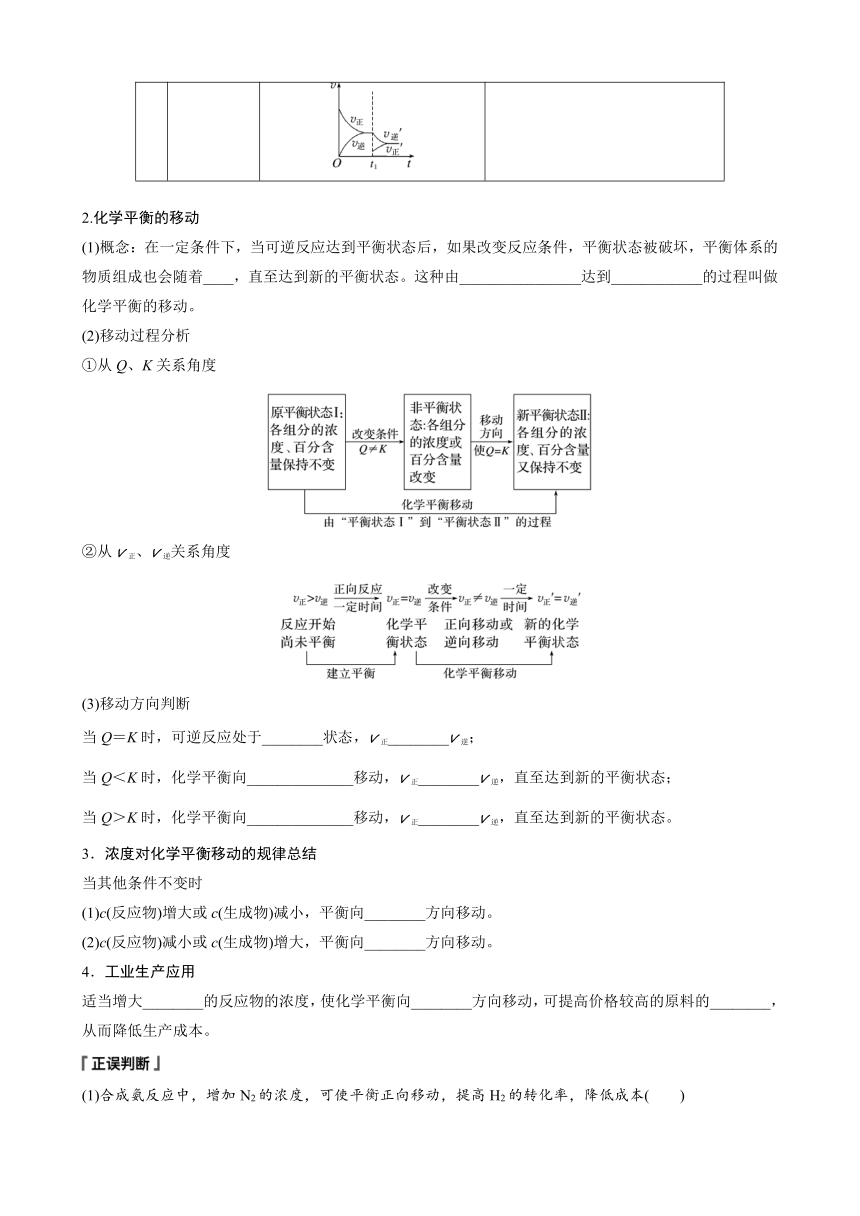
浓度对化学平衡影响的v-t图像分析
已知反应:mA(g)+nB(g)pC(g),当反应达到平衡后,有关物质的浓度发生改变,其反应速率的变化曲线分别如下图所示:
(1)t1时刻,增大反应物浓度,使v正′增大,而v逆′不变,则v正′>v逆′,平衡向正反应方向移动(如图1)。
(2)t1时刻,减小生成物浓度,使v逆′减小,而v正′不变,则v正′>v逆′,平衡向正反应方向移动(如图2)。
(3)t1时刻,增大生成物浓度,使v逆′增大,而v正′不变,则v逆′>v正′,平衡向逆反应方向移动(如图3)。
(4)t1时刻,减小反应物浓度,使v正′减小,而v逆′不变,则v逆′>v正′,平衡向逆反应方向移动(如图4)。
1.检验Fe3+的存在,可向溶液中加入KSCN溶液,发生反应如下:
FeCl3+3KSCN3KCl+Fe(SCN)3
(浅黄色)(无色) (无色) (红色)
能使该可逆反应发生平衡移动的是________(填序号,下同)。不能使平衡发生移动的是________________________________________________________________________,
原因是________________________________________________________________________
________________________________________________________________________。
①加入KCl固体 ②加入Fe粉 ③加入FeCl3固体
2.常温下,水溶液中的反应Fe3++SCN-Fe(SCN)2+达到平衡时,c(SCN-)=0.10 mol·L-1,c(Fe3+)=0.04 mol·L-1,c[Fe(SCN)2+]=0.68 mol·L-1。思考下列问题:
(1)该反应的平衡常数K为______________。
(2)加水稀释至原溶液体积的2倍,平衡将向__________(填“正”或“逆”)反应方向移动。
反应物的转化率及生成物的含量分析
(1)反应物的转化率
①按计量数之比投料,各反应物转化率相等。
②若增大一种反应物浓度,可以增大另一反应物的转化率,而其本身的转化率减小。
(2)生成物的含量
在一定的温度和压强下,若反应物投料比等于化学计量数之比时,生成物的含量最高。
1.(2022·北京海淀区质检)将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后混合液呈红色,再将混合液分为5份,分别进行如下实验:
试管①:滴加4滴水,振荡
试管②:滴加4滴饱和FeCl3溶液,振荡
试管③:滴加4滴1 mol·L-1 KCl溶液,振荡
试管④:滴加4滴1 mol·L-1 KSCN溶液,振荡
试管⑤:滴加4滴1 mol·L-1 NaOH溶液,振荡
下列说法不正确的是( )
A.对比试管①和②,为了证明增大反应物浓度,平衡正向移动
B.对比试管①和③,为了证明增大反应物浓度,平衡逆向移动
C.对比试管①和④,为了证明增大反应物浓度,平衡正向移动
D.对比试管①和⑤,为了证明减小反应物浓度,平衡逆向移动
2.在一定温度下,发生反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。改变起始时n(SO2)对反应的影响如图所示。下列说法正确的是( )
A.SO2的起始量越大,混合气体中SO3的体积分数越大
B.a、b、c三点中,a点时SO2的转化率最高
C.a、b、c三点的平衡常数:Kb>Kc>Ka
D.b、c点均为化学平衡点,a点未达到平衡且反应正向进行
二、压强对化学平衡的影响
1.实验探究压强对化学平衡的影响
按表中实验操作步骤完成实验,观察实验现象,将有关实验现象及其结论填入表中:
实验原理 容器容积减小,气体压强增大;容器容积增大,气体压强减小
2NO2(g)N2O4(g) (红棕色) (无色)
实验步骤
活塞Ⅱ处→Ⅰ处,压强增大 活塞Ⅰ处→Ⅱ处,压强减小
实验现象 混合气体的颜色先____后又逐渐____ 混合气体的颜色先____后又逐渐____
实验结论 活塞往里推,管内容积减小,c(NO2)增大,颜色变深,但颜色又变浅[即c(NO2)减小],推理得知,气体的压强____,平衡向__________方向移动 活塞往外拉,管内容积增大,c(NO2)减小,颜色变浅,但颜色又变深[即c(NO2)增大],推理得知,气体的压强______,平衡向______方向移动
2.压强对化学平衡的影响规律及解释
(1)对于有气体参加的可逆反应,当达到平衡时,在其他条件不变时
①增大压强(减小容器的容积),化学平衡向____________的方向移动。
②减小压强(增大容器的容积),化学平衡向____________的方向移动。
③对于反应后气体的总体积不变的可逆反应,改变压强,平衡__________。
(2)用Q、K关系分析压强对化学平衡的影响
对于有气体参加的可逆反应,在一定温度下,增大体系压强,各气体的浓度也同等倍数增大。对于反应mA(g)+nB(g)pC(g),
若m+n=p,增大压强,Q=K,化学平衡状态不变;
若m+nK,化学平衡向逆反应方向移动;
若m+n>p,增大压强,Q(3)用v-t图像分析压强对化学平衡的影响
ⅰ.对于反应mA(g)+nB(g)pC(g) m+nt1时刻,增大容器容积,压强________,v正′、v逆′均减小,缩体方向的v逆′减小幅度更大,则v正′______v逆′,平衡向________方向移动
t1时刻,缩小容器容积,压强______,v正′、v逆′均增大,缩体方向的v逆′增大幅度更大,则v逆′________v正′,平衡向________方向移动
ⅱ.对于反应mA(g)+nB(g)pC(g) m+n=p,当反应达到平衡后,其他条件不变,在t1时刻改变压强,图像如③所示:
t1时刻,若缩小容器容积,压强增大,v正′、v逆′均增大,且v正′=v逆′,平衡不移动,如图中上线
t1时刻,若增大容器容积,压强减小,v正′、v逆′均减小,且v正′=v逆′,平衡不移动,如图中下线
提醒 ①压强对平衡移动的影响:对于只涉及固体或液体的反应,压强的影响不予考虑。
②压强能否使化学平衡发生移动,要看压强改变是否使浓度发生改变,从而使v正′≠v逆′。
(1)有气体参与的反应,改变压强,平衡一定发生移动( )
(2)增大压强可使反应2SO2(g)+O2(g)2SO3(g)平衡正向移动,原因是增大压强,v正增大,v逆减小( )
(3)对于反应:2HI(g)H2(g)+I2(g),其他条件不变时,增大压强,体系的颜色加深,平衡正向移动( )
1.在一密闭容器中,反应aA(g)bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是________(填序号)。
①平衡向逆反应方向移动
②物质A的转化率减小
③物质B的质量分数增大
④a>b
2.已知化学反应2A(?)+B(g)2C(?)达到平衡,当增大压强时,平衡向逆反应方向移动,则下列物质的状态可能是A是_____________,C是___________________________。
3.在密闭容器中,反应:xA(g)+yB(g)zC(g),在一定条件下达到平衡状态,试回答下列问题:
(1)若x+y>z,缩小体积,增大压强,则平衡向________方向移动。
(2)若保持体积不变,通入氦气,则平衡________移动。
(3)若保持压强不变,通入氦气,平衡向正反应方向移动,则x、y、z的关系为________。
(4)若x+y=z,缩小体积,增大压强,则平衡____移动。
充入“惰性”气体对化学平衡的影响
1.已知反应:mA(s)+nB(g)pC(g) ΔH<0,在一定温度下,反应达到平衡时,B的体积分数φ(B)与压强变化的关系如图所示,下列叙述一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率 ③x点表示的反应速率比y点的小
④n>p
A.①② B.②④ C.②③ D.①③
2.一定条件下,某可逆反应在密闭容器中建立化学平衡,在t1时刻改变某一个条件,建立新的平衡,其v-t图像如下:
(1)对于反应:2SO2(g)+O2(g)2SO3(g),t1时刻缩小容器体积,其图像为________(填字母,下同),平衡________________(填“向正反应方向”“向逆反应方向”或“不”,下同)移动。
(2)对于反应:2NH3(g)N2(g)+3H2(g),t1时刻增大容器体积,其图像为________,平衡__________________移动。
(3)对于反应:H2(g)+I2(g)2HI(g),t1时刻缩小容器体积,其图像为_____,平衡_____移动。
压强改变的途径
(1)改变容器容积:在物质量不变的前提下,增大容器容积,相当于给反应体系减压,减小容器容积相当于给反应体系加压。
(2)同倍数改变气体物质的物质的量或浓度:恒温恒容时,若按起始投料比或反应过程中某时刻各气体物质的量(或浓度)之比充入气体物质,相当于给反应体系加压。
注意:题干中没有特殊说明时,压强的改变往往默认为改变容器的容积实现。
3.Ⅰ.在一定条件下,反应xA+yBzC达到平衡。
(1)若A、B、C都是气体,在增压后平衡向逆反应方向移动,则x、y、z之间的关系是________________________________________________________________________。
(2)若C是气体,且x+y=z,增大压强如果平衡发生移动,则A的转化率将________(填“增大”“减小”或“不变”)。
Ⅱ.(3)利用现代手持技术可以探究压强对2NO2(g)N2O4(g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,传感器测定出针筒内气体压强变化如图所示。
B、E两点对应的正反应速率大小为vB________(填“>”“<”或“=”)vE,E、F、G、H四点时对应气体的平均相对分子质量最大的点为______。
第3课时 浓度、压强对化学平衡的影响
[核心素养发展目标]
1.从变化的角度认识化学平衡的移动,即可逆反应达到平衡后,浓度、压强改变,平衡将会发生移动而建立新的平衡。
2.从Q与K的关系及浓度、压强对可逆反应速率的影响,分析理解化学平衡的移动。
3.通过实验论证说明浓度、压强的改变对化学平衡移动的影响。
一、浓度对化学平衡的影响
1.实验探究浓度对化学平衡的影响
按表中实验操作步骤完成实验,观察实验现象,将有关实验现象及其结论填入表中:
实验原理 Fe3++ 3SCN-Fe(SCN)3 (浅黄色) (无色) (红色)
实验操作
现象与结论 b溶液颜色变浅,平衡向逆反应方向移动 c溶液颜色变深,平衡向正反应方向移动
理论解释 改变条件 发生反应:Fe+2Fe3+===3Fe2+,c(Fe3+)减小,即反应物浓度减小 c(SCN-)增大,即反应物浓度增大
从Q、K关系角度 Q= 增大,Q>K,平衡向逆反应方向移动 Q= 减小,Q<K,平衡向正反应方向移动
从v正、v逆关系角度 t1时刻,c(Fe3+)浓度减小,使 v正′减小,而v逆′不变,则 v逆′>v正′,平衡向逆反应方向移动 t1时刻,c(SCN-)增大,使v正′增大,而v逆′不变,则v正′>v逆′,平衡向正反应方向移动
2.化学平衡的移动
(1)概念:在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着改变,直至达到新的平衡状态。这种由原有的平衡状态达到新的平衡状态的过程叫做化学平衡的移动。
(2)移动过程分析
①从Q、K关系角度
②从v正、v逆关系角度
(3)移动方向判断
当Q=K时,可逆反应处于平衡状态,v正=v逆;
当Q<K时,化学平衡向正反应方向移动,v正>v逆,直至达到新的平衡状态;
当Q>K时,化学平衡向逆反应方向移动,v正<v逆,直至达到新的平衡状态。
3.浓度对化学平衡移动的规律总结
当其他条件不变时
(1)c(反应物)增大或c(生成物)减小,平衡向正反应方向移动。
(2)c(反应物)减小或c(生成物)增大,平衡向逆反应方向移动。
4.工业生产应用
适当增大廉价的反应物的浓度,使化学平衡向正反应方向移动,可提高价格较高的原料的转化率,从而降低生产成本。
(1)合成氨反应中,增加N2的浓度,可使平衡正向移动,提高H2的转化率,降低成本( )
(2)C(s)+H2O(g)CO(g)+H2(g)在某温度下达到平衡后,增加一部分C(s),v正增大,平衡正向移动( )
(3)化学平衡向正反应方向移动,v逆一定比v正小( )
(4)反应混合物各组分百分含量发生改变,化学平衡一定发生了移动( )
答案 (1)√ (2)× (3)√ (4)√
浓度对化学平衡影响的v-t图像分析
已知反应:mA(g)+nB(g)pC(g),当反应达到平衡后,有关物质的浓度发生改变,其反应速率的变化曲线分别如下图所示:
(1)t1时刻,增大反应物浓度,使v正′增大,而v逆′不变,则v正′>v逆′,平衡向正反应方向移动(如图1)。
(2)t1时刻,减小生成物浓度,使v逆′减小,而v正′不变,则v正′>v逆′,平衡向正反应方向移动(如图2)。
(3)t1时刻,增大生成物浓度,使v逆′增大,而v正′不变,则v逆′>v正′,平衡向逆反应方向移动(如图3)。
(4)t1时刻,减小反应物浓度,使v正′减小,而v逆′不变,则v逆′>v正′,平衡向逆反应方向移动(如图4)。
1.检验Fe3+的存在,可向溶液中加入KSCN溶液,发生反应如下:
FeCl3+3KSCN3KCl+Fe(SCN)3
(浅黄色) (无色) (无色) (红色)
能使该可逆反应发生平衡移动的是________(填序号,下同)。不能使平衡发生移动的是________,原因是________________________________________________________________
_______________________________________________________________________________。
①加入KCl固体 ②加入Fe粉 ③加入FeCl3固体
答案 ②③ ① 该可逆反应的实质为Fe3++3SCN-Fe(SCN)3,加入KCl固体,只增加了c(K+)、c(Cl-),未改变c(Fe3+)、c(SCN-)、c[Fe(SCN)3],平衡不移动
2.常温下,水溶液中的反应Fe3++SCN-Fe(SCN)2+达到平衡时,c(SCN-)=0.10 mol·L-1,c(Fe3+)=0.04 mol·L-1,c[Fe(SCN)2+]=0.68 mol·L-1。思考下列问题:
(1)该反应的平衡常数K为______________。
(2)加水稀释至原溶液体积的2倍,平衡将向___________(填“正”或“逆”)反应方向移动。
答案 (1)1.7×102 (2)逆
解析 (1)该反应的平衡常数K===1.7×102。
(2)加水稀释至原溶液体积的2倍,各离子的浓度均为原浓度的,Q==3.4×102>K,平衡逆向移动。
反应物的转化率及生成物的含量分析
(1)反应物的转化率
①按计量数之比投料,各反应物转化率相等。
②若增大一种反应物浓度,可以增大另一反应物的转化率,而其本身的转化率减小。
(2)生成物的含量
在一定的温度和压强下,若反应物投料比等于化学计量数之比时,生成物的含量最高。
1.(2022·北京海淀区质检)将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后混合液呈红色,再将混合液分为5份,分别进行如下实验:
试管①:滴加4滴水,振荡
试管②:滴加4滴饱和FeCl3溶液,振荡
试管③:滴加4滴1 mol·L-1 KCl溶液,振荡
试管④:滴加4滴1 mol·L-1 KSCN溶液,振荡
试管⑤:滴加4滴1 mol·L-1 NaOH溶液,振荡
下列说法不正确的是( )
A.对比试管①和②,为了证明增大反应物浓度,平衡正向移动
B.对比试管①和③,为了证明增大反应物浓度,平衡逆向移动
C.对比试管①和④,为了证明增大反应物浓度,平衡正向移动
D.对比试管①和⑤,为了证明减小反应物浓度,平衡逆向移动
答案 B
解析 试管②与①对比,改变了Fe3+的浓度,A正确;FeCl3溶液和KSCN溶液反应的本质是Fe3++3SCN-Fe(SCN)3,改变钾离子或氯离子的浓度对平衡没有影响,B错误;试管④与①对比,改变了反应物SCN-的浓度,C正确;在原平衡体系中加入NaOH溶液,Fe3+与之反应生成Fe(OH)3沉淀,溶液中Fe3+的浓度减小,D正确。
2.在一定温度下,发生反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。改变起始时n(SO2)对反应的影响如图所示。下列说法正确的是( )
A.SO2的起始量越大,混合气体中SO3的体积分数越大
B.a、b、c三点中,a点时SO2的转化率最高
C.a、b、c三点的平衡常数:Kb>Kc>Ka
D.b、c点均为化学平衡点,a点未达到平衡且反应正向进行
答案 B
解析 由题图可知,O2的量一定,SO2的量越少,其转化率越高,故a点时SO2的转化率最高,B正确。
二、压强对化学平衡的影响
1.实验探究压强对化学平衡的影响
按表中实验操作步骤完成实验,观察实验现象,将有关实验现象及其结论填入表中:
实验原理 容器容积减小,气体压强增大;容器容积增大,气体压强减小
2NO2(g)N2O4(g) (红棕色) (无色)
实验步骤
活塞Ⅱ处→Ⅰ处,压强增大 活塞Ⅰ处→Ⅱ处,压强减小
实验现象 混合气体的颜色先变深后又逐渐变浅 混合气体的颜色先变浅后又逐渐变深
实验结论 活塞往里推,管内容积减小,c(NO2)增大,颜色变深,但颜色又变浅[即c(NO2)减小],推理得知,气体的压强增大,平衡向正反应方向移动 活塞往外拉,管内容积增大,c(NO2)减小,颜色变浅,但颜色又变深[即c(NO2)增大],推理得知,气体的压强减小,平衡向逆反应方向移动
2.压强对化学平衡的影响规律及解释
(1)对于有气体参加的可逆反应,当达到平衡时,在其他条件不变时
①增大压强(减小容器的容积),化学平衡向气体体积缩小的方向移动。
②减小压强(增大容器的容积),化学平衡向气体体积增大的方向移动。
③对于反应后气体的总体积不变的可逆反应,改变压强,平衡不移动。
(2)用Q、K关系分析压强对化学平衡的影响
对于有气体参加的可逆反应,在一定温度下,增大体系压强,各气体的浓度也同等倍数增大。对于反应mA(g)+nB(g)pC(g),
若m+n=p,增大压强,Q=K,化学平衡状态不变;
若m+nK,化学平衡向逆反应方向移动;
若m+n>p,增大压强,Q(3)用v-t图像分析压强对化学平衡的影响
ⅰ.对于反应mA(g)+nB(g)pC(g) m+nt1时刻,增大容器容积,压强减小,v正′、v逆′均减小,缩体方向的v逆′减小幅度更大,则v正′>v逆′,平衡向正反应方向移动
t1时刻,缩小容器容积,压强增大,v正′、v逆′均增大,缩体方向的v逆′增大幅度更大,则v逆′>v正′,平衡向逆反应方向移动
ⅱ.对于反应mA(g)+nB(g)pC(g) m+n=p,当反应达到平衡后,其他条件不变,在t1时刻改变压强,图像如③所示:
t1时刻,若缩小容器容积,压强增大,v正′、v逆′均增大,且v正′=v逆′,平衡不移动,如图中上线
t1时刻,若增大容器容积,压强减小,v正′、v逆′均减小,且v正′=v逆′,平衡不移动,如图中下线
提醒 ①压强对平衡移动的影响:对于只涉及固体或液体的反应,压强的影响不予考虑。
②压强能否使化学平衡发生移动,要看压强改变是否使浓度发生改变,从而使v正′≠v逆′。
(1)有气体参与的反应,改变压强,平衡一定发生移动( )
(2)增大压强可使反应2SO2(g)+O2(g)2SO3(g)平衡正向移动,原因是增大压强,v正增大,v逆减小( )
(3)对于反应:2HI(g)H2(g)+I2(g),其他条件不变时,增大压强,体系的颜色加深,平衡正向移动( )
答案 (1)× (2)× (3)×
1.在一密闭容器中,反应aA(g)bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是________(填序号)。
①平衡向逆反应方向移动
②物质A的转化率减小
③物质B的质量分数增大
④a>b
答案 ①②④
2.已知化学反应2A(?)+B(g)2C(?)达到平衡,当增大压强时,平衡向逆反应方向移动,则下列物质的状态可能是A是_____________,C是___________________________。
答案 固体或液体 气体
解析 增大压强,平衡向逆反应方向移动,说明逆向为气体体积减小的反应,由于B为气体,所以C为气体,A为非气体。
3.在密闭容器中,反应:xA(g)+yB(g)zC(g),在一定条件下达到平衡状态,试回答下列问题:
(1)若x+y>z,缩小体积,增大压强,则平衡向________方向移动。
(2)若保持体积不变,通入氦气,则平衡________移动。
(3)若保持压强不变,通入氦气,平衡向正反应方向移动,则x、y、z的关系为________。
(4)若x+y=z,缩小体积,增大压强,则平衡____移动。
答案 (1)正反应 (2)不 (3)x+y<z (4)不
充入“惰性”气体对化学平衡的影响
1.已知反应:mA(s)+nB(g)pC(g) ΔH<0,在一定温度下,反应达到平衡时,B的体积分数φ(B)与压强变化的关系如图所示,下列叙述一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率 ③x点表示的反应速率比y点的小 ④n>p
A.①② B.②④ C.②③ D.①③
答案 C
解析 从题图的曲线变化特征可以看出,增大压强,B的体积分数增大,说明平衡向逆反应方向移动,A为固态,则有nv逆,故②正确;x点对应的压强小于y点,压强越大,反应速率越大,故x点比y点的反应速率小,故③正确。
2.一定条件下,某可逆反应在密闭容器中建立化学平衡,在t1时刻改变某一个条件,建立新的平衡,其v-t图像如下:
(1)对于反应:2SO2(g)+O2(g)2SO3(g),t1时刻缩小容器体积,其图像为________(填字母,下同),平衡________________(填“向正反应方向”“向逆反应方向”或“不”,下同)移动。
(2)对于反应:2NH3(g)N2(g)+3H2(g),t1时刻增大容器体积,其图像为________,平衡__________________移动。
(3)对于反应:H2(g)+I2(g)2HI(g),t1时刻缩小容器体积,其图像为________,平衡__________移动。
答案 (1)D 向正反应方向 (2)C 向正反应方向 (3)A 不
压强改变的途径
(1)改变容器容积:在物质量不变的前提下,增大容器容积,相当于给反应体系减压,减小容器容积相当于给反应体系加压。
(2)同倍数改变气体物质的物质的量或浓度:恒温恒容时,若按起始投料比或反应过程中某时刻各气体物质的量(或浓度)之比充入气体物质,相当于给反应体系加压。
注意:题干中没有特殊说明时,压强的改变往往默认为改变容器的容积实现。
3.Ⅰ.在一定条件下,反应xA+yBzC达到平衡。
(1)若A、B、C都是气体,在增压后平衡向逆反应方向移动,则x、y、z之间的关系是________。
(2)若C是气体,且x+y=z,增大压强如果平衡发生移动,则A的转化率将________(填“增大”“减小”或“不变”)。
Ⅱ.(3)利用现代手持技术可以探究压强对2NO2(g)N2O4(g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,传感器测定出针筒内气体压强变化如图所示。
B、E两点对应的正反应速率大小为vB________(填“>”“<”或“=”)vE,E、F、G、H四点时对应气体的平均相对分子质量最大的点为________。
答案 (1)x+y H
解析 (1)增压后平衡向逆反应方向移动,则说明产物气体分子数更多,则有x+yvE;E到F点压强迅速变大,则为容器体积减小,压强变大,平衡正向移动,总的物质的量减小,E、F、G、H四点中H对应物质的量最小,故对应气体的平均相对分子质量最大的点为H。
[核心素养发展目标]
1.从变化的角度认识化学平衡的移动,即可逆反应达到平衡后,浓度、压强改变,平衡将会发生移动而建立新的平衡。
2.从Q与K的关系及浓度、压强对可逆反应速率的影响,分析理解化学平衡的移动。
3.通过实验论证说明浓度、压强的改变对化学平衡移动的影响。
一、浓度对化学平衡的影响
1.实验探究浓度对化学平衡的影响
按表中实验操作步骤完成实验,观察实验现象,将有关实验现象及其结论填入表中:
实验原理 Fe3++3SCN-Fe(SCN)3 (浅黄色) (无色) (红色)
实验操作
现象与结论 b溶液颜色 ,平衡向 移动 c溶液颜色 ,平衡向 移动
理论解释 改变条件 发生反应:Fe+2Fe3+===3Fe2+,c(Fe3+)减小,即反应物浓度减小 c(SCN-)增大,即反应物浓度增大
从Q、K关系角度 Q= 增大,Q>K,平衡向逆反应方向移动 Q= 减小,Q<K,平衡向正反应方向移动
从v正、v逆关系角度 t1时刻,c(Fe3+)浓度减小,使v正′减小,而v逆′不变,则___________________,平衡向____________方向移动 t1时刻,c(SCN-)增大,使v正′增大,而v逆′不变,则__________,平衡向 方向移动
2.化学平衡的移动
(1)概念:在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着____,直至达到新的平衡状态。这种由________________达到____________的过程叫做化学平衡的移动。
(2)移动过程分析
①从Q、K关系角度
②从v正、v逆关系角度
(3)移动方向判断
当Q=K时,可逆反应处于________状态,v正________v逆;
当Q<K时,化学平衡向______________移动,v正________v逆,直至达到新的平衡状态;
当Q>K时,化学平衡向______________移动,v正________v逆,直至达到新的平衡状态。
3.浓度对化学平衡移动的规律总结
当其他条件不变时
(1)c(反应物)增大或c(生成物)减小,平衡向________方向移动。
(2)c(反应物)减小或c(生成物)增大,平衡向________方向移动。
4.工业生产应用
适当增大________的反应物的浓度,使化学平衡向________方向移动,可提高价格较高的原料的________,从而降低生产成本。
(1)合成氨反应中,增加N2的浓度,可使平衡正向移动,提高H2的转化率,降低成本( )
(2)C(s)+H2O(g)CO(g)+H2(g)在某温度下达到平衡后,增加一部分C(s),v正增大,平衡正向移动( )
(3)化学平衡向正反应方向移动,v逆一定比v正小( )
(4)反应混合物各组分百分含量发生改变,化学平衡一定发生了移动( )
浓度对化学平衡影响的v-t图像分析
已知反应:mA(g)+nB(g)pC(g),当反应达到平衡后,有关物质的浓度发生改变,其反应速率的变化曲线分别如下图所示:
(1)t1时刻,增大反应物浓度,使v正′增大,而v逆′不变,则v正′>v逆′,平衡向正反应方向移动(如图1)。
(2)t1时刻,减小生成物浓度,使v逆′减小,而v正′不变,则v正′>v逆′,平衡向正反应方向移动(如图2)。
(3)t1时刻,增大生成物浓度,使v逆′增大,而v正′不变,则v逆′>v正′,平衡向逆反应方向移动(如图3)。
(4)t1时刻,减小反应物浓度,使v正′减小,而v逆′不变,则v逆′>v正′,平衡向逆反应方向移动(如图4)。
1.检验Fe3+的存在,可向溶液中加入KSCN溶液,发生反应如下:
FeCl3+3KSCN3KCl+Fe(SCN)3
(浅黄色)(无色) (无色) (红色)
能使该可逆反应发生平衡移动的是________(填序号,下同)。不能使平衡发生移动的是________________________________________________________________________,
原因是________________________________________________________________________
________________________________________________________________________。
①加入KCl固体 ②加入Fe粉 ③加入FeCl3固体
2.常温下,水溶液中的反应Fe3++SCN-Fe(SCN)2+达到平衡时,c(SCN-)=0.10 mol·L-1,c(Fe3+)=0.04 mol·L-1,c[Fe(SCN)2+]=0.68 mol·L-1。思考下列问题:
(1)该反应的平衡常数K为______________。
(2)加水稀释至原溶液体积的2倍,平衡将向__________(填“正”或“逆”)反应方向移动。
反应物的转化率及生成物的含量分析
(1)反应物的转化率
①按计量数之比投料,各反应物转化率相等。
②若增大一种反应物浓度,可以增大另一反应物的转化率,而其本身的转化率减小。
(2)生成物的含量
在一定的温度和压强下,若反应物投料比等于化学计量数之比时,生成物的含量最高。
1.(2022·北京海淀区质检)将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后混合液呈红色,再将混合液分为5份,分别进行如下实验:
试管①:滴加4滴水,振荡
试管②:滴加4滴饱和FeCl3溶液,振荡
试管③:滴加4滴1 mol·L-1 KCl溶液,振荡
试管④:滴加4滴1 mol·L-1 KSCN溶液,振荡
试管⑤:滴加4滴1 mol·L-1 NaOH溶液,振荡
下列说法不正确的是( )
A.对比试管①和②,为了证明增大反应物浓度,平衡正向移动
B.对比试管①和③,为了证明增大反应物浓度,平衡逆向移动
C.对比试管①和④,为了证明增大反应物浓度,平衡正向移动
D.对比试管①和⑤,为了证明减小反应物浓度,平衡逆向移动
2.在一定温度下,发生反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。改变起始时n(SO2)对反应的影响如图所示。下列说法正确的是( )
A.SO2的起始量越大,混合气体中SO3的体积分数越大
B.a、b、c三点中,a点时SO2的转化率最高
C.a、b、c三点的平衡常数:Kb>Kc>Ka
D.b、c点均为化学平衡点,a点未达到平衡且反应正向进行
二、压强对化学平衡的影响
1.实验探究压强对化学平衡的影响
按表中实验操作步骤完成实验,观察实验现象,将有关实验现象及其结论填入表中:
实验原理 容器容积减小,气体压强增大;容器容积增大,气体压强减小
2NO2(g)N2O4(g) (红棕色) (无色)
实验步骤
活塞Ⅱ处→Ⅰ处,压强增大 活塞Ⅰ处→Ⅱ处,压强减小
实验现象 混合气体的颜色先____后又逐渐____ 混合气体的颜色先____后又逐渐____
实验结论 活塞往里推,管内容积减小,c(NO2)增大,颜色变深,但颜色又变浅[即c(NO2)减小],推理得知,气体的压强____,平衡向__________方向移动 活塞往外拉,管内容积增大,c(NO2)减小,颜色变浅,但颜色又变深[即c(NO2)增大],推理得知,气体的压强______,平衡向______方向移动
2.压强对化学平衡的影响规律及解释
(1)对于有气体参加的可逆反应,当达到平衡时,在其他条件不变时
①增大压强(减小容器的容积),化学平衡向____________的方向移动。
②减小压强(增大容器的容积),化学平衡向____________的方向移动。
③对于反应后气体的总体积不变的可逆反应,改变压强,平衡__________。
(2)用Q、K关系分析压强对化学平衡的影响
对于有气体参加的可逆反应,在一定温度下,增大体系压强,各气体的浓度也同等倍数增大。对于反应mA(g)+nB(g)pC(g),
若m+n=p,增大压强,Q=K,化学平衡状态不变;
若m+n
若m+n>p,增大压强,Q
ⅰ.对于反应mA(g)+nB(g)pC(g) m+n
t1时刻,缩小容器容积,压强______,v正′、v逆′均增大,缩体方向的v逆′增大幅度更大,则v逆′________v正′,平衡向________方向移动
ⅱ.对于反应mA(g)+nB(g)pC(g) m+n=p,当反应达到平衡后,其他条件不变,在t1时刻改变压强,图像如③所示:
t1时刻,若缩小容器容积,压强增大,v正′、v逆′均增大,且v正′=v逆′,平衡不移动,如图中上线
t1时刻,若增大容器容积,压强减小,v正′、v逆′均减小,且v正′=v逆′,平衡不移动,如图中下线
提醒 ①压强对平衡移动的影响:对于只涉及固体或液体的反应,压强的影响不予考虑。
②压强能否使化学平衡发生移动,要看压强改变是否使浓度发生改变,从而使v正′≠v逆′。
(1)有气体参与的反应,改变压强,平衡一定发生移动( )
(2)增大压强可使反应2SO2(g)+O2(g)2SO3(g)平衡正向移动,原因是增大压强,v正增大,v逆减小( )
(3)对于反应:2HI(g)H2(g)+I2(g),其他条件不变时,增大压强,体系的颜色加深,平衡正向移动( )
1.在一密闭容器中,反应aA(g)bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是________(填序号)。
①平衡向逆反应方向移动
②物质A的转化率减小
③物质B的质量分数增大
④a>b
2.已知化学反应2A(?)+B(g)2C(?)达到平衡,当增大压强时,平衡向逆反应方向移动,则下列物质的状态可能是A是_____________,C是___________________________。
3.在密闭容器中,反应:xA(g)+yB(g)zC(g),在一定条件下达到平衡状态,试回答下列问题:
(1)若x+y>z,缩小体积,增大压强,则平衡向________方向移动。
(2)若保持体积不变,通入氦气,则平衡________移动。
(3)若保持压强不变,通入氦气,平衡向正反应方向移动,则x、y、z的关系为________。
(4)若x+y=z,缩小体积,增大压强,则平衡____移动。
充入“惰性”气体对化学平衡的影响
1.已知反应:mA(s)+nB(g)pC(g) ΔH<0,在一定温度下,反应达到平衡时,B的体积分数φ(B)与压强变化的关系如图所示,下列叙述一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率 ③x点表示的反应速率比y点的小
④n>p
A.①② B.②④ C.②③ D.①③
2.一定条件下,某可逆反应在密闭容器中建立化学平衡,在t1时刻改变某一个条件,建立新的平衡,其v-t图像如下:
(1)对于反应:2SO2(g)+O2(g)2SO3(g),t1时刻缩小容器体积,其图像为________(填字母,下同),平衡________________(填“向正反应方向”“向逆反应方向”或“不”,下同)移动。
(2)对于反应:2NH3(g)N2(g)+3H2(g),t1时刻增大容器体积,其图像为________,平衡__________________移动。
(3)对于反应:H2(g)+I2(g)2HI(g),t1时刻缩小容器体积,其图像为_____,平衡_____移动。
压强改变的途径
(1)改变容器容积:在物质量不变的前提下,增大容器容积,相当于给反应体系减压,减小容器容积相当于给反应体系加压。
(2)同倍数改变气体物质的物质的量或浓度:恒温恒容时,若按起始投料比或反应过程中某时刻各气体物质的量(或浓度)之比充入气体物质,相当于给反应体系加压。
注意:题干中没有特殊说明时,压强的改变往往默认为改变容器的容积实现。
3.Ⅰ.在一定条件下,反应xA+yBzC达到平衡。
(1)若A、B、C都是气体,在增压后平衡向逆反应方向移动,则x、y、z之间的关系是________________________________________________________________________。
(2)若C是气体,且x+y=z,增大压强如果平衡发生移动,则A的转化率将________(填“增大”“减小”或“不变”)。
Ⅱ.(3)利用现代手持技术可以探究压强对2NO2(g)N2O4(g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,传感器测定出针筒内气体压强变化如图所示。
B、E两点对应的正反应速率大小为vB________(填“>”“<”或“=”)vE,E、F、G、H四点时对应气体的平均相对分子质量最大的点为______。
第3课时 浓度、压强对化学平衡的影响
[核心素养发展目标]
1.从变化的角度认识化学平衡的移动,即可逆反应达到平衡后,浓度、压强改变,平衡将会发生移动而建立新的平衡。
2.从Q与K的关系及浓度、压强对可逆反应速率的影响,分析理解化学平衡的移动。
3.通过实验论证说明浓度、压强的改变对化学平衡移动的影响。
一、浓度对化学平衡的影响
1.实验探究浓度对化学平衡的影响
按表中实验操作步骤完成实验,观察实验现象,将有关实验现象及其结论填入表中:
实验原理 Fe3++ 3SCN-Fe(SCN)3 (浅黄色) (无色) (红色)
实验操作
现象与结论 b溶液颜色变浅,平衡向逆反应方向移动 c溶液颜色变深,平衡向正反应方向移动
理论解释 改变条件 发生反应:Fe+2Fe3+===3Fe2+,c(Fe3+)减小,即反应物浓度减小 c(SCN-)增大,即反应物浓度增大
从Q、K关系角度 Q= 增大,Q>K,平衡向逆反应方向移动 Q= 减小,Q<K,平衡向正反应方向移动
从v正、v逆关系角度 t1时刻,c(Fe3+)浓度减小,使 v正′减小,而v逆′不变,则 v逆′>v正′,平衡向逆反应方向移动 t1时刻,c(SCN-)增大,使v正′增大,而v逆′不变,则v正′>v逆′,平衡向正反应方向移动
2.化学平衡的移动
(1)概念:在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着改变,直至达到新的平衡状态。这种由原有的平衡状态达到新的平衡状态的过程叫做化学平衡的移动。
(2)移动过程分析
①从Q、K关系角度
②从v正、v逆关系角度
(3)移动方向判断
当Q=K时,可逆反应处于平衡状态,v正=v逆;
当Q<K时,化学平衡向正反应方向移动,v正>v逆,直至达到新的平衡状态;
当Q>K时,化学平衡向逆反应方向移动,v正<v逆,直至达到新的平衡状态。
3.浓度对化学平衡移动的规律总结
当其他条件不变时
(1)c(反应物)增大或c(生成物)减小,平衡向正反应方向移动。
(2)c(反应物)减小或c(生成物)增大,平衡向逆反应方向移动。
4.工业生产应用
适当增大廉价的反应物的浓度,使化学平衡向正反应方向移动,可提高价格较高的原料的转化率,从而降低生产成本。
(1)合成氨反应中,增加N2的浓度,可使平衡正向移动,提高H2的转化率,降低成本( )
(2)C(s)+H2O(g)CO(g)+H2(g)在某温度下达到平衡后,增加一部分C(s),v正增大,平衡正向移动( )
(3)化学平衡向正反应方向移动,v逆一定比v正小( )
(4)反应混合物各组分百分含量发生改变,化学平衡一定发生了移动( )
答案 (1)√ (2)× (3)√ (4)√
浓度对化学平衡影响的v-t图像分析
已知反应:mA(g)+nB(g)pC(g),当反应达到平衡后,有关物质的浓度发生改变,其反应速率的变化曲线分别如下图所示:
(1)t1时刻,增大反应物浓度,使v正′增大,而v逆′不变,则v正′>v逆′,平衡向正反应方向移动(如图1)。
(2)t1时刻,减小生成物浓度,使v逆′减小,而v正′不变,则v正′>v逆′,平衡向正反应方向移动(如图2)。
(3)t1时刻,增大生成物浓度,使v逆′增大,而v正′不变,则v逆′>v正′,平衡向逆反应方向移动(如图3)。
(4)t1时刻,减小反应物浓度,使v正′减小,而v逆′不变,则v逆′>v正′,平衡向逆反应方向移动(如图4)。
1.检验Fe3+的存在,可向溶液中加入KSCN溶液,发生反应如下:
FeCl3+3KSCN3KCl+Fe(SCN)3
(浅黄色) (无色) (无色) (红色)
能使该可逆反应发生平衡移动的是________(填序号,下同)。不能使平衡发生移动的是________,原因是________________________________________________________________
_______________________________________________________________________________。
①加入KCl固体 ②加入Fe粉 ③加入FeCl3固体
答案 ②③ ① 该可逆反应的实质为Fe3++3SCN-Fe(SCN)3,加入KCl固体,只增加了c(K+)、c(Cl-),未改变c(Fe3+)、c(SCN-)、c[Fe(SCN)3],平衡不移动
2.常温下,水溶液中的反应Fe3++SCN-Fe(SCN)2+达到平衡时,c(SCN-)=0.10 mol·L-1,c(Fe3+)=0.04 mol·L-1,c[Fe(SCN)2+]=0.68 mol·L-1。思考下列问题:
(1)该反应的平衡常数K为______________。
(2)加水稀释至原溶液体积的2倍,平衡将向___________(填“正”或“逆”)反应方向移动。
答案 (1)1.7×102 (2)逆
解析 (1)该反应的平衡常数K===1.7×102。
(2)加水稀释至原溶液体积的2倍,各离子的浓度均为原浓度的,Q==3.4×102>K,平衡逆向移动。
反应物的转化率及生成物的含量分析
(1)反应物的转化率
①按计量数之比投料,各反应物转化率相等。
②若增大一种反应物浓度,可以增大另一反应物的转化率,而其本身的转化率减小。
(2)生成物的含量
在一定的温度和压强下,若反应物投料比等于化学计量数之比时,生成物的含量最高。
1.(2022·北京海淀区质检)将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后混合液呈红色,再将混合液分为5份,分别进行如下实验:
试管①:滴加4滴水,振荡
试管②:滴加4滴饱和FeCl3溶液,振荡
试管③:滴加4滴1 mol·L-1 KCl溶液,振荡
试管④:滴加4滴1 mol·L-1 KSCN溶液,振荡
试管⑤:滴加4滴1 mol·L-1 NaOH溶液,振荡
下列说法不正确的是( )
A.对比试管①和②,为了证明增大反应物浓度,平衡正向移动
B.对比试管①和③,为了证明增大反应物浓度,平衡逆向移动
C.对比试管①和④,为了证明增大反应物浓度,平衡正向移动
D.对比试管①和⑤,为了证明减小反应物浓度,平衡逆向移动
答案 B
解析 试管②与①对比,改变了Fe3+的浓度,A正确;FeCl3溶液和KSCN溶液反应的本质是Fe3++3SCN-Fe(SCN)3,改变钾离子或氯离子的浓度对平衡没有影响,B错误;试管④与①对比,改变了反应物SCN-的浓度,C正确;在原平衡体系中加入NaOH溶液,Fe3+与之反应生成Fe(OH)3沉淀,溶液中Fe3+的浓度减小,D正确。
2.在一定温度下,发生反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。改变起始时n(SO2)对反应的影响如图所示。下列说法正确的是( )
A.SO2的起始量越大,混合气体中SO3的体积分数越大
B.a、b、c三点中,a点时SO2的转化率最高
C.a、b、c三点的平衡常数:Kb>Kc>Ka
D.b、c点均为化学平衡点,a点未达到平衡且反应正向进行
答案 B
解析 由题图可知,O2的量一定,SO2的量越少,其转化率越高,故a点时SO2的转化率最高,B正确。
二、压强对化学平衡的影响
1.实验探究压强对化学平衡的影响
按表中实验操作步骤完成实验,观察实验现象,将有关实验现象及其结论填入表中:
实验原理 容器容积减小,气体压强增大;容器容积增大,气体压强减小
2NO2(g)N2O4(g) (红棕色) (无色)
实验步骤
活塞Ⅱ处→Ⅰ处,压强增大 活塞Ⅰ处→Ⅱ处,压强减小
实验现象 混合气体的颜色先变深后又逐渐变浅 混合气体的颜色先变浅后又逐渐变深
实验结论 活塞往里推,管内容积减小,c(NO2)增大,颜色变深,但颜色又变浅[即c(NO2)减小],推理得知,气体的压强增大,平衡向正反应方向移动 活塞往外拉,管内容积增大,c(NO2)减小,颜色变浅,但颜色又变深[即c(NO2)增大],推理得知,气体的压强减小,平衡向逆反应方向移动
2.压强对化学平衡的影响规律及解释
(1)对于有气体参加的可逆反应,当达到平衡时,在其他条件不变时
①增大压强(减小容器的容积),化学平衡向气体体积缩小的方向移动。
②减小压强(增大容器的容积),化学平衡向气体体积增大的方向移动。
③对于反应后气体的总体积不变的可逆反应,改变压强,平衡不移动。
(2)用Q、K关系分析压强对化学平衡的影响
对于有气体参加的可逆反应,在一定温度下,增大体系压强,各气体的浓度也同等倍数增大。对于反应mA(g)+nB(g)pC(g),
若m+n=p,增大压强,Q=K,化学平衡状态不变;
若m+n
若m+n>p,增大压强,Q
ⅰ.对于反应mA(g)+nB(g)pC(g) m+n
t1时刻,缩小容器容积,压强增大,v正′、v逆′均增大,缩体方向的v逆′增大幅度更大,则v逆′>v正′,平衡向逆反应方向移动
ⅱ.对于反应mA(g)+nB(g)pC(g) m+n=p,当反应达到平衡后,其他条件不变,在t1时刻改变压强,图像如③所示:
t1时刻,若缩小容器容积,压强增大,v正′、v逆′均增大,且v正′=v逆′,平衡不移动,如图中上线
t1时刻,若增大容器容积,压强减小,v正′、v逆′均减小,且v正′=v逆′,平衡不移动,如图中下线
提醒 ①压强对平衡移动的影响:对于只涉及固体或液体的反应,压强的影响不予考虑。
②压强能否使化学平衡发生移动,要看压强改变是否使浓度发生改变,从而使v正′≠v逆′。
(1)有气体参与的反应,改变压强,平衡一定发生移动( )
(2)增大压强可使反应2SO2(g)+O2(g)2SO3(g)平衡正向移动,原因是增大压强,v正增大,v逆减小( )
(3)对于反应:2HI(g)H2(g)+I2(g),其他条件不变时,增大压强,体系的颜色加深,平衡正向移动( )
答案 (1)× (2)× (3)×
1.在一密闭容器中,反应aA(g)bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是________(填序号)。
①平衡向逆反应方向移动
②物质A的转化率减小
③物质B的质量分数增大
④a>b
答案 ①②④
2.已知化学反应2A(?)+B(g)2C(?)达到平衡,当增大压强时,平衡向逆反应方向移动,则下列物质的状态可能是A是_____________,C是___________________________。
答案 固体或液体 气体
解析 增大压强,平衡向逆反应方向移动,说明逆向为气体体积减小的反应,由于B为气体,所以C为气体,A为非气体。
3.在密闭容器中,反应:xA(g)+yB(g)zC(g),在一定条件下达到平衡状态,试回答下列问题:
(1)若x+y>z,缩小体积,增大压强,则平衡向________方向移动。
(2)若保持体积不变,通入氦气,则平衡________移动。
(3)若保持压强不变,通入氦气,平衡向正反应方向移动,则x、y、z的关系为________。
(4)若x+y=z,缩小体积,增大压强,则平衡____移动。
答案 (1)正反应 (2)不 (3)x+y<z (4)不
充入“惰性”气体对化学平衡的影响
1.已知反应:mA(s)+nB(g)pC(g) ΔH<0,在一定温度下,反应达到平衡时,B的体积分数φ(B)与压强变化的关系如图所示,下列叙述一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率 ③x点表示的反应速率比y点的小 ④n>p
A.①② B.②④ C.②③ D.①③
答案 C
解析 从题图的曲线变化特征可以看出,增大压强,B的体积分数增大,说明平衡向逆反应方向移动,A为固态,则有n
2.一定条件下,某可逆反应在密闭容器中建立化学平衡,在t1时刻改变某一个条件,建立新的平衡,其v-t图像如下:
(1)对于反应:2SO2(g)+O2(g)2SO3(g),t1时刻缩小容器体积,其图像为________(填字母,下同),平衡________________(填“向正反应方向”“向逆反应方向”或“不”,下同)移动。
(2)对于反应:2NH3(g)N2(g)+3H2(g),t1时刻增大容器体积,其图像为________,平衡__________________移动。
(3)对于反应:H2(g)+I2(g)2HI(g),t1时刻缩小容器体积,其图像为________,平衡__________移动。
答案 (1)D 向正反应方向 (2)C 向正反应方向 (3)A 不
压强改变的途径
(1)改变容器容积:在物质量不变的前提下,增大容器容积,相当于给反应体系减压,减小容器容积相当于给反应体系加压。
(2)同倍数改变气体物质的物质的量或浓度:恒温恒容时,若按起始投料比或反应过程中某时刻各气体物质的量(或浓度)之比充入气体物质,相当于给反应体系加压。
注意:题干中没有特殊说明时,压强的改变往往默认为改变容器的容积实现。
3.Ⅰ.在一定条件下,反应xA+yBzC达到平衡。
(1)若A、B、C都是气体,在增压后平衡向逆反应方向移动,则x、y、z之间的关系是________。
(2)若C是气体,且x+y=z,增大压强如果平衡发生移动,则A的转化率将________(填“增大”“减小”或“不变”)。
Ⅱ.(3)利用现代手持技术可以探究压强对2NO2(g)N2O4(g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,传感器测定出针筒内气体压强变化如图所示。
B、E两点对应的正反应速率大小为vB________(填“>”“<”或“=”)vE,E、F、G、H四点时对应气体的平均相对分子质量最大的点为________。
答案 (1)x+y
解析 (1)增压后平衡向逆反应方向移动,则说明产物气体分子数更多,则有x+y
