2.2.6化学反应速率与平衡图像(1) 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1
文档属性
| 名称 | 2.2.6化学反应速率与平衡图像(1) 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 403.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-06 22:58:49 | ||
图片预览



文档简介
第6课时 化学反应速率与平衡图像(1)
[核心素养发展目标]
1.从变化的角度认识与时间相关的各类图像,分析时间变化时v、c、n、α、φ等物理量变化的原因。
2.通过对常见图像的分析,构建分析时间图像的思维模型。
一、单因素时间图像
1.坐标型图像分析思路
(1)找“重点”——起点、拐点、终点、交点、突变点等
借助“重点”中的有效信息,能够快速找到图像解题思路,突破图像分析难点。
(2)看变化——线的走向与斜率大小
①线的走向:随着横坐标自变量的增大,纵坐标因变量是变大、变小或不变。例如,当纵坐标表示的物理量是速率、物质的量浓度、物质的量、转化率、体积分数时,图像中出现一条水平直线,则该反应达到化学平衡状态。
②斜率大小:斜率是化学平衡图像曲线中一个重要的参数。图像中通常对比两条不同曲线的斜率,或者比较同一条曲线不同时刻的斜率变化来判断反应改变的外界条件。
(3)想规律——化学反应规律和化学平衡
结合影响化学反应速率的因素及勒夏特列原理,控制变量分析图像。
2.常见单因素时间图像分析
(1)反应过程中物质的量或浓度—时间图像
图像示例 方法指导
在2 L密闭容器中,某一反应有关物质A(g)、B(g)、C(g)的物质的量变化如图所示。 看坐标,定意义; 零起点,定投料; 线变化,定方向; 量变化,定计量。 注:n、c、v等变化量之比等于化学计量数之比
①横坐标表示反应过程中________的变化,纵坐标表示反应过程中物质的_________的变化; ②该反应的化学方程式是3A(g)+B(g)2C(g); ③在反应到达2 min时,正反应速率与逆反应速率之间的关系:________; ④若用A物质的量浓度的变化表示反应达到平衡(2 min)时的正反应速率是____________
(2)条件改变时速率—时间图像
图像示例 方法指导
对于反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,填写改变的条件及平衡移动的方向 看坐标,定意义; 零起点,定投料; 线变化,定条件; v高低,定移动。 注:改变浓度条件,图像一点保持连续;改变温度或压强,两点突变
①t1时,____________,平衡________移动; ②t2时,____________,平衡________移动; ③t3时,____________,平衡________移动; ④t4时,____________,平衡______移动
(3)条件改变时物质的量或浓度—时间图像
条件改变 图像示例 方法指导
减压(容器体积扩大到原来的2倍) N2(g)+3H2(g)2NH3(g) 当容器体积扩大到原来的n倍,反应体系中气态各物质的浓度均变为原来浓度的倍,所有线都出现“断点”
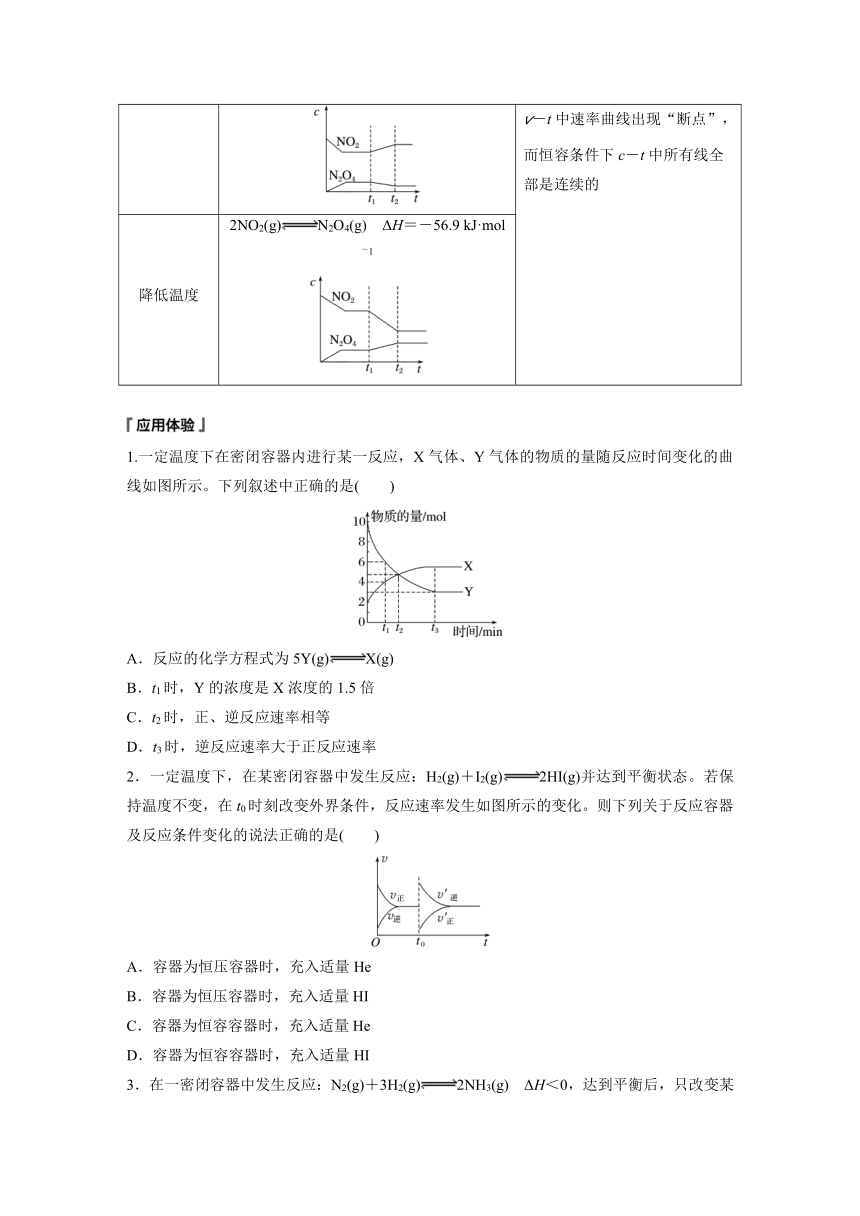
升高温度 2NO2(g)N2O4(g) ΔH=-56.9 kJ·mol-1 当反应体系中温度发生改变时,v-t中速率曲线出现“断点”,而恒容条件下c-t中所有线全部是连续的
降低温度 2NO2(g)N2O4(g) ΔH=-56.9 kJ·mol-1
1.一定温度下在密闭容器内进行某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示。下列叙述中正确的是( )
A.反应的化学方程式为5Y(g)X(g)
B.t1时,Y的浓度是X浓度的1.5倍
C.t2时,正、逆反应速率相等
D.t3时,逆反应速率大于正反应速率
2.一定温度下,在某密闭容器中发生反应:H2(g)+I2(g)2HI(g)并达到平衡状态。若保持温度不变,在t0时刻改变外界条件,反应速率发生如图所示的变化。则下列关于反应容器及反应条件变化的说法正确的是( )
A.容器为恒压容器时,充入适量He
B.容器为恒压容器时,充入适量HI
C.容器为恒容容器时,充入适量He
D.容器为恒容容器时,充入适量HI
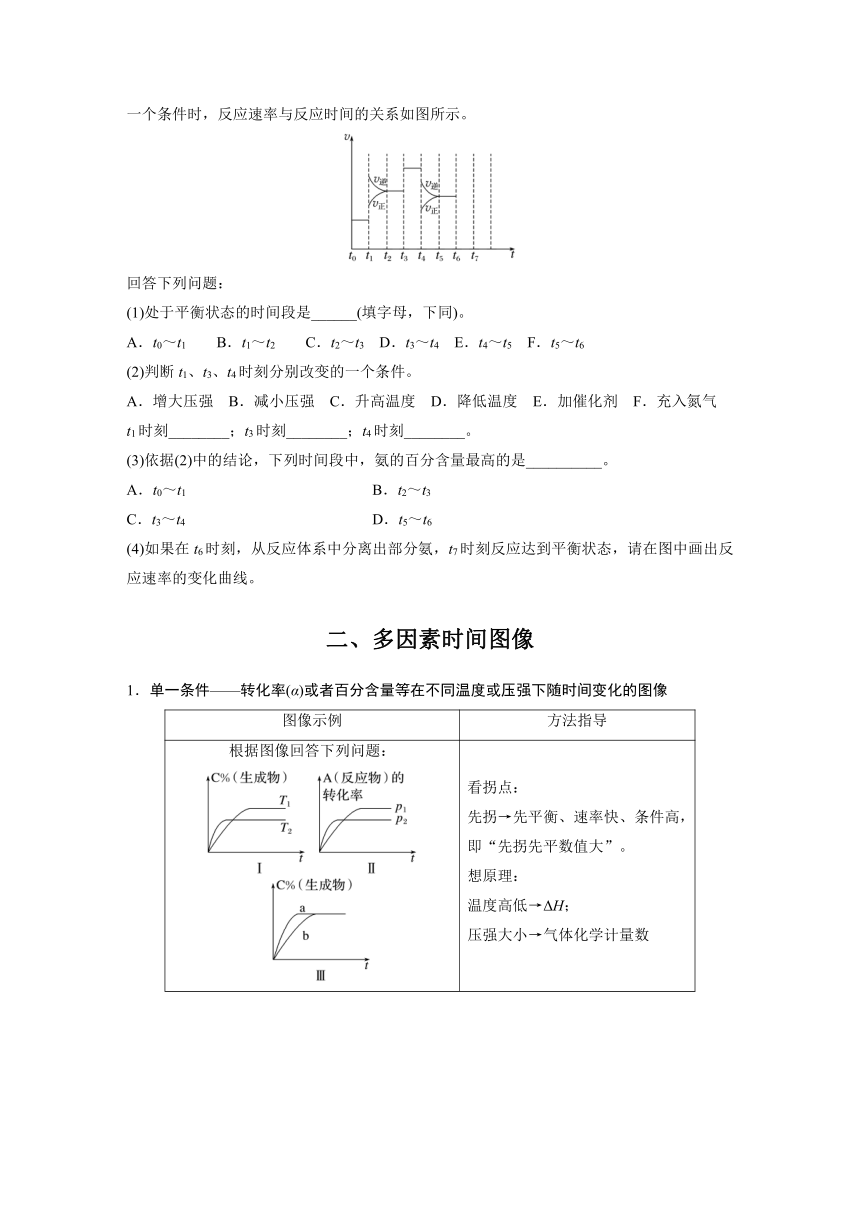
3.在一密闭容器中发生反应:N2(g)+3H2(g)2NH3(g) ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
回答下列问题:
(1)处于平衡状态的时间段是______(填字母,下同)。
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)判断t1、t3、t4时刻分别改变的一个条件。
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氮气
t1时刻________;t3时刻________;t4时刻________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__________。
A.t0~t1 B.t2~t3
C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
二、多因素时间图像
1.单一条件——转化率(α)或者百分含量等在不同温度或压强下随时间变化的图像
图像示例 方法指导
根据图像回答下列问题: 看拐点: 先拐→先平衡、速率快、条件高,即“先拐先平数值大”。 想原理: 温度高低→ΔH; 压强大小→气体化学计量数
(1)图Ⅰ表示T2________T1,正反应是______反应,温度升高,平衡逆向移动; (2)图Ⅱ表示p2________p1,压强增大,A的转化率减小,平衡逆向移动,说明正反应是气体总体积________的反应; (3)图Ⅲ中生成物C的百分含量不变,说明平衡不发生移动,但反应速率a________b,故a可能使用了________;也可能该反应是反应前后气体总体积不变的可逆反应,a________了压强(压缩体积)
2.多条件——转化率(α)或者百分含量等在不同温度或压强下随时间变化的图像
A(g)+B(g)xC(g)
图像中有三个量时“定一议二”,利用控制变量法、结合“先拐先平数值大”原则分析化学平衡图像:
T相同时比较p:p2 >p1,x=1
p相同时比较T:T2 >T1,正反应吸热
1.已知:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( )
2.已知某可逆反应mA(g)+nB(g)pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数φ(B)的关系曲线,由曲线分析,下列判断正确的是( )
A.T1<T2,p1>p2,m+n>p,放热反应
B.T1>T2,p1<p2,m+n>p,吸热反应
C.T1<T2,p1>p2,m+n<p,放热反应
D.T1>T2,p1<p2,m+n<p,吸热反应
3.在一定条件下,可逆反应A+BmC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器内加压的变化情况,请回答下列问题:
(1)温度T1________(填“大于”“等于”或“小于”)T2,正反应是________(填“吸热”或“放热”)反应。
(2)如果A、B、C均为气体,则m________(填“大于”“等于”或“小于”)2。
(3)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡________(填“向正反应方向”“向逆反应方向”或“不”,下同)移动;当温度和压强不变时,如向平衡体系中加入一定量的某稀有气体,平衡__________________________________________________________移动。
第6课时 化学反应速率与平衡图像(1)
[核心素养发展目标] 1.从变化的角度认识与时间相关的各类图像,分析时间变化时v、c、n、α、φ等物理量变化的原因。2.通过对常见图像的分析,构建分析时间图像的思维模型。
一、单因素时间图像
1.坐标型图像分析思路
(1)找“重点”——起点、拐点、终点、交点、突变点等
借助“重点”中的有效信息,能够快速找到图像解题思路,突破图像分析难点。
(2)看变化——线的走向与斜率大小
①线的走向:随着横坐标自变量的增大,纵坐标因变量是变大、变小或不变。例如,当纵坐标表示的物理量是速率、物质的量浓度、物质的量、转化率、体积分数时,图像中出现一条水平直线,则该反应达到化学平衡状态。
②斜率大小:斜率是化学平衡图像曲线中一个重要的参数。图像中通常对比两条不同曲线的斜率,或者比较同一条曲线不同时刻的斜率变化来判断反应改变的外界条件。
(3)想规律——化学反应规律和化学平衡
结合影响化学反应速率的因素及勒夏特列原理,控制变量分析图像。
2.常见单因素时间图像分析
(1)反应过程中物质的量或浓度—时间图像
图像示例 方法指导
在2 L密闭容器中,某一反应有关物质A(g)、B(g)、C(g)的物质的量变化如图所示。 看坐标,定意义; 零起点,定投料; 线变化,定方向; 量变化,定计量。 注:n、c、v等变化量之比等于化学计量数之比
①横坐标表示反应过程中时间的变化,纵坐标表示反应过程中物质的物质的量的变化; ②该反应的化学方程式是3A(g)+B(g)2C(g); ③在反应到达2 min时,正反应速率与逆反应速率之间的关系:相等; ④若用A物质的量浓度的变化表示反应达到平衡(2 min)时的正反应速率是0.15 mol· L-1·min-1
(2)条件改变时速率—时间图像
图像示例 方法指导
对于反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,填写改变的条件及平衡移动的方向 看坐标,定意义; 零起点,定投料; 线变化,定条件; v高低,定移动。 注:改变浓度条件,图像一点保持连续;改变温度或压强,两点突变
①t1时,增大反应物的浓度,平衡正向移动; ②t2时,降低温度,平衡正向移动; ③t3时,增大压强,平衡正向移动; ④t4时,使用催化剂,平衡不移动
(3)条件改变时物质的量或浓度—时间图像
条件改变 图像示例 方法指导
减压(容器体积扩大到原来的2倍) N2(g)+3H2(g)2NH3(g) 当容器体积扩大到原来的n倍,反应体系中气态各物质的浓度均变为原来浓度的倍,所有线都出现“断点”
升高温度 2NO2(g)N2O4(g) ΔH=-56.9 kJ·mol-1 当反应体系中温度发生改变时,v-t中速率曲线出现“断点”,而恒容条件下c-t中所有线全部是连续的
降低温度 2NO2(g)N2O4(g) ΔH=-56.9 kJ·mol-1
1.一定温度下在密闭容器内进行某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示。下列叙述中正确的是( )
A.反应的化学方程式为5Y(g)X(g)
B.t1时,Y的浓度是X浓度的1.5倍
C.t2时,正、逆反应速率相等
D.t3时,逆反应速率大于正反应速率
答案 B
2.一定温度下,在某密闭容器中发生反应:H2(g)+I2(g)2HI(g)并达到平衡状态。若保持温度不变,在t0时刻改变外界条件,反应速率发生如图所示的变化。则下列关于反应容器及反应条件变化的说法正确的是( )
A.容器为恒压容器时,充入适量He
B.容器为恒压容器时,充入适量HI
C.容器为恒容容器时,充入适量He
D.容器为恒容容器时,充入适量HI
答案 B
解析 恒容充入He,对反应气体的浓度没有影响,正、逆反应速率不变,C项错误;恒容充入HI,相当于增大压强,正、逆反应速率均增大,且对于该反应,增大压强平衡不会移动,与图像不符,D项错误;恒压充入He,相当于减小压强,正、逆反应速率都减小,且对于该反应,减小压强平衡不会移动,与图像不符,A项错误;恒压充入HI,体系的体积增大,H2和I2的浓度都变小,正反应速率减小而HI的浓度增大,逆反应速率增大,而且最终达到平衡时,与原平衡各物质的浓度完全一样,B项正确。
3.在一密闭容器中发生反应:N2(g)+3H2(g)2NH3(g) ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
回答下列问题:
(1)处于平衡状态的时间段是______(填字母,下同)。
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)判断t1、t3、t4时刻分别改变的一个条件。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻________;t3时刻________;t4时刻________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__________。
A.t0~t1 B.t2~t3
C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
答案 (1)ACDF (2)C E B (3)A
(4)
解析 (1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态。
(2)t1时,v正、v逆同时增大,且v逆增大得更多,平衡向逆反应方向移动,所以t1时改变的条件是升温。t3时,v正、v逆同时增大且增大量相同,平衡不移动,所以t3时改变的条件是加催化剂。t4时,v正、v逆同时减小,但平衡向逆反应方向移动,所以t4时改变的条件是减小压强。
(3)根据图示知,t1~t2、t4~t5时间段内平衡均向逆反应方向移动,NH3的含量均比t0~t1时间段的低,所以t0~t1时间段内NH3的百分含量最高。
(4)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达到平衡,据此可画出反应速率的变化曲线。
二、多因素时间图像
1.单一条件——转化率(α)或者百分含量等在不同温度或压强下随时间变化的图像
图像示例 方法指导
根据图像回答下列问题: 看拐点: 先拐→先平衡、速率快、条件高,即“先拐先平数值大”。 想原理: 温度高低→ΔH; 压强大小→气体化学计量数
(1)图Ⅰ表示T2>T1,正反应是放热反应,温度升高,平衡逆向移动; (2)图Ⅱ表示p2>p1,压强增大,A的转化率减小,平衡逆向移动,说明正反应是气体总体积增大的反应; (3)图Ⅲ中生成物C的百分含量不变,说明平衡不发生移动,但反应速率a>b,故a可能使用了催化剂;也可能该反应是反应前后气体总体积不变的可逆反应,a增大了压强(压缩体积)
2.多条件——转化率(α)或者百分含量等在不同温度或压强下随时间变化的图像
A(g)+B(g)xC(g)
图像中有三个量时“定一议二”,利用控制变量法、结合“先拐先平数值大”原则分析化学平衡图像:
T相同时比较p:p2 >p1,x=1
p相同时比较T:T2 >T1,正反应吸热
1.已知:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( )
答案 C
解析 因为正反应为放热反应,升高温度,反应速率加快,达到平衡所用时间减少,但是平衡向逆反应方向移动,NO的含量减小,A正确、C错误;增大压强,反应速率加快,达到平衡所用时间减少,正反应为气体体积增大的反应,增大压强,平衡向逆反应方向移动,NO的含量减小,B正确;催化剂对平衡没有影响,只是加快反应速率,缩短达到平衡所用的时间,D正确。
2.已知某可逆反应mA(g)+nB(g)pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数φ(B)的关系曲线,由曲线分析,下列判断正确的是( )
A.T1<T2,p1>p2,m+n>p,放热反应
B.T1>T2,p1<p2,m+n>p,吸热反应
C.T1<T2,p1>p2,m+n<p,放热反应
D.T1>T2,p1<p2,m+n<p,吸热反应
答案 D
解析 由“先拐先平数值大”原则,对比①②可知T1>T2,对比②③可知p2>p1;对比①②,温度由T2升高到T1,φ(B)减小,说明升温平衡向正反应方向移动,所以正向为吸热反应;对比②③,由p1加压到p2,φ(B)增大,说明加压平衡向逆反应方向移动,所以逆向为缩体反应,即m+n<p。
3.在一定条件下,可逆反应A+BmC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器内加压的变化情况,请回答下列问题:
(1)温度T1________(填“大于”“等于”或“小于”)T2,正反应是________(填“吸热”或“放热”)反应。
(2)如果A、B、C均为气体,则m________(填“大于”“等于”或“小于”)2。
(3)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡________(填“向正反应方向”“向逆反应方向”或“不”,下同)移动;当温度和压强不变时,如向平衡体系中加入一定量的某稀有气体,平衡________移动。
答案 (1)大于 放热 (2)大于 (3)增大 不 向正反应方向
解析 (1)由图像可知,T1>T2,温度升高,ω(C)降低,所以升温,平衡左移,正反应为放热反应。
(2)增大压强,ω(C)降低,平衡左移,正反应为气体体积增大的反应,m>2。
(3)当温度、容积不变时,充入稀有气体,由于各反应物、生成物的浓度不变,所以平衡不移动。当温度、压强不变时,充入稀有气体,体积增大,根据m>2,平衡向正反应方向移动。
[核心素养发展目标]
1.从变化的角度认识与时间相关的各类图像,分析时间变化时v、c、n、α、φ等物理量变化的原因。
2.通过对常见图像的分析,构建分析时间图像的思维模型。
一、单因素时间图像
1.坐标型图像分析思路
(1)找“重点”——起点、拐点、终点、交点、突变点等
借助“重点”中的有效信息,能够快速找到图像解题思路,突破图像分析难点。
(2)看变化——线的走向与斜率大小
①线的走向:随着横坐标自变量的增大,纵坐标因变量是变大、变小或不变。例如,当纵坐标表示的物理量是速率、物质的量浓度、物质的量、转化率、体积分数时,图像中出现一条水平直线,则该反应达到化学平衡状态。
②斜率大小:斜率是化学平衡图像曲线中一个重要的参数。图像中通常对比两条不同曲线的斜率,或者比较同一条曲线不同时刻的斜率变化来判断反应改变的外界条件。
(3)想规律——化学反应规律和化学平衡
结合影响化学反应速率的因素及勒夏特列原理,控制变量分析图像。
2.常见单因素时间图像分析
(1)反应过程中物质的量或浓度—时间图像
图像示例 方法指导
在2 L密闭容器中,某一反应有关物质A(g)、B(g)、C(g)的物质的量变化如图所示。 看坐标,定意义; 零起点,定投料; 线变化,定方向; 量变化,定计量。 注:n、c、v等变化量之比等于化学计量数之比
①横坐标表示反应过程中________的变化,纵坐标表示反应过程中物质的_________的变化; ②该反应的化学方程式是3A(g)+B(g)2C(g); ③在反应到达2 min时,正反应速率与逆反应速率之间的关系:________; ④若用A物质的量浓度的变化表示反应达到平衡(2 min)时的正反应速率是____________
(2)条件改变时速率—时间图像
图像示例 方法指导
对于反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,填写改变的条件及平衡移动的方向 看坐标,定意义; 零起点,定投料; 线变化,定条件; v高低,定移动。 注:改变浓度条件,图像一点保持连续;改变温度或压强,两点突变
①t1时,____________,平衡________移动; ②t2时,____________,平衡________移动; ③t3时,____________,平衡________移动; ④t4时,____________,平衡______移动
(3)条件改变时物质的量或浓度—时间图像
条件改变 图像示例 方法指导
减压(容器体积扩大到原来的2倍) N2(g)+3H2(g)2NH3(g) 当容器体积扩大到原来的n倍,反应体系中气态各物质的浓度均变为原来浓度的倍,所有线都出现“断点”
升高温度 2NO2(g)N2O4(g) ΔH=-56.9 kJ·mol-1 当反应体系中温度发生改变时,v-t中速率曲线出现“断点”,而恒容条件下c-t中所有线全部是连续的
降低温度 2NO2(g)N2O4(g) ΔH=-56.9 kJ·mol-1
1.一定温度下在密闭容器内进行某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示。下列叙述中正确的是( )
A.反应的化学方程式为5Y(g)X(g)
B.t1时,Y的浓度是X浓度的1.5倍
C.t2时,正、逆反应速率相等
D.t3时,逆反应速率大于正反应速率
2.一定温度下,在某密闭容器中发生反应:H2(g)+I2(g)2HI(g)并达到平衡状态。若保持温度不变,在t0时刻改变外界条件,反应速率发生如图所示的变化。则下列关于反应容器及反应条件变化的说法正确的是( )
A.容器为恒压容器时,充入适量He
B.容器为恒压容器时,充入适量HI
C.容器为恒容容器时,充入适量He
D.容器为恒容容器时,充入适量HI
3.在一密闭容器中发生反应:N2(g)+3H2(g)2NH3(g) ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
回答下列问题:
(1)处于平衡状态的时间段是______(填字母,下同)。
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)判断t1、t3、t4时刻分别改变的一个条件。
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氮气
t1时刻________;t3时刻________;t4时刻________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__________。
A.t0~t1 B.t2~t3
C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
二、多因素时间图像
1.单一条件——转化率(α)或者百分含量等在不同温度或压强下随时间变化的图像
图像示例 方法指导
根据图像回答下列问题: 看拐点: 先拐→先平衡、速率快、条件高,即“先拐先平数值大”。 想原理: 温度高低→ΔH; 压强大小→气体化学计量数
(1)图Ⅰ表示T2________T1,正反应是______反应,温度升高,平衡逆向移动; (2)图Ⅱ表示p2________p1,压强增大,A的转化率减小,平衡逆向移动,说明正反应是气体总体积________的反应; (3)图Ⅲ中生成物C的百分含量不变,说明平衡不发生移动,但反应速率a________b,故a可能使用了________;也可能该反应是反应前后气体总体积不变的可逆反应,a________了压强(压缩体积)
2.多条件——转化率(α)或者百分含量等在不同温度或压强下随时间变化的图像
A(g)+B(g)xC(g)
图像中有三个量时“定一议二”,利用控制变量法、结合“先拐先平数值大”原则分析化学平衡图像:
T相同时比较p:p2 >p1,x=1
p相同时比较T:T2 >T1,正反应吸热
1.已知:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( )
2.已知某可逆反应mA(g)+nB(g)pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数φ(B)的关系曲线,由曲线分析,下列判断正确的是( )
A.T1<T2,p1>p2,m+n>p,放热反应
B.T1>T2,p1<p2,m+n>p,吸热反应
C.T1<T2,p1>p2,m+n<p,放热反应
D.T1>T2,p1<p2,m+n<p,吸热反应
3.在一定条件下,可逆反应A+BmC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器内加压的变化情况,请回答下列问题:
(1)温度T1________(填“大于”“等于”或“小于”)T2,正反应是________(填“吸热”或“放热”)反应。
(2)如果A、B、C均为气体,则m________(填“大于”“等于”或“小于”)2。
(3)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡________(填“向正反应方向”“向逆反应方向”或“不”,下同)移动;当温度和压强不变时,如向平衡体系中加入一定量的某稀有气体,平衡__________________________________________________________移动。
第6课时 化学反应速率与平衡图像(1)
[核心素养发展目标] 1.从变化的角度认识与时间相关的各类图像,分析时间变化时v、c、n、α、φ等物理量变化的原因。2.通过对常见图像的分析,构建分析时间图像的思维模型。
一、单因素时间图像
1.坐标型图像分析思路
(1)找“重点”——起点、拐点、终点、交点、突变点等
借助“重点”中的有效信息,能够快速找到图像解题思路,突破图像分析难点。
(2)看变化——线的走向与斜率大小
①线的走向:随着横坐标自变量的增大,纵坐标因变量是变大、变小或不变。例如,当纵坐标表示的物理量是速率、物质的量浓度、物质的量、转化率、体积分数时,图像中出现一条水平直线,则该反应达到化学平衡状态。
②斜率大小:斜率是化学平衡图像曲线中一个重要的参数。图像中通常对比两条不同曲线的斜率,或者比较同一条曲线不同时刻的斜率变化来判断反应改变的外界条件。
(3)想规律——化学反应规律和化学平衡
结合影响化学反应速率的因素及勒夏特列原理,控制变量分析图像。
2.常见单因素时间图像分析
(1)反应过程中物质的量或浓度—时间图像
图像示例 方法指导
在2 L密闭容器中,某一反应有关物质A(g)、B(g)、C(g)的物质的量变化如图所示。 看坐标,定意义; 零起点,定投料; 线变化,定方向; 量变化,定计量。 注:n、c、v等变化量之比等于化学计量数之比
①横坐标表示反应过程中时间的变化,纵坐标表示反应过程中物质的物质的量的变化; ②该反应的化学方程式是3A(g)+B(g)2C(g); ③在反应到达2 min时,正反应速率与逆反应速率之间的关系:相等; ④若用A物质的量浓度的变化表示反应达到平衡(2 min)时的正反应速率是0.15 mol· L-1·min-1
(2)条件改变时速率—时间图像
图像示例 方法指导
对于反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,填写改变的条件及平衡移动的方向 看坐标,定意义; 零起点,定投料; 线变化,定条件; v高低,定移动。 注:改变浓度条件,图像一点保持连续;改变温度或压强,两点突变
①t1时,增大反应物的浓度,平衡正向移动; ②t2时,降低温度,平衡正向移动; ③t3时,增大压强,平衡正向移动; ④t4时,使用催化剂,平衡不移动
(3)条件改变时物质的量或浓度—时间图像
条件改变 图像示例 方法指导
减压(容器体积扩大到原来的2倍) N2(g)+3H2(g)2NH3(g) 当容器体积扩大到原来的n倍,反应体系中气态各物质的浓度均变为原来浓度的倍,所有线都出现“断点”
升高温度 2NO2(g)N2O4(g) ΔH=-56.9 kJ·mol-1 当反应体系中温度发生改变时,v-t中速率曲线出现“断点”,而恒容条件下c-t中所有线全部是连续的
降低温度 2NO2(g)N2O4(g) ΔH=-56.9 kJ·mol-1
1.一定温度下在密闭容器内进行某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示。下列叙述中正确的是( )
A.反应的化学方程式为5Y(g)X(g)
B.t1时,Y的浓度是X浓度的1.5倍
C.t2时,正、逆反应速率相等
D.t3时,逆反应速率大于正反应速率
答案 B
2.一定温度下,在某密闭容器中发生反应:H2(g)+I2(g)2HI(g)并达到平衡状态。若保持温度不变,在t0时刻改变外界条件,反应速率发生如图所示的变化。则下列关于反应容器及反应条件变化的说法正确的是( )
A.容器为恒压容器时,充入适量He
B.容器为恒压容器时,充入适量HI
C.容器为恒容容器时,充入适量He
D.容器为恒容容器时,充入适量HI
答案 B
解析 恒容充入He,对反应气体的浓度没有影响,正、逆反应速率不变,C项错误;恒容充入HI,相当于增大压强,正、逆反应速率均增大,且对于该反应,增大压强平衡不会移动,与图像不符,D项错误;恒压充入He,相当于减小压强,正、逆反应速率都减小,且对于该反应,减小压强平衡不会移动,与图像不符,A项错误;恒压充入HI,体系的体积增大,H2和I2的浓度都变小,正反应速率减小而HI的浓度增大,逆反应速率增大,而且最终达到平衡时,与原平衡各物质的浓度完全一样,B项正确。
3.在一密闭容器中发生反应:N2(g)+3H2(g)2NH3(g) ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
回答下列问题:
(1)处于平衡状态的时间段是______(填字母,下同)。
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)判断t1、t3、t4时刻分别改变的一个条件。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻________;t3时刻________;t4时刻________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__________。
A.t0~t1 B.t2~t3
C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
答案 (1)ACDF (2)C E B (3)A
(4)
解析 (1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态。
(2)t1时,v正、v逆同时增大,且v逆增大得更多,平衡向逆反应方向移动,所以t1时改变的条件是升温。t3时,v正、v逆同时增大且增大量相同,平衡不移动,所以t3时改变的条件是加催化剂。t4时,v正、v逆同时减小,但平衡向逆反应方向移动,所以t4时改变的条件是减小压强。
(3)根据图示知,t1~t2、t4~t5时间段内平衡均向逆反应方向移动,NH3的含量均比t0~t1时间段的低,所以t0~t1时间段内NH3的百分含量最高。
(4)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达到平衡,据此可画出反应速率的变化曲线。
二、多因素时间图像
1.单一条件——转化率(α)或者百分含量等在不同温度或压强下随时间变化的图像
图像示例 方法指导
根据图像回答下列问题: 看拐点: 先拐→先平衡、速率快、条件高,即“先拐先平数值大”。 想原理: 温度高低→ΔH; 压强大小→气体化学计量数
(1)图Ⅰ表示T2>T1,正反应是放热反应,温度升高,平衡逆向移动; (2)图Ⅱ表示p2>p1,压强增大,A的转化率减小,平衡逆向移动,说明正反应是气体总体积增大的反应; (3)图Ⅲ中生成物C的百分含量不变,说明平衡不发生移动,但反应速率a>b,故a可能使用了催化剂;也可能该反应是反应前后气体总体积不变的可逆反应,a增大了压强(压缩体积)
2.多条件——转化率(α)或者百分含量等在不同温度或压强下随时间变化的图像
A(g)+B(g)xC(g)
图像中有三个量时“定一议二”,利用控制变量法、结合“先拐先平数值大”原则分析化学平衡图像:
T相同时比较p:p2 >p1,x=1
p相同时比较T:T2 >T1,正反应吸热
1.已知:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( )
答案 C
解析 因为正反应为放热反应,升高温度,反应速率加快,达到平衡所用时间减少,但是平衡向逆反应方向移动,NO的含量减小,A正确、C错误;增大压强,反应速率加快,达到平衡所用时间减少,正反应为气体体积增大的反应,增大压强,平衡向逆反应方向移动,NO的含量减小,B正确;催化剂对平衡没有影响,只是加快反应速率,缩短达到平衡所用的时间,D正确。
2.已知某可逆反应mA(g)+nB(g)pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数φ(B)的关系曲线,由曲线分析,下列判断正确的是( )
A.T1<T2,p1>p2,m+n>p,放热反应
B.T1>T2,p1<p2,m+n>p,吸热反应
C.T1<T2,p1>p2,m+n<p,放热反应
D.T1>T2,p1<p2,m+n<p,吸热反应
答案 D
解析 由“先拐先平数值大”原则,对比①②可知T1>T2,对比②③可知p2>p1;对比①②,温度由T2升高到T1,φ(B)减小,说明升温平衡向正反应方向移动,所以正向为吸热反应;对比②③,由p1加压到p2,φ(B)增大,说明加压平衡向逆反应方向移动,所以逆向为缩体反应,即m+n<p。
3.在一定条件下,可逆反应A+BmC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器内加压的变化情况,请回答下列问题:
(1)温度T1________(填“大于”“等于”或“小于”)T2,正反应是________(填“吸热”或“放热”)反应。
(2)如果A、B、C均为气体,则m________(填“大于”“等于”或“小于”)2。
(3)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡________(填“向正反应方向”“向逆反应方向”或“不”,下同)移动;当温度和压强不变时,如向平衡体系中加入一定量的某稀有气体,平衡________移动。
答案 (1)大于 放热 (2)大于 (3)增大 不 向正反应方向
解析 (1)由图像可知,T1>T2,温度升高,ω(C)降低,所以升温,平衡左移,正反应为放热反应。
(2)增大压强,ω(C)降低,平衡左移,正反应为气体体积增大的反应,m>2。
(3)当温度、容积不变时,充入稀有气体,由于各反应物、生成物的浓度不变,所以平衡不移动。当温度、压强不变时,充入稀有气体,体积增大,根据m>2,平衡向正反应方向移动。
