第二章 第二节 第7课时 化学反应速率与平衡图像(2) 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1
文档属性
| 名称 | 第二章 第二节 第7课时 化学反应速率与平衡图像(2) 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 368.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-06 22:59:23 | ||
图片预览




文档简介
第7课时 化学反应速率与平衡图像(2)
[核心素养发展目标]
1.从变化的角度认识温度(压强)、起始投料等相关的图像,分析曲线与平衡移动的关系。
2.通过对图像的分析,构建分析图像的思维模型。
一、温度(压强)的相关图像
1.恒温(恒压)图像
在恒温(恒压)图像中,包括纵坐标、横坐标和曲线所表示的三个量。确定横坐标所表示的量,讨论纵坐标与曲线的关系,或者确定纵坐标所表示的量,讨论横坐标与曲线的关系,即“定一议二”。
(1)反应aA(g)+bB(g)cC(g)在不同温度下(T1①选一等温线(如T1),随着压强的增大,C%________,化学平衡________移动,a+b________c;
②作一等压线(如p3),温度升高,C%________,化学平衡________移动,正反应是________反应。
(2)反应aA(g)+bB(g)cC(g)在不同压强下,混合气体中C的含量(C%)与温度(T)的关系图像如图所示:
①选一等压线,随着温度的升高,C%______,化学平衡________移动,ΔH______0;
②作一等温线(如T1),随着压强的增大,C%________,化学平衡________移动,a+b______c。
2.速率—压强(或温度)图像
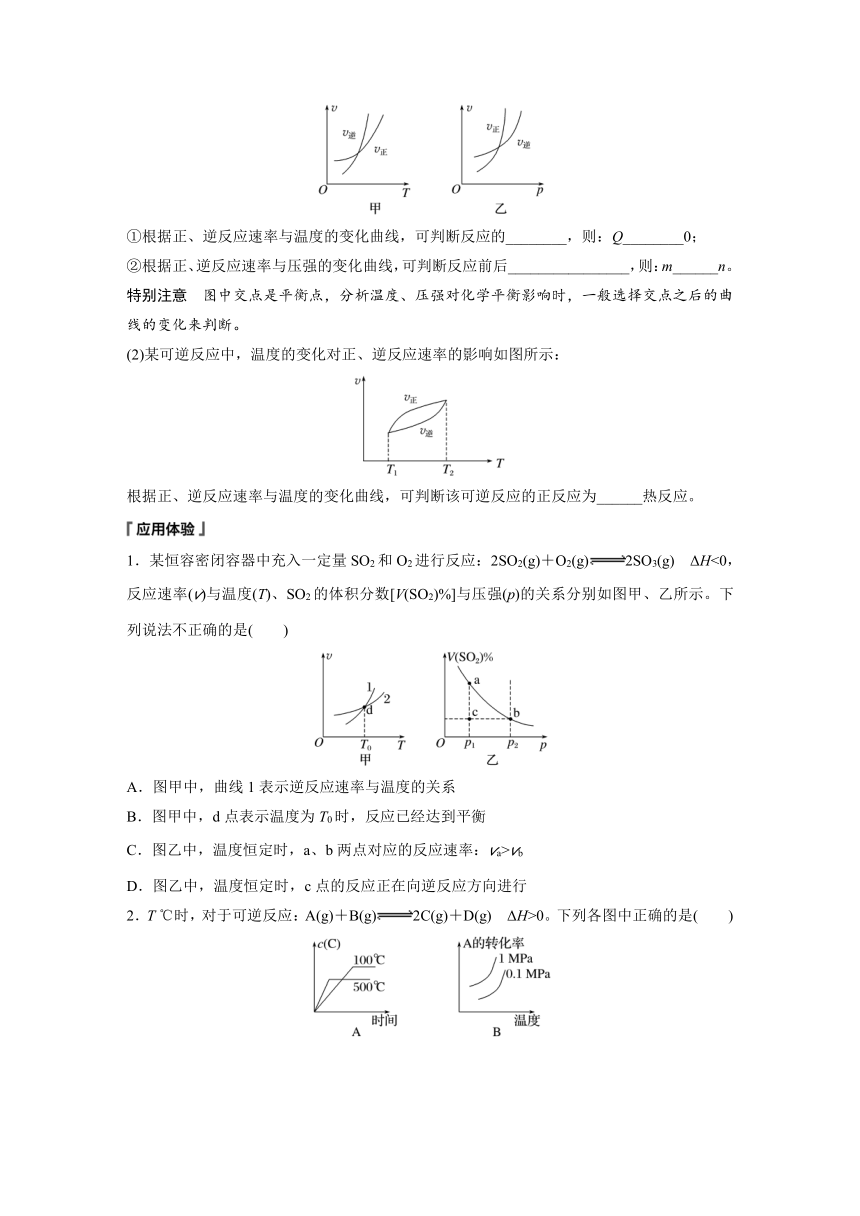
(1)可逆反应mA(g)nB(g)+pC(s) ΔH=Q kJ·mol-1,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图像:
①根据正、逆反应速率与温度的变化曲线,可判断反应的________,则:Q________0;
②根据正、逆反应速率与压强的变化曲线,可判断反应前后________________,则:m______n。
特别注意 图中交点是平衡点,分析温度、压强对化学平衡影响时,一般选择交点之后的曲线的变化来判断。
(2)某可逆反应中,温度的变化对正、逆反应速率的影响如图所示:
根据正、逆反应速率与温度的变化曲线,可判断该可逆反应的正反应为______热反应。
1.某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,反应速率(v)与温度(T)、SO2的体积分数[V(SO2)%]与压强(p)的关系分别如图甲、乙所示。下列说法不正确的是( )
A.图甲中,曲线1表示逆反应速率与温度的关系
B.图甲中,d点表示温度为T0时,反应已经达到平衡
C.图乙中,温度恒定时,a、b两点对应的反应速率:va>vb
D.图乙中,温度恒定时,c点的反应正在向逆反应方向进行
2.T ℃时,对于可逆反应:A(g)+B(g)2C(g)+D(g) ΔH>0。下列各图中正确的是( )
二、几种特殊图像
1.平衡曲线
序号 图像示例 方法指导
(1) 对于化学反应mA(g)+nB(g) pC(g)+qD(g),L线上所有的点都是平衡点(如图)。 平衡曲线上的任意一点均为该条件下达到平衡的点,线外点均未达到平衡。 若未达到平衡的点在该条件下达到平衡过程如图所示:
则:L线的左上方(E点),A%大于此压强时平衡体系的A%,E点v正 v逆; L线的右下方(F点),F点v正 v逆
(2) 如图所示曲线是其他条件不变时,某反应物的平衡转化率与温度的关系曲线如图所示: 若未达到平衡的点在该条件下达到平衡过程如图所示:
图中标出的1、2、3、4四个点,表示v正>v逆的是点 ,表示v正<v逆的是点 ,而点2、4表示v正 v逆
2.拋物线型
(1)对于反应aA(g)+bB(g)cC(g)+dD(g) ΔH<0。
①M点前,表示化学反应从反应开始到建立平衡的过程,则v正______v逆,M点为________,M点后为平衡受温度或压强的影响情况。
②方法指导
拋物线型图像顶(最低)点前未达到平衡,从顶(最低)点向后分析平衡移动情况。
注意 曲线上的每个点是否都达到平衡,往往需要通过曲线的升降或斜率变化来判断,如果未到达平衡则不能使用平衡移动原理,考虑速率变化对纵坐标量的影响,到达平衡以后的点使用平衡移动原理分析。
(2)投料平衡曲线
①反应物不止一种的可逆反应,如N2(g)+3H2(g)2NH3(g) ΔH<0,改变反应物的投料比,当反应物按照n(N2)∶n(H2)=1∶3投料时,NH3百分含量最大。
②方法指导
a.投料平衡曲线上的点均为平衡点。
b.投料比等于化学计量数之比时,生成物的含量最大。
注意 横坐标也可能是一种反应物的起始物质的量。
1.已知A(g)+B(g)2C(g),反应过程中C的百分含量与温度的关系如图所示,下列说法正确的是( )
A.正反应速率:v(c)>v(d)>v(b)
B.化学平衡常数:K(d)>K(c)
C.c点向d点变化时,v正D.d点状态加入合适的催化剂可使C%增大
2.如图为条件一定时,反应2NO+O22NO2+Q(Q>0)中NO的最大转化率与温度变化关系曲线图,图中有A、B、C、D、E五点,其中表示未达到平衡状态,且v正<v逆的点是( )
A.B和C B.A和E
C.E D.A和C
3.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
A.反应2NO(g)+O2(g)2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间不能提高NO的转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO的转化率
D.380 ℃下,c起始(O2)=5.0×10-4 mol·L-1,NO的平衡转化率为50%,则平衡常数K>2 000
4.温度为T1时,在1 L密闭容器中按照一定比例充入NO(g)和O2(g)。发生反应:2NO(g)+O2(g)2NO2(g)。达到平衡时NO2(g)的体积分数φ(NO2)随的变化如图所示,则A、B、C三点中NO的转化率最大的是________;当=2.3时,达到平衡时φ(NO2)可能是D、E、F三点中的________。
第7课时 化学反应速率与平衡图像(2)
[核心素养发展目标] 1.从变化的角度认识温度(压强)、起始投料等相关的图像,分析曲线与平衡移动的关系。2.通过对图像的分析,构建分析图像的思维模型。
一、温度(压强)的相关图像
1.恒温(恒压)图像
在恒温(恒压)图像中,包括纵坐标、横坐标和曲线所表示的三个量。确定横坐标所表示的量,讨论纵坐标与曲线的关系,或者确定纵坐标所表示的量,讨论横坐标与曲线的关系,即“定一议二”。
(1)反应aA(g)+bB(g)cC(g)在不同温度下(T1①选一等温线(如T1),随着压强的增大,C%减小,化学平衡逆向移动,a+b②作一等压线(如p3),温度升高,C%增大,化学平衡正向移动,正反应是吸热反应。
(2)反应aA(g)+bB(g)cC(g)在不同压强下,混合气体中C的含量(C%)与温度(T)的关系图像如图所示:
①选一等压线,随着温度的升高,C%减小,化学平衡逆向移动,ΔH <0;
②作一等温线(如T1),随着压强的增大,C%增大,化学平衡正向移动,a+b>c。
2.速率—压强(或温度)图像
(1)可逆反应mA(g)nB(g)+pC(s) ΔH=Q kJ·mol-1,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图像:
①根据正、逆反应速率与温度的变化曲线,可判断反应的ΔH,则:Q <0;
②根据正、逆反应速率与压强的变化曲线,可判断反应前后气体体积的变化,则:m >n。
特别注意 图中交点是平衡点,分析温度、压强对化学平衡影响时,一般选择交点之后的曲线的变化来判断。
(2)某可逆反应中,温度的变化对正、逆反应速率的影响如图所示:
根据正、逆反应速率与温度的变化曲线,可判断该可逆反应的正反应为吸热反应。
1.某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,反应速率(v)与温度(T)、SO2的体积分数[V(SO2)%]与压强(p)的关系分别如图甲、乙所示。下列说法不正确的是( )
A.图甲中,曲线1表示逆反应速率与温度的关系
B.图甲中,d点表示温度为T0时,反应已经达到平衡
C.图乙中,温度恒定时,a、b两点对应的反应速率:va>vb
D.图乙中,温度恒定时,c点的反应正在向逆反应方向进行
答案 C
解析 d点正、逆反应速率相等,反应处于平衡状态,平衡后温度升高,平衡向逆反应方向移动,故v逆>v正,曲线1表示逆反应速率;图乙中,b点时压强大,反应速率快,p1时达到平衡时SO2的体积分数大于c点时SO2的体积分数,所以c点的反应向生成SO2的方向进行。
2.T ℃时,对于可逆反应:A(g)+B(g)2C(g)+D(g) ΔH>0。下列各图中正确的是( )
答案 D
解析 升高温度平衡向正反应方向移动,C的浓度增大,A错误;升高温度平衡向正反应方向移动,A的转化率增大,增大压强平衡向逆反应方向移动,A的转化率降低,B错误;增大压强正、逆反应速率均增大,C错误;升高温度平衡向正反应方向移动,C的质量分数增大,增大压强平衡向逆反应方向移动,C的质量分数减小,D正确。
二、几种特殊图像
1.平衡曲线
序号 图像示例 方法指导
(1) 对于化学反应mA(g)+nB(g) pC(g)+qD(g),L线上所有的点都是平衡点(如图)。 平衡曲线上的任意一点均为该条件下达到平衡的点,线外点均未达到平衡。 若未达到平衡的点在该条件下达到平衡过程如图所示:
则:L线的左上方(E点),A%大于此压强时平衡体系的A%,E点v正>v逆; L线的右下方(F点),F点v正(2) 如图所示曲线是其他条件不变时,某反应物的平衡转化率与温度的关系曲线如图所示: 若未达到平衡的点在该条件下达到平衡过程如图所示:
图中标出的1、2、3、4四个点,表示v正>v逆的是点3,表示v正<v逆的是点1,而点2、4表示v正=v逆
2.拋物线型
(1)对于反应aA(g)+bB(g)cC(g)+dD(g) ΔH<0。
①M点前,表示化学反应从反应开始到建立平衡的过程,则v正>v逆,M点为平衡点,M点后为平衡受温度或压强的影响情况。
②方法指导
拋物线型图像顶(最低)点前未达到平衡,从顶(最低)点向后分析平衡移动情况。
注意 曲线上的每个点是否都达到平衡,往往需要通过曲线的升降或斜率变化来判断,如果未到达平衡则不能使用平衡移动原理,考虑速率变化对纵坐标量的影响,到达平衡以后的点使用平衡移动原理分析。
(2)投料平衡曲线
①反应物不止一种的可逆反应,如N2(g)+3H2(g)2NH3(g) ΔH<0,改变反应物的投料比,当反应物按照n(N2)∶n(H2)=1∶3投料时,NH3百分含量最大。
②方法指导
a.投料平衡曲线上的点均为平衡点。
b.投料比等于化学计量数之比时,生成物的含量最大。
注意 横坐标也可能是一种反应物的起始物质的量。
1.已知A(g)+B(g)2C(g),反应过程中C的百分含量与温度的关系如图所示,下列说法正确的是( )
A.正反应速率:v(c)>v(d)>v(b)
B.化学平衡常数:K(d)>K(c)
C.c点向d点变化时,v正D.d点状态加入合适的催化剂可使C%增大
答案 C
解析 温度越高,反应速率越大,则正反应速率v(d)>v(c)>v(b),A错误;正反应为放热反应,升高温度平衡逆向移动,K减小,则化学平衡常数:K(d)2.如图为条件一定时,反应2NO+O22NO2+Q(Q>0)中NO的最大转化率与温度变化关系曲线图,图中有A、B、C、D、E五点,其中表示未达到平衡状态,且v正<v逆的点是( )
A.B和C B.A和E
C.E D.A和C
答案 C
解析 图像中的曲线为平衡线,线上的点都处于平衡状态,v正=v逆;线以下的各点反应物NO的转化率偏小,反应向右进行,v正>v逆;线以上的点反应物NO的转化率偏大,反应向左进行,v正<v逆。所以,图像中的A、D两点,v正=v逆;B、C两点,v正>v逆;E点,v正<v逆。
3.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
A.反应2NO(g)+O2(g)2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间不能提高NO的转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO的转化率
D.380 ℃下,c起始(O2)=5.0×10-4 mol·L-1,NO的平衡转化率为50%,则平衡常数K>2 000
答案 D
解析 由虚线可知,随温度升高,NO的平衡转化率逐渐降低,说明平衡逆向移动,则NO与O2生成NO2的反应为放热反应,ΔH<0,A项错误;图像中实线的最高点为平衡点,X点未达到平衡,延长时间反应继续向右进行,NO的转化率增大,B项错误;Y点为平衡点,增大O2的浓度,平衡正向移动,可以提高NO的转化率,C项错误;设NO起始浓度为a mol·
L-1,NO的转化率为50%,则平衡时NO、O2和NO2的浓度分别为0.5a mol·L-1、(5.0×10-4-0.25a) mol·L-1、0.5a mol·L-1,该反应的平衡常数K==>
=2 000,D项正确。
4.温度为T1时,在1 L密闭容器中按照一定比例充入NO(g)和O2(g)。发生反应:2NO(g)+O2(g)2NO2(g)。达到平衡时NO2(g)的体积分数φ(NO2)随的变化如图所示,则A、B、C三点中NO的转化率最大的是________;当=2.3时,达到平衡时φ(NO2)可能是D、E、F三点中的________。
答案 A F
解析 总物质的量一定时,氧气的浓度越大,NO的转化率越大,故A点最大。两者按2∶1充入时,NO2的体积分数最大,当比值增大后,二氧化氮的体积分数减小,当=2.3时,达到平衡时φ(NO2)可能是F点。
[核心素养发展目标]
1.从变化的角度认识温度(压强)、起始投料等相关的图像,分析曲线与平衡移动的关系。
2.通过对图像的分析,构建分析图像的思维模型。
一、温度(压强)的相关图像
1.恒温(恒压)图像
在恒温(恒压)图像中,包括纵坐标、横坐标和曲线所表示的三个量。确定横坐标所表示的量,讨论纵坐标与曲线的关系,或者确定纵坐标所表示的量,讨论横坐标与曲线的关系,即“定一议二”。
(1)反应aA(g)+bB(g)cC(g)在不同温度下(T1
②作一等压线(如p3),温度升高,C%________,化学平衡________移动,正反应是________反应。
(2)反应aA(g)+bB(g)cC(g)在不同压强下,混合气体中C的含量(C%)与温度(T)的关系图像如图所示:
①选一等压线,随着温度的升高,C%______,化学平衡________移动,ΔH______0;
②作一等温线(如T1),随着压强的增大,C%________,化学平衡________移动,a+b______c。
2.速率—压强(或温度)图像
(1)可逆反应mA(g)nB(g)+pC(s) ΔH=Q kJ·mol-1,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图像:
①根据正、逆反应速率与温度的变化曲线,可判断反应的________,则:Q________0;
②根据正、逆反应速率与压强的变化曲线,可判断反应前后________________,则:m______n。
特别注意 图中交点是平衡点,分析温度、压强对化学平衡影响时,一般选择交点之后的曲线的变化来判断。
(2)某可逆反应中,温度的变化对正、逆反应速率的影响如图所示:
根据正、逆反应速率与温度的变化曲线,可判断该可逆反应的正反应为______热反应。
1.某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,反应速率(v)与温度(T)、SO2的体积分数[V(SO2)%]与压强(p)的关系分别如图甲、乙所示。下列说法不正确的是( )
A.图甲中,曲线1表示逆反应速率与温度的关系
B.图甲中,d点表示温度为T0时,反应已经达到平衡
C.图乙中,温度恒定时,a、b两点对应的反应速率:va>vb
D.图乙中,温度恒定时,c点的反应正在向逆反应方向进行
2.T ℃时,对于可逆反应:A(g)+B(g)2C(g)+D(g) ΔH>0。下列各图中正确的是( )
二、几种特殊图像
1.平衡曲线
序号 图像示例 方法指导
(1) 对于化学反应mA(g)+nB(g) pC(g)+qD(g),L线上所有的点都是平衡点(如图)。 平衡曲线上的任意一点均为该条件下达到平衡的点,线外点均未达到平衡。 若未达到平衡的点在该条件下达到平衡过程如图所示:
则:L线的左上方(E点),A%大于此压强时平衡体系的A%,E点v正 v逆; L线的右下方(F点),F点v正 v逆
(2) 如图所示曲线是其他条件不变时,某反应物的平衡转化率与温度的关系曲线如图所示: 若未达到平衡的点在该条件下达到平衡过程如图所示:
图中标出的1、2、3、4四个点,表示v正>v逆的是点 ,表示v正<v逆的是点 ,而点2、4表示v正 v逆
2.拋物线型
(1)对于反应aA(g)+bB(g)cC(g)+dD(g) ΔH<0。
①M点前,表示化学反应从反应开始到建立平衡的过程,则v正______v逆,M点为________,M点后为平衡受温度或压强的影响情况。
②方法指导
拋物线型图像顶(最低)点前未达到平衡,从顶(最低)点向后分析平衡移动情况。
注意 曲线上的每个点是否都达到平衡,往往需要通过曲线的升降或斜率变化来判断,如果未到达平衡则不能使用平衡移动原理,考虑速率变化对纵坐标量的影响,到达平衡以后的点使用平衡移动原理分析。
(2)投料平衡曲线
①反应物不止一种的可逆反应,如N2(g)+3H2(g)2NH3(g) ΔH<0,改变反应物的投料比,当反应物按照n(N2)∶n(H2)=1∶3投料时,NH3百分含量最大。
②方法指导
a.投料平衡曲线上的点均为平衡点。
b.投料比等于化学计量数之比时,生成物的含量最大。
注意 横坐标也可能是一种反应物的起始物质的量。
1.已知A(g)+B(g)2C(g),反应过程中C的百分含量与温度的关系如图所示,下列说法正确的是( )
A.正反应速率:v(c)>v(d)>v(b)
B.化学平衡常数:K(d)>K(c)
C.c点向d点变化时,v正
2.如图为条件一定时,反应2NO+O22NO2+Q(Q>0)中NO的最大转化率与温度变化关系曲线图,图中有A、B、C、D、E五点,其中表示未达到平衡状态,且v正<v逆的点是( )
A.B和C B.A和E
C.E D.A和C
3.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
A.反应2NO(g)+O2(g)2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间不能提高NO的转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO的转化率
D.380 ℃下,c起始(O2)=5.0×10-4 mol·L-1,NO的平衡转化率为50%,则平衡常数K>2 000
4.温度为T1时,在1 L密闭容器中按照一定比例充入NO(g)和O2(g)。发生反应:2NO(g)+O2(g)2NO2(g)。达到平衡时NO2(g)的体积分数φ(NO2)随的变化如图所示,则A、B、C三点中NO的转化率最大的是________;当=2.3时,达到平衡时φ(NO2)可能是D、E、F三点中的________。
第7课时 化学反应速率与平衡图像(2)
[核心素养发展目标] 1.从变化的角度认识温度(压强)、起始投料等相关的图像,分析曲线与平衡移动的关系。2.通过对图像的分析,构建分析图像的思维模型。
一、温度(压强)的相关图像
1.恒温(恒压)图像
在恒温(恒压)图像中,包括纵坐标、横坐标和曲线所表示的三个量。确定横坐标所表示的量,讨论纵坐标与曲线的关系,或者确定纵坐标所表示的量,讨论横坐标与曲线的关系,即“定一议二”。
(1)反应aA(g)+bB(g)cC(g)在不同温度下(T1
(2)反应aA(g)+bB(g)cC(g)在不同压强下,混合气体中C的含量(C%)与温度(T)的关系图像如图所示:
①选一等压线,随着温度的升高,C%减小,化学平衡逆向移动,ΔH <0;
②作一等温线(如T1),随着压强的增大,C%增大,化学平衡正向移动,a+b>c。
2.速率—压强(或温度)图像
(1)可逆反应mA(g)nB(g)+pC(s) ΔH=Q kJ·mol-1,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图像:
①根据正、逆反应速率与温度的变化曲线,可判断反应的ΔH,则:Q <0;
②根据正、逆反应速率与压强的变化曲线,可判断反应前后气体体积的变化,则:m >n。
特别注意 图中交点是平衡点,分析温度、压强对化学平衡影响时,一般选择交点之后的曲线的变化来判断。
(2)某可逆反应中,温度的变化对正、逆反应速率的影响如图所示:
根据正、逆反应速率与温度的变化曲线,可判断该可逆反应的正反应为吸热反应。
1.某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,反应速率(v)与温度(T)、SO2的体积分数[V(SO2)%]与压强(p)的关系分别如图甲、乙所示。下列说法不正确的是( )
A.图甲中,曲线1表示逆反应速率与温度的关系
B.图甲中,d点表示温度为T0时,反应已经达到平衡
C.图乙中,温度恒定时,a、b两点对应的反应速率:va>vb
D.图乙中,温度恒定时,c点的反应正在向逆反应方向进行
答案 C
解析 d点正、逆反应速率相等,反应处于平衡状态,平衡后温度升高,平衡向逆反应方向移动,故v逆>v正,曲线1表示逆反应速率;图乙中,b点时压强大,反应速率快,p1时达到平衡时SO2的体积分数大于c点时SO2的体积分数,所以c点的反应向生成SO2的方向进行。
2.T ℃时,对于可逆反应:A(g)+B(g)2C(g)+D(g) ΔH>0。下列各图中正确的是( )
答案 D
解析 升高温度平衡向正反应方向移动,C的浓度增大,A错误;升高温度平衡向正反应方向移动,A的转化率增大,增大压强平衡向逆反应方向移动,A的转化率降低,B错误;增大压强正、逆反应速率均增大,C错误;升高温度平衡向正反应方向移动,C的质量分数增大,增大压强平衡向逆反应方向移动,C的质量分数减小,D正确。
二、几种特殊图像
1.平衡曲线
序号 图像示例 方法指导
(1) 对于化学反应mA(g)+nB(g) pC(g)+qD(g),L线上所有的点都是平衡点(如图)。 平衡曲线上的任意一点均为该条件下达到平衡的点,线外点均未达到平衡。 若未达到平衡的点在该条件下达到平衡过程如图所示:
则:L线的左上方(E点),A%大于此压强时平衡体系的A%,E点v正>v逆; L线的右下方(F点),F点v正
图中标出的1、2、3、4四个点,表示v正>v逆的是点3,表示v正<v逆的是点1,而点2、4表示v正=v逆
2.拋物线型
(1)对于反应aA(g)+bB(g)cC(g)+dD(g) ΔH<0。
①M点前,表示化学反应从反应开始到建立平衡的过程,则v正>v逆,M点为平衡点,M点后为平衡受温度或压强的影响情况。
②方法指导
拋物线型图像顶(最低)点前未达到平衡,从顶(最低)点向后分析平衡移动情况。
注意 曲线上的每个点是否都达到平衡,往往需要通过曲线的升降或斜率变化来判断,如果未到达平衡则不能使用平衡移动原理,考虑速率变化对纵坐标量的影响,到达平衡以后的点使用平衡移动原理分析。
(2)投料平衡曲线
①反应物不止一种的可逆反应,如N2(g)+3H2(g)2NH3(g) ΔH<0,改变反应物的投料比,当反应物按照n(N2)∶n(H2)=1∶3投料时,NH3百分含量最大。
②方法指导
a.投料平衡曲线上的点均为平衡点。
b.投料比等于化学计量数之比时,生成物的含量最大。
注意 横坐标也可能是一种反应物的起始物质的量。
1.已知A(g)+B(g)2C(g),反应过程中C的百分含量与温度的关系如图所示,下列说法正确的是( )
A.正反应速率:v(c)>v(d)>v(b)
B.化学平衡常数:K(d)>K(c)
C.c点向d点变化时,v正
答案 C
解析 温度越高,反应速率越大,则正反应速率v(d)>v(c)>v(b),A错误;正反应为放热反应,升高温度平衡逆向移动,K减小,则化学平衡常数:K(d)
A.B和C B.A和E
C.E D.A和C
答案 C
解析 图像中的曲线为平衡线,线上的点都处于平衡状态,v正=v逆;线以下的各点反应物NO的转化率偏小,反应向右进行,v正>v逆;线以上的点反应物NO的转化率偏大,反应向左进行,v正<v逆。所以,图像中的A、D两点,v正=v逆;B、C两点,v正>v逆;E点,v正<v逆。
3.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
A.反应2NO(g)+O2(g)2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间不能提高NO的转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO的转化率
D.380 ℃下,c起始(O2)=5.0×10-4 mol·L-1,NO的平衡转化率为50%,则平衡常数K>2 000
答案 D
解析 由虚线可知,随温度升高,NO的平衡转化率逐渐降低,说明平衡逆向移动,则NO与O2生成NO2的反应为放热反应,ΔH<0,A项错误;图像中实线的最高点为平衡点,X点未达到平衡,延长时间反应继续向右进行,NO的转化率增大,B项错误;Y点为平衡点,增大O2的浓度,平衡正向移动,可以提高NO的转化率,C项错误;设NO起始浓度为a mol·
L-1,NO的转化率为50%,则平衡时NO、O2和NO2的浓度分别为0.5a mol·L-1、(5.0×10-4-0.25a) mol·L-1、0.5a mol·L-1,该反应的平衡常数K==>
=2 000,D项正确。
4.温度为T1时,在1 L密闭容器中按照一定比例充入NO(g)和O2(g)。发生反应:2NO(g)+O2(g)2NO2(g)。达到平衡时NO2(g)的体积分数φ(NO2)随的变化如图所示,则A、B、C三点中NO的转化率最大的是________;当=2.3时,达到平衡时φ(NO2)可能是D、E、F三点中的________。
答案 A F
解析 总物质的量一定时,氧气的浓度越大,NO的转化率越大,故A点最大。两者按2∶1充入时,NO2的体积分数最大,当比值增大后,二氧化氮的体积分数减小,当=2.3时,达到平衡时φ(NO2)可能是F点。
