1.1.2中和热的测定 课件(共19张PPT)2023-2024学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.1.2中和热的测定 课件(共19张PPT)2023-2024学年上学期高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 32.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-07 07:57:11 | ||
图片预览





文档简介
(共19张PPT)
新人教版高中化学选择性必修一
第一章 化学反应的热效应
第一节 反应热
第2课时 中和热的测定
测量热效应的仪器
微量热计
H+(aq)+OH-(aq)=H2O(l); = -57.3 kJ/mol
在25℃和101kPa下,强酸的稀溶液与强碱的稀溶液,发生中和反应生成1molH2O时,放出的热量。
研究条件:稀溶液
反应物:强酸与强碱
生成物及其物质的量:1mol
注:强酸与弱碱反应,强碱与弱酸、弱酸和弱碱反应生成1molH2O放出的热小于57.3KJ/mol
学习任务一:中和热
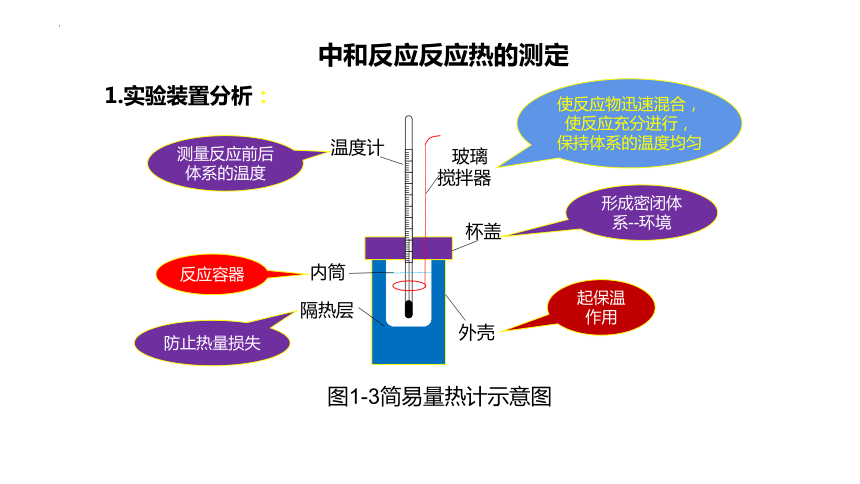
H
温度计
内筒
隔热层
玻璃搅拌器
杯盖
外壳
中和反应反应热的测定
图1-3简易量热计示意图
测量反应前后体系的温度
使反应物迅速混合,使反应充分进行,
保持体系的温度均匀
反应容器
防止热量损失
起保温作用
形成密闭体系--环境
1.实验装置分析:
中和反应反应热的测定
(1)测量那些数据?
(2)如何利用数据计算反应热?
(3)如何提高实验的准确度?
2.测定原理:
通过量热计测得体系在反应前后的温度变化,再利用有关物质的比热容计算反应热。
应以50 mL 0.5 mol·L-1 盐酸与50 mL 0.55 mol·L-1 NaOH溶液反应为例)
t1—起始温度,
t2—终止温度。
ΔH =- kJ·mol-1
n(H2O)
(m1+m2)×4.18×(t2-t1)×10-3
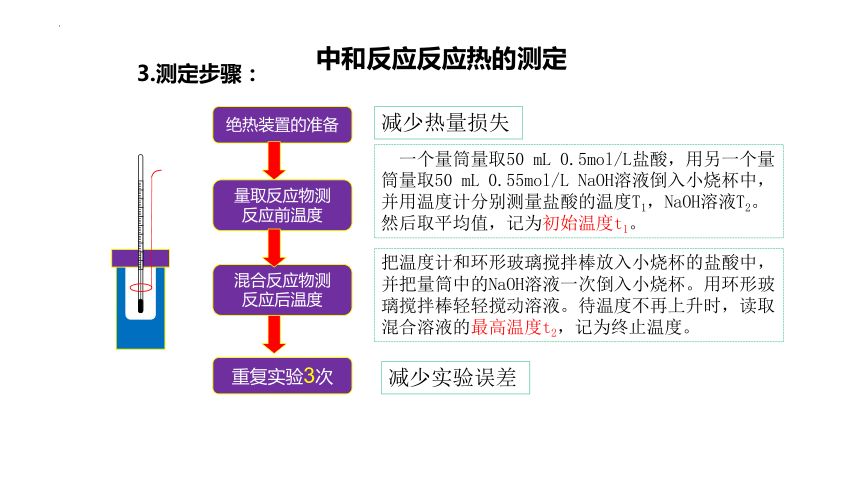
3.测定步骤:
绝热装置的准备
量取反应物测
反应前温度
混合反应物测
反应后温度
重复实验3次
减少热量损失
用一个量筒量取50 mL 0.5mol/L盐酸,用另一个量筒量取50 mL 0.55mol/L NaOH溶液倒入小烧杯中,并用温度计分别测量盐酸的温度T1,NaOH溶液T2。然后取平均值,记为初始温度t1。
把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯。用环形玻璃搅拌棒轻轻搅动溶液。待温度不再上升时,读取混合溶液的最高温度t2,记为终止温度。
减少实验误差
中和反应反应热的测定
3.4
3.4
28.3
25.5
4
25.5
26.5
26.0
28.0
2.0
1.42
56.8
通过大量实验测得,在25℃和101kPa下,强酸的稀溶液与强碱的稀溶液,发生中和反应生成1molH2O时,放出57.3kJ的热量,该热量称为中和反应反应热。
4.中和热测定的注意事项:
中和反应反应热的测定
①实验中要用强酸、强碱稀溶液
②操作动作要快,尽量减少热量的损失,使用绝热装置,避免热量散发到反应体系外。
③测量盐酸的温度后,要将温度计上的盐酸冲洗干净,再测量NaOH溶液的温度,避免酸、碱在温度计的表面反应放热而影响测量结果。
④读取中和反应的温度(t2)是反应混合液的最高温度。
⑤测定中和热不能用弱酸或弱碱,因弱酸、弱碱电离时吸收热量而使测量数值偏低。
若生成物中有沉淀,会因为成键放热而使测量数值偏高。
⑥中和热的数值是57.3kJ·mol-1,测定时与强酸、强碱用
量无关。
5.中和热测定的误差分析:
=- kJ·mol-1
0.025
0.418(t2-t1)
中和反应反应热的测定
ΔH =- kJ·mol-1
n(H2O)
(m1+m2)×4.18×(t2-t1)×10-3
①量取溶液体积不准确
②温度计读数有误。
③实验过程中有液体溅出。
④酸碱混合时动作缓慢。
⑤隔热操作不到位,致使实验过程中热量损失。
⑥测过盐酸后的温度计未用水清洗立即去测碱溶液的温度。
快问快答
1、大、小烧杯放置时,为何要使两杯口相平?填碎纸条的作用是什么?
2、酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?
3、实验中能否用环形铜丝搅拌棒代替玻璃搅拌器?为什么?
4、有人建议用50mL0.55mol/LNaOH进行上述实验,测得的中和热数值会更加准确。为什么?
减少热量损失
减少热量损失
不能。因为铜丝易导热,使热量损失较大
可以保证盐酸完全反应。使测得的热量更加准确。
5、判断下列实验操作对中和热测定的数值有如何影响?填变大变小或者不变。
①大烧杯上没有盖硬纸板
②用相同浓度和体积的氨水代替NaOH溶液进行实验
③用相同浓度和体积的醋酸代替稀盐酸溶液 进行实验
④实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行实验
变 小
变 小
变 小
不变
随堂练习
1.下列说法正确的是( )A.浓硫酸与NaOH溶液反应生成1mol水时放出57.3kJ热量B.稀硫酸和稀Ba(OH)2反应生成1mol水时放出57.3kJ热量C.1L 1mol/L稀硫酸被NaOH溶液恰好完全中和放出57.3kJ热量D.0.1mol/L HCl和0.2mol/L NaOH溶液反应的中和热的焓变(ΔH)为-57.3kJ/mol
D
3.若将1L 1mol/LNaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H1、△H2 、△H3 ;则三者的大小
关系为 。
随堂练习
△H1> △H3 > △H2
B
2.某同学通过实验测出稀盐酸和稀NaOH溶液(碱稍过量)发生中和反应,生成1 mol H2O(l)时放出52.3 kJ的热量,造成这一结果的原因不可能是( )A.实验装置保温、隔热效果差B.用量筒量取盐酸时仰视读数C.分多次将NaOH溶液倒入小烧杯中D.温度计测量了盐酸的温度后直接测定NaOH溶液的温度
1、在同温、同压下,比较下列反应放出热量ΔH1 、 ΔH2的大小
A:2H2(g)+O2(g)=2H2O(g)
2H2(g)+O2(g)=2H2O(l)
ΔH1 = -Q1
ΔH2= -Q2
Q2>Q1
ΔH2 < ΔH1
思考与交流
2、在同温、同压下,比较下列反应放出热量Q1、Q2的大小
B: S(g)+O2(g)=SO2(g)
S(S)+O2(g)=SO2(g)
思考与交流
Q23、在同温、同压下,比较下列反应放出热量Q1、Q2的大小
C: C(s)+1/2O2(g)=CO(g) C(s)+O2(g)=CO2(g)
思考与交流
Q2>Q1
4、在同温、同压下,比较下列反应放出热量Q1、Q2的大小
D: H2(g)+Cl2(g)=2HCl(g)
1/2H2(g)+1/2Cl2(g)= HCl(g)
思考与交流
Q2<Q1
4、已知
(1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = a kJ/mol
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 。
A、ad>0 C、2a=b< 0 D、2c=d>0
C
随堂练习
新人教版高中化学选择性必修一
第一章 化学反应的热效应
第一节 反应热
第2课时 中和热的测定
测量热效应的仪器
微量热计
H+(aq)+OH-(aq)=H2O(l); = -57.3 kJ/mol
在25℃和101kPa下,强酸的稀溶液与强碱的稀溶液,发生中和反应生成1molH2O时,放出的热量。
研究条件:稀溶液
反应物:强酸与强碱
生成物及其物质的量:1mol
注:强酸与弱碱反应,强碱与弱酸、弱酸和弱碱反应生成1molH2O放出的热小于57.3KJ/mol
学习任务一:中和热
H
温度计
内筒
隔热层
玻璃搅拌器
杯盖
外壳
中和反应反应热的测定
图1-3简易量热计示意图
测量反应前后体系的温度
使反应物迅速混合,使反应充分进行,
保持体系的温度均匀
反应容器
防止热量损失
起保温作用
形成密闭体系--环境
1.实验装置分析:
中和反应反应热的测定
(1)测量那些数据?
(2)如何利用数据计算反应热?
(3)如何提高实验的准确度?
2.测定原理:
通过量热计测得体系在反应前后的温度变化,再利用有关物质的比热容计算反应热。
应以50 mL 0.5 mol·L-1 盐酸与50 mL 0.55 mol·L-1 NaOH溶液反应为例)
t1—起始温度,
t2—终止温度。
ΔH =- kJ·mol-1
n(H2O)
(m1+m2)×4.18×(t2-t1)×10-3
3.测定步骤:
绝热装置的准备
量取反应物测
反应前温度
混合反应物测
反应后温度
重复实验3次
减少热量损失
用一个量筒量取50 mL 0.5mol/L盐酸,用另一个量筒量取50 mL 0.55mol/L NaOH溶液倒入小烧杯中,并用温度计分别测量盐酸的温度T1,NaOH溶液T2。然后取平均值,记为初始温度t1。
把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯。用环形玻璃搅拌棒轻轻搅动溶液。待温度不再上升时,读取混合溶液的最高温度t2,记为终止温度。
减少实验误差
中和反应反应热的测定
3.4
3.4
28.3
25.5
4
25.5
26.5
26.0
28.0
2.0
1.42
56.8
通过大量实验测得,在25℃和101kPa下,强酸的稀溶液与强碱的稀溶液,发生中和反应生成1molH2O时,放出57.3kJ的热量,该热量称为中和反应反应热。
4.中和热测定的注意事项:
中和反应反应热的测定
①实验中要用强酸、强碱稀溶液
②操作动作要快,尽量减少热量的损失,使用绝热装置,避免热量散发到反应体系外。
③测量盐酸的温度后,要将温度计上的盐酸冲洗干净,再测量NaOH溶液的温度,避免酸、碱在温度计的表面反应放热而影响测量结果。
④读取中和反应的温度(t2)是反应混合液的最高温度。
⑤测定中和热不能用弱酸或弱碱,因弱酸、弱碱电离时吸收热量而使测量数值偏低。
若生成物中有沉淀,会因为成键放热而使测量数值偏高。
⑥中和热的数值是57.3kJ·mol-1,测定时与强酸、强碱用
量无关。
5.中和热测定的误差分析:
=- kJ·mol-1
0.025
0.418(t2-t1)
中和反应反应热的测定
ΔH =- kJ·mol-1
n(H2O)
(m1+m2)×4.18×(t2-t1)×10-3
①量取溶液体积不准确
②温度计读数有误。
③实验过程中有液体溅出。
④酸碱混合时动作缓慢。
⑤隔热操作不到位,致使实验过程中热量损失。
⑥测过盐酸后的温度计未用水清洗立即去测碱溶液的温度。
快问快答
1、大、小烧杯放置时,为何要使两杯口相平?填碎纸条的作用是什么?
2、酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?
3、实验中能否用环形铜丝搅拌棒代替玻璃搅拌器?为什么?
4、有人建议用50mL0.55mol/LNaOH进行上述实验,测得的中和热数值会更加准确。为什么?
减少热量损失
减少热量损失
不能。因为铜丝易导热,使热量损失较大
可以保证盐酸完全反应。使测得的热量更加准确。
5、判断下列实验操作对中和热测定的数值有如何影响?填变大变小或者不变。
①大烧杯上没有盖硬纸板
②用相同浓度和体积的氨水代替NaOH溶液进行实验
③用相同浓度和体积的醋酸代替稀盐酸溶液 进行实验
④实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行实验
变 小
变 小
变 小
不变
随堂练习
1.下列说法正确的是( )A.浓硫酸与NaOH溶液反应生成1mol水时放出57.3kJ热量B.稀硫酸和稀Ba(OH)2反应生成1mol水时放出57.3kJ热量C.1L 1mol/L稀硫酸被NaOH溶液恰好完全中和放出57.3kJ热量D.0.1mol/L HCl和0.2mol/L NaOH溶液反应的中和热的焓变(ΔH)为-57.3kJ/mol
D
3.若将1L 1mol/LNaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H1、△H2 、△H3 ;则三者的大小
关系为 。
随堂练习
△H1> △H3 > △H2
B
2.某同学通过实验测出稀盐酸和稀NaOH溶液(碱稍过量)发生中和反应,生成1 mol H2O(l)时放出52.3 kJ的热量,造成这一结果的原因不可能是( )A.实验装置保温、隔热效果差B.用量筒量取盐酸时仰视读数C.分多次将NaOH溶液倒入小烧杯中D.温度计测量了盐酸的温度后直接测定NaOH溶液的温度
1、在同温、同压下,比较下列反应放出热量ΔH1 、 ΔH2的大小
A:2H2(g)+O2(g)=2H2O(g)
2H2(g)+O2(g)=2H2O(l)
ΔH1 = -Q1
ΔH2= -Q2
Q2>Q1
ΔH2 < ΔH1
思考与交流
2、在同温、同压下,比较下列反应放出热量Q1、Q2的大小
B: S(g)+O2(g)=SO2(g)
S(S)+O2(g)=SO2(g)
思考与交流
Q2
C: C(s)+1/2O2(g)=CO(g) C(s)+O2(g)=CO2(g)
思考与交流
Q2>Q1
4、在同温、同压下,比较下列反应放出热量Q1、Q2的大小
D: H2(g)+Cl2(g)=2HCl(g)
1/2H2(g)+1/2Cl2(g)= HCl(g)
思考与交流
Q2<Q1
4、已知
(1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = a kJ/mol
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 。
A、a
C
随堂练习
