化学苏教版(2019)必修第一册 5.3.2晶体非晶体课件(共17张PPT)
文档属性
| 名称 | 化学苏教版(2019)必修第一册 5.3.2晶体非晶体课件(共17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-07 18:49:19 | ||
图片预览





文档简介
(共17张PPT)
5.3.2 晶体 非晶体
常
见
晶
体
交流与讨论
外观上有何特点?它们的物理性质(如硬度、熔点、沸点、导电性等)有什么特点?
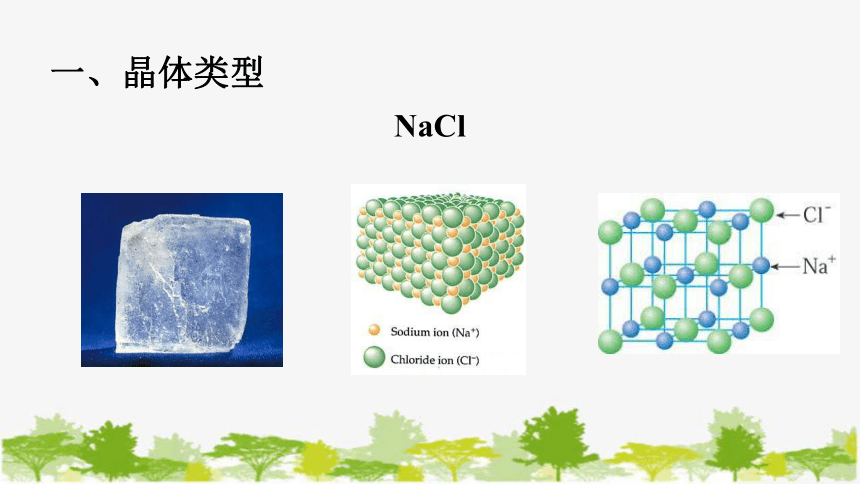
一、晶体类型
NaCl
思考
①晶体中有没有单个小分子,那么化学式NaCl表示什么意思呢?
②构成晶体的微粒是什么?
③离子晶体中微粒间的作用是什么?
④离子晶体物理性质有什么特点?
⑤哪些物质属于离子晶体?
1、离子晶体
定义:阴、阳离子通过离子键结合而成的晶体。
特点:无单个分子存在;如:NaCl不表示分子式。
熔沸点较高,硬度较大。
水溶液或者熔融状态下均导电。
强碱、部分金属氧化物、部分盐类属于离子晶体
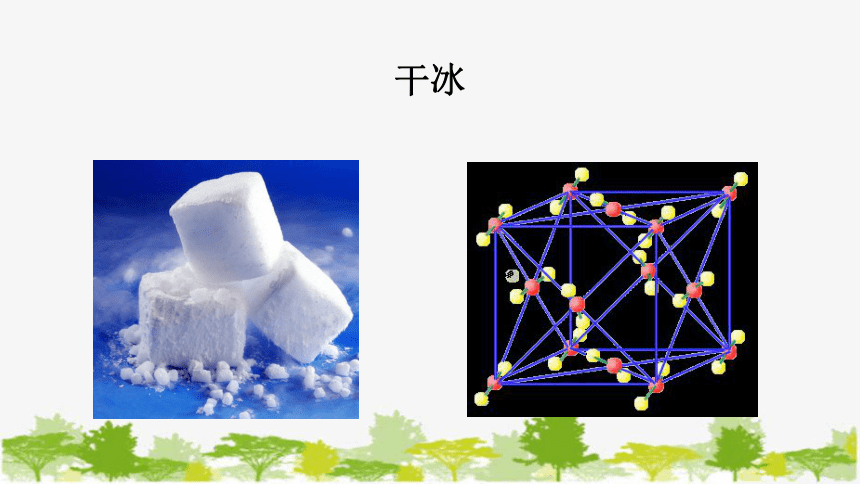
干冰
思考:
①晶体中有没有单个小分子?
②构成晶体的微粒是什么?
③分子晶体中微粒间的作用是什么?
④分子晶体物理性质有什么特点?
⑤哪些物质属于分子晶体?
2、分子晶体
定义:分子间通过分子间作用力结合成的晶体。
特点:有单个分子存在,化学式就是分子式。
熔沸点较低,硬度较小。
卤素、氧气、氢气等多数非金属单质、稀有气体、非金属氢化物、多数非金属氧化物等属于分子晶体。
水晶
分析下列数据推测石英是否是分子晶体?
思考
①晶体中有没有单个小分子?
②构成晶体的微粒是什么?
③原子晶体中微粒间的作用是什么?
④原子晶体物理性质有什么特点
⑤哪些物质属于原子晶体?
3、原子晶体
定义:原子间通过共价键结合成的具有空间网状结构的晶体。
特点:熔沸点很高,硬度很大。
金刚石、单晶硅、碳化硅、二氧化硅属于原子晶体
4、金属晶体
常见金属晶体:
金属单质或合金如:钠、钾、铜
物理性质:
有金属光泽、导电、导热、延展性
离子晶体、分子晶体、原子晶体结构与性质关系的比较:
晶体类型
离子晶体
分子晶体
原子晶体
金属晶体
结构
构成晶体的粒子
微粒间的相互作用
性质
硬度
熔点
导电性
阴、阳离子
分子
原子
离子键
分子间
作用力
共价键
差距大
大
小
较大
较大
小
高
差距大
导电
不导电
不导电
熔融状态导电
-------
-------
二、晶体类型的判断
根据组成判断:有无离子、有无分子
根据性质判断:熔沸点高低、硬度大小、导电性
5.3.2 晶体 非晶体
常
见
晶
体
交流与讨论
外观上有何特点?它们的物理性质(如硬度、熔点、沸点、导电性等)有什么特点?
一、晶体类型
NaCl
思考
①晶体中有没有单个小分子,那么化学式NaCl表示什么意思呢?
②构成晶体的微粒是什么?
③离子晶体中微粒间的作用是什么?
④离子晶体物理性质有什么特点?
⑤哪些物质属于离子晶体?
1、离子晶体
定义:阴、阳离子通过离子键结合而成的晶体。
特点:无单个分子存在;如:NaCl不表示分子式。
熔沸点较高,硬度较大。
水溶液或者熔融状态下均导电。
强碱、部分金属氧化物、部分盐类属于离子晶体
干冰
思考:
①晶体中有没有单个小分子?
②构成晶体的微粒是什么?
③分子晶体中微粒间的作用是什么?
④分子晶体物理性质有什么特点?
⑤哪些物质属于分子晶体?
2、分子晶体
定义:分子间通过分子间作用力结合成的晶体。
特点:有单个分子存在,化学式就是分子式。
熔沸点较低,硬度较小。
卤素、氧气、氢气等多数非金属单质、稀有气体、非金属氢化物、多数非金属氧化物等属于分子晶体。
水晶
分析下列数据推测石英是否是分子晶体?
思考
①晶体中有没有单个小分子?
②构成晶体的微粒是什么?
③原子晶体中微粒间的作用是什么?
④原子晶体物理性质有什么特点
⑤哪些物质属于原子晶体?
3、原子晶体
定义:原子间通过共价键结合成的具有空间网状结构的晶体。
特点:熔沸点很高,硬度很大。
金刚石、单晶硅、碳化硅、二氧化硅属于原子晶体
4、金属晶体
常见金属晶体:
金属单质或合金如:钠、钾、铜
物理性质:
有金属光泽、导电、导热、延展性
离子晶体、分子晶体、原子晶体结构与性质关系的比较:
晶体类型
离子晶体
分子晶体
原子晶体
金属晶体
结构
构成晶体的粒子
微粒间的相互作用
性质
硬度
熔点
导电性
阴、阳离子
分子
原子
离子键
分子间
作用力
共价键
差距大
大
小
较大
较大
小
高
差距大
导电
不导电
不导电
熔融状态导电
-------
-------
二、晶体类型的判断
根据组成判断:有无离子、有无分子
根据性质判断:熔沸点高低、硬度大小、导电性
