2023-2024学年人教版高中化学选择性必修1 4.1原电池 课件 (共18张PPT)
文档属性
| 名称 | 2023-2024学年人教版高中化学选择性必修1 4.1原电池 课件 (共18张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-07 18:51:29 | ||
图片预览





文档简介
(共18张PPT)
人教版高中化学
选择性必修1第四章
第一节原电池
普通干电池
手机电池
钮扣电池
笔记本电脑
专用电池
心脏起搏器
“神六”用
太阳能电池
小型化
多样化
高能化
可持续化
创新意识
推动社会进步
课标要求
1、认识能量转换的基本方式,知道原电池的工作原理,掌握构成原电池的条件。
2、能够正确书写电极方程式和电池总方程式。
3、运用原电池理论的模型认知,能设计简单的原电池。
4、通过对实验现象的证据推理,培养科学探究和创新意识。
学生展示
前置作业
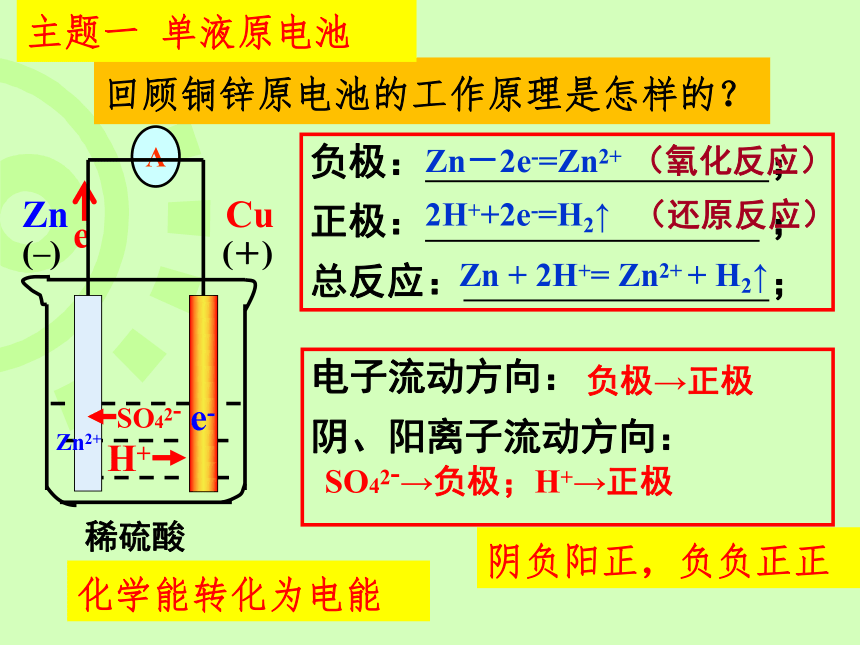
1、如图所示,当电解质溶液为CuSO4
溶液时: Zn电极是____极,
其电极反应为_____________
,该反应是_____反应;Cu电
极是____极,其电极反应
为_________ , 该反应
是______反应.
负
Zn -2e - = Zn 2+
氧化
正
Cu2+ + 2e - = Cu
还原
负极: ;
正极: ;
总反应: ;
A
电子流动方向:
阴、阳离子流动方向:
e
H+
2H++2e-=H2↑
Zn-2e-=Zn2+
Zn + 2H+= Zn2+ + H2↑
(氧化反应)
(还原反应)
(–)
(+)
回顾铜锌原电池的工作原理是怎样的?
稀硫酸
Zn
Cu
负极→正极
SO42-→负极;H+→正极
SO42-
Zn2+
e-
化学能转化为电能
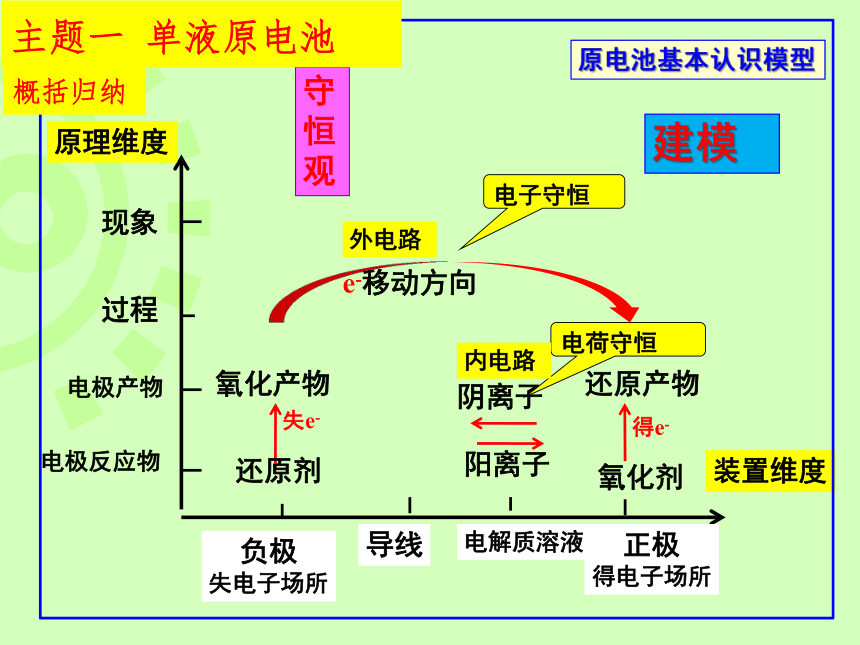
主题一 单液原电池
阴负阳正,负负正正
守
恒
观
失e-
负极
失电子场所
导线
电解质溶液)
正极
得电子场所
电极反应物
电极产物
过程
现象
装置维度
原理维度
还原剂
氧化产物
氧化剂
得e-
还原产物
e-移动方向
阴离子
阳离子
原电池基本认识模型
建模
概括归纳
电子守恒
电荷守恒
外电路
内电路
主题一 单液原电池
原电池的形成条件
(1)活动性不同的金属(或一种金属和一种非金属导体)作电极。
(2)两电极插入电解质溶液中。
(3)形成闭合回路。(两电极外线用导线
连接,可以接用电器。)
两个电极中至少有一个可以和电解质溶液自发地发生氧化还原反应.
构成前提:
主题一 单液原电池
1、实验药品和仪器:
铜片、锌片、铁片、硫酸铜溶液; 灵敏电流计、导线、烧杯、原电池实验器。
2、实验要求:
1)、设计原电池
2)、画出实验装置图
3)、写出电极方程式
4)、预测现象
实践新知
主题一 单液原电池
实验装置图 电极反应式书写 预测实验现象
负极 Zn -2e =Zn2+
正极 Cu2++2e=Cu
1、电流表示数发生偏转
2、铜片表面有铜析出
3、锌片逐渐溶解
注意事项:
1、实验前用砂纸打磨锌片,烧杯中倒入2/3的硫酸铜溶液。
2、实验至少半分钟以上,观察实验现象和记录电流表的最大读数和变化趋势。
3、使用后在用砂纸打磨锌片,以待之后的实验。
主题一 单液原电池
问题1、为什么不同的金属材料做负极,电流表示数
不同
问题2、锌片表面的红色物质是什么?电流表的示数逐渐减小说明了什么?为什么会逐渐减小?
讨论
原电池输出电能的能力:取决于组成原电池的反应物的氧化还原能力
问题3、应怎么避免锌片表面出现红色物质?
主题一 单液原电池
硫酸铜溶液
硫酸锌溶液
问题4
上述装置构成原电池了吗?为什么?怎样才能构成原电池呢?
主题二 双液原电池
盐桥中通常装有含琼胶的KCl饱和溶液
作用:(1)使整个装置构成通路,代替两溶液直接接触。(2)平衡电荷。
锌半电池反应: Zn - 2e- = Zn2+
铜半电池反应: : Cu2++ 2e- = Cu
双液原电池是由两个半电池组成的;
总反应: : Zn+ Cu2+ = Zn2+ + Cu
1、判断下列哪些装置能构成原电池。为什么?
√
√
双液原电池比单液原电池优点:
1、能量转化率高, 2、电流稳定。
主题二 双液原电池
1、根据氧化还原反应电子转移判断电极反应。
负极:F e-2e - = Fe 2+
正极: Cu2++ 2e- = Cu
2、根据电极反应确定合适的电极材料和电解质溶液
原电池的设计
利用Fe + Cu2+=Fe2+ +Cu ,设计一个原电池.
Cu
Fe
CuSO4
FeSO4
化合价升高 失2e-
化合价降低 得2e-
主题三 设计原电池
用模
某原电池的总反应的离子方程式为:
2Fe3++Fe == 3Fe2+,
不能实现该反应的原电池组成是( )
A、正极为铜,负极为铁,电解质溶液为FeCl3溶液
B、正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C、正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D、正极为银,负极为铁,电解质溶液为CuSO4溶液
CD
【当堂达标】
归纳总结
推理
发现问题分析问题
证据
微观:氧化还原原理
宏观:原电池装置
模型
原电池设计的二维图
创新
设计新型原电池
应用
意义
社会责任
将化学价值最大化
谢谢大家
人教版高中化学
选择性必修1第四章
第一节原电池
普通干电池
手机电池
钮扣电池
笔记本电脑
专用电池
心脏起搏器
“神六”用
太阳能电池
小型化
多样化
高能化
可持续化
创新意识
推动社会进步
课标要求
1、认识能量转换的基本方式,知道原电池的工作原理,掌握构成原电池的条件。
2、能够正确书写电极方程式和电池总方程式。
3、运用原电池理论的模型认知,能设计简单的原电池。
4、通过对实验现象的证据推理,培养科学探究和创新意识。
学生展示
前置作业
1、如图所示,当电解质溶液为CuSO4
溶液时: Zn电极是____极,
其电极反应为_____________
,该反应是_____反应;Cu电
极是____极,其电极反应
为_________ , 该反应
是______反应.
负
Zn -2e - = Zn 2+
氧化
正
Cu2+ + 2e - = Cu
还原
负极: ;
正极: ;
总反应: ;
A
电子流动方向:
阴、阳离子流动方向:
e
H+
2H++2e-=H2↑
Zn-2e-=Zn2+
Zn + 2H+= Zn2+ + H2↑
(氧化反应)
(还原反应)
(–)
(+)
回顾铜锌原电池的工作原理是怎样的?
稀硫酸
Zn
Cu
负极→正极
SO42-→负极;H+→正极
SO42-
Zn2+
e-
化学能转化为电能
主题一 单液原电池
阴负阳正,负负正正
守
恒
观
失e-
负极
失电子场所
导线
电解质溶液)
正极
得电子场所
电极反应物
电极产物
过程
现象
装置维度
原理维度
还原剂
氧化产物
氧化剂
得e-
还原产物
e-移动方向
阴离子
阳离子
原电池基本认识模型
建模
概括归纳
电子守恒
电荷守恒
外电路
内电路
主题一 单液原电池
原电池的形成条件
(1)活动性不同的金属(或一种金属和一种非金属导体)作电极。
(2)两电极插入电解质溶液中。
(3)形成闭合回路。(两电极外线用导线
连接,可以接用电器。)
两个电极中至少有一个可以和电解质溶液自发地发生氧化还原反应.
构成前提:
主题一 单液原电池
1、实验药品和仪器:
铜片、锌片、铁片、硫酸铜溶液; 灵敏电流计、导线、烧杯、原电池实验器。
2、实验要求:
1)、设计原电池
2)、画出实验装置图
3)、写出电极方程式
4)、预测现象
实践新知
主题一 单液原电池
实验装置图 电极反应式书写 预测实验现象
负极 Zn -2e =Zn2+
正极 Cu2++2e=Cu
1、电流表示数发生偏转
2、铜片表面有铜析出
3、锌片逐渐溶解
注意事项:
1、实验前用砂纸打磨锌片,烧杯中倒入2/3的硫酸铜溶液。
2、实验至少半分钟以上,观察实验现象和记录电流表的最大读数和变化趋势。
3、使用后在用砂纸打磨锌片,以待之后的实验。
主题一 单液原电池
问题1、为什么不同的金属材料做负极,电流表示数
不同
问题2、锌片表面的红色物质是什么?电流表的示数逐渐减小说明了什么?为什么会逐渐减小?
讨论
原电池输出电能的能力:取决于组成原电池的反应物的氧化还原能力
问题3、应怎么避免锌片表面出现红色物质?
主题一 单液原电池
硫酸铜溶液
硫酸锌溶液
问题4
上述装置构成原电池了吗?为什么?怎样才能构成原电池呢?
主题二 双液原电池
盐桥中通常装有含琼胶的KCl饱和溶液
作用:(1)使整个装置构成通路,代替两溶液直接接触。(2)平衡电荷。
锌半电池反应: Zn - 2e- = Zn2+
铜半电池反应: : Cu2++ 2e- = Cu
双液原电池是由两个半电池组成的;
总反应: : Zn+ Cu2+ = Zn2+ + Cu
1、判断下列哪些装置能构成原电池。为什么?
√
√
双液原电池比单液原电池优点:
1、能量转化率高, 2、电流稳定。
主题二 双液原电池
1、根据氧化还原反应电子转移判断电极反应。
负极:F e-2e - = Fe 2+
正极: Cu2++ 2e- = Cu
2、根据电极反应确定合适的电极材料和电解质溶液
原电池的设计
利用Fe + Cu2+=Fe2+ +Cu ,设计一个原电池.
Cu
Fe
CuSO4
FeSO4
化合价升高 失2e-
化合价降低 得2e-
主题三 设计原电池
用模
某原电池的总反应的离子方程式为:
2Fe3++Fe == 3Fe2+,
不能实现该反应的原电池组成是( )
A、正极为铜,负极为铁,电解质溶液为FeCl3溶液
B、正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C、正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D、正极为银,负极为铁,电解质溶液为CuSO4溶液
CD
【当堂达标】
归纳总结
推理
发现问题分析问题
证据
微观:氧化还原原理
宏观:原电池装置
模型
原电池设计的二维图
创新
设计新型原电池
应用
意义
社会责任
将化学价值最大化
谢谢大家
