化学人教版(2019)必修第一册1.2.1电解质的电离(共29张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2.1电解质的电离(共29张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-07 19:04:54 | ||
图片预览






文档简介
(共29张PPT)
第一章 物质及其变化
第二节 离子反应
第1 课时 电解质的电离
习
学
目
标
1.通过探究几组物质的导电性实验形成电离的概念,能从宏微
结合的角度进一步对物质进行分类,以探究的方式建构电离
模型。
2.通过合作探究对溶液导电性的分析,知道电解质、非电解质
的概念,认识常见的电解质,能从微观的角度(电离)认识
酸、碱和盐,并能用电离方程式表示酸、碱、盐的电离过程。
3.通过化学实验认识电解质的电离及电离条件,建立电离方程
式的认知模型,激发学习化学的兴趣,培养严谨求实、勇于探
索的科学精神。
查阅资料,这主要是因为人皮肤中汗液有盐分(主要成分是NaCl),这样湿手就成了导电体,此时去摸开关是十分危险的。
《用电安全规范》中要求:
不要用湿手去接触电源开关、插座或其他电气设备。
物质导电的原因有哪些?NaCl固体 溶于水到底发生了什么变化呢?
一、电解质及其导电性
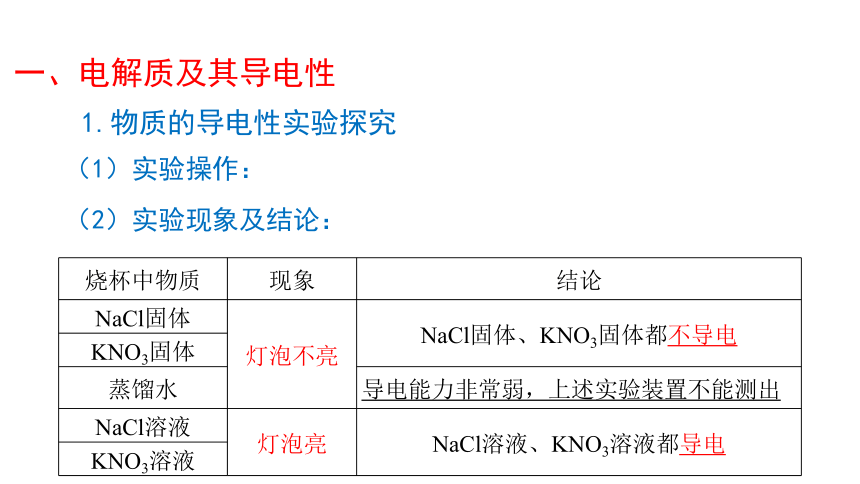
1.物质的导电性实验探究
(1)实验操作:
将如图装置中的样品依次更换为NaCl固体、KNO3固体、蒸馏水、NaCl溶液、KNO3溶液
一、电解质及其导电性
1.物质的导电性实验探究
(1)实验操作:
(2)实验现象及结论:
烧杯中物质 现象 结论
NaCl固体 灯泡不亮 NaCl固体、KNO3固体都不导电
KNO3固体
蒸馏水 导电能力非常弱,上述实验装置不能测出
NaCl溶液 灯泡亮 NaCl溶液、KNO3溶液都导电
KNO3溶液
一、电解质及其导电性
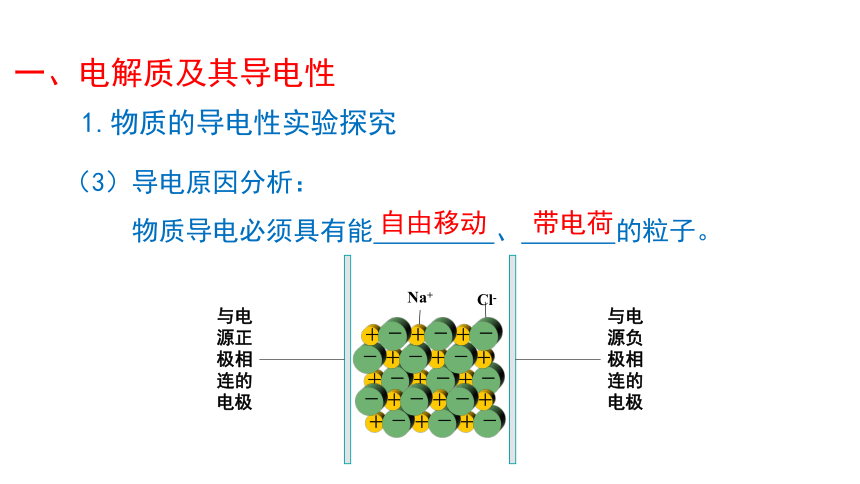
1.物质的导电性实验探究
(3)导电原因分析:
物质导电必须具有能 、 的粒子。
自由移动
带电荷
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
Cl-
Na+
与电源正极相连的电极
与电源负极相连的电极
一、电解质及其导电性
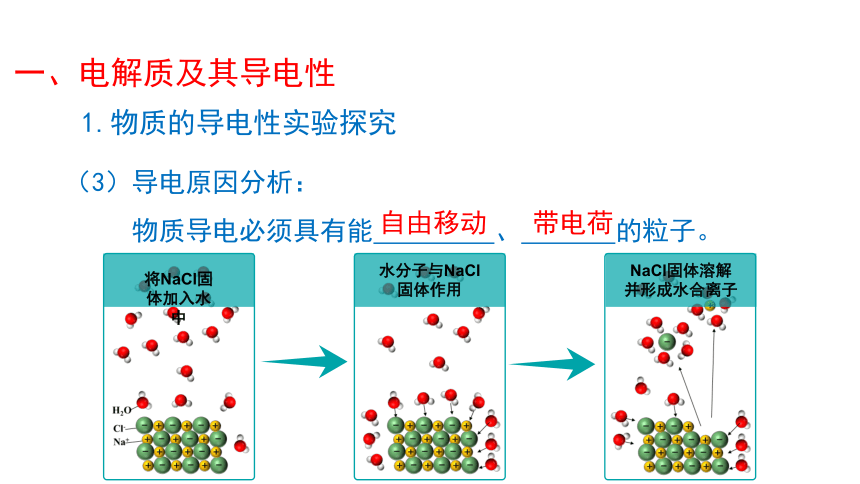
1.物质的导电性实验探究
(3)导电原因分析:
物质导电必须具有能 、 的粒子。
自由移动
带电荷
将NaCl固体加入水中
水分子与NaCl固体作用
NaCl固体溶解并形成水合离子
一、电解质及其导电性
1.物质的导电性实验探究
(3)导电原因分析:
物质导电必须具有能 、 的粒子。
①NaCl固体、KNO3固体中含有阴、阳离子,但这些离子不能自由移动,因此其固体不导电
②NaCl溶液、KNO3溶液导电的原因是在水溶液中,存在着能自由移动的、带电荷的粒子。
自由移动
带电荷
一、电解质及其导电性
1.物质的导电性实验探究
(3)导电原因分析:
物质导电必须具有能 、 的粒子。
自由移动
带电荷
一、电解质及其导电性
1.物质的导电性实验探究
(3)导电原因分析:
物质导电必须具有能 、 的粒子。
③NaCl固体受热熔化时,因温度升高,离子的运动加快,克服了离子间的相互作用,产生了能够自由移动的Na+与Cl-,所以熔融状态的NaCl可以导电。
结论:某些化合物在水溶液或熔融状态下能产生自由移动的离子。
自由移动
带电荷
2.电解质和非电解质
水溶液
熔融状态
化合物
酸
碱
盐
一、电解质及其导电性
(1)
一、电解质及其导电性
2.电解质和非电解质
(2)
一、电解质及其导电性
2.电解质和非电解质
(3)强电解质和弱电解质:
①强电解质:在水溶液或熔融状态下能全部电离的电解质。 包括以下几种:
强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI(常考六大强酸);
强碱:KOH、NaOH、Ca(OH)2、Ba(OH)2(四大强碱);
绝大多数盐:NaCl、Na2CO3、CaCO3、AgCl等;
金属氧化物:Na2O、CaO等。
一、电解质及其导电性
2.电解质和非电解质
(3)强电解质和弱电解质:
②弱电解质:在水溶液或熔融状态下部分电离的电解质。包括以下几种:
弱酸:CH3COOH、H2SO3、H2S、H2CO3、H3PO4等;
弱碱:NH3·H2O、Mg(OH)2、Fe(OH)3、Cu(OH)2等;
少数盐:(CH3COO)2Pb、Hg2Cl2等;
H2O
【典例精讲】下列物质中哪些是电解质?哪些是非电解质?哪些能导电?物质为什么能导电?
①金属铜 ②固态NaCl ③O2 ④稀硫酸 ⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液 ⑧熔融状态的KNO3 ⑨葡萄糖 ⑩ BaSO4 CO2 盐酸 水
①金属铜、碳棒能导电
②稀硫酸、KOH水溶液、熔融KNO3、盐酸能导电
有自由移动的电子存在
有自由移动的离子存在
电解质:②⑧⑩
非电解质:⑨
能导电:①④⑤⑦⑧
①单质和混合物既不是电解质也不是非电解质。
②电解质不一定能导电,如固态NaCl、液态HCl等;
③能导电的物质不一定是电解质,如铁、铝等金属单质;
④非电解质不导电,但不导电的物质不一定是非电解质,如金刚石、单质硫等一些非金属单质。
⑤电解质一定是指自身电离生成离子的化合物,有些化合物的水溶液能导电,但溶液中的离子不是它自身电离产生的,不属于电解质。如CO2、SO2、NH3、SO3等是非电解质,它们与水反应生成的产物H2CO3、H2SO3、NH3·H2O、H2SO4自身能电离,是电解质。
【易错提示】
1、下列说法正确的是( )
A.硫酸钡不溶于水,所以硫酸钡是非电解质
B.某物质溶于水所得溶液可以导电,故该物质一定是电解质
C.电解质在熔融状态时和溶于水时都能导电
D.液态氯化氢不能导电,但氯化氢是电解质
【对点训练1】
D
2、下列有关电解质的说法正确的是( )
A.Ca(OH)2固体溶于水后能导电,所以Ca(OH)2是电解质
B.CO2的水溶液能够导电,所以CO2是电解质
C.铜导电性很好,所以铜是电解质
D.FeCl3溶液能够导电,所以FeCl3溶液是电解质
【对点训练1】
A
1.电解质的电离
二、电解质的电离与电离方程式
(1)电离:电解质在水溶液中或熔融状态下,离解成自由移动的离子的过程。
一般情况下,酸的电离条件是溶于水,盐、碱或氧化物的电离条件是溶于水或熔融。
2. 电离方程式的书写
二、电解质的电离与电离方程式
(1)强电解质电离方程式:用 连接
NaCl Na++Cl- KNO3 K++NO3-
H2SO4 2H++SO42- NaOH Na++OH-
(2)弱电解质电离方程式:用 连接
CH3COOH CH3COO- + H+ NH3·H2O NH4+ + OH-
H2CO3 H++ HCO3-
HCO3- H++ CO32-
多元弱酸分步电离
Cu(OH)2 Cu2++2OH-
多元弱碱分步电离,但一步写出所有离子
2. 电离方程式的书写
二、电解质的电离与电离方程式
(3)酸式盐的电离方程式:用 连接
①NaHSO4的电离
在水溶液中:NaHSO4 Na++ H++ SO42-
在熔融状态下:NaHSO4(熔融) Na++ HSO4-
②NaHCO3的电离
在水溶液中:NaHCO3 Na++ HCO3- HCO3- H++ CO32-
在熔融状态下:NaHCO3(熔融) Na++ HCO3-
【典例精讲】写出 H2SO4、HNO3 、KOH、Ba(OH)2 、K2SO4和NH4NO3的电离方程式。
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
KOH = OH- + K+
Ba(OH)2 = 2OH- + Ba 2+
K2SO4 = 2K+ + SO4 2-
NH4NO3 = NH4+ + NO3-
3.从电离的角度认识酸、碱、盐:
二、电解质的电离与电离方程式
(1)酸:
(2)碱:
(3)盐:
水溶液中电离出的阳离子全部是H+的化合物。
水溶液中电离出的阴离子全部是OH-的化合物。
由金属阳离子(或NH4+)和酸根阴离子组成的化合物。
1、下列有关物质在水溶液中的电离方程式书写正确的是( )
A.Na2CO3===2Na++CO32-
B.AlCl3===Al3++Cl-
C.Mg(NO3)2===Mg+2+2NO3-
D.KMnO4===K++Mn7++4O2-
【对点训练2】
A
1、下列有关物质在水溶液中的电离方程式书写正确的是( )
A.Na2CO3===2Na++CO32-
B.AlCl3===Al3++Cl-
C.Mg(NO3)2===Mg+2+2NO3-
D.KMnO4===K++Mn7++4O2-
【对点训练2】
A
【易错提示】电离方程式书写注意事项
(1)符合客观事实。不能随意书写离子符号,离子所带电荷数必须等于该元素或原子团在该化合物中的化合价。离子的个数用“2”“3”等标在离子符号之前。
(2)质量守恒。即电离方程式左右两侧元素的种类、原子或原子团的个数相等。
(3)电荷守恒。即电离方程式左右两侧的正负电荷数相等,溶液呈电中性。
化合物
非电解质
电解质
水溶液或熔融状态下能导电
电解质导电原因
电解质种类
电解质电离方程式书写
从电离的角度认识酸碱盐
多数有机物、
非金属氧化物(CO2、SO2等)、
NH3等
【课堂小结】
THANKS
第一章 物质及其变化
第二节 离子反应
第1 课时 电解质的电离
习
学
目
标
1.通过探究几组物质的导电性实验形成电离的概念,能从宏微
结合的角度进一步对物质进行分类,以探究的方式建构电离
模型。
2.通过合作探究对溶液导电性的分析,知道电解质、非电解质
的概念,认识常见的电解质,能从微观的角度(电离)认识
酸、碱和盐,并能用电离方程式表示酸、碱、盐的电离过程。
3.通过化学实验认识电解质的电离及电离条件,建立电离方程
式的认知模型,激发学习化学的兴趣,培养严谨求实、勇于探
索的科学精神。
查阅资料,这主要是因为人皮肤中汗液有盐分(主要成分是NaCl),这样湿手就成了导电体,此时去摸开关是十分危险的。
《用电安全规范》中要求:
不要用湿手去接触电源开关、插座或其他电气设备。
物质导电的原因有哪些?NaCl固体 溶于水到底发生了什么变化呢?
一、电解质及其导电性
1.物质的导电性实验探究
(1)实验操作:
将如图装置中的样品依次更换为NaCl固体、KNO3固体、蒸馏水、NaCl溶液、KNO3溶液
一、电解质及其导电性
1.物质的导电性实验探究
(1)实验操作:
(2)实验现象及结论:
烧杯中物质 现象 结论
NaCl固体 灯泡不亮 NaCl固体、KNO3固体都不导电
KNO3固体
蒸馏水 导电能力非常弱,上述实验装置不能测出
NaCl溶液 灯泡亮 NaCl溶液、KNO3溶液都导电
KNO3溶液
一、电解质及其导电性
1.物质的导电性实验探究
(3)导电原因分析:
物质导电必须具有能 、 的粒子。
自由移动
带电荷
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
Cl-
Na+
与电源正极相连的电极
与电源负极相连的电极
一、电解质及其导电性
1.物质的导电性实验探究
(3)导电原因分析:
物质导电必须具有能 、 的粒子。
自由移动
带电荷
将NaCl固体加入水中
水分子与NaCl固体作用
NaCl固体溶解并形成水合离子
一、电解质及其导电性
1.物质的导电性实验探究
(3)导电原因分析:
物质导电必须具有能 、 的粒子。
①NaCl固体、KNO3固体中含有阴、阳离子,但这些离子不能自由移动,因此其固体不导电
②NaCl溶液、KNO3溶液导电的原因是在水溶液中,存在着能自由移动的、带电荷的粒子。
自由移动
带电荷
一、电解质及其导电性
1.物质的导电性实验探究
(3)导电原因分析:
物质导电必须具有能 、 的粒子。
自由移动
带电荷
一、电解质及其导电性
1.物质的导电性实验探究
(3)导电原因分析:
物质导电必须具有能 、 的粒子。
③NaCl固体受热熔化时,因温度升高,离子的运动加快,克服了离子间的相互作用,产生了能够自由移动的Na+与Cl-,所以熔融状态的NaCl可以导电。
结论:某些化合物在水溶液或熔融状态下能产生自由移动的离子。
自由移动
带电荷
2.电解质和非电解质
水溶液
熔融状态
化合物
酸
碱
盐
一、电解质及其导电性
(1)
一、电解质及其导电性
2.电解质和非电解质
(2)
一、电解质及其导电性
2.电解质和非电解质
(3)强电解质和弱电解质:
①强电解质:在水溶液或熔融状态下能全部电离的电解质。 包括以下几种:
强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI(常考六大强酸);
强碱:KOH、NaOH、Ca(OH)2、Ba(OH)2(四大强碱);
绝大多数盐:NaCl、Na2CO3、CaCO3、AgCl等;
金属氧化物:Na2O、CaO等。
一、电解质及其导电性
2.电解质和非电解质
(3)强电解质和弱电解质:
②弱电解质:在水溶液或熔融状态下部分电离的电解质。包括以下几种:
弱酸:CH3COOH、H2SO3、H2S、H2CO3、H3PO4等;
弱碱:NH3·H2O、Mg(OH)2、Fe(OH)3、Cu(OH)2等;
少数盐:(CH3COO)2Pb、Hg2Cl2等;
H2O
【典例精讲】下列物质中哪些是电解质?哪些是非电解质?哪些能导电?物质为什么能导电?
①金属铜 ②固态NaCl ③O2 ④稀硫酸 ⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液 ⑧熔融状态的KNO3 ⑨葡萄糖 ⑩ BaSO4 CO2 盐酸 水
①金属铜、碳棒能导电
②稀硫酸、KOH水溶液、熔融KNO3、盐酸能导电
有自由移动的电子存在
有自由移动的离子存在
电解质:②⑧⑩
非电解质:⑨
能导电:①④⑤⑦⑧
①单质和混合物既不是电解质也不是非电解质。
②电解质不一定能导电,如固态NaCl、液态HCl等;
③能导电的物质不一定是电解质,如铁、铝等金属单质;
④非电解质不导电,但不导电的物质不一定是非电解质,如金刚石、单质硫等一些非金属单质。
⑤电解质一定是指自身电离生成离子的化合物,有些化合物的水溶液能导电,但溶液中的离子不是它自身电离产生的,不属于电解质。如CO2、SO2、NH3、SO3等是非电解质,它们与水反应生成的产物H2CO3、H2SO3、NH3·H2O、H2SO4自身能电离,是电解质。
【易错提示】
1、下列说法正确的是( )
A.硫酸钡不溶于水,所以硫酸钡是非电解质
B.某物质溶于水所得溶液可以导电,故该物质一定是电解质
C.电解质在熔融状态时和溶于水时都能导电
D.液态氯化氢不能导电,但氯化氢是电解质
【对点训练1】
D
2、下列有关电解质的说法正确的是( )
A.Ca(OH)2固体溶于水后能导电,所以Ca(OH)2是电解质
B.CO2的水溶液能够导电,所以CO2是电解质
C.铜导电性很好,所以铜是电解质
D.FeCl3溶液能够导电,所以FeCl3溶液是电解质
【对点训练1】
A
1.电解质的电离
二、电解质的电离与电离方程式
(1)电离:电解质在水溶液中或熔融状态下,离解成自由移动的离子的过程。
一般情况下,酸的电离条件是溶于水,盐、碱或氧化物的电离条件是溶于水或熔融。
2. 电离方程式的书写
二、电解质的电离与电离方程式
(1)强电解质电离方程式:用 连接
NaCl Na++Cl- KNO3 K++NO3-
H2SO4 2H++SO42- NaOH Na++OH-
(2)弱电解质电离方程式:用 连接
CH3COOH CH3COO- + H+ NH3·H2O NH4+ + OH-
H2CO3 H++ HCO3-
HCO3- H++ CO32-
多元弱酸分步电离
Cu(OH)2 Cu2++2OH-
多元弱碱分步电离,但一步写出所有离子
2. 电离方程式的书写
二、电解质的电离与电离方程式
(3)酸式盐的电离方程式:用 连接
①NaHSO4的电离
在水溶液中:NaHSO4 Na++ H++ SO42-
在熔融状态下:NaHSO4(熔融) Na++ HSO4-
②NaHCO3的电离
在水溶液中:NaHCO3 Na++ HCO3- HCO3- H++ CO32-
在熔融状态下:NaHCO3(熔融) Na++ HCO3-
【典例精讲】写出 H2SO4、HNO3 、KOH、Ba(OH)2 、K2SO4和NH4NO3的电离方程式。
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
KOH = OH- + K+
Ba(OH)2 = 2OH- + Ba 2+
K2SO4 = 2K+ + SO4 2-
NH4NO3 = NH4+ + NO3-
3.从电离的角度认识酸、碱、盐:
二、电解质的电离与电离方程式
(1)酸:
(2)碱:
(3)盐:
水溶液中电离出的阳离子全部是H+的化合物。
水溶液中电离出的阴离子全部是OH-的化合物。
由金属阳离子(或NH4+)和酸根阴离子组成的化合物。
1、下列有关物质在水溶液中的电离方程式书写正确的是( )
A.Na2CO3===2Na++CO32-
B.AlCl3===Al3++Cl-
C.Mg(NO3)2===Mg+2+2NO3-
D.KMnO4===K++Mn7++4O2-
【对点训练2】
A
1、下列有关物质在水溶液中的电离方程式书写正确的是( )
A.Na2CO3===2Na++CO32-
B.AlCl3===Al3++Cl-
C.Mg(NO3)2===Mg+2+2NO3-
D.KMnO4===K++Mn7++4O2-
【对点训练2】
A
【易错提示】电离方程式书写注意事项
(1)符合客观事实。不能随意书写离子符号,离子所带电荷数必须等于该元素或原子团在该化合物中的化合价。离子的个数用“2”“3”等标在离子符号之前。
(2)质量守恒。即电离方程式左右两侧元素的种类、原子或原子团的个数相等。
(3)电荷守恒。即电离方程式左右两侧的正负电荷数相等,溶液呈电中性。
化合物
非电解质
电解质
水溶液或熔融状态下能导电
电解质导电原因
电解质种类
电解质电离方程式书写
从电离的角度认识酸碱盐
多数有机物、
非金属氧化物(CO2、SO2等)、
NH3等
【课堂小结】
THANKS
