9.3溶液的浓度同步练习 (无答案)九年级化学人教版下册
文档属性
| 名称 | 9.3溶液的浓度同步练习 (无答案)九年级化学人教版下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 129.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-07 00:00:00 | ||
图片预览

文档简介
人教版九年级下9.3溶液的浓度
一、选择题
1. 用氯化钠固体和水配制50g质量分数为3%的氯化钠溶液,实验步骤是
A.计算、称量、量取、溶解 B.计算、称量、过滤、溶解
C.计算、量取、溶解 D.计算、量取、混匀
2. 下图是配制100g溶质质量分数为10%的氯化钠溶液的操作。以下认识错误的是
A.②中称量氯化钠时在天平两边垫上等质量的纸片
B.称量时如果发现指针偏向右边,应向左盘添加氯化钠至天平平衡
C.该实验操作顺序为④②①⑤③
D.配制该溶液需要称取10g氯化钠,量取100mL水
3. 现有四种溶液:①20℃时饱和石灰水;②20℃时不饱和石灰水;③20℃时饱和硝酸钾溶液;④20℃时不饱和硝酸钾溶液,关于它们的溶质质量分数的说法中正确的是
A.①一定比③大 B.④一定比②大
C.④一定比①小 D.②一定比③小
4. 下列有关说法不正确的是
A.“真金不怕火炼”不是说黄金的熔点高,而是黄金的化学性质稳定
B.在化学反应中,原子的核电荷数和核外电子数都不发生变化
C.变瘪乒乓球放入热水中能鼓起来,是因为分子间隔变大的缘故
D.一定温度下,向溶液中加入溶质可能导致其溶质质量分数增大
5. 下列关于溶解度图像分析(不考滤结晶水合物)正确的是
A.高于t1℃时甲溶液溶质质量分数一定更大
B.降温是将a处的甲溶液变饱和的唯一方法
C.t1℃时50g乙投入水中一定能形成饱和溶液
D.t2℃时相同质量的甲、乙饱和溶液,乙溶液中溶剂质量更大
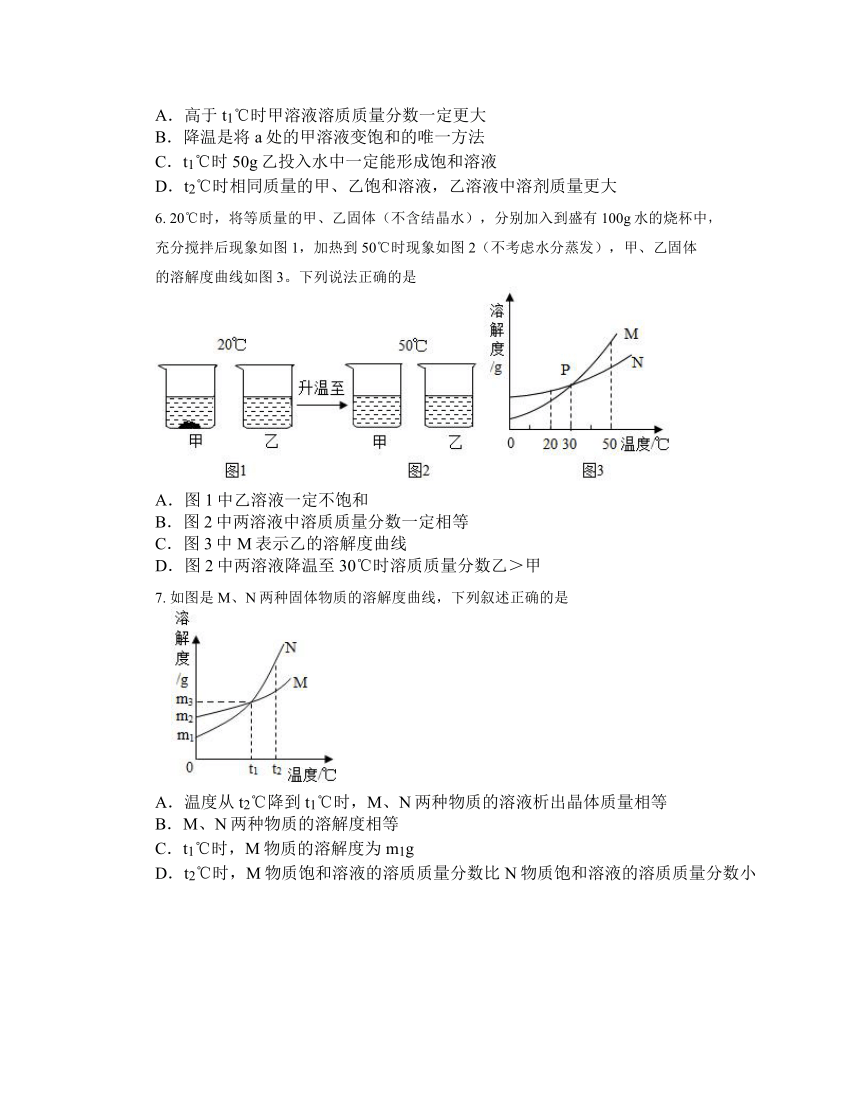
6. 20℃时,将等质量的甲、乙固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2(不考虑水分蒸发),甲、乙固体的溶解度曲线如图3。下列说法正确的是
A.图1中乙溶液一定不饱和
B.图2中两溶液中溶质质量分数一定相等
C.图3中M表示乙的溶解度曲线
D.图2中两溶液降温至30℃时溶质质量分数乙>甲
7. 如图是M、N两种固体物质的溶解度曲线,下列叙述正确的是
A.温度从t2℃降到t1℃时,M、N两种物质的溶液析出晶体质量相等
B.M、N两种物质的溶解度相等
C.t1℃时,M物质的溶解度为m1g
D.t2℃时,M物质饱和溶液的溶质质量分数比N物质饱和溶液的溶质质量分数小
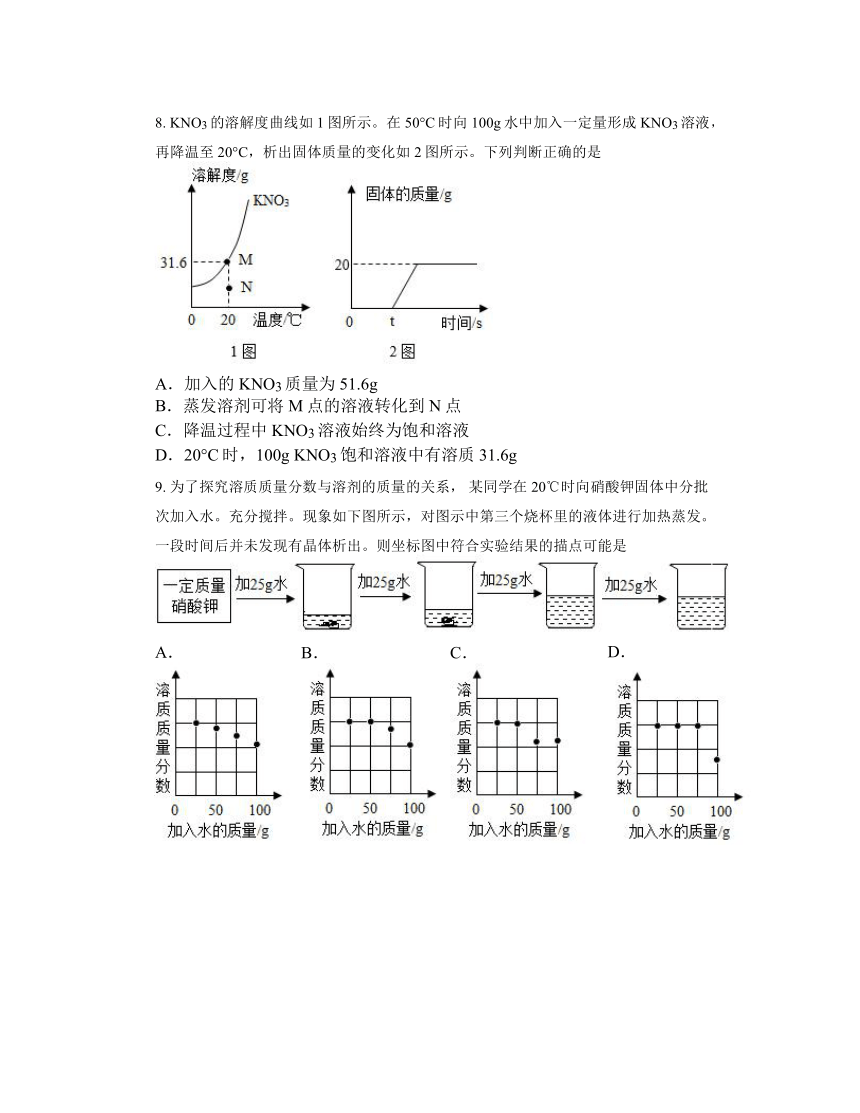
8. KNO3的溶解度曲线如1图所示。在50°C时向100g水中加入一定量形成KNO3溶液,再降温至20°C,析出固体质量的变化如2图所示。下列判断正确的是
A.加入的KNO3质量为51.6g
B.蒸发溶剂可将M点的溶液转化到N点
C.降温过程中KNO3溶液始终为饱和溶液
D.20°C时,100g KNO3饱和溶液中有溶质31.6g
9. 为了探究溶质质量分数与溶剂的质量的关系, 某同学在20℃时向硝酸钾固体中分批次加入水。充分搅拌。现象如下图所示,对图示中第三个烧杯里的液体进行加热蒸发。一段时间后并未发现有晶体析出。则坐标图中符合实验结果的描点可能是
A. B. C. D.
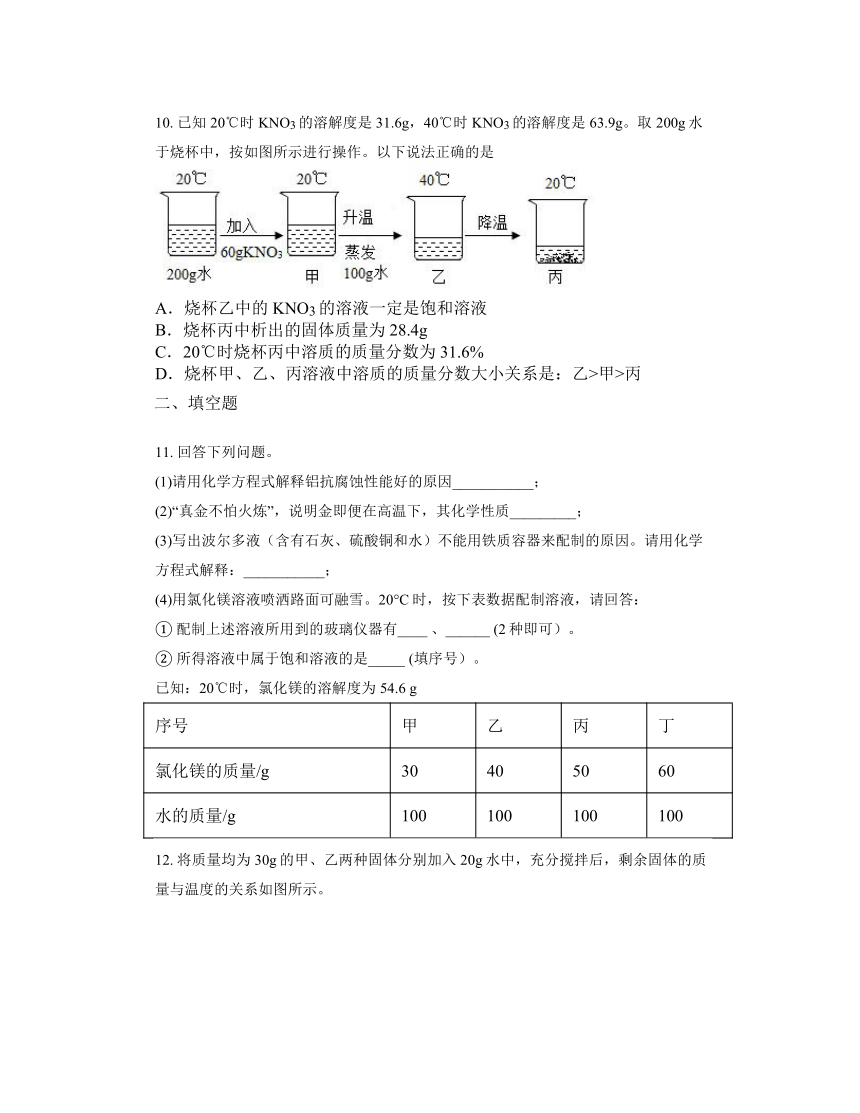
10. 已知20℃时KNO3的溶解度是31.6g,40℃时KNO3的溶解度是63.9g。取200g水于烧杯中,按如图所示进行操作。以下说法正确的是
A.烧杯乙中的KNO3的溶液一定是饱和溶液
B.烧杯丙中析出的固体质量为28.4g
C.20℃时烧杯丙中溶质的质量分数为31.6%
D.烧杯甲、乙、丙溶液中溶质的质量分数大小关系是:乙>甲>丙
二、填空题
11. 回答下列问题。
(1)请用化学方程式解释铝抗腐蚀性能好的原因___________;
(2)“真金不怕火炼”,说明金即便在高温下,其化学性质_________;
(3)写出波尔多液(含有石灰、硫酸铜和水)不能用铁质容器来配制的原因。请用化学方程式解释:___________;
(4)用氯化镁溶液喷洒路面可融雪。20°C时,按下表数据配制溶液,请回答:
① 配制上述溶液所用到的玻璃仪器有____ 、______ (2种即可)。
② 所得溶液中属于饱和溶液的是_____ (填序号)。
已知:20℃时,氯化镁的溶解度为54.6 g
序号 甲 乙 丙 丁
氯化镁的质量/g 30 40 50 60
水的质量/g 100 100 100 100
12. 将质量均为30g的甲、乙两种固体分别加入20g水中,充分搅拌后,剩余固体的质量与温度的关系如图所示。
(1)a点对应的乙溶液的溶质质量分数是___。
(2)t2°C时,甲物质的溶解度为___。
(3)a、b、c三点对应的溶液的溶质质量分数大小关系为___。
(4)若乙溶液中混有少量甲,提纯乙的方法可采用___。
13. 如图是A、B两种物质的溶解度曲线,请回答:
(1)在40℃时,A、B的溶解度大小关系是___________;
(2)a点是A、B两条曲线的交点,其含义是___________;
(3)20℃时,将20gA固体放入50g水中,充分溶解后,所得溶液的溶质质量分数是___________。
(4)若A中含有少量的B杂质,提纯A的方法是___________。
14. 溶液与人类生产、生活密切相关。请结合下列图像回答问题:
(1)交点a表示的含义是______。
(2)b点处KNO3溶液的溶质质量分数为______(写出计算式即可)。
(3)KNO3溶液由d点→c点的方法是______(写一种即可)。
(4)等质量的硝酸钾和氯化钠两种固体的饱和溶液由t2℃降温到t1℃时(忽略水的蒸发),所得溶液中所含溶剂质量最少的是______(写化学式)。
(5)室温时,向25g某固体中分批次加入水,充分搅拌,结果如图2所示(保持温度不变),室温时该固体的溶解度可能是______(填写字母选项),请说明你的判断理由______。
A. 50g B. 35g C. 30g D. 25g
三、综合题
15. 金属材料在生产、生活和社会发展中的应用较为广泛。
(1)青铜是铜锡合金,其熔点要比铜______________(选填“高”或“低”)。
(2)比较铜和青铜的硬度,可采用的方法是什么?
(3)生活中铝制品的抗腐蚀性比较好,原因是_______________(用化学方程式解释)。
(4)下图是探究铁钉生锈的实验。
①一段时间后,观察到U形管中红墨水液面的变化情况是____________________。
②对比a、b中的实验现象,可得出铁生锈的一个条件是什么?____
(5)在“天问一号”探测器的控制系统中使用了导电性优良的金属铜。铜可采用如下方法制备:
方法一:火法炼铜,反应原理为
方法二:湿法炼铜,反应原理为
上述两种方法中,方法____________(选填“一”或“二”)更好,原因是________________(写一条)。
(6)贡铜是铜和锌的合金,常用来制造机械零件,仪表等。化学小组想测定某黄铜样品中锌的含量,将10g该黄铜粉末放入烧杯中,加入10g溶质质量分数为9.8%的稀硫酸,恰好完全反应。10g该黄铜粉末中锌的质量是多少?
一、选择题
1. 用氯化钠固体和水配制50g质量分数为3%的氯化钠溶液,实验步骤是
A.计算、称量、量取、溶解 B.计算、称量、过滤、溶解
C.计算、量取、溶解 D.计算、量取、混匀
2. 下图是配制100g溶质质量分数为10%的氯化钠溶液的操作。以下认识错误的是
A.②中称量氯化钠时在天平两边垫上等质量的纸片
B.称量时如果发现指针偏向右边,应向左盘添加氯化钠至天平平衡
C.该实验操作顺序为④②①⑤③
D.配制该溶液需要称取10g氯化钠,量取100mL水
3. 现有四种溶液:①20℃时饱和石灰水;②20℃时不饱和石灰水;③20℃时饱和硝酸钾溶液;④20℃时不饱和硝酸钾溶液,关于它们的溶质质量分数的说法中正确的是
A.①一定比③大 B.④一定比②大
C.④一定比①小 D.②一定比③小
4. 下列有关说法不正确的是
A.“真金不怕火炼”不是说黄金的熔点高,而是黄金的化学性质稳定
B.在化学反应中,原子的核电荷数和核外电子数都不发生变化
C.变瘪乒乓球放入热水中能鼓起来,是因为分子间隔变大的缘故
D.一定温度下,向溶液中加入溶质可能导致其溶质质量分数增大
5. 下列关于溶解度图像分析(不考滤结晶水合物)正确的是
A.高于t1℃时甲溶液溶质质量分数一定更大
B.降温是将a处的甲溶液变饱和的唯一方法
C.t1℃时50g乙投入水中一定能形成饱和溶液
D.t2℃时相同质量的甲、乙饱和溶液,乙溶液中溶剂质量更大
6. 20℃时,将等质量的甲、乙固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2(不考虑水分蒸发),甲、乙固体的溶解度曲线如图3。下列说法正确的是
A.图1中乙溶液一定不饱和
B.图2中两溶液中溶质质量分数一定相等
C.图3中M表示乙的溶解度曲线
D.图2中两溶液降温至30℃时溶质质量分数乙>甲
7. 如图是M、N两种固体物质的溶解度曲线,下列叙述正确的是
A.温度从t2℃降到t1℃时,M、N两种物质的溶液析出晶体质量相等
B.M、N两种物质的溶解度相等
C.t1℃时,M物质的溶解度为m1g
D.t2℃时,M物质饱和溶液的溶质质量分数比N物质饱和溶液的溶质质量分数小
8. KNO3的溶解度曲线如1图所示。在50°C时向100g水中加入一定量形成KNO3溶液,再降温至20°C,析出固体质量的变化如2图所示。下列判断正确的是
A.加入的KNO3质量为51.6g
B.蒸发溶剂可将M点的溶液转化到N点
C.降温过程中KNO3溶液始终为饱和溶液
D.20°C时,100g KNO3饱和溶液中有溶质31.6g
9. 为了探究溶质质量分数与溶剂的质量的关系, 某同学在20℃时向硝酸钾固体中分批次加入水。充分搅拌。现象如下图所示,对图示中第三个烧杯里的液体进行加热蒸发。一段时间后并未发现有晶体析出。则坐标图中符合实验结果的描点可能是
A. B. C. D.
10. 已知20℃时KNO3的溶解度是31.6g,40℃时KNO3的溶解度是63.9g。取200g水于烧杯中,按如图所示进行操作。以下说法正确的是
A.烧杯乙中的KNO3的溶液一定是饱和溶液
B.烧杯丙中析出的固体质量为28.4g
C.20℃时烧杯丙中溶质的质量分数为31.6%
D.烧杯甲、乙、丙溶液中溶质的质量分数大小关系是:乙>甲>丙
二、填空题
11. 回答下列问题。
(1)请用化学方程式解释铝抗腐蚀性能好的原因___________;
(2)“真金不怕火炼”,说明金即便在高温下,其化学性质_________;
(3)写出波尔多液(含有石灰、硫酸铜和水)不能用铁质容器来配制的原因。请用化学方程式解释:___________;
(4)用氯化镁溶液喷洒路面可融雪。20°C时,按下表数据配制溶液,请回答:
① 配制上述溶液所用到的玻璃仪器有____ 、______ (2种即可)。
② 所得溶液中属于饱和溶液的是_____ (填序号)。
已知:20℃时,氯化镁的溶解度为54.6 g
序号 甲 乙 丙 丁
氯化镁的质量/g 30 40 50 60
水的质量/g 100 100 100 100
12. 将质量均为30g的甲、乙两种固体分别加入20g水中,充分搅拌后,剩余固体的质量与温度的关系如图所示。
(1)a点对应的乙溶液的溶质质量分数是___。
(2)t2°C时,甲物质的溶解度为___。
(3)a、b、c三点对应的溶液的溶质质量分数大小关系为___。
(4)若乙溶液中混有少量甲,提纯乙的方法可采用___。
13. 如图是A、B两种物质的溶解度曲线,请回答:
(1)在40℃时,A、B的溶解度大小关系是___________;
(2)a点是A、B两条曲线的交点,其含义是___________;
(3)20℃时,将20gA固体放入50g水中,充分溶解后,所得溶液的溶质质量分数是___________。
(4)若A中含有少量的B杂质,提纯A的方法是___________。
14. 溶液与人类生产、生活密切相关。请结合下列图像回答问题:
(1)交点a表示的含义是______。
(2)b点处KNO3溶液的溶质质量分数为______(写出计算式即可)。
(3)KNO3溶液由d点→c点的方法是______(写一种即可)。
(4)等质量的硝酸钾和氯化钠两种固体的饱和溶液由t2℃降温到t1℃时(忽略水的蒸发),所得溶液中所含溶剂质量最少的是______(写化学式)。
(5)室温时,向25g某固体中分批次加入水,充分搅拌,结果如图2所示(保持温度不变),室温时该固体的溶解度可能是______(填写字母选项),请说明你的判断理由______。
A. 50g B. 35g C. 30g D. 25g
三、综合题
15. 金属材料在生产、生活和社会发展中的应用较为广泛。
(1)青铜是铜锡合金,其熔点要比铜______________(选填“高”或“低”)。
(2)比较铜和青铜的硬度,可采用的方法是什么?
(3)生活中铝制品的抗腐蚀性比较好,原因是_______________(用化学方程式解释)。
(4)下图是探究铁钉生锈的实验。
①一段时间后,观察到U形管中红墨水液面的变化情况是____________________。
②对比a、b中的实验现象,可得出铁生锈的一个条件是什么?____
(5)在“天问一号”探测器的控制系统中使用了导电性优良的金属铜。铜可采用如下方法制备:
方法一:火法炼铜,反应原理为
方法二:湿法炼铜,反应原理为
上述两种方法中,方法____________(选填“一”或“二”)更好,原因是________________(写一条)。
(6)贡铜是铜和锌的合金,常用来制造机械零件,仪表等。化学小组想测定某黄铜样品中锌的含量,将10g该黄铜粉末放入烧杯中,加入10g溶质质量分数为9.8%的稀硫酸,恰好完全反应。10g该黄铜粉末中锌的质量是多少?
同课章节目录
