第二章 第一节 第2课时 影响化学反应速率的因素 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1
文档属性
| 名称 | 第二章 第一节 第2课时 影响化学反应速率的因素 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 497.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-07 19:29:12 | ||
图片预览




文档简介
第2课时 影响化学反应速率的因素
[核心素养发展目标]
1.通过实验,从宏观上认识外界因素影响化学反应速率的规律。
2.建立分析探究外界因素影响化学反应速率的思维模型。
3.通过定性与定量研究影响化学反应速率的因素,提高学生设计探究方案、进行实验探究的能力。
一、实验探究影响化学反应速率的外界因素
Ⅰ、定性研究影响化学反应速率的因素
1.科学研究的基本步骤
提出问题→收集化学事实与信息→提出假设→设计实验方案→实验探究→得出结论
化学事实和信息 提出假设——反应速率的影响因素
Na与水的反应比Mg与水的反应剧烈
食物真空保存变质慢
夏天食物变质快
向H2O2中加入MnO2后会迅速分解产生气泡
将等质量的铁片与铁粉放入稀硫酸中,铁粉产生气泡较快
2.化学反应速率的定性描述
能体现化学反应速率的反应现象有:颜色________快慢,产生气泡________,产生浑浊快慢,固体减少快慢等。
3.定性研究影响化学反应速率的因素
(1)实验原理
Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O
2H2O22H2O+O2↑
(2)实验方案设计
影响因素 实验步骤 实验现象 实验结论
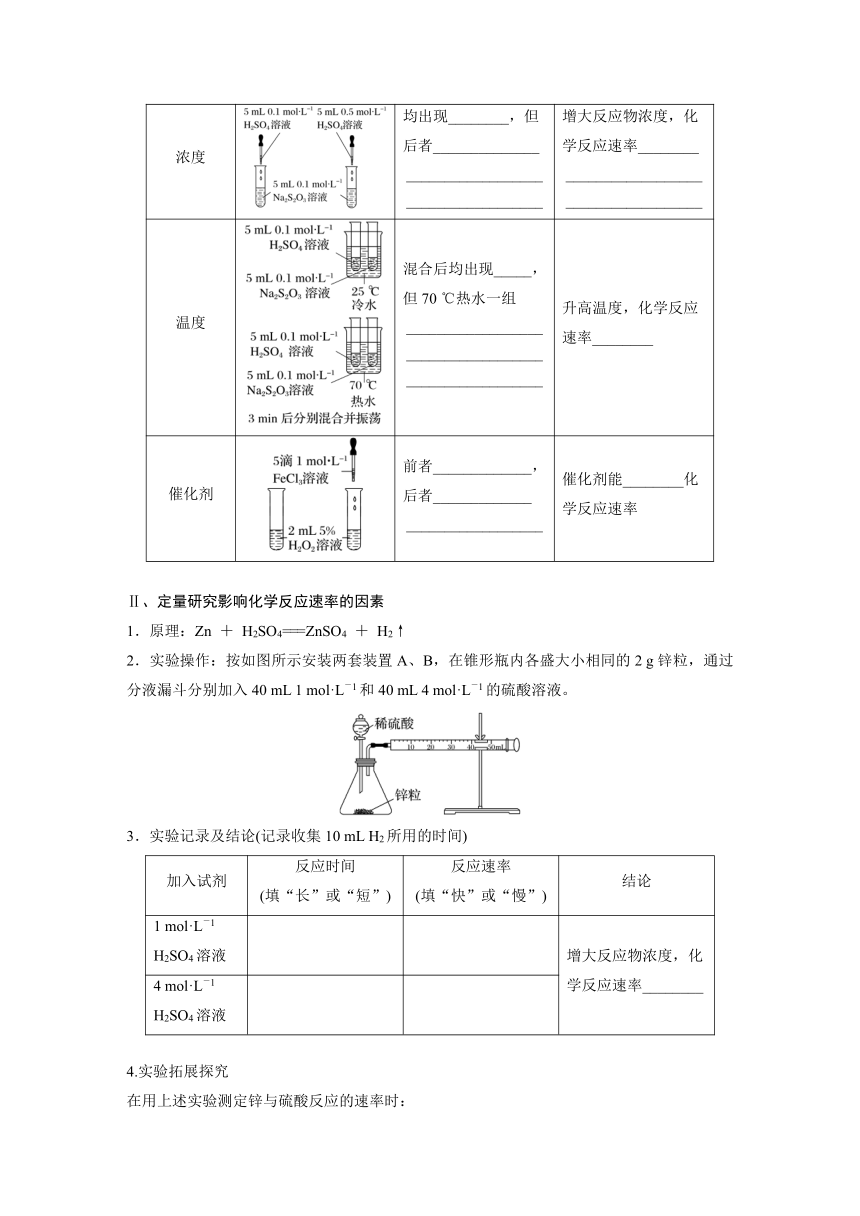
浓度 均出现________,但后者______________ ____________________________________ 增大反应物浓度,化学反应速率________ ____________________________________
温度 混合后均出现_____,但70 ℃热水一组 ______________________________________________________ 升高温度,化学反应速率________
催化剂 前者_____________,后者_____________ __________________ 催化剂能________化学反应速率
Ⅱ、定量研究影响化学反应速率的因素
1.原理:Zn + H2SO4===ZnSO4 + H2↑
2.实验操作:按如图所示安装两套装置A、B,在锥形瓶内各盛大小相同的2 g锌粒,通过分液漏斗分别加入40 mL 1 mol·L-1和40 mL 4 mol·L-1的硫酸溶液。
3.实验记录及结论(记录收集10 mL H2所用的时间)
加入试剂 反应时间 (填“长”或“短”) 反应速率 (填“快”或“慢”) 结论
1 mol·L-1 H2SO4溶液 增大反应物浓度,化学反应速率________
4 mol·L-1 H2SO4溶液
4.实验拓展探究
在用上述实验测定锌与硫酸反应的速率时:
(1)为确保测定的准确性,应注意哪些事项?
________________________________________________________________________
________________________________________________________________________。
(2)用上述装置测定化学反应速率时,操作、药品无误,结果测定速率偏大,从装置缺陷的角度分析可能的原因是______________________________________________________
________________________________________________________________________。
(3)除了测定氢气的体积外,你还能设计哪些方案测定锌与稀硫酸反应的速率?________________________________________________________________________
________________________________________________________________________
(1)任何化学反应都可以通过反应现象判断化学反应的快慢( )
(2)测定化学反应速率,可以用比色的方法测定溶液颜色的深浅进行比较( )
(3)可用装置测定过氧化氢分解的化学反应速率( )
(4)锌与H2SO4反应,H2SO4的浓度越大,产生H2的速率越快( )
1.(1)亚氯酸盐(如NaClO2)可用作漂白剂,在常温,不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O,分解时刚加入硫酸反应缓慢,随后突然反应释放出大量ClO2,这是因为_______________________________。
(2)H2O2分解制O2的实验中,在10% H2O2溶液中未加催化剂,试管口带火星的木条没有明显变化。加入MnO2粉末,溶液中迅速产生大量气泡,木条立刻复燃;若加入1 mL 0.1 mol·
L-1 FeCl3溶液,溶液中产生气泡比较快,木条复燃; 若加入1 mL 0.1 mol·L-1 CuCl2溶液,溶液中产生气泡比较慢,一段时间后木条复燃。由此可知催化剂的催化效果 _____________。
2.控制变量法是化学实验的常用方法之一。某化学兴趣小组为探究外界条件对化学反应速率的影响,设计以下四组实验。
实验方案 反应温度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
回答下列问题:
(1)V1=____,V2=____。
(2)设计实验方案①和②的目的是:_________________________________________________。
(3)设计实验方案②和④的目的是: __________________________________________
________________________________________________________________________。
(4)各实验方案中均需加入一定体积的水的原因: ______________________________。
1.某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为( )
实验编号 反应物 催化剂
① 10 mL 2% H2O2溶液 无
② 无
③ 10 mL 5% H2O2溶液 MnO2固体
A.5 mL 2% H2O2溶液
B.10 mL 2% H2O2溶液
C.10 mL 5% H2O2溶液
D.5 mL 10% H2O2溶液
2.草酸(H2C2O4)是一种重要的化学试剂。下面是利用草酸探究外界条件对反应速率影响的实验。
(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是________(填字母)。
A.可能明显加快
B.可能明显减慢
C.几乎无影响,可以忽略
(2)用酸性KMnO4和H2C2O4反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1(KMnO4溶液已酸化):
实验序号 A溶液 B溶液
① 20 mL 0.1 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
② 20 mL 0.2 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
①该反应的离子方程式为__________________________________________________________
________________________________________________________________________。
②该实验探究的是________对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是________(用实验序号填空)。
(3)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min 末c(MnO)=__________ mol·L-1(假设混合液体积为50 mL)。
(4)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:
①________________________________________________________________________;
②________________________________________________________________________。
1.实验探究的科学方法及思路
变量控制→对照实验→定性观察或定量测定→科学归纳
2.控制变量探究实验题的思维流程
二、外界因素对化学反应速率的影响
1.浓度
增大反应物的浓度,化学反应速率______;减小反应物的浓度,化学反应速率______。
注意事项 ①浓度对速率的影响适用于气体或溶液参与的反应,固体和纯液体的浓度视为常数。②对于离子反应,实际参加反应的离子浓度发生变化,才会引起化学反应速率的改变。
2.压强
增大压强,引起气体反应物浓度________,化学反应速率________;减小压强,引起气体反应物浓度________,化学反应速率____________。
注意事项 压强对速率的影响适用于有气体参与的反应,且通过浓度对反应速率的影响实现。
3.温度
升高温度,化学反应速率________;
降低温度,化学反应速率________。
注意事项 温度对反应速率的影响适用于除电化学反应外的绝大多数化学反应,如升高温度,不论吸热反应还是放热反应,不论正反应速率还是逆反应速率,均加快。
4.催化剂
催化剂同等程度的影响正、逆反应速率,正催化剂________化学反应速率,逆催化剂________化学反应速率。
5.其他因素
接触面积、溶剂的性质、光、超声波、磁场、形成原电池等均能影响化学反应速率。
注意 实际生产生活中,影响一个化学反应速率的因素可能是多方面的。
(1)增加少量固体反应物的质量,化学反应速率增大( )
(2)100 mL 2 mol·L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变( )
(3)升高温度,吸热反应速率会加快而放热反应速率会减慢( )
(4)恒容体系发生反应:2SO2+O22SO3
ΔH<0,升高温度,v正增大,v逆减小( )
(5)无论任何反应,若增大压强,反应速率一定增大( )
(6)恒温恒容密闭容器中发生的全为气体的反应,若容器内总压强增大,则反应速率一定增大( )
对于反应:N2(g)+3H2(g)2NH3(g)
(1)恒温恒容条件下,向反应体系中充入氮气,反应速率________(填“增大”“减小”或“不变”,下同),原因是_____________________________________________________。
(2)恒温恒容条件下,向反应体系中充入氦气,反应速率________,原因是________
________________________________________________________________________。
(3)恒温恒压条件下,向反应体系中充入氦气,反应速率________,原因是________
________________________________________________________________________。
1.下列实验中将水、试剂1、试剂2混合后褪色最快的是( )
选项 温度 水 试剂1 试剂2
A 25 ℃ 4 mL 4 mL 0.01 mol·L-1 KMnO4 2 mL 0.1 mol·L-1 H2C2O4
B 25 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4
C 35 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4
D 35 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4、少量MnSO4固体
2.(2022·河南新乡高二检测)下列关于化学反应速率的说法中,正确的是( )
①反应4NH3(g)+5O2(g)??4NO(g)+6H2O(g)在2 L的密闭容器中进行,1 min后,NH3减少了0.12 mol,则1 min末的化学反应速率为v(NO)=0.06 mol·L-1·min-1 ②H2(g)+S(s)??H2S(g)恒压条件下充入He,化学反应速率不变 ③恒容条件下充入气体,增大压强,一定能加快化学反应速率 ④一定量的锌与过量的稀硫酸反应制取氢气,为减缓反应速率,可向其中加入CH3COONa溶液 ⑤煅烧黄铁矿时将矿石磨成粉末可以加快反应速率 ⑥用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 ⑦光是影响某些化学反应速率的外界条件之一
A.①④⑤⑦ B.①②⑤
C.④⑤⑦ D.③④⑥
(1)温度对反应速率的影响具有一致性,升高温度,v正、v逆都增大,降低温度,v正、v逆都减小。
(2)在温度、浓度、催化剂等影响反应速率的因素中,各因素对反应速率的影响程度不同,催化剂为主要因素,其次是温度,最后是浓度。
(3)探究外界因素对化学反应速率的思维模型“实验现象——影响规律——理论解释”,解决实际问题时注意运用证据推理思路和思维认知模型。
第2课时 影响化学反应速率的因素
[核心素养发展目标] 1.通过实验,从宏观上认识外界因素影响化学反应速率的规律。2.建立分析探究外界因素影响化学反应速率的思维模型。3.通过定性与定量研究影响化学反应速率的因素,提高学生设计探究方案、进行实验探究的能力。
一、实验探究影响化学反应速率的外界因素
Ⅰ、定性研究影响化学反应速率的因素
1.科学研究的基本步骤
提出问题→收集化学事实与信息→提出假设→设计实验方案→实验探究→得出结论
化学事实和信息 提出假设——反应速率的影响因素
Na与水的反应比Mg与水的反应剧烈 反应物本身的性质
食物真空保存变质慢 反应物的浓度
夏天食物变质快 温度
向H2O2中加入MnO2后会迅速分解产生气泡 催化剂
将等质量的铁片与铁粉放入稀硫酸中,铁粉产生气泡较快 接触面积
2.化学反应速率的定性描述
能体现化学反应速率的反应现象有:颜色变化快慢,产生气泡快慢,产生浑浊快慢,固体减少快慢等。
3.定性研究影响化学反应速率的因素
(1)实验原理
Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O
2H2O22H2O+O2↑
(2)实验方案设计
影响因素 实验步骤 实验现象 实验结论
浓度 均出现浑浊,但后者出现浑浊更快 增大反应物浓度,化学反应速率增大
温度 混合后均出现浑浊,但70 ℃热水一组首先出现浑浊 升高温度,化学反应速率增大
催化剂 前者无明显现象,后者出现大量气泡 催化剂能加快化学反应速率
Ⅱ、定量研究影响化学反应速率的因素
1.原理:Zn + H2SO4===ZnSO4 + H2↑
2.实验操作:按如图所示安装两套装置A、B,在锥形瓶内各盛大小相同的2 g锌粒,通过分液漏斗分别加入40 mL 1 mol·L-1和40 mL 4 mol·L-1的硫酸溶液。
3.实验记录及结论(记录收集10 mL H2所用的时间)
加入试剂 反应时间(填“长”或“短”) 反应速率(填“快”或“慢”) 结论
1 mol·L-1 H2SO4溶液 长 慢 增大反应物浓度,化学反应速率增大
4 mol·L-1 H2SO4溶液 短 快
4.实验拓展探究
在用上述实验测定锌与硫酸反应的速率时:
(1)为确保测定的准确性,应注意哪些事项?锌的颗粒(即比表面积)大小基本相同;稀硫酸要迅速加入;装置气密性良好,且计时要迅速准确。
(2)用上述装置测定化学反应速率时,操作、药品无误,结果测定速率偏大,从装置缺陷的角度分析可能的原因是忽视加入稀硫酸排出气体的体积。
(3)除了测定氢气的体积外,你还能设计哪些方案测定锌与稀硫酸反应的速率?在恒容反应装置中,测定一段时间内压强的变化;测定一段时间内H+的浓度变化;测定一段时间内锌粒的质量变化等。
(1)任何化学反应都可以通过反应现象判断化学反应的快慢( )
(2)测定化学反应速率,可以用比色的方法测定溶液颜色的深浅进行比较( )
(3)可用装置测定过氧化氢分解的化学反应速率( )
(4)锌与H2SO4反应,H2SO4的浓度越大,产生H2的速率越快( )
答案 (1)× (2)√ (3)× (4)×
1.(1)亚氯酸盐(如NaClO2)可用作漂白剂,在常温,不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O,分解时刚加入硫酸反应缓慢,随后突然反应释放出大量ClO2,这是因为________________________。
(2)H2O2分解制O2的实验中,在10% H2O2溶液中未加催化剂,试管口带火星的木条没有明显变化。加入MnO2粉末,溶液中迅速产生大量气泡,木条立刻复燃;若加入1 mL 0.1 mol·
L-1 FeCl3溶液,溶液中产生气泡比较快,木条复燃;若加入1 mL 0.1 mol·L-1 CuCl2溶液,溶液中产生气泡比较慢,一段时间后木条复燃。由此可知催化剂的催化效果______________。
答案 (1)溶液中的 Cl- 起催化作用 (2)MnO2>Fe3+>Cu2+
解析 (1)由题给信息可知,NaClO2在酸性溶液中生成亚氯酸,生成的亚氯酸在刚加入硫酸时反应缓慢,随后突然反应加快,这说明分解生成的产物中某种物质起了催化剂的作用且该物质反应前不存在。
2.控制变量法是化学实验的常用方法之一。某化学兴趣小组为探究外界条件对化学反应速率的影响,设计以下四组实验。
实验方案 反应温度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
回答下列问题:
(1)V1=____,V2=____。
(2)设计实验方案①和②的目的是:__________________________________________________
_______________________________________________________________________________。
(3)设计实验方案②和④的目的是:__________________________________________________
_______________________________________________________________________________。
(4)各实验方案中均需加入一定体积的水的原因:_____________________________________。
答案 (1)5 10 (2)探究Na2S2O3的浓度对化学反应速率的影响 (3)探究温度对化学反应速率的影响 (4)各实验方案中混合液的体积均相等
1.某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为( )
实验编号 反应物 催化剂
① 10 mL 2% H2O2溶液 无
② 无
③ 10 mL 5% H2O2溶液 MnO2固体
A.5 mL 2% H2O2溶液
B.10 mL 2% H2O2溶液
C.10 mL 5% H2O2溶液
D.5 mL 10% H2O2溶液
答案 C
解析 本实验的目的是运用控制变量法,探究浓度、催化剂对反应速率的影响,表中已有数据中,实验①和③中有两个反应条件不同,二者无法达到实验目的;实验②和③中,应是探究催化剂对反应速率的影响,所以实验②中双氧水浓度和体积必须与实验③相同,即反应物为10 mL 5% H2O2溶液;实验①和②中都没有使用催化剂,可以探究双氧水浓度对反应速率的影响,实验②的反应物为10 mL 5% H2O2溶液,C正确。
2.草酸(H2C2O4)是一种重要的化学试剂。下面是利用草酸探究外界条件对反应速率影响的实验。
(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是________(填字母)。
A.可能明显加快
B.可能明显减慢
C.几乎无影响,可以忽略
(2)用酸性KMnO4和H2C2O4反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1(KMnO4溶液已酸化):
实验序号 A溶液 B溶液
① 20 mL 0.1 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
② 20 mL 0.2 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
①该反应的离子方程式为__________________________________________________。
②该实验探究的是________对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是________(用实验序号填空)。
(3)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min 末c(MnO)=________
mol·L-1(假设混合液体积为50 mL)。
(4)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:
①________________________________________________________________________;
②________________________________________________________________________。
答案 (1)C (2)①2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O ②草酸浓度 ②>① (3)0.005 2 (4)该反应为放热反应 产物Mn2+(或MnSO4)是反应的催化剂
解析 (1)该反应是溶液之间发生的不可逆反应,改变压强没有引起溶液体积变化,反应物浓度不改变,则对其反应速率几乎无影响,可以忽略,选项C符合题意。
(2)①MnO中Mn元素化合价从+7价降低到+2价的Mn2+,H2C2O4中C元素化合价从+3价升高到+4价的CO2,并根据元素守恒进行配平,故离子方程式为2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O;②对比①②实验,根据单一变量原则可知,该实验探究的是草酸浓度对化学反应速率的影响,两组实验溶液总体积一样,②中A溶液的草酸浓度比①中大,化学反应速率大,所得CO2的体积大。
(3)CO2的物质的量n===0.000 2 mol,用CO2表示2 min内的反应速率为=0.000 1 mol·min-1;设2 min末,反应的MnO的物质的量为x,由2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O可得关系式:
2MnO ~ 10CO2
2 10
x 0.000 2 mol
解得x=0.000 04 mol,30 mL×10-3 L·mL-1×0.01 mol·L-1-0.000 04 mol=0.000 26 mol,c(MnO)===0.005 2 mol·L-1。
(4)催化剂能加快化学反应的速率,产物Mn2+(或MnSO4)是反应的催化剂,此外反应释放热量,也可以使化学反应速率加快。
1.实验探究的科学方法及思路
变量控制→对照实验→定性观察或定量测定→科学归纳
2.控制变量探究实验题的思维流程
二、外界因素对化学反应速率的影响
1.浓度
增大反应物的浓度,化学反应速率加快;减小反应物的浓度,化学反应速率减慢。
注意事项 ①浓度对速率的影响适用于气体或溶液参与的反应,固体和纯液体的浓度视为常数。②对于离子反应,实际参加反应的离子浓度发生变化,才会引起化学反应速率的改变。
2.压强
增大压强,引起气体反应物浓度增大,化学反应速率加快;减小压强,引起气体反应物浓度减小,化学反应速率减慢。
注意事项 压强对速率的影响适用于有气体参与的反应,且通过浓度对反应速率的影响实现。
3.温度
升高温度,化学反应速率加快;
降低温度,化学反应速率减慢。
注意事项 温度对反应速率的影响适用于除电化学反应外的绝大多数化学反应,如升高温度,不论吸热反应还是放热反应,不论正反应速率还是逆反应速率,均加快。
4.催化剂
催化剂同等程度的影响正、逆反应速率,正催化剂加快化学反应速率,逆催化剂减慢化学反应速率。
5.其他因素
接触面积、溶剂的性质、光、超声波、磁场、形成原电池等均能影响化学反应速率。
注意 实际生产生活中,影响一个化学反应速率的因素可能是多方面的。
(1)增加少量固体反应物的质量,化学反应速率增大( )
(2)100 mL 2 mol·L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变( )
(3)升高温度,吸热反应速率会加快而放热反应速率会减慢( )
(4)恒容体系发生反应:2SO2+O22SO3 ΔH<0,升高温度,v正增大,v逆减小( )
(5)无论任何反应,若增大压强,反应速率一定增大( )
(6)恒温恒容密闭容器中发生的全为气体的反应,若容器内总压强增大,则反应速率一定增大( )
答案 (1)× (2)× (3)× (4)× (5)× (6)×
对于反应:N2(g)+3H2(g)2NH3(g)
(1)恒温恒容条件下,向反应体系中充入氮气,反应速率________(填“增大”“减小”或“不变”,下同),原因是_____________________________________________________。
(2)恒温恒容条件下,向反应体系中充入氦气,反应速率________,原因是__________________
_______________________________________________________________________________。
(3)恒温恒压条件下,向反应体系中充入氦气,反应速率________,原因是_______________
_______________________________________________________________________________。
答案 (1)增大 增大反应物的浓度,化学反应速率增大
(2)不变 恒容条件下,充入氦气,反应物和生成物的浓度不变,化学反应速率不变
(3)减小 压强不变,充入氦气,容积增大,反应物和生成物的浓度减小,化学反应速率减小
1.下列实验中将水、试剂1、试剂2混合后褪色最快的是( )
选项 温度 水 试剂1 试剂2
A 25 ℃ 4 mL 4 mL 0.01 mol·L-1 KMnO4 2 mL 0.1 mol·L-1 H2C2O4
B 25 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4
C 35 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4
D 35 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4、少量MnSO4固体
答案 D
解析 根据水、试剂1和试剂2三者混合后溶液总体积为10 mL,B、C、D中草酸的物质的量比A中草酸物质的量多,又因B的温度比C、D的温度低,再根据D中加入了催化剂,因此D的反应速率最快,则褪色最快,故D符合题意。
2.(2022·河南新乡高二检测)下列关于化学反应速率的说法中,正确的是( )
①反应4NH3(g)+5O2(g)??4NO(g)+6H2O(g)在2 L的密闭容器中进行,1 min后,NH3减少了0.12 mol,则1 min末的化学反应速率为v(NO)=0.06 mol·L-1·min-1 ②H2(g)+S(s)??H2S(g)恒压条件下充入He,化学反应速率不变 ③恒容条件下充入气体,增大压强,一定能加快化学反应速率 ④一定量的锌与过量的稀硫酸反应制取氢气,为减缓反应速率,可向其中加入CH3COONa溶液 ⑤煅烧黄铁矿时将矿石磨成粉末可以加快反应速率 ⑥用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 ⑦光是影响某些化学反应速率的外界条件之一
A.①④⑤⑦ B.①②⑤
C.④⑤⑦ D.③④⑥
答案 C
解析 化学反应速率为平均反应速率,不是瞬时反应速率,①错误;H2(g)+S(s)H2S(g)该反应为等体反应,恒压条件下充入稀有气体,相当于容器的体积增大,反应速率减小,②错误;恒容条件下充入无关气体(如惰性气体),容器的总压增大,分压不变,则反应速率不变,③错误;加入CH3COONa溶液,与硫酸反应生成醋酸,则氢离子的浓度减小,减缓反应速率,④正确;将矿石磨成粉末可增大接触面积,加快反应速率,⑤正确;98%的浓硫酸具有强氧化性,冷的浓硫酸与铁发生钝化,则不产生氢气,⑥错误;光是影响某些化学反应速率的外界条件之一,如氢气和氯气在光照条件下可反应生成氯化氢,⑦正确;综上所述,正确的为④⑤⑦。
(1)温度对反应速率的影响具有一致性,升高温度,v正、v逆都增大,降低温度,v正、v逆都减小。
(2)在温度、浓度、催化剂等影响反应速率的因素中,各因素对反应速率的影响程度不同,催化剂为主要因素,其次是温度,最后是浓度。
(3)探究外界因素对化学反应速率的思维模型“实验现象——影响规律——理论解释”,解决实际问题时注意运用证据推理思路和思维认知模型。
[核心素养发展目标]
1.通过实验,从宏观上认识外界因素影响化学反应速率的规律。
2.建立分析探究外界因素影响化学反应速率的思维模型。
3.通过定性与定量研究影响化学反应速率的因素,提高学生设计探究方案、进行实验探究的能力。
一、实验探究影响化学反应速率的外界因素
Ⅰ、定性研究影响化学反应速率的因素
1.科学研究的基本步骤
提出问题→收集化学事实与信息→提出假设→设计实验方案→实验探究→得出结论
化学事实和信息 提出假设——反应速率的影响因素
Na与水的反应比Mg与水的反应剧烈
食物真空保存变质慢
夏天食物变质快
向H2O2中加入MnO2后会迅速分解产生气泡
将等质量的铁片与铁粉放入稀硫酸中,铁粉产生气泡较快
2.化学反应速率的定性描述
能体现化学反应速率的反应现象有:颜色________快慢,产生气泡________,产生浑浊快慢,固体减少快慢等。
3.定性研究影响化学反应速率的因素
(1)实验原理
Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O
2H2O22H2O+O2↑
(2)实验方案设计
影响因素 实验步骤 实验现象 实验结论
浓度 均出现________,但后者______________ ____________________________________ 增大反应物浓度,化学反应速率________ ____________________________________
温度 混合后均出现_____,但70 ℃热水一组 ______________________________________________________ 升高温度,化学反应速率________
催化剂 前者_____________,后者_____________ __________________ 催化剂能________化学反应速率
Ⅱ、定量研究影响化学反应速率的因素
1.原理:Zn + H2SO4===ZnSO4 + H2↑
2.实验操作:按如图所示安装两套装置A、B,在锥形瓶内各盛大小相同的2 g锌粒,通过分液漏斗分别加入40 mL 1 mol·L-1和40 mL 4 mol·L-1的硫酸溶液。
3.实验记录及结论(记录收集10 mL H2所用的时间)
加入试剂 反应时间 (填“长”或“短”) 反应速率 (填“快”或“慢”) 结论
1 mol·L-1 H2SO4溶液 增大反应物浓度,化学反应速率________
4 mol·L-1 H2SO4溶液
4.实验拓展探究
在用上述实验测定锌与硫酸反应的速率时:
(1)为确保测定的准确性,应注意哪些事项?
________________________________________________________________________
________________________________________________________________________。
(2)用上述装置测定化学反应速率时,操作、药品无误,结果测定速率偏大,从装置缺陷的角度分析可能的原因是______________________________________________________
________________________________________________________________________。
(3)除了测定氢气的体积外,你还能设计哪些方案测定锌与稀硫酸反应的速率?________________________________________________________________________
________________________________________________________________________
(1)任何化学反应都可以通过反应现象判断化学反应的快慢( )
(2)测定化学反应速率,可以用比色的方法测定溶液颜色的深浅进行比较( )
(3)可用装置测定过氧化氢分解的化学反应速率( )
(4)锌与H2SO4反应,H2SO4的浓度越大,产生H2的速率越快( )
1.(1)亚氯酸盐(如NaClO2)可用作漂白剂,在常温,不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O,分解时刚加入硫酸反应缓慢,随后突然反应释放出大量ClO2,这是因为_______________________________。
(2)H2O2分解制O2的实验中,在10% H2O2溶液中未加催化剂,试管口带火星的木条没有明显变化。加入MnO2粉末,溶液中迅速产生大量气泡,木条立刻复燃;若加入1 mL 0.1 mol·
L-1 FeCl3溶液,溶液中产生气泡比较快,木条复燃; 若加入1 mL 0.1 mol·L-1 CuCl2溶液,溶液中产生气泡比较慢,一段时间后木条复燃。由此可知催化剂的催化效果 _____________。
2.控制变量法是化学实验的常用方法之一。某化学兴趣小组为探究外界条件对化学反应速率的影响,设计以下四组实验。
实验方案 反应温度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
回答下列问题:
(1)V1=____,V2=____。
(2)设计实验方案①和②的目的是:_________________________________________________。
(3)设计实验方案②和④的目的是: __________________________________________
________________________________________________________________________。
(4)各实验方案中均需加入一定体积的水的原因: ______________________________。
1.某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为( )
实验编号 反应物 催化剂
① 10 mL 2% H2O2溶液 无
② 无
③ 10 mL 5% H2O2溶液 MnO2固体
A.5 mL 2% H2O2溶液
B.10 mL 2% H2O2溶液
C.10 mL 5% H2O2溶液
D.5 mL 10% H2O2溶液
2.草酸(H2C2O4)是一种重要的化学试剂。下面是利用草酸探究外界条件对反应速率影响的实验。
(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是________(填字母)。
A.可能明显加快
B.可能明显减慢
C.几乎无影响,可以忽略
(2)用酸性KMnO4和H2C2O4反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1(KMnO4溶液已酸化):
实验序号 A溶液 B溶液
① 20 mL 0.1 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
② 20 mL 0.2 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
①该反应的离子方程式为__________________________________________________________
________________________________________________________________________。
②该实验探究的是________对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是________(用实验序号填空)。
(3)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min 末c(MnO)=__________ mol·L-1(假设混合液体积为50 mL)。
(4)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:
①________________________________________________________________________;
②________________________________________________________________________。
1.实验探究的科学方法及思路
变量控制→对照实验→定性观察或定量测定→科学归纳
2.控制变量探究实验题的思维流程
二、外界因素对化学反应速率的影响
1.浓度
增大反应物的浓度,化学反应速率______;减小反应物的浓度,化学反应速率______。
注意事项 ①浓度对速率的影响适用于气体或溶液参与的反应,固体和纯液体的浓度视为常数。②对于离子反应,实际参加反应的离子浓度发生变化,才会引起化学反应速率的改变。
2.压强
增大压强,引起气体反应物浓度________,化学反应速率________;减小压强,引起气体反应物浓度________,化学反应速率____________。
注意事项 压强对速率的影响适用于有气体参与的反应,且通过浓度对反应速率的影响实现。
3.温度
升高温度,化学反应速率________;
降低温度,化学反应速率________。
注意事项 温度对反应速率的影响适用于除电化学反应外的绝大多数化学反应,如升高温度,不论吸热反应还是放热反应,不论正反应速率还是逆反应速率,均加快。
4.催化剂
催化剂同等程度的影响正、逆反应速率,正催化剂________化学反应速率,逆催化剂________化学反应速率。
5.其他因素
接触面积、溶剂的性质、光、超声波、磁场、形成原电池等均能影响化学反应速率。
注意 实际生产生活中,影响一个化学反应速率的因素可能是多方面的。
(1)增加少量固体反应物的质量,化学反应速率增大( )
(2)100 mL 2 mol·L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变( )
(3)升高温度,吸热反应速率会加快而放热反应速率会减慢( )
(4)恒容体系发生反应:2SO2+O22SO3
ΔH<0,升高温度,v正增大,v逆减小( )
(5)无论任何反应,若增大压强,反应速率一定增大( )
(6)恒温恒容密闭容器中发生的全为气体的反应,若容器内总压强增大,则反应速率一定增大( )
对于反应:N2(g)+3H2(g)2NH3(g)
(1)恒温恒容条件下,向反应体系中充入氮气,反应速率________(填“增大”“减小”或“不变”,下同),原因是_____________________________________________________。
(2)恒温恒容条件下,向反应体系中充入氦气,反应速率________,原因是________
________________________________________________________________________。
(3)恒温恒压条件下,向反应体系中充入氦气,反应速率________,原因是________
________________________________________________________________________。
1.下列实验中将水、试剂1、试剂2混合后褪色最快的是( )
选项 温度 水 试剂1 试剂2
A 25 ℃ 4 mL 4 mL 0.01 mol·L-1 KMnO4 2 mL 0.1 mol·L-1 H2C2O4
B 25 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4
C 35 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4
D 35 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4、少量MnSO4固体
2.(2022·河南新乡高二检测)下列关于化学反应速率的说法中,正确的是( )
①反应4NH3(g)+5O2(g)??4NO(g)+6H2O(g)在2 L的密闭容器中进行,1 min后,NH3减少了0.12 mol,则1 min末的化学反应速率为v(NO)=0.06 mol·L-1·min-1 ②H2(g)+S(s)??H2S(g)恒压条件下充入He,化学反应速率不变 ③恒容条件下充入气体,增大压强,一定能加快化学反应速率 ④一定量的锌与过量的稀硫酸反应制取氢气,为减缓反应速率,可向其中加入CH3COONa溶液 ⑤煅烧黄铁矿时将矿石磨成粉末可以加快反应速率 ⑥用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 ⑦光是影响某些化学反应速率的外界条件之一
A.①④⑤⑦ B.①②⑤
C.④⑤⑦ D.③④⑥
(1)温度对反应速率的影响具有一致性,升高温度,v正、v逆都增大,降低温度,v正、v逆都减小。
(2)在温度、浓度、催化剂等影响反应速率的因素中,各因素对反应速率的影响程度不同,催化剂为主要因素,其次是温度,最后是浓度。
(3)探究外界因素对化学反应速率的思维模型“实验现象——影响规律——理论解释”,解决实际问题时注意运用证据推理思路和思维认知模型。
第2课时 影响化学反应速率的因素
[核心素养发展目标] 1.通过实验,从宏观上认识外界因素影响化学反应速率的规律。2.建立分析探究外界因素影响化学反应速率的思维模型。3.通过定性与定量研究影响化学反应速率的因素,提高学生设计探究方案、进行实验探究的能力。
一、实验探究影响化学反应速率的外界因素
Ⅰ、定性研究影响化学反应速率的因素
1.科学研究的基本步骤
提出问题→收集化学事实与信息→提出假设→设计实验方案→实验探究→得出结论
化学事实和信息 提出假设——反应速率的影响因素
Na与水的反应比Mg与水的反应剧烈 反应物本身的性质
食物真空保存变质慢 反应物的浓度
夏天食物变质快 温度
向H2O2中加入MnO2后会迅速分解产生气泡 催化剂
将等质量的铁片与铁粉放入稀硫酸中,铁粉产生气泡较快 接触面积
2.化学反应速率的定性描述
能体现化学反应速率的反应现象有:颜色变化快慢,产生气泡快慢,产生浑浊快慢,固体减少快慢等。
3.定性研究影响化学反应速率的因素
(1)实验原理
Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O
2H2O22H2O+O2↑
(2)实验方案设计
影响因素 实验步骤 实验现象 实验结论
浓度 均出现浑浊,但后者出现浑浊更快 增大反应物浓度,化学反应速率增大
温度 混合后均出现浑浊,但70 ℃热水一组首先出现浑浊 升高温度,化学反应速率增大
催化剂 前者无明显现象,后者出现大量气泡 催化剂能加快化学反应速率
Ⅱ、定量研究影响化学反应速率的因素
1.原理:Zn + H2SO4===ZnSO4 + H2↑
2.实验操作:按如图所示安装两套装置A、B,在锥形瓶内各盛大小相同的2 g锌粒,通过分液漏斗分别加入40 mL 1 mol·L-1和40 mL 4 mol·L-1的硫酸溶液。
3.实验记录及结论(记录收集10 mL H2所用的时间)
加入试剂 反应时间(填“长”或“短”) 反应速率(填“快”或“慢”) 结论
1 mol·L-1 H2SO4溶液 长 慢 增大反应物浓度,化学反应速率增大
4 mol·L-1 H2SO4溶液 短 快
4.实验拓展探究
在用上述实验测定锌与硫酸反应的速率时:
(1)为确保测定的准确性,应注意哪些事项?锌的颗粒(即比表面积)大小基本相同;稀硫酸要迅速加入;装置气密性良好,且计时要迅速准确。
(2)用上述装置测定化学反应速率时,操作、药品无误,结果测定速率偏大,从装置缺陷的角度分析可能的原因是忽视加入稀硫酸排出气体的体积。
(3)除了测定氢气的体积外,你还能设计哪些方案测定锌与稀硫酸反应的速率?在恒容反应装置中,测定一段时间内压强的变化;测定一段时间内H+的浓度变化;测定一段时间内锌粒的质量变化等。
(1)任何化学反应都可以通过反应现象判断化学反应的快慢( )
(2)测定化学反应速率,可以用比色的方法测定溶液颜色的深浅进行比较( )
(3)可用装置测定过氧化氢分解的化学反应速率( )
(4)锌与H2SO4反应,H2SO4的浓度越大,产生H2的速率越快( )
答案 (1)× (2)√ (3)× (4)×
1.(1)亚氯酸盐(如NaClO2)可用作漂白剂,在常温,不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O,分解时刚加入硫酸反应缓慢,随后突然反应释放出大量ClO2,这是因为________________________。
(2)H2O2分解制O2的实验中,在10% H2O2溶液中未加催化剂,试管口带火星的木条没有明显变化。加入MnO2粉末,溶液中迅速产生大量气泡,木条立刻复燃;若加入1 mL 0.1 mol·
L-1 FeCl3溶液,溶液中产生气泡比较快,木条复燃;若加入1 mL 0.1 mol·L-1 CuCl2溶液,溶液中产生气泡比较慢,一段时间后木条复燃。由此可知催化剂的催化效果______________。
答案 (1)溶液中的 Cl- 起催化作用 (2)MnO2>Fe3+>Cu2+
解析 (1)由题给信息可知,NaClO2在酸性溶液中生成亚氯酸,生成的亚氯酸在刚加入硫酸时反应缓慢,随后突然反应加快,这说明分解生成的产物中某种物质起了催化剂的作用且该物质反应前不存在。
2.控制变量法是化学实验的常用方法之一。某化学兴趣小组为探究外界条件对化学反应速率的影响,设计以下四组实验。
实验方案 反应温度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
回答下列问题:
(1)V1=____,V2=____。
(2)设计实验方案①和②的目的是:__________________________________________________
_______________________________________________________________________________。
(3)设计实验方案②和④的目的是:__________________________________________________
_______________________________________________________________________________。
(4)各实验方案中均需加入一定体积的水的原因:_____________________________________。
答案 (1)5 10 (2)探究Na2S2O3的浓度对化学反应速率的影响 (3)探究温度对化学反应速率的影响 (4)各实验方案中混合液的体积均相等
1.某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为( )
实验编号 反应物 催化剂
① 10 mL 2% H2O2溶液 无
② 无
③ 10 mL 5% H2O2溶液 MnO2固体
A.5 mL 2% H2O2溶液
B.10 mL 2% H2O2溶液
C.10 mL 5% H2O2溶液
D.5 mL 10% H2O2溶液
答案 C
解析 本实验的目的是运用控制变量法,探究浓度、催化剂对反应速率的影响,表中已有数据中,实验①和③中有两个反应条件不同,二者无法达到实验目的;实验②和③中,应是探究催化剂对反应速率的影响,所以实验②中双氧水浓度和体积必须与实验③相同,即反应物为10 mL 5% H2O2溶液;实验①和②中都没有使用催化剂,可以探究双氧水浓度对反应速率的影响,实验②的反应物为10 mL 5% H2O2溶液,C正确。
2.草酸(H2C2O4)是一种重要的化学试剂。下面是利用草酸探究外界条件对反应速率影响的实验。
(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是________(填字母)。
A.可能明显加快
B.可能明显减慢
C.几乎无影响,可以忽略
(2)用酸性KMnO4和H2C2O4反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1(KMnO4溶液已酸化):
实验序号 A溶液 B溶液
① 20 mL 0.1 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
② 20 mL 0.2 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
①该反应的离子方程式为__________________________________________________。
②该实验探究的是________对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是________(用实验序号填空)。
(3)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min 末c(MnO)=________
mol·L-1(假设混合液体积为50 mL)。
(4)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:
①________________________________________________________________________;
②________________________________________________________________________。
答案 (1)C (2)①2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O ②草酸浓度 ②>① (3)0.005 2 (4)该反应为放热反应 产物Mn2+(或MnSO4)是反应的催化剂
解析 (1)该反应是溶液之间发生的不可逆反应,改变压强没有引起溶液体积变化,反应物浓度不改变,则对其反应速率几乎无影响,可以忽略,选项C符合题意。
(2)①MnO中Mn元素化合价从+7价降低到+2价的Mn2+,H2C2O4中C元素化合价从+3价升高到+4价的CO2,并根据元素守恒进行配平,故离子方程式为2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O;②对比①②实验,根据单一变量原则可知,该实验探究的是草酸浓度对化学反应速率的影响,两组实验溶液总体积一样,②中A溶液的草酸浓度比①中大,化学反应速率大,所得CO2的体积大。
(3)CO2的物质的量n===0.000 2 mol,用CO2表示2 min内的反应速率为=0.000 1 mol·min-1;设2 min末,反应的MnO的物质的量为x,由2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O可得关系式:
2MnO ~ 10CO2
2 10
x 0.000 2 mol
解得x=0.000 04 mol,30 mL×10-3 L·mL-1×0.01 mol·L-1-0.000 04 mol=0.000 26 mol,c(MnO)===0.005 2 mol·L-1。
(4)催化剂能加快化学反应的速率,产物Mn2+(或MnSO4)是反应的催化剂,此外反应释放热量,也可以使化学反应速率加快。
1.实验探究的科学方法及思路
变量控制→对照实验→定性观察或定量测定→科学归纳
2.控制变量探究实验题的思维流程
二、外界因素对化学反应速率的影响
1.浓度
增大反应物的浓度,化学反应速率加快;减小反应物的浓度,化学反应速率减慢。
注意事项 ①浓度对速率的影响适用于气体或溶液参与的反应,固体和纯液体的浓度视为常数。②对于离子反应,实际参加反应的离子浓度发生变化,才会引起化学反应速率的改变。
2.压强
增大压强,引起气体反应物浓度增大,化学反应速率加快;减小压强,引起气体反应物浓度减小,化学反应速率减慢。
注意事项 压强对速率的影响适用于有气体参与的反应,且通过浓度对反应速率的影响实现。
3.温度
升高温度,化学反应速率加快;
降低温度,化学反应速率减慢。
注意事项 温度对反应速率的影响适用于除电化学反应外的绝大多数化学反应,如升高温度,不论吸热反应还是放热反应,不论正反应速率还是逆反应速率,均加快。
4.催化剂
催化剂同等程度的影响正、逆反应速率,正催化剂加快化学反应速率,逆催化剂减慢化学反应速率。
5.其他因素
接触面积、溶剂的性质、光、超声波、磁场、形成原电池等均能影响化学反应速率。
注意 实际生产生活中,影响一个化学反应速率的因素可能是多方面的。
(1)增加少量固体反应物的质量,化学反应速率增大( )
(2)100 mL 2 mol·L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变( )
(3)升高温度,吸热反应速率会加快而放热反应速率会减慢( )
(4)恒容体系发生反应:2SO2+O22SO3 ΔH<0,升高温度,v正增大,v逆减小( )
(5)无论任何反应,若增大压强,反应速率一定增大( )
(6)恒温恒容密闭容器中发生的全为气体的反应,若容器内总压强增大,则反应速率一定增大( )
答案 (1)× (2)× (3)× (4)× (5)× (6)×
对于反应:N2(g)+3H2(g)2NH3(g)
(1)恒温恒容条件下,向反应体系中充入氮气,反应速率________(填“增大”“减小”或“不变”,下同),原因是_____________________________________________________。
(2)恒温恒容条件下,向反应体系中充入氦气,反应速率________,原因是__________________
_______________________________________________________________________________。
(3)恒温恒压条件下,向反应体系中充入氦气,反应速率________,原因是_______________
_______________________________________________________________________________。
答案 (1)增大 增大反应物的浓度,化学反应速率增大
(2)不变 恒容条件下,充入氦气,反应物和生成物的浓度不变,化学反应速率不变
(3)减小 压强不变,充入氦气,容积增大,反应物和生成物的浓度减小,化学反应速率减小
1.下列实验中将水、试剂1、试剂2混合后褪色最快的是( )
选项 温度 水 试剂1 试剂2
A 25 ℃ 4 mL 4 mL 0.01 mol·L-1 KMnO4 2 mL 0.1 mol·L-1 H2C2O4
B 25 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4
C 35 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4
D 35 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4、少量MnSO4固体
答案 D
解析 根据水、试剂1和试剂2三者混合后溶液总体积为10 mL,B、C、D中草酸的物质的量比A中草酸物质的量多,又因B的温度比C、D的温度低,再根据D中加入了催化剂,因此D的反应速率最快,则褪色最快,故D符合题意。
2.(2022·河南新乡高二检测)下列关于化学反应速率的说法中,正确的是( )
①反应4NH3(g)+5O2(g)??4NO(g)+6H2O(g)在2 L的密闭容器中进行,1 min后,NH3减少了0.12 mol,则1 min末的化学反应速率为v(NO)=0.06 mol·L-1·min-1 ②H2(g)+S(s)??H2S(g)恒压条件下充入He,化学反应速率不变 ③恒容条件下充入气体,增大压强,一定能加快化学反应速率 ④一定量的锌与过量的稀硫酸反应制取氢气,为减缓反应速率,可向其中加入CH3COONa溶液 ⑤煅烧黄铁矿时将矿石磨成粉末可以加快反应速率 ⑥用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 ⑦光是影响某些化学反应速率的外界条件之一
A.①④⑤⑦ B.①②⑤
C.④⑤⑦ D.③④⑥
答案 C
解析 化学反应速率为平均反应速率,不是瞬时反应速率,①错误;H2(g)+S(s)H2S(g)该反应为等体反应,恒压条件下充入稀有气体,相当于容器的体积增大,反应速率减小,②错误;恒容条件下充入无关气体(如惰性气体),容器的总压增大,分压不变,则反应速率不变,③错误;加入CH3COONa溶液,与硫酸反应生成醋酸,则氢离子的浓度减小,减缓反应速率,④正确;将矿石磨成粉末可增大接触面积,加快反应速率,⑤正确;98%的浓硫酸具有强氧化性,冷的浓硫酸与铁发生钝化,则不产生氢气,⑥错误;光是影响某些化学反应速率的外界条件之一,如氢气和氯气在光照条件下可反应生成氯化氢,⑦正确;综上所述,正确的为④⑤⑦。
(1)温度对反应速率的影响具有一致性,升高温度,v正、v逆都增大,降低温度,v正、v逆都减小。
(2)在温度、浓度、催化剂等影响反应速率的因素中,各因素对反应速率的影响程度不同,催化剂为主要因素,其次是温度,最后是浓度。
(3)探究外界因素对化学反应速率的思维模型“实验现象——影响规律——理论解释”,解决实际问题时注意运用证据推理思路和思维认知模型。
