第二章 第一节 第3课时 活化能 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1
文档属性
| 名称 | 第二章 第一节 第3课时 活化能 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 863.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-07 19:29:38 | ||
图片预览




文档简介
第3课时 活化能
[核心素养发展目标]
1.知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响;知道催化剂可以改变反应历程。
2.能用简单碰撞理论说明反应条件对化学反应速率的影响,体会理论模型的建构过程,强化模型认知意识。
一、基元反应与反应历程
1.基元反应
大多数的化学反应往往经过多个反应步骤才能实现。其中__________都称为基元反应。如2HI===H2+I2的两步基元反应为__________________、____________。
2.反应机理
先后进行的____________反映了化学反应的反应历程,反应历程又称____________。
3.飞秒化学
(1)基元反应的整个过程一般分为:始态→过渡态→终态(或中间体、中间产物)。
(2)跟踪和检测化学反应中某些寿命______的中间体或过渡态,必须采用________ s的时间分辨技术,可以分辨分子、原子飞秒级变动图像的________________,可以跟踪、观察基元反应的整个过程。
(3)对________________的研究称为飞秒(fs,1 fs=10-15 s)化学。
(4)飞秒化学对了解________________、________________、充分利用物质和能源等非常重要。
1.由反应物微粒一步直接实现的化学反应称为基元反应。某化学反应是通过三步基元反应实现:①Ce4++Mn2+―→Ce3++Mn3+;②Ce4++Mn3+―→Ce3++Mn4+;③Ti++Mn4+―→Ti3++Mn2+。由此可知:
(1)该反应的总反应的方程式为________________________________。
(2)该反应的催化剂是________。
2.甲烷气相热分解反应的化学方程式为2CH4―→CH3—CH3+H2,该反应的机理如下:
①CH4―→·CH3+·H;②________________________________;
③CH4+H·―→·CH3+H2;④·CH3+H·―→CH4。补充反应②的方程式。
3.利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示:
(1)X是____________。
(2)上述历程的总反应为____________________________________________________。
(3)由反应历程可知,[(NH4)(HNO2)]+是该反应的______________。
在催化循环反应体系中:
催化剂首先直接和原料反应,反应前后存在,反应过程中不存在,催化剂可循环再生,即“失而复得”;而中间体(中间产物)只在反应过程中出现。
1.卤代烃与端基炔(R′C≡CH)催化偶联反应的一种机理如图所示。下列说法错误的是( )
A.偶联反应中起催化作用的是M和CuI
B.R′C≡CCu为该催化过程的中间产物
C.该偶联反应的原理为R′C≡CH+RI―→R′C≡CR+HI
D.该催化机理改变了反应路径和反应热
2.CO与N2O在铁催化剂表面进行如下两步反应,其相对能量与反应历程如图所示。
第一步:Fe*+N2O===FeO*+N2
第二步:FeO*+CO===Fe*+CO2
回答下列问题:
(1)该反应的催化剂是______________。
(2)第一步反应是________(填“放热”或“吸热”,下同)反应,第二步反应是________反应。
(3)该反应的总反应化学方程式为____________________________________________。
二、影响化学反应速率的理论分析
1.基元反应发生的先决条件
反应物的分子必须发生________,但是并不是每一次碰撞都能发生化学反应。
2.有效碰撞
3.活化能和活化分子
(1)活化分子:能够发生____________的分子。
对于某一化学反应来说,在一定条件下,反应物分子中活化分子的百分数是________的。
(2)活化能:活化分子具有的____________与反应物分子具有的平均能量之差,叫做反应的活化能。
4.反应物、生成物的能量与活化能的关系图
5.有效碰撞理论影响化学反应速率因素的解释
(1)浓度
反应物浓度增大→单位体积内活化分子数________→单位时间内有效碰撞的次数________→化学反应速率________;反之,化学反应速率________。
(2)压强
增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数________→单位时间内有效碰撞的次数________→化学反应速率________;反之,化学反应速率________。
压强对化学反应速率的影响,可转化成浓度对化学反应速率的影响。
(3)温度
升高温度,反应物分子的能量________→使一部分原来能量较低的分子变成____________→活化分子的百分数________→单位时间内有效碰撞的次数________→化学反应速率________;反之,化学反应速率____________。
(4)催化剂
使用催化剂→改变了反应历程(如下图),反应的活化能________→更多的反应物分子成为____________→活化分子的百分数________→单位时间内有效碰撞的次数________→化学反应速率________。
(1)当碰撞的分子具有足够的能量和适当的取向时才能发生化学反应( )
(2)活化能大的反应一定是吸热反应( )
(3)催化剂能降低反应所需的活化能,ΔH也会发生变化( )
(4)活化能越高,反应越难发生,反应速率越慢( )
(5)增大反应物的浓度,使活化分子百分数增大,化学反应速率增大( )
(6)增大压强,活化分子百分数增大,化学反应速率一定增大( )
(7)升高反应体系温度,活化分子百分数增大,化学反应速率一定增大( )
(8)一般使用催化剂可降低反应的活化能,活化分子百分数不变,化学反应速率增大( )
1.浓度、压强、温度、催化剂四因素中,能够改变活化分子百分数的有哪些?
________________________________________________________________________________________________________________________________________________________________
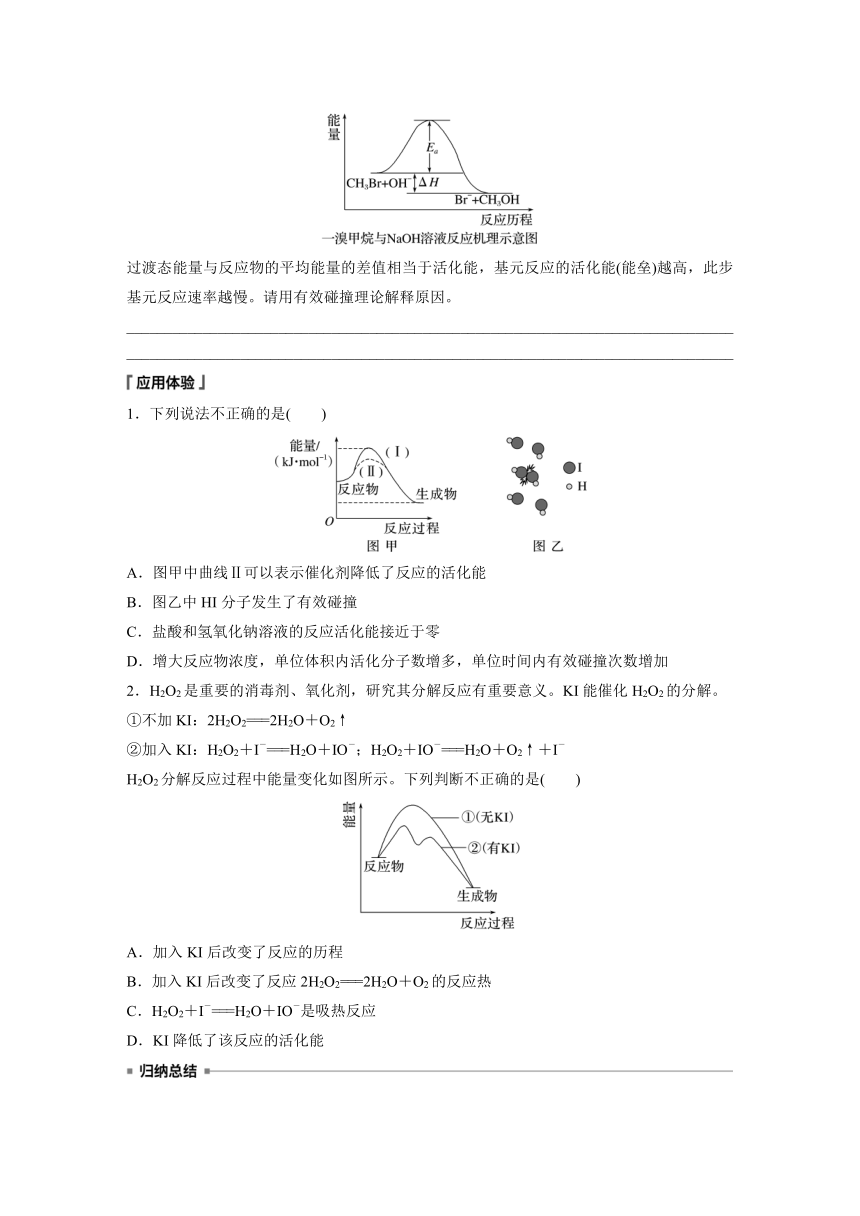
2.基元反应过渡状态理论认为,基元反应在从反应物到生成物的变化过程中要经历一个中间状态,这个状态称为过渡态。例如,一溴甲烷与NaOH溶液反应的过程可以表示为CH3Br+OH-―→[Br…CH3…OH]―→Br-+CH3OH
过渡态能量与反应物的平均能量的差值相当于活化能,基元反应的活化能(能垒)越高,此步基元反应速率越慢。请用有效碰撞理论解释原因。
________________________________________________________________________________________________________________________________________________________________
1.下列说法不正确的是( )
A.图甲中曲线Ⅱ可以表示催化剂降低了反应的活化能
B.图乙中HI分子发生了有效碰撞
C.盐酸和氢氧化钠溶液的反应活化能接近于零
D.增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加
2.H2O2是重要的消毒剂、氧化剂,研究其分解反应有重要意义。KI能催化H2O2的分解。
①不加KI:2H2O2===2H2O+O2↑
②加入KI:H2O2+I-===H2O+IO-;H2O2+IO-===H2O+O2↑+I-
H2O2分解反应过程中能量变化如图所示。下列判断不正确的是( )
A.加入KI后改变了反应的历程
B.加入KI后改变了反应2H2O2===2H2O+O2的反应热
C.H2O2+I-===H2O+IO-是吸热反应
D.KI降低了该反应的活化能
活化分子、有效碰撞与反应速率的关系
三、催化机理与反应历程
1.催化剂特点
(1)催化剂具有高效性和________性,某种催化剂对某一反应可能催化活性很强,但对其他反应不一定具有催化作用,可以选用____________来调控反应。
(2)催化剂的催化活性除了与自身成分有关外,还与粒径、合成方法等因素以及温度、压强等条件有关,催化剂发挥作用需要维持在活性温度范围内,温度过高,催化活性____。
2.催化剂与反应历程
(1)催化反应历程可表示为扩散→吸附→断键→成键→脱附。
(2)催化剂通过参与反应改变__________、________反应的活化能来加快反应速率。活化能越大,反应越______进行。
(3)复杂反应中的速度控制步骤决定反应的速率,各步基元反应活化能(能垒)______的慢反应是决定整个反应速率的关键步骤。故改变温度,活化能______的反应速率改变程度大。
1.反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应:CH4(g)=== C(s)+2H2(g) 消碳反应:CO2(g)+C(s) ===2CO(g)
ΔH/(kJ·mol-1) +75 +172
活化能/(kJ·mol-1) 催化剂X 33 91
催化剂Y 43 72
由上表判断,催化剂X________(填“优于”或“劣于”)Y,理由是_____________
________________________________________________________________________。
2.生物催化剂——酶对反应速率的影响如图所示:
根据酶促反应速率曲线说明酶的催化活性:__________________________________
________________________________________________________________________。
对催化剂的选择性的理解
(1)同一反应,不同催化剂对该反应的催化效果不同。
(2)同一催化剂,对不同反应催化效果也不同。
(3)催化剂的催化活性还与温度、酸碱度等因素有关,使用催化剂时需选择适宜条件。
1.甲酸被认为是理想的氢能载体,我国科技工作者运用DFT计算研究单分子HCOOH在催化剂表面分解产生H2的反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
回答下列问题:
(1)该历程中决定正反应速率步骤的能垒(活化能)E正=________eV,该步骤的反应方程式为
________________________________________________________________________。
(2)该历程中甲酸分解制氢气的热化学方程式为________________________________。
2.(2022·沈阳高二检测)氧化亚氮在碘蒸气存在时的热分解反应:2N2O―→2N2+O2,其反应机理包含以下步骤:
第一步:I2(g)??2I(g)(快反应);
第二步:I(g)+N2O(g)―→N2(g)+IO(g)(慢反应);
第三步:IO(g)+N2O(g)―→N2(g)+O2(g)+I(g)(快反应)。
下列说法错误的是( )
A.第二步对分解反应速率起决定作用
B.I2的浓度与N2O的分解速率无关
C.慢反应的活化能大于快反应的活化能
D.第二步反应中I(g)作还原剂
3.平流层中氟氯烃对臭氧层的破坏是由于含氯化合物的催化作用改变了臭氧分解反应的历程,其反应过程的能量变化如图。总反应:O3+O―→2O2。催化反应:①O3+Cl―→O2+ClO;②ClO+O―→Cl+O2。下列说法正确的是( )
A.Ea=Ea1+Ea2
B.反应①为吸热反应,反应②为放热反应,因此反应速率:反应①<反应②
C.对于加了催化剂的反应:反应速率主要由反应①决定
D.对于总反应,反应物的键能之和大于生成物的键能之和
第3课时 活化能
[核心素养发展目标] 1.知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响;知道催化剂可以改变反应历程。2.能用简单碰撞理论说明反应条件对化学反应速率的影响,体会理论模型的建构过程,强化模型认知意识。
一、基元反应与反应历程
1.基元反应
大多数的化学反应往往经过多个反应步骤才能实现。其中每一步反应都称为基元反应。如2HI===H2+I2的两步基元反应为2HI―→H2+2I·、2I·―→I2。
2.反应机理
先后进行的基元反应反映了化学反应的反应历程,反应历程又称反应机理。
3.飞秒化学
(1)基元反应的整个过程一般分为:始态→过渡态→终态(或中间体、中间产物)。
(2)跟踪和检测化学反应中某些寿命极短的中间体或过渡态,必须采用10-15~10-12 s的时间分辨技术,可以分辨分子、原子飞秒级变动图像的激光脉冲技术,可以跟踪、观察基元反应的整个过程。
(3)对超快速化学反应的研究称为飞秒(fs,1 fs=10-15 s)化学。
(4)飞秒化学对了解化学反应机理、控制反应进程、充分利用物质和能源等非常重要。
1.由反应物微粒一步直接实现的化学反应称为基元反应。某化学反应是通过三步基元反应实现:①Ce4++Mn2+―→Ce3++Mn3+;②Ce4++Mn3+―→Ce3++Mn4+;③Ti++Mn4+―→Ti3++Mn2+。由此可知:
(1)该反应的总反应的方程式为________________________________。
(2)该反应的催化剂是________。
答案 (1)2Ce4++Ti+===2Ce3++Ti3+ (2)Mn2+
解析 催化剂是在化学反应里能改变反应物的化学反应速率(既能提高也能降低),而本身的质量和化学性质在化学反应前后都没有发生改变的物质。从三个反应可以看出Ce4+最终变为Ce3+,Ti+变为Ti3+,Mn2+没变,故为催化剂。
2.甲烷气相热分解反应的化学方程式为2CH4―→CH3—CH3+H2,该反应的机理如下:
①CH4―→·CH3+·H;②________________________________;
③CH4+H·―→·CH3+H2;④·CH3+H·―→CH4。补充反应②的方程式。
答案 ·CH3+CH4―→CH3—CH3+H·
解析 烷烃的热解反应,是典型的自由基反应,自由基反应一般经历链引发、链传递、链终止的过程,故第二步反应属于链传递环节,产物中还有自由基生成,且生成物有乙烷,故确定其反应原理为·CH3+CH4―→CH3—CH3+H·。
3.利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示:
(1)X是________。
(2)上述历程的总反应为________________________________。
(3)由反应历程可知,[(NH4)(HNO2)]+是该反应的________。
答案 (1)N2、H2O (2)2NH3+NO+NO22N2+3H2O (3)中间产物
解析 (1)图示反应可以生成X的反应为[(NH4)2(NO2)]2++NO===[(NH4)(HNO2)]++X+H+,由原子守恒判断X为N2和H2O。(2)由反应历程图可知,氨气、二氧化氮和一氧化氮是反应物,氮气与水是生成物,所以总反应为2NH3+NO+NO22N2+3H2O。(3)由反应历程可知,[(NH4)(HNO2)]+是该反应的中间产物。
在催化循环反应体系中:
催化剂首先直接和原料反应,反应前后存在,反应过程中不存在,催化剂可循环再生,即“失而复得”;而中间体(中间产物)只在反应过程中出现。
1.卤代烃与端基炔(R′C≡CH)催化偶联反应的一种机理如图所示。下列说法错误的是( )
A.偶联反应中起催化作用的是M和CuI
B.R′C≡CCu为该催化过程的中间产物
C.该偶联反应的原理为R′C≡CH+RI―→R′C≡CR+HI
D.该催化机理改变了反应路径和反应热
答案 D
解析 由转化图可知,偶联反应中起催化作用的是M和CuI,故A正确;由转化关系可知,R′C≡CCu产生后又被消耗,为该催化过程的中间产物,故B正确;由流程可知,该偶联反应的原理为R′C≡CH+RI―→R′C≡CR+HI,故C正确;催化剂改变反应路径,不改变反应热,故D错误。
2.CO与N2O在铁催化剂表面进行如下两步反应,其相对能量与反应历程如图所示。
第一步:Fe*+N2O===FeO*+N2
第二步:FeO*+CO===Fe*+CO2
回答下列问题:
(1)该反应的催化剂是______________。
(2)第一步反应是________(填“放热”或“吸热”,下同)反应,第二步反应是________反应。
(3)该反应的总反应化学方程式为____________________________________________。
答案 (1)Fe* (2)放热 放热 (3)CO+N2O===N2+CO2
解析 (1)由题意可知,第一步Fe*被消耗,第二步又生成,说明Fe*是反应的催化剂。(2)根据反应历程图可知,两步反应的生成物的总能量均低于反应物的总能量,则两步反应均为放热反应。(3)根据盖斯定律:第一步反应+第二步反应=总反应,则总反应为CO+N2O===N2+CO2。
二、影响化学反应速率的理论分析
1.基元反应发生的先决条件
反应物的分子必须发生碰撞,但是并不是每一次碰撞都能发生化学反应。
2.有效碰撞
3.活化能和活化分子
(1)活化分子:能够发生有效碰撞的分子。
对于某一化学反应来说,在一定条件下,反应物分子中活化分子的百分数是一定的。
(2)活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。
4.反应物、生成物的能量与活化能的关系图
5.有效碰撞理论影响化学反应速率因素的解释
(1)浓度
反应物浓度增大→单位体积内活化分子数增多→单位时间内有效碰撞的次数增加→化学反应速率增大;反之,化学反应速率减小。
(2)压强
增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数增多→单位时间内有效碰撞的次数增加→化学反应速率增大;反之,化学反应速率减小。
压强对化学反应速率的影响,可转化成浓度对化学反应速率的影响。
(3)温度
升高温度,反应物分子的能量增加→使一部分原来能量较低的分子变成活化分子→活化分子的百分数增大→单位时间内有效碰撞的次数增加→化学反应速率增大;反之,化学反应速率减小。
(4)催化剂
使用催化剂→改变了反应历程(如下图),反应的活化能降低→更多的反应物分子成为活化分子→活化分子的百分数增大→单位时间内有效碰撞的次数增加→化学反应速率增大。
(1)当碰撞的分子具有足够的能量和适当的取向时才能发生化学反应( )
(2)活化能大的反应一定是吸热反应( )
(3)催化剂能降低反应所需的活化能,ΔH也会发生变化( )
(4)活化能越高,反应越难发生,反应速率越慢( )
(5)增大反应物的浓度,使活化分子百分数增大,化学反应速率增大( )
(6)增大压强,活化分子百分数增大,化学反应速率一定增大( )
(7)升高反应体系温度,活化分子百分数增大,化学反应速率一定增大( )
(8)一般使用催化剂可降低反应的活化能,活化分子百分数不变,化学反应速率增大( )
答案 (1)√ (2)× (3)× (4)√ (5)× (6)× (7)√ (8)×
1.浓度、压强、温度、催化剂四因素中,能够改变活化分子百分数的有哪些?
提示 温度、催化剂能够改变活化分子百分数。
2.基元反应过渡状态理论认为,基元反应在从反应物到生成物的变化过程中要经历一个中间状态,这个状态称为过渡态。例如,一溴甲烷与NaOH溶液反应的过程可以表示为CH3Br+OH-―→[Br…CH3…OH]―→Br-+CH3OH
过渡态能量与反应物的平均能量的差值相当于活化能,基元反应的活化能(能垒)越高,此步基元反应速率越慢。请用有效碰撞理论解释原因。
提示 活化能大时,反应物分子不易成为活化分子,很少发生有效碰撞,反应不易发生。
1.下列说法不正确的是( )
A.图甲中曲线Ⅱ可以表示催化剂降低了反应的活化能
B.图乙中HI分子发生了有效碰撞
C.盐酸和氢氧化钠溶液的反应活化能接近于零
D.增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加
答案 B
解析 催化剂可降低反应的活化能,A正确;能够发生化学反应的碰撞才是有效碰撞,由图乙可知碰撞后没有生成新物质,即没有发生化学反应,不是有效碰撞,B错误;盐酸和氢氧化钠溶液反应的实质是氢离子与氢氧根离子反应生成水,在溶液中氢离子与氢氧根离子已经处于活跃状态,因此盐酸和氢氧化钠溶液反应的活化能接近于零,C正确;增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加,D正确。
2.H2O2是重要的消毒剂、氧化剂,研究其分解反应有重要意义。KI能催化H2O2的分解。
①不加KI:2H2O2===2H2O+O2↑
②加入KI:H2O2+I-===H2O+IO-;H2O2+IO-===H2O+O2↑+I-
H2O2分解反应过程中能量变化如图所示。下列判断不正确的是( )
A.加入KI后改变了反应的历程
B.加入KI后改变了反应2H2O2===2H2O+O2的反应热
C.H2O2+I-===H2O+IO-是吸热反应
D.KI降低了该反应的活化能
答案 B
解析 由反应历程图可知,不加KI时反应一步完成,加入KI后分两步进行,并且KI是催化剂,即加入KI后改变了反应的历程,故A项正确;KI是该反应的催化剂,但催化剂不能改变反应的始态和终态,即不能改变反应的反应热,故B项错误;加入KI后反应分两步进行:H2O2+I-===H2O+IO-、H2O2+IO-===H2O+O2↑+I-,由图可知,H2O2和I-具有的能量小于H2O和IO-具有的能量,所以该步反应是吸热反应,故C项正确;催化剂能降低反应的活化能,KI是该反应的催化剂,降低了反应的活化能,故D项正确。
活化分子、有效碰撞与反应速率的关系
三、催化机理与反应历程
1.催化剂特点
(1)催化剂具有高效性和选择性,某种催化剂对某一反应可能催化活性很强,但对其他反应不一定具有催化作用,可以选用合适的催化剂来调控反应。
(2)催化剂的催化活性除了与自身成分有关外,还与粒径、合成方法等因素以及温度、压强等条件有关,催化剂发挥作用需要维持在活性温度范围内,温度过高,催化活性降低。
2.催化剂与反应历程
(1)催化反应历程可表示为扩散→吸附→断键→成键→脱附。
(2)催化剂通过参与反应改变反应历程、降低反应的活化能来加快反应速率。活化能越大,反应越难进行。
(3)复杂反应中的速度控制步骤决定反应的速率,各步基元反应活化能(能垒)大的慢反应是决定整个反应速率的关键步骤。故改变温度,活化能大的反应速率改变程度大。
1.反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应:CH4(g)=== C(s)+2H2(g) 消碳反应:CO2(g)+C(s) ===2CO(g)
ΔH/(kJ·mol-1) +75 +172
活化能/(kJ·mol-1) 催化剂X 33 91
催化剂Y 43 72
由上表判断,催化剂X________(填“优于”或“劣于”)Y,理由是______________________
_______________________________________________________________________________。
提示 劣于 催化剂X较催化剂Y,积碳反应时,活化能低,反应速率大,消碳反应时,活化能高,反应速率小,综合考虑,催化剂X较催化剂Y更利于积碳反应,不利于消碳反应,会降低催化剂活性
2.生物催化剂——酶对反应速率的影响如图所示:
根据酶促反应速率曲线说明酶的催化活性:_________________________________________。
提示 由曲线说明在最适的温度和pH条件下,酶的活性最高
对催化剂的选择性的理解
(1)同一反应,不同催化剂对该反应的催化效果不同。
(2)同一催化剂,对不同反应催化效果也不同。
(3)催化剂的催化活性还与温度、酸碱度等因素有关,使用催化剂时需选择适宜条件。
1.甲酸被认为是理想的氢能载体,我国科技工作者运用DFT计算研究单分子HCOOH在催化剂表面分解产生H2的反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
回答下列问题:
(1)该历程中决定正反应速率步骤的能垒(活化能)E正=________eV,该步骤的反应方程式为________________________________________________________________________。
(2)该历程中甲酸分解制氢气的热化学方程式为________________________________。
答案 (1)0.98 HCOOH*===HCOO*+H*
(2)HCOOH(g)===CO2(g)+H2(g) ΔH=-0.15NA eV·mol-1
解析 (1)反应的活化能越大,反应速率越慢,化学反应速率取决于最慢的一步,由图可知,HCOOH*转化为HCOO*和H*的反应的活化能最大,反应速率最慢,则该历程中决定正反应速率步骤的反应方程式为HCOOH*===HCOO*+H*,能垒(活化能)E正=0.77 eV-(-0.21)eV=0.98 eV。(2)由图可知,甲酸分解生成二氧化碳和氢气的反应为放热反应,反应热ΔH=
-0.15NA eV·mol-1,则反应的热化学方程式为HCOOH(g)===CO2(g)+H2(g) ΔH=-0.15NA eV·
mol-1。
2.(2022·沈阳高二检测)氧化亚氮在碘蒸气存在时的热分解反应:2N2O―→2N2+O2,其反应机理包含以下步骤:
第一步:I2(g)??2I(g)(快反应);
第二步:I(g)+N2O(g)―→N2(g)+IO(g)(慢反应);
第三步:IO(g)+N2O(g)―→N2(g)+O2(g)+I(g)(快反应)。
下列说法错误的是( )
A.第二步对分解反应速率起决定作用
B.I2的浓度与N2O的分解速率无关
C.慢反应的活化能大于快反应的活化能
D.第二步反应中I(g)作还原剂
答案 B
解析 化学反应速率的快慢取决于慢反应,则第二步对分解反应速率起决定作用,故A正确;N2O分解反应中,I2是反应物,碘蒸气的浓度与N2O的分解速率有关,故B错误;活化能越大反应速率越慢,则慢反应的活化能大于快反应的活化能,故C正确;第二步反应中I(g)→IO(g),I元素化合价升高,作还原剂,故D正确。
3.平流层中氟氯烃对臭氧层的破坏是由于含氯化合物的催化作用改变了臭氧分解反应的历程,其反应过程的能量变化如图。总反应:O3+O―→2O2。催化反应:①O3+Cl―→O2+ClO;②ClO+O―→Cl+O2。下列说法正确的是( )
A.Ea=Ea1+Ea2
B.反应①为吸热反应,反应②为放热反应,因此反应速率:反应①<反应②
C.对于加了催化剂的反应:反应速率主要由反应①决定
D.对于总反应,反应物的键能之和大于生成物的键能之和
答案 C
解析 催化剂能降低反应的活化能,并且催化效率越强,活化能降低越多,所以图中Ea与(Ea1+Ea2)之间没有等量关系,A错误;由图可知,反应①为吸热反应,反应②为放热反应,反应①的活化能大于反应②,所以反应速率:反应①<反应②,与反应是吸热反应还是放热反应无关,B错误、C正确;由图可知,总反应为放热反应,焓变=反应物的总键能-生成物的总键能,所以反应物的键能之和小于生成物的键能之和,D错误。
[核心素养发展目标]
1.知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响;知道催化剂可以改变反应历程。
2.能用简单碰撞理论说明反应条件对化学反应速率的影响,体会理论模型的建构过程,强化模型认知意识。
一、基元反应与反应历程
1.基元反应
大多数的化学反应往往经过多个反应步骤才能实现。其中__________都称为基元反应。如2HI===H2+I2的两步基元反应为__________________、____________。
2.反应机理
先后进行的____________反映了化学反应的反应历程,反应历程又称____________。
3.飞秒化学
(1)基元反应的整个过程一般分为:始态→过渡态→终态(或中间体、中间产物)。
(2)跟踪和检测化学反应中某些寿命______的中间体或过渡态,必须采用________ s的时间分辨技术,可以分辨分子、原子飞秒级变动图像的________________,可以跟踪、观察基元反应的整个过程。
(3)对________________的研究称为飞秒(fs,1 fs=10-15 s)化学。
(4)飞秒化学对了解________________、________________、充分利用物质和能源等非常重要。
1.由反应物微粒一步直接实现的化学反应称为基元反应。某化学反应是通过三步基元反应实现:①Ce4++Mn2+―→Ce3++Mn3+;②Ce4++Mn3+―→Ce3++Mn4+;③Ti++Mn4+―→Ti3++Mn2+。由此可知:
(1)该反应的总反应的方程式为________________________________。
(2)该反应的催化剂是________。
2.甲烷气相热分解反应的化学方程式为2CH4―→CH3—CH3+H2,该反应的机理如下:
①CH4―→·CH3+·H;②________________________________;
③CH4+H·―→·CH3+H2;④·CH3+H·―→CH4。补充反应②的方程式。
3.利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示:
(1)X是____________。
(2)上述历程的总反应为____________________________________________________。
(3)由反应历程可知,[(NH4)(HNO2)]+是该反应的______________。
在催化循环反应体系中:
催化剂首先直接和原料反应,反应前后存在,反应过程中不存在,催化剂可循环再生,即“失而复得”;而中间体(中间产物)只在反应过程中出现。
1.卤代烃与端基炔(R′C≡CH)催化偶联反应的一种机理如图所示。下列说法错误的是( )
A.偶联反应中起催化作用的是M和CuI
B.R′C≡CCu为该催化过程的中间产物
C.该偶联反应的原理为R′C≡CH+RI―→R′C≡CR+HI
D.该催化机理改变了反应路径和反应热
2.CO与N2O在铁催化剂表面进行如下两步反应,其相对能量与反应历程如图所示。
第一步:Fe*+N2O===FeO*+N2
第二步:FeO*+CO===Fe*+CO2
回答下列问题:
(1)该反应的催化剂是______________。
(2)第一步反应是________(填“放热”或“吸热”,下同)反应,第二步反应是________反应。
(3)该反应的总反应化学方程式为____________________________________________。
二、影响化学反应速率的理论分析
1.基元反应发生的先决条件
反应物的分子必须发生________,但是并不是每一次碰撞都能发生化学反应。
2.有效碰撞
3.活化能和活化分子
(1)活化分子:能够发生____________的分子。
对于某一化学反应来说,在一定条件下,反应物分子中活化分子的百分数是________的。
(2)活化能:活化分子具有的____________与反应物分子具有的平均能量之差,叫做反应的活化能。
4.反应物、生成物的能量与活化能的关系图
5.有效碰撞理论影响化学反应速率因素的解释
(1)浓度
反应物浓度增大→单位体积内活化分子数________→单位时间内有效碰撞的次数________→化学反应速率________;反之,化学反应速率________。
(2)压强
增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数________→单位时间内有效碰撞的次数________→化学反应速率________;反之,化学反应速率________。
压强对化学反应速率的影响,可转化成浓度对化学反应速率的影响。
(3)温度
升高温度,反应物分子的能量________→使一部分原来能量较低的分子变成____________→活化分子的百分数________→单位时间内有效碰撞的次数________→化学反应速率________;反之,化学反应速率____________。
(4)催化剂
使用催化剂→改变了反应历程(如下图),反应的活化能________→更多的反应物分子成为____________→活化分子的百分数________→单位时间内有效碰撞的次数________→化学反应速率________。
(1)当碰撞的分子具有足够的能量和适当的取向时才能发生化学反应( )
(2)活化能大的反应一定是吸热反应( )
(3)催化剂能降低反应所需的活化能,ΔH也会发生变化( )
(4)活化能越高,反应越难发生,反应速率越慢( )
(5)增大反应物的浓度,使活化分子百分数增大,化学反应速率增大( )
(6)增大压强,活化分子百分数增大,化学反应速率一定增大( )
(7)升高反应体系温度,活化分子百分数增大,化学反应速率一定增大( )
(8)一般使用催化剂可降低反应的活化能,活化分子百分数不变,化学反应速率增大( )
1.浓度、压强、温度、催化剂四因素中,能够改变活化分子百分数的有哪些?
________________________________________________________________________________________________________________________________________________________________
2.基元反应过渡状态理论认为,基元反应在从反应物到生成物的变化过程中要经历一个中间状态,这个状态称为过渡态。例如,一溴甲烷与NaOH溶液反应的过程可以表示为CH3Br+OH-―→[Br…CH3…OH]―→Br-+CH3OH
过渡态能量与反应物的平均能量的差值相当于活化能,基元反应的活化能(能垒)越高,此步基元反应速率越慢。请用有效碰撞理论解释原因。
________________________________________________________________________________________________________________________________________________________________
1.下列说法不正确的是( )
A.图甲中曲线Ⅱ可以表示催化剂降低了反应的活化能
B.图乙中HI分子发生了有效碰撞
C.盐酸和氢氧化钠溶液的反应活化能接近于零
D.增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加
2.H2O2是重要的消毒剂、氧化剂,研究其分解反应有重要意义。KI能催化H2O2的分解。
①不加KI:2H2O2===2H2O+O2↑
②加入KI:H2O2+I-===H2O+IO-;H2O2+IO-===H2O+O2↑+I-
H2O2分解反应过程中能量变化如图所示。下列判断不正确的是( )
A.加入KI后改变了反应的历程
B.加入KI后改变了反应2H2O2===2H2O+O2的反应热
C.H2O2+I-===H2O+IO-是吸热反应
D.KI降低了该反应的活化能
活化分子、有效碰撞与反应速率的关系
三、催化机理与反应历程
1.催化剂特点
(1)催化剂具有高效性和________性,某种催化剂对某一反应可能催化活性很强,但对其他反应不一定具有催化作用,可以选用____________来调控反应。
(2)催化剂的催化活性除了与自身成分有关外,还与粒径、合成方法等因素以及温度、压强等条件有关,催化剂发挥作用需要维持在活性温度范围内,温度过高,催化活性____。
2.催化剂与反应历程
(1)催化反应历程可表示为扩散→吸附→断键→成键→脱附。
(2)催化剂通过参与反应改变__________、________反应的活化能来加快反应速率。活化能越大,反应越______进行。
(3)复杂反应中的速度控制步骤决定反应的速率,各步基元反应活化能(能垒)______的慢反应是决定整个反应速率的关键步骤。故改变温度,活化能______的反应速率改变程度大。
1.反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应:CH4(g)=== C(s)+2H2(g) 消碳反应:CO2(g)+C(s) ===2CO(g)
ΔH/(kJ·mol-1) +75 +172
活化能/(kJ·mol-1) 催化剂X 33 91
催化剂Y 43 72
由上表判断,催化剂X________(填“优于”或“劣于”)Y,理由是_____________
________________________________________________________________________。
2.生物催化剂——酶对反应速率的影响如图所示:
根据酶促反应速率曲线说明酶的催化活性:__________________________________
________________________________________________________________________。
对催化剂的选择性的理解
(1)同一反应,不同催化剂对该反应的催化效果不同。
(2)同一催化剂,对不同反应催化效果也不同。
(3)催化剂的催化活性还与温度、酸碱度等因素有关,使用催化剂时需选择适宜条件。
1.甲酸被认为是理想的氢能载体,我国科技工作者运用DFT计算研究单分子HCOOH在催化剂表面分解产生H2的反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
回答下列问题:
(1)该历程中决定正反应速率步骤的能垒(活化能)E正=________eV,该步骤的反应方程式为
________________________________________________________________________。
(2)该历程中甲酸分解制氢气的热化学方程式为________________________________。
2.(2022·沈阳高二检测)氧化亚氮在碘蒸气存在时的热分解反应:2N2O―→2N2+O2,其反应机理包含以下步骤:
第一步:I2(g)??2I(g)(快反应);
第二步:I(g)+N2O(g)―→N2(g)+IO(g)(慢反应);
第三步:IO(g)+N2O(g)―→N2(g)+O2(g)+I(g)(快反应)。
下列说法错误的是( )
A.第二步对分解反应速率起决定作用
B.I2的浓度与N2O的分解速率无关
C.慢反应的活化能大于快反应的活化能
D.第二步反应中I(g)作还原剂
3.平流层中氟氯烃对臭氧层的破坏是由于含氯化合物的催化作用改变了臭氧分解反应的历程,其反应过程的能量变化如图。总反应:O3+O―→2O2。催化反应:①O3+Cl―→O2+ClO;②ClO+O―→Cl+O2。下列说法正确的是( )
A.Ea=Ea1+Ea2
B.反应①为吸热反应,反应②为放热反应,因此反应速率:反应①<反应②
C.对于加了催化剂的反应:反应速率主要由反应①决定
D.对于总反应,反应物的键能之和大于生成物的键能之和
第3课时 活化能
[核心素养发展目标] 1.知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响;知道催化剂可以改变反应历程。2.能用简单碰撞理论说明反应条件对化学反应速率的影响,体会理论模型的建构过程,强化模型认知意识。
一、基元反应与反应历程
1.基元反应
大多数的化学反应往往经过多个反应步骤才能实现。其中每一步反应都称为基元反应。如2HI===H2+I2的两步基元反应为2HI―→H2+2I·、2I·―→I2。
2.反应机理
先后进行的基元反应反映了化学反应的反应历程,反应历程又称反应机理。
3.飞秒化学
(1)基元反应的整个过程一般分为:始态→过渡态→终态(或中间体、中间产物)。
(2)跟踪和检测化学反应中某些寿命极短的中间体或过渡态,必须采用10-15~10-12 s的时间分辨技术,可以分辨分子、原子飞秒级变动图像的激光脉冲技术,可以跟踪、观察基元反应的整个过程。
(3)对超快速化学反应的研究称为飞秒(fs,1 fs=10-15 s)化学。
(4)飞秒化学对了解化学反应机理、控制反应进程、充分利用物质和能源等非常重要。
1.由反应物微粒一步直接实现的化学反应称为基元反应。某化学反应是通过三步基元反应实现:①Ce4++Mn2+―→Ce3++Mn3+;②Ce4++Mn3+―→Ce3++Mn4+;③Ti++Mn4+―→Ti3++Mn2+。由此可知:
(1)该反应的总反应的方程式为________________________________。
(2)该反应的催化剂是________。
答案 (1)2Ce4++Ti+===2Ce3++Ti3+ (2)Mn2+
解析 催化剂是在化学反应里能改变反应物的化学反应速率(既能提高也能降低),而本身的质量和化学性质在化学反应前后都没有发生改变的物质。从三个反应可以看出Ce4+最终变为Ce3+,Ti+变为Ti3+,Mn2+没变,故为催化剂。
2.甲烷气相热分解反应的化学方程式为2CH4―→CH3—CH3+H2,该反应的机理如下:
①CH4―→·CH3+·H;②________________________________;
③CH4+H·―→·CH3+H2;④·CH3+H·―→CH4。补充反应②的方程式。
答案 ·CH3+CH4―→CH3—CH3+H·
解析 烷烃的热解反应,是典型的自由基反应,自由基反应一般经历链引发、链传递、链终止的过程,故第二步反应属于链传递环节,产物中还有自由基生成,且生成物有乙烷,故确定其反应原理为·CH3+CH4―→CH3—CH3+H·。
3.利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示:
(1)X是________。
(2)上述历程的总反应为________________________________。
(3)由反应历程可知,[(NH4)(HNO2)]+是该反应的________。
答案 (1)N2、H2O (2)2NH3+NO+NO22N2+3H2O (3)中间产物
解析 (1)图示反应可以生成X的反应为[(NH4)2(NO2)]2++NO===[(NH4)(HNO2)]++X+H+,由原子守恒判断X为N2和H2O。(2)由反应历程图可知,氨气、二氧化氮和一氧化氮是反应物,氮气与水是生成物,所以总反应为2NH3+NO+NO22N2+3H2O。(3)由反应历程可知,[(NH4)(HNO2)]+是该反应的中间产物。
在催化循环反应体系中:
催化剂首先直接和原料反应,反应前后存在,反应过程中不存在,催化剂可循环再生,即“失而复得”;而中间体(中间产物)只在反应过程中出现。
1.卤代烃与端基炔(R′C≡CH)催化偶联反应的一种机理如图所示。下列说法错误的是( )
A.偶联反应中起催化作用的是M和CuI
B.R′C≡CCu为该催化过程的中间产物
C.该偶联反应的原理为R′C≡CH+RI―→R′C≡CR+HI
D.该催化机理改变了反应路径和反应热
答案 D
解析 由转化图可知,偶联反应中起催化作用的是M和CuI,故A正确;由转化关系可知,R′C≡CCu产生后又被消耗,为该催化过程的中间产物,故B正确;由流程可知,该偶联反应的原理为R′C≡CH+RI―→R′C≡CR+HI,故C正确;催化剂改变反应路径,不改变反应热,故D错误。
2.CO与N2O在铁催化剂表面进行如下两步反应,其相对能量与反应历程如图所示。
第一步:Fe*+N2O===FeO*+N2
第二步:FeO*+CO===Fe*+CO2
回答下列问题:
(1)该反应的催化剂是______________。
(2)第一步反应是________(填“放热”或“吸热”,下同)反应,第二步反应是________反应。
(3)该反应的总反应化学方程式为____________________________________________。
答案 (1)Fe* (2)放热 放热 (3)CO+N2O===N2+CO2
解析 (1)由题意可知,第一步Fe*被消耗,第二步又生成,说明Fe*是反应的催化剂。(2)根据反应历程图可知,两步反应的生成物的总能量均低于反应物的总能量,则两步反应均为放热反应。(3)根据盖斯定律:第一步反应+第二步反应=总反应,则总反应为CO+N2O===N2+CO2。
二、影响化学反应速率的理论分析
1.基元反应发生的先决条件
反应物的分子必须发生碰撞,但是并不是每一次碰撞都能发生化学反应。
2.有效碰撞
3.活化能和活化分子
(1)活化分子:能够发生有效碰撞的分子。
对于某一化学反应来说,在一定条件下,反应物分子中活化分子的百分数是一定的。
(2)活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。
4.反应物、生成物的能量与活化能的关系图
5.有效碰撞理论影响化学反应速率因素的解释
(1)浓度
反应物浓度增大→单位体积内活化分子数增多→单位时间内有效碰撞的次数增加→化学反应速率增大;反之,化学反应速率减小。
(2)压强
增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数增多→单位时间内有效碰撞的次数增加→化学反应速率增大;反之,化学反应速率减小。
压强对化学反应速率的影响,可转化成浓度对化学反应速率的影响。
(3)温度
升高温度,反应物分子的能量增加→使一部分原来能量较低的分子变成活化分子→活化分子的百分数增大→单位时间内有效碰撞的次数增加→化学反应速率增大;反之,化学反应速率减小。
(4)催化剂
使用催化剂→改变了反应历程(如下图),反应的活化能降低→更多的反应物分子成为活化分子→活化分子的百分数增大→单位时间内有效碰撞的次数增加→化学反应速率增大。
(1)当碰撞的分子具有足够的能量和适当的取向时才能发生化学反应( )
(2)活化能大的反应一定是吸热反应( )
(3)催化剂能降低反应所需的活化能,ΔH也会发生变化( )
(4)活化能越高,反应越难发生,反应速率越慢( )
(5)增大反应物的浓度,使活化分子百分数增大,化学反应速率增大( )
(6)增大压强,活化分子百分数增大,化学反应速率一定增大( )
(7)升高反应体系温度,活化分子百分数增大,化学反应速率一定增大( )
(8)一般使用催化剂可降低反应的活化能,活化分子百分数不变,化学反应速率增大( )
答案 (1)√ (2)× (3)× (4)√ (5)× (6)× (7)√ (8)×
1.浓度、压强、温度、催化剂四因素中,能够改变活化分子百分数的有哪些?
提示 温度、催化剂能够改变活化分子百分数。
2.基元反应过渡状态理论认为,基元反应在从反应物到生成物的变化过程中要经历一个中间状态,这个状态称为过渡态。例如,一溴甲烷与NaOH溶液反应的过程可以表示为CH3Br+OH-―→[Br…CH3…OH]―→Br-+CH3OH
过渡态能量与反应物的平均能量的差值相当于活化能,基元反应的活化能(能垒)越高,此步基元反应速率越慢。请用有效碰撞理论解释原因。
提示 活化能大时,反应物分子不易成为活化分子,很少发生有效碰撞,反应不易发生。
1.下列说法不正确的是( )
A.图甲中曲线Ⅱ可以表示催化剂降低了反应的活化能
B.图乙中HI分子发生了有效碰撞
C.盐酸和氢氧化钠溶液的反应活化能接近于零
D.增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加
答案 B
解析 催化剂可降低反应的活化能,A正确;能够发生化学反应的碰撞才是有效碰撞,由图乙可知碰撞后没有生成新物质,即没有发生化学反应,不是有效碰撞,B错误;盐酸和氢氧化钠溶液反应的实质是氢离子与氢氧根离子反应生成水,在溶液中氢离子与氢氧根离子已经处于活跃状态,因此盐酸和氢氧化钠溶液反应的活化能接近于零,C正确;增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加,D正确。
2.H2O2是重要的消毒剂、氧化剂,研究其分解反应有重要意义。KI能催化H2O2的分解。
①不加KI:2H2O2===2H2O+O2↑
②加入KI:H2O2+I-===H2O+IO-;H2O2+IO-===H2O+O2↑+I-
H2O2分解反应过程中能量变化如图所示。下列判断不正确的是( )
A.加入KI后改变了反应的历程
B.加入KI后改变了反应2H2O2===2H2O+O2的反应热
C.H2O2+I-===H2O+IO-是吸热反应
D.KI降低了该反应的活化能
答案 B
解析 由反应历程图可知,不加KI时反应一步完成,加入KI后分两步进行,并且KI是催化剂,即加入KI后改变了反应的历程,故A项正确;KI是该反应的催化剂,但催化剂不能改变反应的始态和终态,即不能改变反应的反应热,故B项错误;加入KI后反应分两步进行:H2O2+I-===H2O+IO-、H2O2+IO-===H2O+O2↑+I-,由图可知,H2O2和I-具有的能量小于H2O和IO-具有的能量,所以该步反应是吸热反应,故C项正确;催化剂能降低反应的活化能,KI是该反应的催化剂,降低了反应的活化能,故D项正确。
活化分子、有效碰撞与反应速率的关系
三、催化机理与反应历程
1.催化剂特点
(1)催化剂具有高效性和选择性,某种催化剂对某一反应可能催化活性很强,但对其他反应不一定具有催化作用,可以选用合适的催化剂来调控反应。
(2)催化剂的催化活性除了与自身成分有关外,还与粒径、合成方法等因素以及温度、压强等条件有关,催化剂发挥作用需要维持在活性温度范围内,温度过高,催化活性降低。
2.催化剂与反应历程
(1)催化反应历程可表示为扩散→吸附→断键→成键→脱附。
(2)催化剂通过参与反应改变反应历程、降低反应的活化能来加快反应速率。活化能越大,反应越难进行。
(3)复杂反应中的速度控制步骤决定反应的速率,各步基元反应活化能(能垒)大的慢反应是决定整个反应速率的关键步骤。故改变温度,活化能大的反应速率改变程度大。
1.反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应:CH4(g)=== C(s)+2H2(g) 消碳反应:CO2(g)+C(s) ===2CO(g)
ΔH/(kJ·mol-1) +75 +172
活化能/(kJ·mol-1) 催化剂X 33 91
催化剂Y 43 72
由上表判断,催化剂X________(填“优于”或“劣于”)Y,理由是______________________
_______________________________________________________________________________。
提示 劣于 催化剂X较催化剂Y,积碳反应时,活化能低,反应速率大,消碳反应时,活化能高,反应速率小,综合考虑,催化剂X较催化剂Y更利于积碳反应,不利于消碳反应,会降低催化剂活性
2.生物催化剂——酶对反应速率的影响如图所示:
根据酶促反应速率曲线说明酶的催化活性:_________________________________________。
提示 由曲线说明在最适的温度和pH条件下,酶的活性最高
对催化剂的选择性的理解
(1)同一反应,不同催化剂对该反应的催化效果不同。
(2)同一催化剂,对不同反应催化效果也不同。
(3)催化剂的催化活性还与温度、酸碱度等因素有关,使用催化剂时需选择适宜条件。
1.甲酸被认为是理想的氢能载体,我国科技工作者运用DFT计算研究单分子HCOOH在催化剂表面分解产生H2的反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
回答下列问题:
(1)该历程中决定正反应速率步骤的能垒(活化能)E正=________eV,该步骤的反应方程式为________________________________________________________________________。
(2)该历程中甲酸分解制氢气的热化学方程式为________________________________。
答案 (1)0.98 HCOOH*===HCOO*+H*
(2)HCOOH(g)===CO2(g)+H2(g) ΔH=-0.15NA eV·mol-1
解析 (1)反应的活化能越大,反应速率越慢,化学反应速率取决于最慢的一步,由图可知,HCOOH*转化为HCOO*和H*的反应的活化能最大,反应速率最慢,则该历程中决定正反应速率步骤的反应方程式为HCOOH*===HCOO*+H*,能垒(活化能)E正=0.77 eV-(-0.21)eV=0.98 eV。(2)由图可知,甲酸分解生成二氧化碳和氢气的反应为放热反应,反应热ΔH=
-0.15NA eV·mol-1,则反应的热化学方程式为HCOOH(g)===CO2(g)+H2(g) ΔH=-0.15NA eV·
mol-1。
2.(2022·沈阳高二检测)氧化亚氮在碘蒸气存在时的热分解反应:2N2O―→2N2+O2,其反应机理包含以下步骤:
第一步:I2(g)??2I(g)(快反应);
第二步:I(g)+N2O(g)―→N2(g)+IO(g)(慢反应);
第三步:IO(g)+N2O(g)―→N2(g)+O2(g)+I(g)(快反应)。
下列说法错误的是( )
A.第二步对分解反应速率起决定作用
B.I2的浓度与N2O的分解速率无关
C.慢反应的活化能大于快反应的活化能
D.第二步反应中I(g)作还原剂
答案 B
解析 化学反应速率的快慢取决于慢反应,则第二步对分解反应速率起决定作用,故A正确;N2O分解反应中,I2是反应物,碘蒸气的浓度与N2O的分解速率有关,故B错误;活化能越大反应速率越慢,则慢反应的活化能大于快反应的活化能,故C正确;第二步反应中I(g)→IO(g),I元素化合价升高,作还原剂,故D正确。
3.平流层中氟氯烃对臭氧层的破坏是由于含氯化合物的催化作用改变了臭氧分解反应的历程,其反应过程的能量变化如图。总反应:O3+O―→2O2。催化反应:①O3+Cl―→O2+ClO;②ClO+O―→Cl+O2。下列说法正确的是( )
A.Ea=Ea1+Ea2
B.反应①为吸热反应,反应②为放热反应,因此反应速率:反应①<反应②
C.对于加了催化剂的反应:反应速率主要由反应①决定
D.对于总反应,反应物的键能之和大于生成物的键能之和
答案 C
解析 催化剂能降低反应的活化能,并且催化效率越强,活化能降低越多,所以图中Ea与(Ea1+Ea2)之间没有等量关系,A错误;由图可知,反应①为吸热反应,反应②为放热反应,反应①的活化能大于反应②,所以反应速率:反应①<反应②,与反应是吸热反应还是放热反应无关,B错误、C正确;由图可知,总反应为放热反应,焓变=反应物的总键能-生成物的总键能,所以反应物的键能之和小于生成物的键能之和,D错误。
