2.1.4反应机理、变量控制与图像分析 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1
文档属性
| 名称 | 2.1.4反应机理、变量控制与图像分析 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1 |
|
|
| 格式 | docx | ||
| 文件大小 | 826.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-07 19:31:15 | ||
图片预览



文档简介
第4课时 反应机理、变量控制与图像分析
[核心素养发展目标]
1.利用变量控制思维设计实验,基于图像分析反应速率及其影响因素。
2.从微观角度认识反应历程中能量变化与反应速率的关系。
一、反应机理
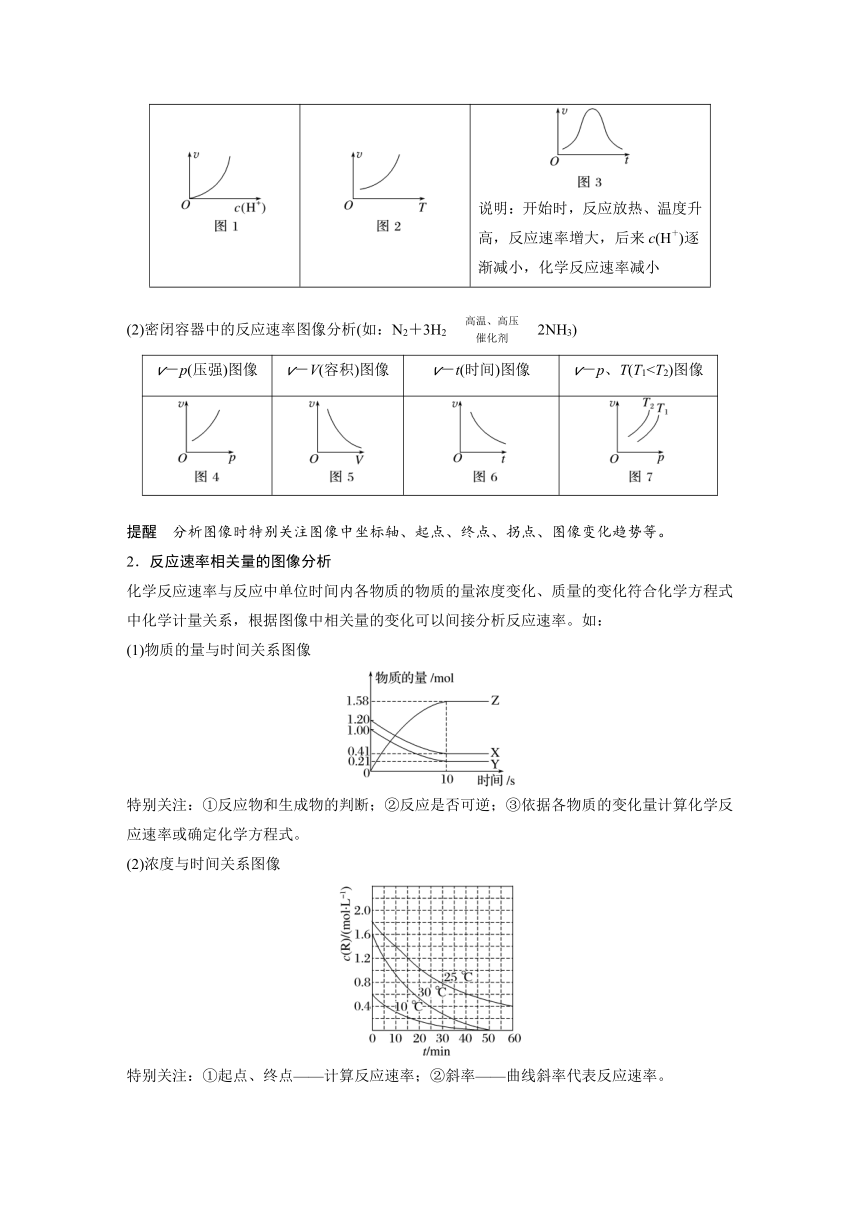
1.(2021·山东,14)18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为:+OH-+CH3O-能量变化如图所示。已知为快速平衡,下列说法正确的是( )
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在CH318OH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
2.(2021·湖南,14改编)铁的配合物离子(用[L Fe H]+表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法错误的是( )
A.该过程的总反应为HCOOHCO2↑+H2↑
B.H+浓度过大或者过小,均导致反应速率降低
C.该催化循环中Fe元素的化合价未发生变化
D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定
二、变量控制
1.(2022·广州高二期中)某兴趣小组将下表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,以研究硫酸铜的浓度对稀硫酸与锌反应生成氢气速率的影响。下列判断不正确的是( )
A B C D E F
4 mol·L-1 H2SO4/mL 30 V1 V2 V3 V4 V5
饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
A.V1=30,V6=10,V7=20
B.本实验利用了控制变量思想,变量为Cu2+浓度
C.反应一段时间后,实验A中的金属呈灰黑色,实验F的金属呈红色
D.该小组的实验结论是硫酸铜对稀硫酸与锌反应生成氢气有催化作用
2.(2022·四川遂宁高二期末)某实验小组利用0.1 mol·L-1Na2S2O3溶液与0.2 mol·L-1H2SO4溶液反应研究外界条件对化学反应速率的影响,设计实验如下:(已知Na2S2O3+H2SO4===
Na2SO4+SO2↑+S↓+H2O)
实验编号 温度/℃ V(Na2S2O3)/mL V(H2SO4)/mL V(H2O)/mL 出现浑浊时间/s
① 20 5.0 10.0 0 t1
② 20 5.0 5.0 5.0 t2
③ 50 5.0 10.0 0 t3
下列说法正确的是( )
A.t1>t2>t3
B.实验①②③均应将Na2S2O3溶液逐滴滴入H2SO4溶液中
C.实验②中加入5.0 mL H2O的作用是控制变量,保持c(Na2S2O3)与实验①一致
D.实验②③可探究温度对化学反应速率的影响
3.目前,汽车厂商常利用催化技术将汽车尾气中的CO和NO转化成CO2和N2,反应的化学方程式为2NO+2CO2CO2+N2。为研究如何提高该转化过程的反应速率,降低NO、CO的污染,某课题组进行了以下实验探究。
[资料查阅] ①不同的催化剂对同一反应的催化效率不同;②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
[实验设计] 该课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成下列实验设计:
实验编号 实验目的 T/℃ NO初始浓度/ (mol·L-1) CO初始浓度/ (mol·L-1) 同种催化剂的比表面积/ (m2·g-1)
Ⅰ 为以下实验作参照 280 6.50×10-3 4.00×10-3 80
Ⅱ ①____ ②____ ③______ ④______ 120
Ⅲ 探究温度对尾气转化速率的影响 360 ⑤________ ⑥________ 80
[图像分析与结论] 利用气体传感器测定了三组实验中CO浓度随时间变化的曲线,如图所示。
(2)由曲线Ⅲ可知,0~ min内,用NO表示的反应速率为_____________________。
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂的比表面积,汽车尾气转化速率________(填“增大”“减小”或“不变”)。
三、图像分析
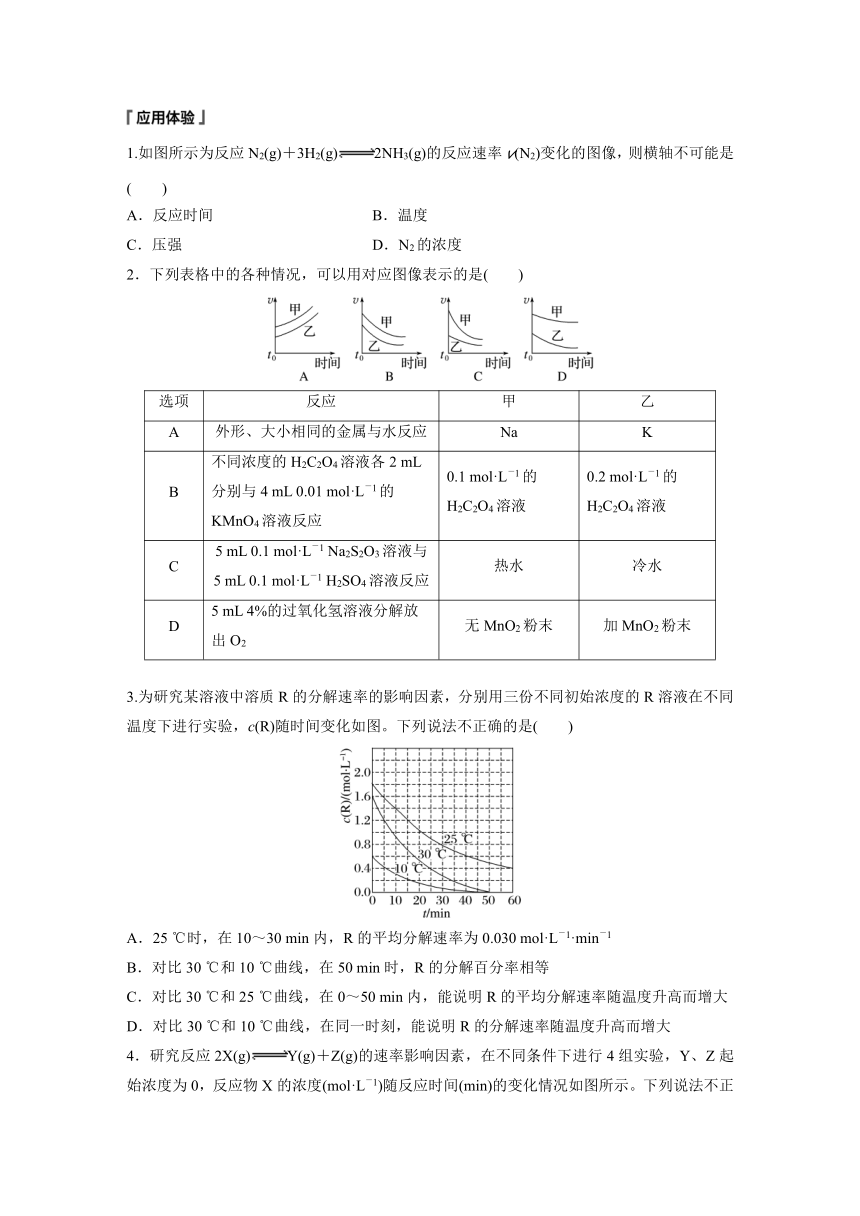
1.反应速率图像分析
化学反应速率与浓度、压强、温度、催化剂等外界因素有关。
(1)溶液中的反应速率图像分析(如:Zn+H2SO4===ZnSO4+H2↑)
v-c(H+)图像 v-T(温度)图像 v-t (时间)图像
说明:开始时,反应放热、温度升高,反应速率增大,后来c(H+)逐渐减小,化学反应速率减小
(2)密闭容器中的反应速率图像分析(如:N2+3H22NH3)
v-p(压强)图像 v-V(容积)图像 v-t(时间)图像 v-p、T(T1提醒 分析图像时特别关注图像中坐标轴、起点、终点、拐点、图像变化趋势等。
2.反应速率相关量的图像分析
化学反应速率与反应中单位时间内各物质的物质的量浓度变化、质量的变化符合化学方程式中化学计量关系,根据图像中相关量的变化可以间接分析反应速率。如:
(1)物质的量与时间关系图像
特别关注:①反应物和生成物的判断;②反应是否可逆;③依据各物质的变化量计算化学反应速率或确定化学方程式。
(2)浓度与时间关系图像
特别关注:①起点、终点——计算反应速率;②斜率——曲线斜率代表反应速率。
1.如图所示为反应N2(g)+3H2(g)2NH3(g)的反应速率v(N2)变化的图像,则横轴不可能是( )
A.反应时间 B.温度
C.压强 D.N2的浓度
2.下列表格中的各种情况,可以用对应图像表示的是( )
选项 反应 甲 乙
A 外形、大小相同的金属与水反应 Na K
B 不同浓度的H2C2O4溶液各2 mL分别与4 mL 0.01 mol·L-1的KMnO4溶液反应 0.1 mol·L-1的H2C2O4溶液 0.2 mol·L-1的H2C2O4溶液
C 5 mL 0.1 mol·L-1 Na2S2O3溶液与5 mL 0.1 mol·L-1 H2SO4溶液反应 热水 冷水
D 5 mL 4%的过氧化氢溶液分解放出O2 无MnO2粉末 加MnO2粉末
3.为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是( )
A.25 ℃时,在10~30 min内,R的平均分解速率为0.030 mol·L-1·min-1
B.对比30 ℃和10 ℃曲线,在50 min时,R的分解百分率相等
C.对比30 ℃和25 ℃曲线,在0~50 min内,能说明R的平均分解速率随温度升高而增大
D.对比30 ℃和10 ℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
4.研究反应2X(g)Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如图所示。下列说法不正确的是( )
A.比较实验②④得出:升高温度,化学反应速率加快
B.比较实验①②得出:增大反应物浓度,化学反应速率加快
C.若实验②③只有一个条件不同,则实验③使用了催化剂
D.在0~10 min内,实验②的平均反应速率v(Y)=0.04 mol·L-1·min-1
第4课时 反应机理、变量控制与图像分析
[核心素养发展目标] 1.利用变量控制思维设计实验,基于图像分析反应速率及其影响因素。2.从微观角度认识反应历程中能量变化与反应速率的关系。
一、反应机理
1.(2021·山东,14)18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为:+OH-+CH3O-能量变化如图所示。已知为快速平衡,下列说法正确的是( )
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在CH318OH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
答案 B
解析 一般来说,反应的活化能越高,反应速率越慢,由图可知,反应Ⅰ和反应Ⅳ的活化能较高,因此反应的决速步为反应Ⅰ、Ⅳ,故A错误;反应Ⅰ为加成反应,而为快速平衡,反应Ⅱ的成键和断键方式为或,后者能生成18OH-,因此反应结束后,溶液中存在18OH-,故B正确;反应Ⅲ的成键和断键方式为或,因此反应结束后溶液中不会存在CH318OH,故C错误;该总反应对应反应物的总能量高于生成物的总能量,总反应为放热反应,因此和CH3O-的总能量与和OH-的总能量之差等于图示总反应的焓变,故D错误。
2.(2021·湖南,14改编)铁的配合物离子(用[L-Fe-H]+表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法错误的是( )
A.该过程的总反应为HCOOHCO2↑+H2↑
B.H+浓度过大或者过小,均导致反应速率降低
C.该催化循环中Fe元素的化合价未发生变化
D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定
答案 D
解析 由反应机理可知,HCOOH电离出氢离子后,HCOO-与催化剂结合,放出二氧化碳,然后又结合氢离子转化为氢气,所以总反应化学方程式为HCOOHCO2↑+H2↑,故A正确;若氢离子浓度过低,则反应Ⅲ→Ⅳ的反应物浓度降低,反应速率减慢,若氢离子浓度过高,则会抑制甲酸的电离,使甲酸根离子浓度降低,反应Ⅰ→Ⅱ速率减慢,所以氢离子浓度过高或过低,均导致反应速率减慢,故B正确;由反应进程可知,反应Ⅳ→Ⅰ能垒最大,反应速率最慢,对该过程的总反应起决定作用,故D错误。
二、变量控制
1.(2022·广州高二期中)某兴趣小组将下表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,以研究硫酸铜的浓度对稀硫酸与锌反应生成氢气速率的影响。下列判断不正确的是( )
A B C D E F
4 mol·L-1 H2SO4/mL 30 V1 V2 V3 V4 V5
饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
A.V1=30,V6=10,V7=20
B.本实验利用了控制变量思想,变量为Cu2+浓度
C.反应一段时间后,实验A中的金属呈灰黑色,实验F的金属呈红色
D.该小组的实验结论是硫酸铜对稀硫酸与锌反应生成氢气有催化作用
答案 D
解析 本实验研究硫酸铜的浓度对反应速率的影响,则每组硫酸的量要保持相同,6组实验溶液的总体积也应该相同,根据实验A和实验F的数据,可知V1=30,V6=10,V7=20,A项正确;本实验利用控制变量思想,通过改变铜离子浓度来研究硫酸铜的浓度对反应速率的影响,B项正确;反应一段时间后,实验A中的金属为Zn,呈灰白色,实验F中的金属为Cu,呈红色,C项正确;硫酸铜的浓度较小时,锌与置换出的铜形成原电池,化学反应速率加快,硫酸铜的浓度较大时,锌与硫酸铜反应生成的铜会附着在锌上,阻碍锌与硫酸反应,氢气生成速率下降,故硫酸铜的浓度与生成氢气的速率不成正比,不能证明硫酸铜对稀硫酸与锌反应生成氢气有催化作用,D项错误。
2.(2022·四川遂宁高二期末)某实验小组利用0.1 mol·L-1Na2S2O3溶液与0.2 mol·L-1H2SO4溶液反应研究外界条件对化学反应速率的影响,设计实验如下:(已知Na2S2O3+H2SO4===
Na2SO4+SO2↑+S↓+H2O)
实验编号 温度/℃ V(Na2S2O3)/mL V(H2SO4)/mL V(H2O)/mL 出现浑浊时间/s
① 20 5.0 10.0 0 t1
② 20 5.0 5.0 5.0 t2
③ 50 5.0 10.0 0 t3
下列说法正确的是( )
A.t1>t2>t3
B.实验①②③均应将Na2S2O3溶液逐滴滴入H2SO4溶液中
C.实验②中加入5.0 mL H2O的作用是控制变量,保持c(Na2S2O3)与实验①一致
D.实验②③可探究温度对化学反应速率的影响
答案 C
解析 温度越高、浓度越大,反应速率越快,则t2>t1>t3,故A错误;应保证Na2S2O3溶液完全反应,则实验①②③均应将H2SO4溶液迅速加入Na2S2O3溶液中,B错误;由控制变量法可知,溶液总体积相同,则实验②中加入5.0 mol H2O的作用是控制变量,保持c(Na2S2O3)与实验①一致,C正确;实验②③中温度及硫酸浓度均不同,不能探究温度对化学反应速率的影响,D错误。
3.目前,汽车厂商常利用催化技术将汽车尾气中的CO和NO转化成CO2和N2,反应的化学方程式为2NO+2CO2CO2+N2。为研究如何提高该转化过程的反应速率,降低NO、CO的污染,某课题组进行了以下实验探究。
[资料查阅] ①不同的催化剂对同一反应的催化效率不同;②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
[实验设计] 该课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成下列实验设计:
实验编号 实验目的 T/℃ NO初始浓度/ (mol·L-1) CO初始浓度/ (mol·L-1) 同种催化剂的比表面积/ (m2·g-1)
Ⅰ 为以下实验作参照 280 6.50×10-3 4.00×10-3 80
Ⅱ ①____ ②____ ③______ ④______ 120
Ⅲ 探究温度对尾气转化速率的影响 360 ⑤________ ⑥________ 80
[图像分析与结论] 利用气体传感器测定了三组实验中CO浓度随时间变化的曲线,如图所示。
(2)由曲线Ⅲ可知,0~ min内,用NO表示的反应速率为_____________________。
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂的比表面积,汽车尾气转化速率________(填“增大”“减小”或“不变”)。
答案 (1)①探究催化剂比表面积对尾气转化速率的影响 ②280 ③6.50×10-3 ④4.00×10-3 ⑤6.50×10-3 ⑥4.00×10-3
(2)3.00×10-3 mol·L-1·min-1
(3)增大
解析 (1)影响化学反应速率的因素有浓度、压强、温度和催化剂的比表面积,而要想探究一种影响因素,必须保持其他影响因素一致;根据实验Ⅲ的实验目的是探究温度对尾气转化速率的影响,故实验Ⅲ和Ⅰ的区别是温度不同,其他因素必须保持一致,故实验Ⅲ中NO初始浓度为6.50×10-3 mol·L-1,CO初始浓度为4.00×10-3 mol·L-1;而通过对比实验Ⅱ和Ⅰ的条件可知,两者的区别是催化剂的比表面积不同,故其他影响因素均应相同,故实验Ⅱ中温度为280 ℃,NO初始浓度为6.50×10-3 mol·L-1,CO初始浓度为4.00×10-3 mol·L-1,而且实验Ⅱ探究的是催化剂比表面积对尾气转化速率的影响。
(2)通过曲线 Ⅲ 可知, min时CO的浓度为2.00×10-3 mol·L-1,可得出CO的浓度的变化量Δc(CO)=2.00×10-3 mol·L-1-4.00×10-3 mol·L-1=-2.00×10-3 mol·L-1,在一个反应中,各物质的浓度的变化量之比等于其化学计量数之比,故NO的浓度的变化量Δc(NO)=-2.00
×10-3 mol·L-1,故用NO表示的反应速率为=-==3.00×10-3 mol·
L-1·min-1。
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂的比表面积,缩短了达到平衡的时间,故增大了反应速率。
三、图像分析
1.反应速率图像分析
化学反应速率与浓度、压强、温度、催化剂等外界因素有关。
(1)溶液中的反应速率图像分析(如:Zn+H2SO4===ZnSO4+H2↑)
v-c(H+)图像 v-T(温度)图像 v-t(时间)图像
说明:开始时,反应放热、温度升高,反应速率增大,后来c(H+)逐渐减小,化学反应速率减小
(2)密闭容器中的反应速率图像分析(如:N2+3H22NH3)
v-p(压强)图像 v-V(容积)图像 v-t(时间)图像 v-p、T(T1提醒 分析图像时特别关注图像中坐标轴、起点、终点、拐点、图像变化趋势等。
2.反应速率相关量的图像分析
化学反应速率与反应中单位时间内各物质的物质的量浓度变化、质量的变化符合化学方程式中化学计量关系,根据图像中相关量的变化可以间接分析反应速率。如:
(1)物质的量与时间关系图像
特别关注:①反应物和生成物的判断;②反应是否可逆;③依据各物质的变化量计算化学反应速率或确定化学方程式。
(2)浓度与时间关系图像
特别关注:①起点、终点——计算反应速率;②斜率——曲线斜率代表反应速率。
1.如图所示为反应N2(g)+3H2(g)2NH3(g)的反应速率v(N2)变化的图像,则横轴不可能是( )
A.反应时间
B.温度
C.压强
D.N2的浓度
答案 A
解析 由题图可知,v(N2)随横轴值的增大而增大。对于反应N2(g)+3H2(g)2NH3(g)来说,其他条件不变时,升高温度、增大压强、增大N2的浓度,都能使v(N2)增大。在N2(g)+3H2(g)2NH3(g)的反应过程中,随着时间的增加,N2的浓度逐渐减小,v(N2)逐渐减小。
2.下列表格中的各种情况,可以用对应图像表示的是( )
选项 反应 甲 乙
A 外形、大小相同的金属与水反应 Na K
B 不同浓度的H2C2O4溶液各2 mL分别与 4 mL 0.01 mol·L-1的KMnO4溶液反应 0.1 mol·L-1的H2C2O4溶液 0.2 mol·L-1的H2C2O4溶液
C 5 mL 0.1 mol·L-1 Na2S2O3溶液与5 mL 0.1 mol·L-1 H2SO4溶液反应 热水 冷水
D 5 mL 4%的过氧化氢溶液分解放出O2 无MnO2粉末 加MnO2粉末
答案 C
解析 Na、K分别与水反应,K更活泼,反应更快,A项不正确;其他条件相同,H2C2O4溶液浓度越大反应速率越快,B项不正确;浓度相同,温度越高反应速率越快,随着反应的进行,反应物的浓度减小,反应速率减小,C项正确;使用催化剂的反应速率更快,D项不正确。
3.为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是( )
A.25 ℃时,在10~30 min内,R的平均分解速率为0.030 mol·L-1·min-1
B.对比30 ℃和10 ℃曲线,在50 min时,R的分解百分率相等
C.对比30 ℃和25 ℃曲线,在0~50 min内,能说明R的平均分解速率随温度升高而增大
D.对比30 ℃和10 ℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
答案 D
解析 由图像可知,25 ℃时,在10~30 min内,R的浓度变化为0.8 mol·L-1-1.4 mol·L-1=-0.6 mol·L-1,R的平均分解速率v=-==0.030 mol·L-1·min-1,A项正确;由图像可知,对比30 ℃和10 ℃曲线,在50 min时,R的浓度均为0,说明R完全分解,所以R的分解百分率相等,均为100%,B项正确;由图像可知,25 ℃曲线在0~50 min内,R的平均分解速率为-==0.026 mol·L-1·min-1,30 ℃曲线在0~50 min内,R的平均分解速率为=0.032 mol·L-1·min-1,虽然30 ℃曲线反应物的起始浓度较小,但在0~50 min内,R的平均分解速率仍比25 ℃曲线大(或30 ℃曲线斜率比25 ℃曲线大),说明R的平均分解速率随温度升高而增大,C项正确;对比30 ℃和10 ℃曲线,能说明R的平均分解速率随温度升高而增大,但30 ℃曲线反应物的起始浓度大,R的分解速率也相应大,因此在同一时刻不能说明R的分解速率随温度升高而增大,D项错误。
4.研究反应2X(g)Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如图所示。下列说法不正确的是( )
A.比较实验②④得出:升高温度,化学反应速率加快
B.比较实验①②得出:增大反应物浓度,化学反应速率加快
C.若实验②③只有一个条件不同,则实验③使用了催化剂
D.在0~10 min内,实验②的平均反应速率v(Y)=0.04 mol·L-1·min-1
答案 D
解析 实验②④起始浓度相同,但温度不同,实验④反应速率较大,则可得出:升高温度,化学反应速率加快,故A正确;实验①②温度相同,但浓度不同,实验①浓度较大,则可得出:增大反应物浓度,化学反应速率加快,故B正确;实验②③温度、浓度相同,实验③反应速率较大,应为加入了催化剂,故C正确;在0~10 min之间,实验②中X的浓度变化为0.2 mol·L-1,则v(Y)=v(X)=×=0.01 mol·L-1·min-1,故D错误。
[核心素养发展目标]
1.利用变量控制思维设计实验,基于图像分析反应速率及其影响因素。
2.从微观角度认识反应历程中能量变化与反应速率的关系。
一、反应机理
1.(2021·山东,14)18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为:+OH-+CH3O-能量变化如图所示。已知为快速平衡,下列说法正确的是( )
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在CH318OH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
2.(2021·湖南,14改编)铁的配合物离子(用[L Fe H]+表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法错误的是( )
A.该过程的总反应为HCOOHCO2↑+H2↑
B.H+浓度过大或者过小,均导致反应速率降低
C.该催化循环中Fe元素的化合价未发生变化
D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定
二、变量控制
1.(2022·广州高二期中)某兴趣小组将下表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,以研究硫酸铜的浓度对稀硫酸与锌反应生成氢气速率的影响。下列判断不正确的是( )
A B C D E F
4 mol·L-1 H2SO4/mL 30 V1 V2 V3 V4 V5
饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
A.V1=30,V6=10,V7=20
B.本实验利用了控制变量思想,变量为Cu2+浓度
C.反应一段时间后,实验A中的金属呈灰黑色,实验F的金属呈红色
D.该小组的实验结论是硫酸铜对稀硫酸与锌反应生成氢气有催化作用
2.(2022·四川遂宁高二期末)某实验小组利用0.1 mol·L-1Na2S2O3溶液与0.2 mol·L-1H2SO4溶液反应研究外界条件对化学反应速率的影响,设计实验如下:(已知Na2S2O3+H2SO4===
Na2SO4+SO2↑+S↓+H2O)
实验编号 温度/℃ V(Na2S2O3)/mL V(H2SO4)/mL V(H2O)/mL 出现浑浊时间/s
① 20 5.0 10.0 0 t1
② 20 5.0 5.0 5.0 t2
③ 50 5.0 10.0 0 t3
下列说法正确的是( )
A.t1>t2>t3
B.实验①②③均应将Na2S2O3溶液逐滴滴入H2SO4溶液中
C.实验②中加入5.0 mL H2O的作用是控制变量,保持c(Na2S2O3)与实验①一致
D.实验②③可探究温度对化学反应速率的影响
3.目前,汽车厂商常利用催化技术将汽车尾气中的CO和NO转化成CO2和N2,反应的化学方程式为2NO+2CO2CO2+N2。为研究如何提高该转化过程的反应速率,降低NO、CO的污染,某课题组进行了以下实验探究。
[资料查阅] ①不同的催化剂对同一反应的催化效率不同;②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
[实验设计] 该课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成下列实验设计:
实验编号 实验目的 T/℃ NO初始浓度/ (mol·L-1) CO初始浓度/ (mol·L-1) 同种催化剂的比表面积/ (m2·g-1)
Ⅰ 为以下实验作参照 280 6.50×10-3 4.00×10-3 80
Ⅱ ①____ ②____ ③______ ④______ 120
Ⅲ 探究温度对尾气转化速率的影响 360 ⑤________ ⑥________ 80
[图像分析与结论] 利用气体传感器测定了三组实验中CO浓度随时间变化的曲线,如图所示。
(2)由曲线Ⅲ可知,0~ min内,用NO表示的反应速率为_____________________。
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂的比表面积,汽车尾气转化速率________(填“增大”“减小”或“不变”)。
三、图像分析
1.反应速率图像分析
化学反应速率与浓度、压强、温度、催化剂等外界因素有关。
(1)溶液中的反应速率图像分析(如:Zn+H2SO4===ZnSO4+H2↑)
v-c(H+)图像 v-T(温度)图像 v-t (时间)图像
说明:开始时,反应放热、温度升高,反应速率增大,后来c(H+)逐渐减小,化学反应速率减小
(2)密闭容器中的反应速率图像分析(如:N2+3H22NH3)
v-p(压强)图像 v-V(容积)图像 v-t(时间)图像 v-p、T(T1
2.反应速率相关量的图像分析
化学反应速率与反应中单位时间内各物质的物质的量浓度变化、质量的变化符合化学方程式中化学计量关系,根据图像中相关量的变化可以间接分析反应速率。如:
(1)物质的量与时间关系图像
特别关注:①反应物和生成物的判断;②反应是否可逆;③依据各物质的变化量计算化学反应速率或确定化学方程式。
(2)浓度与时间关系图像
特别关注:①起点、终点——计算反应速率;②斜率——曲线斜率代表反应速率。
1.如图所示为反应N2(g)+3H2(g)2NH3(g)的反应速率v(N2)变化的图像,则横轴不可能是( )
A.反应时间 B.温度
C.压强 D.N2的浓度
2.下列表格中的各种情况,可以用对应图像表示的是( )
选项 反应 甲 乙
A 外形、大小相同的金属与水反应 Na K
B 不同浓度的H2C2O4溶液各2 mL分别与4 mL 0.01 mol·L-1的KMnO4溶液反应 0.1 mol·L-1的H2C2O4溶液 0.2 mol·L-1的H2C2O4溶液
C 5 mL 0.1 mol·L-1 Na2S2O3溶液与5 mL 0.1 mol·L-1 H2SO4溶液反应 热水 冷水
D 5 mL 4%的过氧化氢溶液分解放出O2 无MnO2粉末 加MnO2粉末
3.为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是( )
A.25 ℃时,在10~30 min内,R的平均分解速率为0.030 mol·L-1·min-1
B.对比30 ℃和10 ℃曲线,在50 min时,R的分解百分率相等
C.对比30 ℃和25 ℃曲线,在0~50 min内,能说明R的平均分解速率随温度升高而增大
D.对比30 ℃和10 ℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
4.研究反应2X(g)Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如图所示。下列说法不正确的是( )
A.比较实验②④得出:升高温度,化学反应速率加快
B.比较实验①②得出:增大反应物浓度,化学反应速率加快
C.若实验②③只有一个条件不同,则实验③使用了催化剂
D.在0~10 min内,实验②的平均反应速率v(Y)=0.04 mol·L-1·min-1
第4课时 反应机理、变量控制与图像分析
[核心素养发展目标] 1.利用变量控制思维设计实验,基于图像分析反应速率及其影响因素。2.从微观角度认识反应历程中能量变化与反应速率的关系。
一、反应机理
1.(2021·山东,14)18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为:+OH-+CH3O-能量变化如图所示。已知为快速平衡,下列说法正确的是( )
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在CH318OH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
答案 B
解析 一般来说,反应的活化能越高,反应速率越慢,由图可知,反应Ⅰ和反应Ⅳ的活化能较高,因此反应的决速步为反应Ⅰ、Ⅳ,故A错误;反应Ⅰ为加成反应,而为快速平衡,反应Ⅱ的成键和断键方式为或,后者能生成18OH-,因此反应结束后,溶液中存在18OH-,故B正确;反应Ⅲ的成键和断键方式为或,因此反应结束后溶液中不会存在CH318OH,故C错误;该总反应对应反应物的总能量高于生成物的总能量,总反应为放热反应,因此和CH3O-的总能量与和OH-的总能量之差等于图示总反应的焓变,故D错误。
2.(2021·湖南,14改编)铁的配合物离子(用[L-Fe-H]+表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法错误的是( )
A.该过程的总反应为HCOOHCO2↑+H2↑
B.H+浓度过大或者过小,均导致反应速率降低
C.该催化循环中Fe元素的化合价未发生变化
D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定
答案 D
解析 由反应机理可知,HCOOH电离出氢离子后,HCOO-与催化剂结合,放出二氧化碳,然后又结合氢离子转化为氢气,所以总反应化学方程式为HCOOHCO2↑+H2↑,故A正确;若氢离子浓度过低,则反应Ⅲ→Ⅳ的反应物浓度降低,反应速率减慢,若氢离子浓度过高,则会抑制甲酸的电离,使甲酸根离子浓度降低,反应Ⅰ→Ⅱ速率减慢,所以氢离子浓度过高或过低,均导致反应速率减慢,故B正确;由反应进程可知,反应Ⅳ→Ⅰ能垒最大,反应速率最慢,对该过程的总反应起决定作用,故D错误。
二、变量控制
1.(2022·广州高二期中)某兴趣小组将下表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,以研究硫酸铜的浓度对稀硫酸与锌反应生成氢气速率的影响。下列判断不正确的是( )
A B C D E F
4 mol·L-1 H2SO4/mL 30 V1 V2 V3 V4 V5
饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
A.V1=30,V6=10,V7=20
B.本实验利用了控制变量思想,变量为Cu2+浓度
C.反应一段时间后,实验A中的金属呈灰黑色,实验F的金属呈红色
D.该小组的实验结论是硫酸铜对稀硫酸与锌反应生成氢气有催化作用
答案 D
解析 本实验研究硫酸铜的浓度对反应速率的影响,则每组硫酸的量要保持相同,6组实验溶液的总体积也应该相同,根据实验A和实验F的数据,可知V1=30,V6=10,V7=20,A项正确;本实验利用控制变量思想,通过改变铜离子浓度来研究硫酸铜的浓度对反应速率的影响,B项正确;反应一段时间后,实验A中的金属为Zn,呈灰白色,实验F中的金属为Cu,呈红色,C项正确;硫酸铜的浓度较小时,锌与置换出的铜形成原电池,化学反应速率加快,硫酸铜的浓度较大时,锌与硫酸铜反应生成的铜会附着在锌上,阻碍锌与硫酸反应,氢气生成速率下降,故硫酸铜的浓度与生成氢气的速率不成正比,不能证明硫酸铜对稀硫酸与锌反应生成氢气有催化作用,D项错误。
2.(2022·四川遂宁高二期末)某实验小组利用0.1 mol·L-1Na2S2O3溶液与0.2 mol·L-1H2SO4溶液反应研究外界条件对化学反应速率的影响,设计实验如下:(已知Na2S2O3+H2SO4===
Na2SO4+SO2↑+S↓+H2O)
实验编号 温度/℃ V(Na2S2O3)/mL V(H2SO4)/mL V(H2O)/mL 出现浑浊时间/s
① 20 5.0 10.0 0 t1
② 20 5.0 5.0 5.0 t2
③ 50 5.0 10.0 0 t3
下列说法正确的是( )
A.t1>t2>t3
B.实验①②③均应将Na2S2O3溶液逐滴滴入H2SO4溶液中
C.实验②中加入5.0 mL H2O的作用是控制变量,保持c(Na2S2O3)与实验①一致
D.实验②③可探究温度对化学反应速率的影响
答案 C
解析 温度越高、浓度越大,反应速率越快,则t2>t1>t3,故A错误;应保证Na2S2O3溶液完全反应,则实验①②③均应将H2SO4溶液迅速加入Na2S2O3溶液中,B错误;由控制变量法可知,溶液总体积相同,则实验②中加入5.0 mol H2O的作用是控制变量,保持c(Na2S2O3)与实验①一致,C正确;实验②③中温度及硫酸浓度均不同,不能探究温度对化学反应速率的影响,D错误。
3.目前,汽车厂商常利用催化技术将汽车尾气中的CO和NO转化成CO2和N2,反应的化学方程式为2NO+2CO2CO2+N2。为研究如何提高该转化过程的反应速率,降低NO、CO的污染,某课题组进行了以下实验探究。
[资料查阅] ①不同的催化剂对同一反应的催化效率不同;②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
[实验设计] 该课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成下列实验设计:
实验编号 实验目的 T/℃ NO初始浓度/ (mol·L-1) CO初始浓度/ (mol·L-1) 同种催化剂的比表面积/ (m2·g-1)
Ⅰ 为以下实验作参照 280 6.50×10-3 4.00×10-3 80
Ⅱ ①____ ②____ ③______ ④______ 120
Ⅲ 探究温度对尾气转化速率的影响 360 ⑤________ ⑥________ 80
[图像分析与结论] 利用气体传感器测定了三组实验中CO浓度随时间变化的曲线,如图所示。
(2)由曲线Ⅲ可知,0~ min内,用NO表示的反应速率为_____________________。
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂的比表面积,汽车尾气转化速率________(填“增大”“减小”或“不变”)。
答案 (1)①探究催化剂比表面积对尾气转化速率的影响 ②280 ③6.50×10-3 ④4.00×10-3 ⑤6.50×10-3 ⑥4.00×10-3
(2)3.00×10-3 mol·L-1·min-1
(3)增大
解析 (1)影响化学反应速率的因素有浓度、压强、温度和催化剂的比表面积,而要想探究一种影响因素,必须保持其他影响因素一致;根据实验Ⅲ的实验目的是探究温度对尾气转化速率的影响,故实验Ⅲ和Ⅰ的区别是温度不同,其他因素必须保持一致,故实验Ⅲ中NO初始浓度为6.50×10-3 mol·L-1,CO初始浓度为4.00×10-3 mol·L-1;而通过对比实验Ⅱ和Ⅰ的条件可知,两者的区别是催化剂的比表面积不同,故其他影响因素均应相同,故实验Ⅱ中温度为280 ℃,NO初始浓度为6.50×10-3 mol·L-1,CO初始浓度为4.00×10-3 mol·L-1,而且实验Ⅱ探究的是催化剂比表面积对尾气转化速率的影响。
(2)通过曲线 Ⅲ 可知, min时CO的浓度为2.00×10-3 mol·L-1,可得出CO的浓度的变化量Δc(CO)=2.00×10-3 mol·L-1-4.00×10-3 mol·L-1=-2.00×10-3 mol·L-1,在一个反应中,各物质的浓度的变化量之比等于其化学计量数之比,故NO的浓度的变化量Δc(NO)=-2.00
×10-3 mol·L-1,故用NO表示的反应速率为=-==3.00×10-3 mol·
L-1·min-1。
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂的比表面积,缩短了达到平衡的时间,故增大了反应速率。
三、图像分析
1.反应速率图像分析
化学反应速率与浓度、压强、温度、催化剂等外界因素有关。
(1)溶液中的反应速率图像分析(如:Zn+H2SO4===ZnSO4+H2↑)
v-c(H+)图像 v-T(温度)图像 v-t(时间)图像
说明:开始时,反应放热、温度升高,反应速率增大,后来c(H+)逐渐减小,化学反应速率减小
(2)密闭容器中的反应速率图像分析(如:N2+3H22NH3)
v-p(压强)图像 v-V(容积)图像 v-t(时间)图像 v-p、T(T1
2.反应速率相关量的图像分析
化学反应速率与反应中单位时间内各物质的物质的量浓度变化、质量的变化符合化学方程式中化学计量关系,根据图像中相关量的变化可以间接分析反应速率。如:
(1)物质的量与时间关系图像
特别关注:①反应物和生成物的判断;②反应是否可逆;③依据各物质的变化量计算化学反应速率或确定化学方程式。
(2)浓度与时间关系图像
特别关注:①起点、终点——计算反应速率;②斜率——曲线斜率代表反应速率。
1.如图所示为反应N2(g)+3H2(g)2NH3(g)的反应速率v(N2)变化的图像,则横轴不可能是( )
A.反应时间
B.温度
C.压强
D.N2的浓度
答案 A
解析 由题图可知,v(N2)随横轴值的增大而增大。对于反应N2(g)+3H2(g)2NH3(g)来说,其他条件不变时,升高温度、增大压强、增大N2的浓度,都能使v(N2)增大。在N2(g)+3H2(g)2NH3(g)的反应过程中,随着时间的增加,N2的浓度逐渐减小,v(N2)逐渐减小。
2.下列表格中的各种情况,可以用对应图像表示的是( )
选项 反应 甲 乙
A 外形、大小相同的金属与水反应 Na K
B 不同浓度的H2C2O4溶液各2 mL分别与 4 mL 0.01 mol·L-1的KMnO4溶液反应 0.1 mol·L-1的H2C2O4溶液 0.2 mol·L-1的H2C2O4溶液
C 5 mL 0.1 mol·L-1 Na2S2O3溶液与5 mL 0.1 mol·L-1 H2SO4溶液反应 热水 冷水
D 5 mL 4%的过氧化氢溶液分解放出O2 无MnO2粉末 加MnO2粉末
答案 C
解析 Na、K分别与水反应,K更活泼,反应更快,A项不正确;其他条件相同,H2C2O4溶液浓度越大反应速率越快,B项不正确;浓度相同,温度越高反应速率越快,随着反应的进行,反应物的浓度减小,反应速率减小,C项正确;使用催化剂的反应速率更快,D项不正确。
3.为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是( )
A.25 ℃时,在10~30 min内,R的平均分解速率为0.030 mol·L-1·min-1
B.对比30 ℃和10 ℃曲线,在50 min时,R的分解百分率相等
C.对比30 ℃和25 ℃曲线,在0~50 min内,能说明R的平均分解速率随温度升高而增大
D.对比30 ℃和10 ℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
答案 D
解析 由图像可知,25 ℃时,在10~30 min内,R的浓度变化为0.8 mol·L-1-1.4 mol·L-1=-0.6 mol·L-1,R的平均分解速率v=-==0.030 mol·L-1·min-1,A项正确;由图像可知,对比30 ℃和10 ℃曲线,在50 min时,R的浓度均为0,说明R完全分解,所以R的分解百分率相等,均为100%,B项正确;由图像可知,25 ℃曲线在0~50 min内,R的平均分解速率为-==0.026 mol·L-1·min-1,30 ℃曲线在0~50 min内,R的平均分解速率为=0.032 mol·L-1·min-1,虽然30 ℃曲线反应物的起始浓度较小,但在0~50 min内,R的平均分解速率仍比25 ℃曲线大(或30 ℃曲线斜率比25 ℃曲线大),说明R的平均分解速率随温度升高而增大,C项正确;对比30 ℃和10 ℃曲线,能说明R的平均分解速率随温度升高而增大,但30 ℃曲线反应物的起始浓度大,R的分解速率也相应大,因此在同一时刻不能说明R的分解速率随温度升高而增大,D项错误。
4.研究反应2X(g)Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如图所示。下列说法不正确的是( )
A.比较实验②④得出:升高温度,化学反应速率加快
B.比较实验①②得出:增大反应物浓度,化学反应速率加快
C.若实验②③只有一个条件不同,则实验③使用了催化剂
D.在0~10 min内,实验②的平均反应速率v(Y)=0.04 mol·L-1·min-1
答案 D
解析 实验②④起始浓度相同,但温度不同,实验④反应速率较大,则可得出:升高温度,化学反应速率加快,故A正确;实验①②温度相同,但浓度不同,实验①浓度较大,则可得出:增大反应物浓度,化学反应速率加快,故B正确;实验②③温度、浓度相同,实验③反应速率较大,应为加入了催化剂,故C正确;在0~10 min之间,实验②中X的浓度变化为0.2 mol·L-1,则v(Y)=v(X)=×=0.01 mol·L-1·min-1,故D错误。
