1.3.3 氧化还原反应的规律及应用 课件 (共22张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.3 氧化还原反应的规律及应用 课件 (共22张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-08 07:52:41 | ||
图片预览






文档简介
(共22张PPT)
第一章 物质及其变化
第三节 氧化还原反应
第3 课时 氧化还原反应的规律及应用
习
学
目
标
1.通过阅读归纳、练习应用,学会利用氧化性和还原性强弱判断化学
反应能否发生;
2.能用氧化还原反应的相关知识解释生活中的一些化学现象。
3.通过对氧化还原反应的学习与研究,感受氧化还原反应的价值。
一、氧化还原反应的价态规律
1.高低规律
A.元素处于最高价,只有氧化性
(如Fe3+、KMnO4、H2SO4等);
B.元素处于最低价,只有还原性(如S2-、I-等);
C.元素处于中间价态,既有氧化性又有还原性。(如Fe2+、S等)
(1)内容:元素在物质中所处的价态,决定该元素的氧化性或还原性,一般来说,
(2)应用:预测物质的氧化性和还原性。
一、氧化还原反应的价态规律
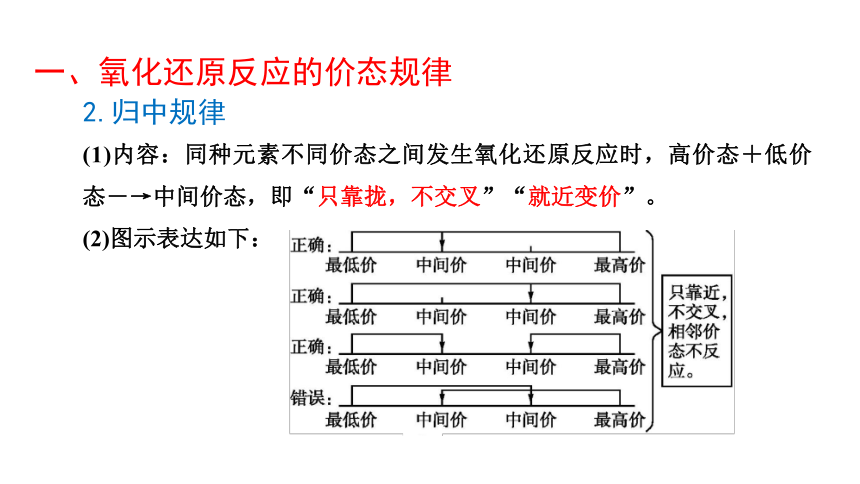
2.归中规律
(1)内容:同种元素不同价态之间发生氧化还原反应时,高价态+低价态―→中间价态,即“只靠拢,不交叉”“就近变价”。
(2)图示表达如下:
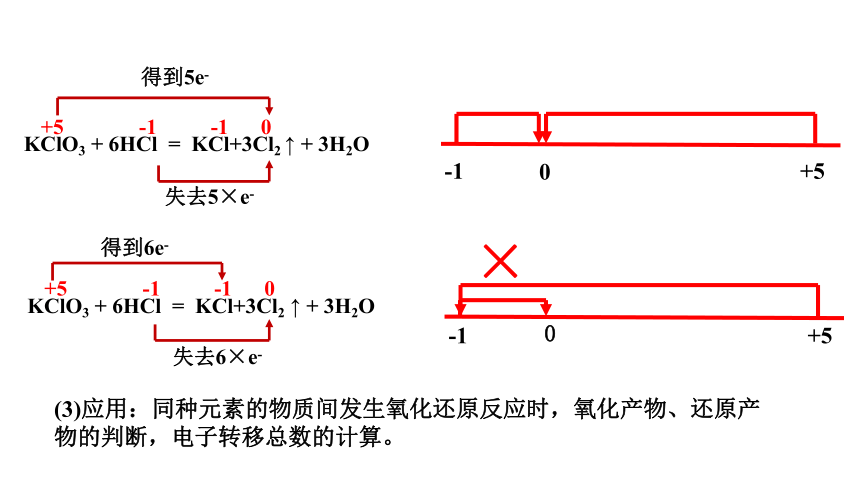
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
得到5e-
失去5×e-
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
失去6×e-
得到6e-
-1
+5
0
-1
+5
0
×
(3)应用:同种元素的物质间发生氧化还原反应时,氧化产物、还原产物的判断,电子转移总数的计算。
一、氧化还原反应的价态规律
3.歧化规律
(1)内容:氧化还原反应中,有原子化合价升高,必然有原子化合价降低。
(2)应用:①利用此规律可准确确定氧化产物和还原产物;
②可判断同种元素不同价态的原子间能否发生氧化还原反应。
元素的中间价态→该元素的高价化合物 + 该元素的低价化合物
例如:
Cl2+2NaOH=NaCl+NaClO+ H2O
0
-1
+1
得 1e-
失 1e-
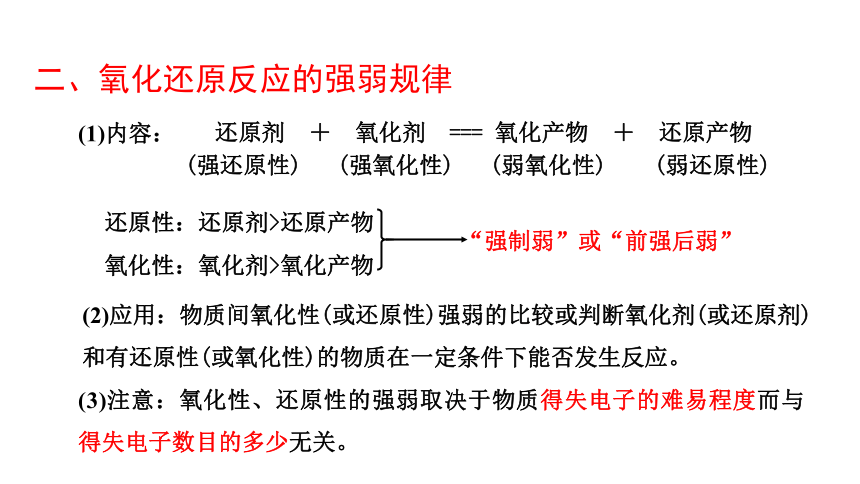
二、氧化还原反应的强弱规律
还原剂 + 氧化剂 === 氧化产物 + 还原产物
(强还原性) (强氧化性) (弱氧化性) (弱还原性)
还原性:还原剂>还原产物
氧化性:氧化剂>氧化产物
“强制弱”或“前强后弱”
(1)内容:
(2)应用:物质间氧化性(或还原性)强弱的比较或判断氧化剂(或还原剂)
和有还原性(或氧化性)的物质在一定条件下能否发生反应。
(3)注意:氧化性、还原性的强弱取决于物质得失电子的难易程度而与得失电子数目的多少无关。
典例精讲
例1:根据反应式:(1)2Fe3+ +2I-——2Fe2+ +I2,(2)Br2+2Fe2+——2Fe3+ +2Br-,可判断离子的还原性从强到弱的顺序是( )
A.Br- 、Fe2+ 、I- B.I- 、Fe2+ 、Br- C.Br- 、I- 、Fe2+ D.Fe2+ 、I- 、Br-
例2:已知X和Y是两种单质,它们之间的反应是X+Y——X2++Y2-。
(1)现有下列叙述:①X被氧化;②X是氧化剂;③Y2- 是还原产物;④X2+ 具有氧化性;⑤Y2- 具有还原性;⑥Y单质的氧化性比X2+ 的氧化性强。
上述说法中正确的是( )
A.①②③ B.①②⑥ C.①③④⑤⑥ D.①③④⑤
B
C
三、氧化还原反应的先后规律
(1)内容:同一氧化剂与多种还原剂混合时,还原性强的先被氧化;
同一还原剂与多种氧化剂混合时,氧化性强的先被还原。
(2)应用:判断物质的氧化性、还原性强弱或判断反应的先后顺序。
例如:已知还原性:I->Fe2+>Br-,当把氯气通入FeBr2溶液时,因为还原性:Fe2+>Br-,所以氯气的量不足时首先氧化Fe2+;把氯气通入FeI2溶液时,因为还原性:I->Fe2+,所以氯气的量不足时首先氧化I-。
例如:在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后再依次与Cu2+、H+反应。
典例精讲
例1:在含有Cu(NO3)2、Mg(NO3)2、AgNO3的溶液中加入适量锌粉,首先置换出的是( )
A.Mg B.Cu C.Ag D.H2
C
例2( 双选):已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-A.2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O
D.2Fe2++I2===2Fe3++2I-
CD
四、氧化还原反应的守恒规律
(1)内容:氧化还原反应中,化合价有升必有降,电子有得必有失。对于一个完整的氧化还原反应,化合价升高总数与降低总数相等,失电子总数与得电子总教相等,即有关系式:
(2)应用:氧化还原反应方程式的配平,氧化还原反应的相关计算。
元素化合价降低的总数=元素化合价升高的总数
还原剂失电子的总数=氧化剂得电子的总数
五、氧化还原反应方程式的配平
1.氧化还原反应方程式配平的基本原则
(1)得失电子守恒:
氧化剂和还原剂得失电子总数相等,化合价升高总数=化合价降低总数。
(2)质量守恒:
反应前后原子的种类和个数不变。
(3)电荷守恒:
离子反应前后,阴、阳离子所带电荷总数相等。
五、氧化还原反应方程式的配平
2.氧化还原反应方程式配平的一般步骤
(1)标价态:写出反应物和生成物的化学式,标出发生氧化反应和还原反应的元素的化合价。
(2)列变化:列出元素得失电子数(元素的化合价的变化);
(3)求总数:通过求最小公倍数使化合价升降总数相等。
(4)配系数:用观察法配平其他物质的化学计量数。
(5)查守恒:检查电荷是否守恒,原子个数是否守恒,配平后,把单线改成等号,标注反应条件。
五、氧化还原反应方程式的配平
3.氧化还原反应方程式配平的技巧方法
(1)正向配平法:氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平。
NH3 + O2 —— NO + H2O
催化剂
-3
+2
0
-2
-2
5
2×2
4
5
4
6
×4
×5
——
练习:H2S+ O2 — SO2+ H2O
点燃
2 3 ==2 2
五、氧化还原反应方程式的配平
3.氧化还原反应方程式配平的技巧方法
(2)逆向配平法:自身氧化还原反应(包括分解、歧化)一般从右边着手配平。
S + KOH —— K2S + K2SO3 + H2O
0
+4
-2
4
2
3
6
2
3
×2
——
Cl2+__NaOH = __NaCl+__NaClO3+__H2O
3
6
5
1
3
练习:
五、氧化还原反应方程式的配平
3.氧化还原反应方程式配平的技巧方法
(3)整体配平法:以有两种元素化合价升高或降低的物质为着手点,将化合价升降总数做为一个整体,再用一般方法进行配平。
配平得 3Cu2S+22HNO3=6Cu(NO3)2+10NO↑+3H2SO4+8H2O
五、氧化还原反应方程式的配平
3.氧化还原反应方程式配平的技巧方法
(4)缺项配平法:
①先配氧化剂、还原剂及还原产物与氧化产物;
②再根据质量守恒、电荷守恒确定所缺的物质的化学式(分子或离子);
③最后观察配平其他物质系数。
Cr2O72- + Fe2+ + ( ) → Cr3+ + Fe3+ + H2O
6 2 6
+6 +2 +3 +3
14 H+ 7
缺项配平的补项原则
条件 补项原则
酸性条件 缺H或多O补H+,少O补H2O
碱性条件 缺H或多O补H2O,少O补OH-
(1)补项原则:
(2)组合方式:
反应物 生成物 使用条件
H+ H2O 酸性溶液
组合二 H2O H+ 酸性溶液或酸碱性未知
组合三 OH- H2O 碱性溶液
组合四 H2O OH- 碱性溶液或酸碱性未知
五、氧化还原反应方程式的计算
1.计算依据
(1)氧化剂获得电子总数等于还原剂失去电子总数,即得失电子守恒。
(2)氧化剂中元素降价总数等于还原剂中元素升价总数,即化合价升降守恒。
2.计算方法
(1)找出氧化剂、还原剂及对应的还原产物、氧化产物。
(2)标准确变价元素的化合价。
(3)找准每个氧化剂、还原剂中变价的原子个数。
(4)列出等式并计算:N(氧化剂)×变价原子个数×|化合价变化值|
=N(还原剂)×变价原子个数×|化合价变化值|。
典例精讲
例:Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的个数之比为1∶16,则x的值为( )
A.2 B.3 C.4 D.5
得关系式1×(6x+2)=16×2
↑(6x+2)
↓ 2
x=5
D
个数比 1 : 16
根据化学式找变化
课堂小结
一、氧化还原反应的四大规律
2.强弱规律(前强后弱)
3.先后规律(谁强谁优先)
1.价态规律(高低规律、归中规律、歧化规律)
4.守恒规律(得失电子守恒)
二、氧化还原反应方程式的配平与计算
元素化合价降低的总数=元素化合价升高的总数
还原剂失电子的总数=氧化剂得电子的总数
THANKS
第一章 物质及其变化
第三节 氧化还原反应
第3 课时 氧化还原反应的规律及应用
习
学
目
标
1.通过阅读归纳、练习应用,学会利用氧化性和还原性强弱判断化学
反应能否发生;
2.能用氧化还原反应的相关知识解释生活中的一些化学现象。
3.通过对氧化还原反应的学习与研究,感受氧化还原反应的价值。
一、氧化还原反应的价态规律
1.高低规律
A.元素处于最高价,只有氧化性
(如Fe3+、KMnO4、H2SO4等);
B.元素处于最低价,只有还原性(如S2-、I-等);
C.元素处于中间价态,既有氧化性又有还原性。(如Fe2+、S等)
(1)内容:元素在物质中所处的价态,决定该元素的氧化性或还原性,一般来说,
(2)应用:预测物质的氧化性和还原性。
一、氧化还原反应的价态规律
2.归中规律
(1)内容:同种元素不同价态之间发生氧化还原反应时,高价态+低价态―→中间价态,即“只靠拢,不交叉”“就近变价”。
(2)图示表达如下:
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
得到5e-
失去5×e-
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
失去6×e-
得到6e-
-1
+5
0
-1
+5
0
×
(3)应用:同种元素的物质间发生氧化还原反应时,氧化产物、还原产物的判断,电子转移总数的计算。
一、氧化还原反应的价态规律
3.歧化规律
(1)内容:氧化还原反应中,有原子化合价升高,必然有原子化合价降低。
(2)应用:①利用此规律可准确确定氧化产物和还原产物;
②可判断同种元素不同价态的原子间能否发生氧化还原反应。
元素的中间价态→该元素的高价化合物 + 该元素的低价化合物
例如:
Cl2+2NaOH=NaCl+NaClO+ H2O
0
-1
+1
得 1e-
失 1e-
二、氧化还原反应的强弱规律
还原剂 + 氧化剂 === 氧化产物 + 还原产物
(强还原性) (强氧化性) (弱氧化性) (弱还原性)
还原性:还原剂>还原产物
氧化性:氧化剂>氧化产物
“强制弱”或“前强后弱”
(1)内容:
(2)应用:物质间氧化性(或还原性)强弱的比较或判断氧化剂(或还原剂)
和有还原性(或氧化性)的物质在一定条件下能否发生反应。
(3)注意:氧化性、还原性的强弱取决于物质得失电子的难易程度而与得失电子数目的多少无关。
典例精讲
例1:根据反应式:(1)2Fe3+ +2I-——2Fe2+ +I2,(2)Br2+2Fe2+——2Fe3+ +2Br-,可判断离子的还原性从强到弱的顺序是( )
A.Br- 、Fe2+ 、I- B.I- 、Fe2+ 、Br- C.Br- 、I- 、Fe2+ D.Fe2+ 、I- 、Br-
例2:已知X和Y是两种单质,它们之间的反应是X+Y——X2++Y2-。
(1)现有下列叙述:①X被氧化;②X是氧化剂;③Y2- 是还原产物;④X2+ 具有氧化性;⑤Y2- 具有还原性;⑥Y单质的氧化性比X2+ 的氧化性强。
上述说法中正确的是( )
A.①②③ B.①②⑥ C.①③④⑤⑥ D.①③④⑤
B
C
三、氧化还原反应的先后规律
(1)内容:同一氧化剂与多种还原剂混合时,还原性强的先被氧化;
同一还原剂与多种氧化剂混合时,氧化性强的先被还原。
(2)应用:判断物质的氧化性、还原性强弱或判断反应的先后顺序。
例如:已知还原性:I->Fe2+>Br-,当把氯气通入FeBr2溶液时,因为还原性:Fe2+>Br-,所以氯气的量不足时首先氧化Fe2+;把氯气通入FeI2溶液时,因为还原性:I->Fe2+,所以氯气的量不足时首先氧化I-。
例如:在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后再依次与Cu2+、H+反应。
典例精讲
例1:在含有Cu(NO3)2、Mg(NO3)2、AgNO3的溶液中加入适量锌粉,首先置换出的是( )
A.Mg B.Cu C.Ag D.H2
C
例2( 双选):已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-
B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O
D.2Fe2++I2===2Fe3++2I-
CD
四、氧化还原反应的守恒规律
(1)内容:氧化还原反应中,化合价有升必有降,电子有得必有失。对于一个完整的氧化还原反应,化合价升高总数与降低总数相等,失电子总数与得电子总教相等,即有关系式:
(2)应用:氧化还原反应方程式的配平,氧化还原反应的相关计算。
元素化合价降低的总数=元素化合价升高的总数
还原剂失电子的总数=氧化剂得电子的总数
五、氧化还原反应方程式的配平
1.氧化还原反应方程式配平的基本原则
(1)得失电子守恒:
氧化剂和还原剂得失电子总数相等,化合价升高总数=化合价降低总数。
(2)质量守恒:
反应前后原子的种类和个数不变。
(3)电荷守恒:
离子反应前后,阴、阳离子所带电荷总数相等。
五、氧化还原反应方程式的配平
2.氧化还原反应方程式配平的一般步骤
(1)标价态:写出反应物和生成物的化学式,标出发生氧化反应和还原反应的元素的化合价。
(2)列变化:列出元素得失电子数(元素的化合价的变化);
(3)求总数:通过求最小公倍数使化合价升降总数相等。
(4)配系数:用观察法配平其他物质的化学计量数。
(5)查守恒:检查电荷是否守恒,原子个数是否守恒,配平后,把单线改成等号,标注反应条件。
五、氧化还原反应方程式的配平
3.氧化还原反应方程式配平的技巧方法
(1)正向配平法:氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平。
NH3 + O2 —— NO + H2O
催化剂
-3
+2
0
-2
-2
5
2×2
4
5
4
6
×4
×5
——
练习:H2S+ O2 — SO2+ H2O
点燃
2 3 ==2 2
五、氧化还原反应方程式的配平
3.氧化还原反应方程式配平的技巧方法
(2)逆向配平法:自身氧化还原反应(包括分解、歧化)一般从右边着手配平。
S + KOH —— K2S + K2SO3 + H2O
0
+4
-2
4
2
3
6
2
3
×2
——
Cl2+__NaOH = __NaCl+__NaClO3+__H2O
3
6
5
1
3
练习:
五、氧化还原反应方程式的配平
3.氧化还原反应方程式配平的技巧方法
(3)整体配平法:以有两种元素化合价升高或降低的物质为着手点,将化合价升降总数做为一个整体,再用一般方法进行配平。
配平得 3Cu2S+22HNO3=6Cu(NO3)2+10NO↑+3H2SO4+8H2O
五、氧化还原反应方程式的配平
3.氧化还原反应方程式配平的技巧方法
(4)缺项配平法:
①先配氧化剂、还原剂及还原产物与氧化产物;
②再根据质量守恒、电荷守恒确定所缺的物质的化学式(分子或离子);
③最后观察配平其他物质系数。
Cr2O72- + Fe2+ + ( ) → Cr3+ + Fe3+ + H2O
6 2 6
+6 +2 +3 +3
14 H+ 7
缺项配平的补项原则
条件 补项原则
酸性条件 缺H或多O补H+,少O补H2O
碱性条件 缺H或多O补H2O,少O补OH-
(1)补项原则:
(2)组合方式:
反应物 生成物 使用条件
H+ H2O 酸性溶液
组合二 H2O H+ 酸性溶液或酸碱性未知
组合三 OH- H2O 碱性溶液
组合四 H2O OH- 碱性溶液或酸碱性未知
五、氧化还原反应方程式的计算
1.计算依据
(1)氧化剂获得电子总数等于还原剂失去电子总数,即得失电子守恒。
(2)氧化剂中元素降价总数等于还原剂中元素升价总数,即化合价升降守恒。
2.计算方法
(1)找出氧化剂、还原剂及对应的还原产物、氧化产物。
(2)标准确变价元素的化合价。
(3)找准每个氧化剂、还原剂中变价的原子个数。
(4)列出等式并计算:N(氧化剂)×变价原子个数×|化合价变化值|
=N(还原剂)×变价原子个数×|化合价变化值|。
典例精讲
例:Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的个数之比为1∶16,则x的值为( )
A.2 B.3 C.4 D.5
得关系式1×(6x+2)=16×2
↑(6x+2)
↓ 2
x=5
D
个数比 1 : 16
根据化学式找变化
课堂小结
一、氧化还原反应的四大规律
2.强弱规律(前强后弱)
3.先后规律(谁强谁优先)
1.价态规律(高低规律、归中规律、歧化规律)
4.守恒规律(得失电子守恒)
二、氧化还原反应方程式的配平与计算
元素化合价降低的总数=元素化合价升高的总数
还原剂失电子的总数=氧化剂得电子的总数
THANKS
