化学人教版(2019)必修第一册4.2.1元素性质的周期性变化规律 课件(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.2.1元素性质的周期性变化规律 课件(共19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 512.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-08 07:55:14 | ||
图片预览




文档简介
(共19张PPT)
第四章 物质结构 元素周期律
第二节 元素周期律
第1课时 元素性质的周期性变化规律
1. 结合有关数据和实验事实认识同周期元素的核外电子排布、元素化合价、原子半径的周期性变化规律。
2. 以第三周期元素为例,掌握同周期主族元素金属性和非金属性等随元素原子序数递增而呈周期性变化的规律、建构元素周期律。
3. 体会元素周期律在学习元素化合物知识与科学研究中的重要作用,培养科学态度与社会责任。
知识回顾
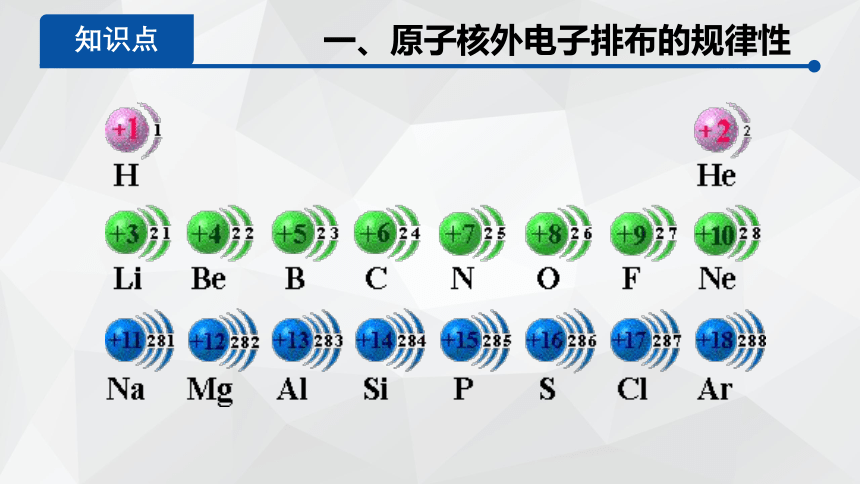
核外电子排布规律:
①核外电子总是尽先依能量逐步升高从内层排起,即:排满K层排L层,排满L层排M层(后有特殊情况)。
② 每个电子层最多可容纳2n2个电子(n表示电子层序数)
③最外层可容纳的电子数不能超过8个(K层是最外层时,最多不超过2个),次外层不能超过18个,倒数第三层不能超过32个。
一、原子核外电子排布的规律性
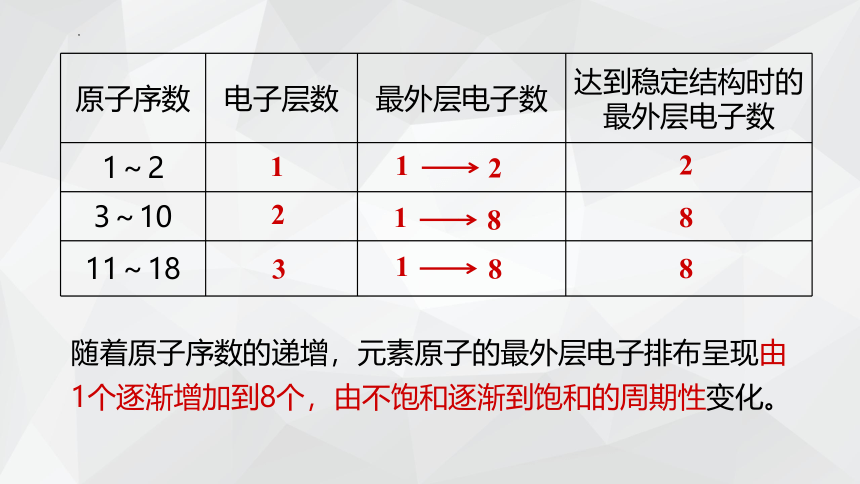
原子序数 电子层数 最外层电子数 达到稳定结构时的最外层电子数
1~2
3~10
11~18
1
2
3
1
2
8
8
2
1
8
1
8
随着原子序数的递增,元素原子的最外层电子排布呈现由
1个逐渐增加到8个,由不饱和逐渐到饱和的周期性变化。
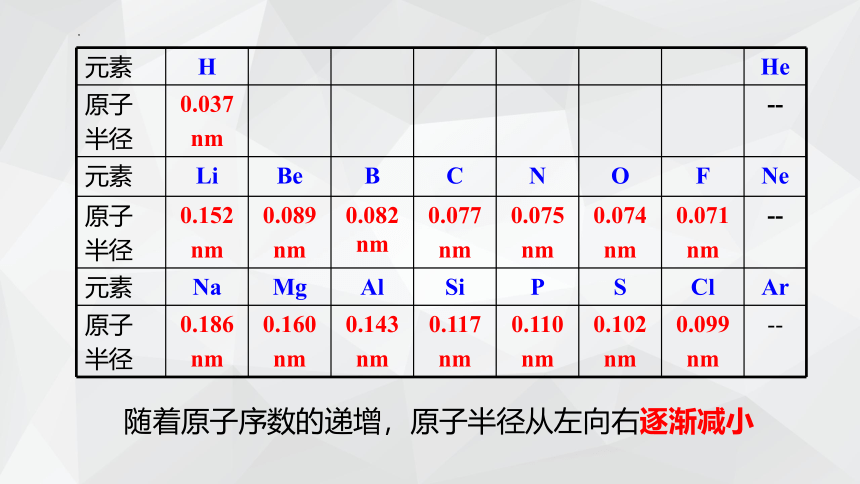
二、原子半径的递变规律
元素 H He
原子 半径 0.037 nm --
元素 Li Be B C N O F Ne
原子 半径 0.152 nm 0.089 nm 0.082 nm 0.077 nm 0.075 nm 0.074 nm 0.071 nm --
元素 Na Mg Al Si P S Cl Ar
原子 半径 0.186 nm 0.160 nm 0.143 nm 0.117 nm 0.110 nm 0.102 nm 0.099 nm --
随着原子序数的递增,原子半径从左向右逐渐减小
三、化合价的周期性变化
随着原子序数的递增,元素化合价呈现由低逐渐升高的周期性变化。
主族元素最高正价=主族序数=最外层电子数
副族元素最高正价=副族序数≠最外层电子数(一般地)
最低负价 + 最高正价 = 8
原子 序数 电子 层数 最外层 电子数 原子半径变化(不考稀有气体素) 最高或者最低化合价的变化
1-2 1 1→2 —— +1→0
3-10 0.152nm→0.071nm 大→小 +1→+5
-4→-1→0
11-18 0.186nm→0.099nm 大→小
2
3
1 8
1 8
+1 +7
-4→-1→0
通过上述探究,我们发现随着原子序数的递增,元素的______________________ 、__________________和__________________都呈现周期性变化。
原子最外层电子排布
原子半径
元素的化合价
归纳总结
元素的金属性和非金属性是否也随元素原子序数的递增而呈周期性变化呢?
交流讨论
判断
依据
金属性
非金属性
金属单质与水或酸反应置换出H2的难易
金属最高价氧化物对应水化物碱性强弱
非金属单质与H2化合的难易
最高价氧化物对应的水化物(最高价含氧酸)的酸性强弱
气态氢化物的稳定性
科学探究
金属元素性质 Na Mg Al
单质和水的反应情况
最高价氧化物对应水化物碱性
跟冷水剧
烈反应
NaOH
强碱
跟沸水反应
放H2
Mg(OH)2
中强碱
Al(OH)3
两性
氢氧化物
金属性逐渐减弱:Na>Mg>Al
四、元素金属性非金属性变化规律
14Si 15P 16S 17Cl
对应氧化物
氧化物的水化物
酸性强弱
单质与H2反应条件
气态氢化物及稳定性
SiO2
P2O5
SO3
Cl2O7
H4SiO4
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
最强酸
逐渐增强
高温
加热
加热
点燃/光照
SiH4
PH3
H2S
HCl
逐渐增强
非金属性逐渐增强:Cl>S>P>Si
根据以上分析,可得出第三周期元素金属性、非金属性的递变规律:
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
对其他周期元素性质进行研究,也可以得到类似的结论。
元素周期律的内容及实质
(1)内容:元素的性质随着原子序数的递增而呈周期性
变化的规律,叫做元素周期律。
(2)实质:元素的性质周期性变化是元素原子核外电子
排布周期性变化的必然结果。
五、元素周期律
元素性质的周期性变化实质:元素原子的核外电子排布的周期性变化。
随着元素原子序数的递增
元素
原子半径
主要化合价
金属性和非金属性
(结构)
(性质)
呈现周期性变化
原子核外电子排布
第四章 物质结构 元素周期律
第二节 元素周期律
第1课时 元素性质的周期性变化规律
1. 结合有关数据和实验事实认识同周期元素的核外电子排布、元素化合价、原子半径的周期性变化规律。
2. 以第三周期元素为例,掌握同周期主族元素金属性和非金属性等随元素原子序数递增而呈周期性变化的规律、建构元素周期律。
3. 体会元素周期律在学习元素化合物知识与科学研究中的重要作用,培养科学态度与社会责任。
知识回顾
核外电子排布规律:
①核外电子总是尽先依能量逐步升高从内层排起,即:排满K层排L层,排满L层排M层(后有特殊情况)。
② 每个电子层最多可容纳2n2个电子(n表示电子层序数)
③最外层可容纳的电子数不能超过8个(K层是最外层时,最多不超过2个),次外层不能超过18个,倒数第三层不能超过32个。
一、原子核外电子排布的规律性
原子序数 电子层数 最外层电子数 达到稳定结构时的最外层电子数
1~2
3~10
11~18
1
2
3
1
2
8
8
2
1
8
1
8
随着原子序数的递增,元素原子的最外层电子排布呈现由
1个逐渐增加到8个,由不饱和逐渐到饱和的周期性变化。
二、原子半径的递变规律
元素 H He
原子 半径 0.037 nm --
元素 Li Be B C N O F Ne
原子 半径 0.152 nm 0.089 nm 0.082 nm 0.077 nm 0.075 nm 0.074 nm 0.071 nm --
元素 Na Mg Al Si P S Cl Ar
原子 半径 0.186 nm 0.160 nm 0.143 nm 0.117 nm 0.110 nm 0.102 nm 0.099 nm --
随着原子序数的递增,原子半径从左向右逐渐减小
三、化合价的周期性变化
随着原子序数的递增,元素化合价呈现由低逐渐升高的周期性变化。
主族元素最高正价=主族序数=最外层电子数
副族元素最高正价=副族序数≠最外层电子数(一般地)
最低负价 + 最高正价 = 8
原子 序数 电子 层数 最外层 电子数 原子半径变化(不考稀有气体素) 最高或者最低化合价的变化
1-2 1 1→2 —— +1→0
3-10 0.152nm→0.071nm 大→小 +1→+5
-4→-1→0
11-18 0.186nm→0.099nm 大→小
2
3
1 8
1 8
+1 +7
-4→-1→0
通过上述探究,我们发现随着原子序数的递增,元素的______________________ 、__________________和__________________都呈现周期性变化。
原子最外层电子排布
原子半径
元素的化合价
归纳总结
元素的金属性和非金属性是否也随元素原子序数的递增而呈周期性变化呢?
交流讨论
判断
依据
金属性
非金属性
金属单质与水或酸反应置换出H2的难易
金属最高价氧化物对应水化物碱性强弱
非金属单质与H2化合的难易
最高价氧化物对应的水化物(最高价含氧酸)的酸性强弱
气态氢化物的稳定性
科学探究
金属元素性质 Na Mg Al
单质和水的反应情况
最高价氧化物对应水化物碱性
跟冷水剧
烈反应
NaOH
强碱
跟沸水反应
放H2
Mg(OH)2
中强碱
Al(OH)3
两性
氢氧化物
金属性逐渐减弱:Na>Mg>Al
四、元素金属性非金属性变化规律
14Si 15P 16S 17Cl
对应氧化物
氧化物的水化物
酸性强弱
单质与H2反应条件
气态氢化物及稳定性
SiO2
P2O5
SO3
Cl2O7
H4SiO4
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
最强酸
逐渐增强
高温
加热
加热
点燃/光照
SiH4
PH3
H2S
HCl
逐渐增强
非金属性逐渐增强:Cl>S>P>Si
根据以上分析,可得出第三周期元素金属性、非金属性的递变规律:
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
对其他周期元素性质进行研究,也可以得到类似的结论。
元素周期律的内容及实质
(1)内容:元素的性质随着原子序数的递增而呈周期性
变化的规律,叫做元素周期律。
(2)实质:元素的性质周期性变化是元素原子核外电子
排布周期性变化的必然结果。
五、元素周期律
元素性质的周期性变化实质:元素原子的核外电子排布的周期性变化。
随着元素原子序数的递增
元素
原子半径
主要化合价
金属性和非金属性
(结构)
(性质)
呈现周期性变化
原子核外电子排布
