1.3.2氧化剂还原剂 课件(共30张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册+
文档属性
| 名称 | 1.3.2氧化剂还原剂 课件(共30张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册+ |  | |
| 格式 | pptx | ||
| 文件大小 | 48.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-08 08:00:57 | ||
图片预览








文档简介
(共30张PPT)
第三节
氧化还原反应
第2课时
氧化剂还原剂
第一章
学习目标
1
3
2
从价态观认识常见的氧化剂和还原剂
运用氧化还原反应模型推测物质的氧化性,还原性
探寻物质氧化性、还原性的强弱规律
环节一:导入
隔绝氧气以及具有还原性的维生素C阻碍了氧化反应进程
为什么涂了柠檬汁的苹果看起来最白?
环节一:导入
维生素C是因为有抗氧化性,本身是一种还原剂,一个维生素C分子会结合两个自由基分子。伟大的维生素C会牺牲自己和坏的自由基分子同归于尽。
还原剂
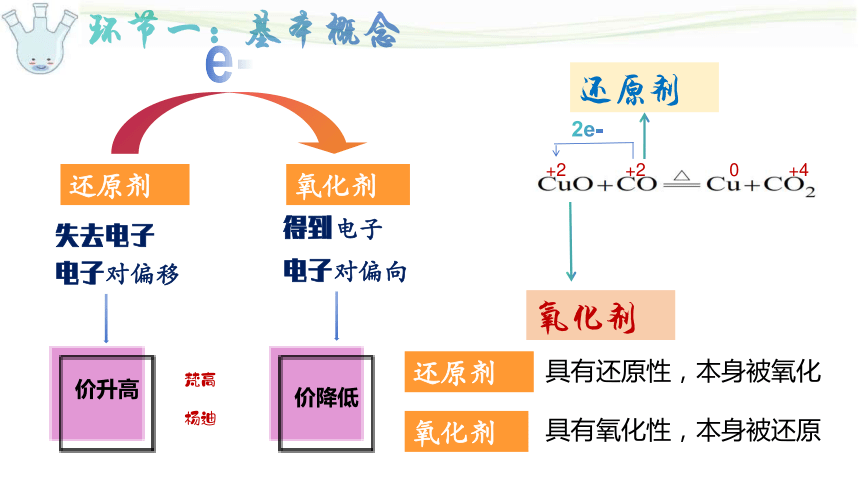
环节一:基本概念
氧化剂
还原剂
还原剂
氧化剂
失去电子
得到电子
e-
电子对偏移
电子对偏向
价升高
价降低
价升高
梵高
杨迪
2e-
+2 +2 0 +4
还原剂
氧化剂
具有还原性,本身被氧化
具有氧化性,本身被还原
环节一:回顾初中
Fe+CuSO4=FeSO4+Cu
实验现象:铁钉表面有红色物质生成,溶液由无色变为浅绿色
还原剂
氧化剂
后面两个怎么称呼?
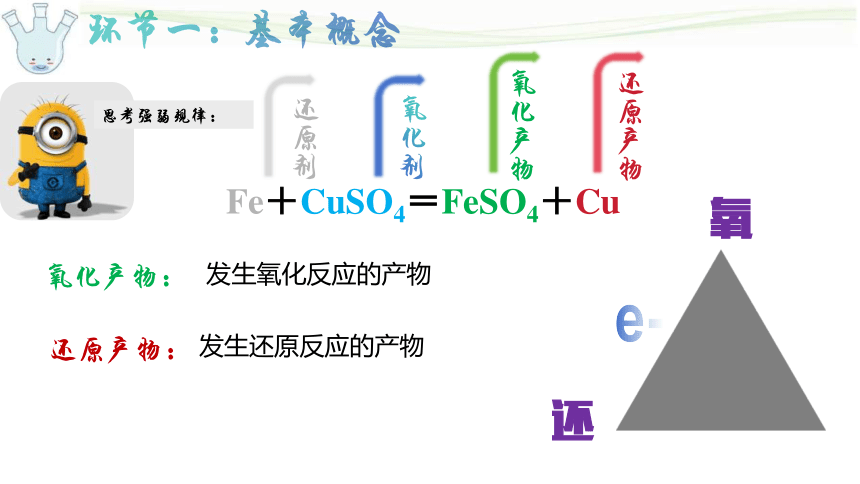
环节一:基本概念
Fe+CuSO4=FeSO4+Cu
思考强弱规律:
还原剂
氧化剂
氧化产物
还原产物
还
氧
e-
氧化产物:
还原产物:
发生氧化反应的产物
发生还原反应的产物
环节一:强弱比较
Fe+CuSO4=FeSO4+Cu
氧化性:
还原性:
CuSO4
Fe
>
>
FeSO4
Cu
思考强弱规律:
还原剂
氧化剂
氧化产物
还原产物
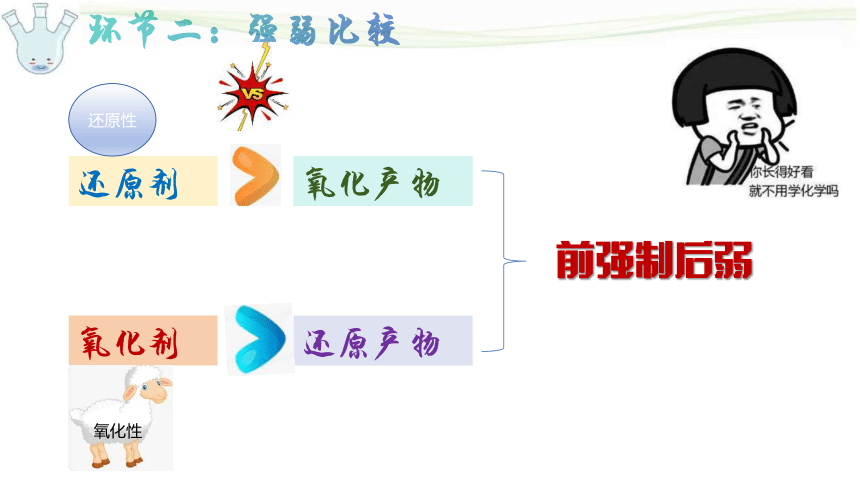
环节二:强弱比较
还原剂
氧化产物
氧化剂
还原产物
还原性
氧化性
前强制后弱
环节二:强弱比较
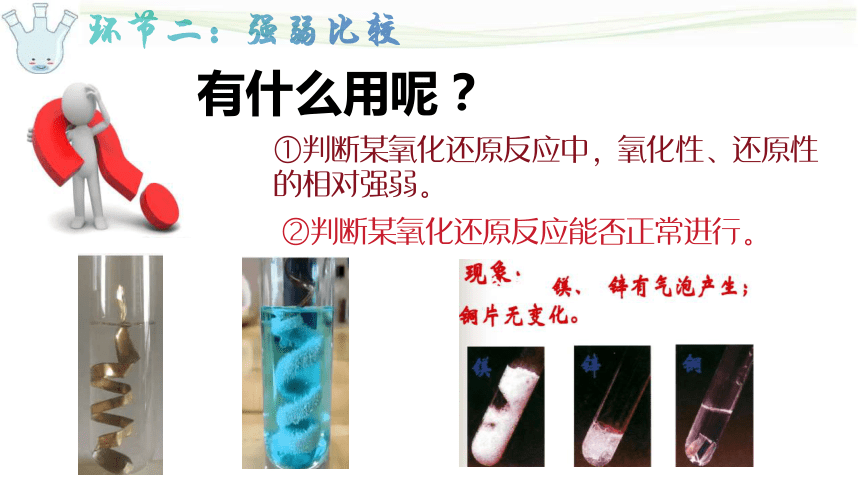
有什么用呢?
①判断某氧化还原反应中,氧化性、还原性的相对强弱。
②判断某氧化还原反应能否正常进行。
环节二:强弱比较
0 +2 +3 0
化合价升高,被氧化
化合价降低,被还原
氧化性:Cu(NO3)2 > Al(NO3)3
还原性:Al > Cu
现象:铝丝表面有红色物质生成,溶液由蓝色逐渐变淡至无色
环节二:强弱比较
0 +1 +2 0
化合价升高,被氧化
化合价降低,被还原
氧化性:AgNO3 > Cu(NO3)2
还原性:Cu > Ag
现象:铜丝表面有银白色物质生成,溶液由无色逐渐变为蓝色。
环节二:强弱比较
氧化性:
还原性:
Cu(NO3)2 > Al(NO3)3
AgNO3 > Cu(NO3)2
AgNO3 > Cu(NO3)2 > Al(NO3)3
Al > Cu
Cu > Ag
Al > Cu > Ag
【拓展】
环节二:强弱比较
根据下列反应判断有关物质还原性由强到弱的顺序是( ) H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2 3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
A. H2SO3>I->Fe2+>NO B. I->Fe2+>H2SO3>NO
C. Fe2+>I->H2SO3>NO D. NO>Fe2+>H2SO3>I-
【典例讲解】
由第一个方程式得还原性:H2SO3>I-,
由第二个方程式得还原性:I->Fe2+
由第三个方程式得还原性:Fe2+>NO
H2SO3 > I- > Fe2+
环节二:课堂练习
1. 铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:
①Tl3++2Ag=Tl++2Ag+,
②Ag++Fe2+=Ag+Fe3+,
③Fe+2Fe3+=3Fe2+。下列离子氧化性比较顺序正确的是( )
A. Tl3+>Fe3+>Ag+ B. Fe3+>Ag+>Tl3+
C. Tl+>Ag+>Fe2+ D. Tl3+>Ag+>Fe3+
D
环节二:课堂练习
B
2.根据下列反应,推断氧化性强弱顺序正确的是( ) ①2Fe2++Cl2=2Fe3++2 Cl-
②HClO+HCl=Cl2↑+H2O
③Cu+2Fe3+=2Fe2++Cu2+
A. Cl2>HClO>Cu2+ B. HClO>Cl2>Fe3+
C. Cl2>Cu2+>Fe3+ D. Fe3+>Cu2+>HClO
环节二:课堂练习
A
3.已知:①向KMnO4晶体中滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉 KI试纸上,试纸变蓝色。下列判断正确的是( ) A. 上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B. 上述实验中,共有两个氧化还原反应
C. 实验①生成的气体不能使湿润的淀粉 KI试纸变蓝 D. 实验②证明Fe2+既有氧化性又有还原性
环节二:课堂练习
4.取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下: ①滴加适量H2O2,紫红色褪去,并有气泡产生;②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;③最后通入足量的SO2气体。请回答下列问题:(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________________________(2)实验③中的现象为__________________。(3)实验①、②中反应的离子方程式分别是________________、_____________________________
PbO2>KMnO4>H2O2
溶液紫红色褪色,有白色沉淀生成
2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O
环节二:小结
升、失、氧、还(剂)
降、得、还、氧(剂)
环节三:氧化剂还原剂
常见的氧化剂
(1)活泼的非金属单质:Cl2、Br2、O2、I2、S等
(2)元素处于高价时的氧化物:CO2、NO2、SO3、MnO2、PbO2等
(3)元素处于高价时的含氧酸:浓H2SO4、HNO3等
环节三:氧化剂还原剂
常见的氧化剂
(4)元素处于高价时的盐:KClO3、 KMnO4、FeCl3、K2Cr2O7等
(5)过氧化物:Na2O2、H2O2等
(6)次氯酸及其盐:HClO、Ca(ClO)2、NaClO等
环节三:氧化剂还原剂
常见的还原剂
①活泼的金属单质:Na、Mg、Al、Zn、Fe(金属活动顺序表)
②某些非金属单质:H2、C、Si
③元素处于低价时的氧化物:CO、SO2
环节三:氧化剂还原剂
常见的还原剂
④元素处于低价时的酸:HCl、HI、H2S、H2SO3等
⑤元素处于低价时的盐:Na2S、KI、Na2SO3、FeSO4等
环节三:氧化剂还原剂
在同一氧化还原反应中一定有氧化剂和还原剂,氧化剂和还原剂可以是不同的物质也可以是同种物质。
【拓展】
化合价降低
化合价升高
氧化剂
还原剂
还原产物
氧化产物
歧化反应
环节三:对应产物的判断
常见氧化剂 对应还原产物 常见还原剂 对应氧化产物
含氧有机物()
环节三:对应产物的判断
1. KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2。该反应
的离子方程式:___________________________________________________。
2MnO4- + 5C2O42- + 16H+ 2Mn2+ + 10CO2↑ + 8H2O
【典例讲解】
2.+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,反
应的离子方程式为________________________________________。
Cr2O72-+3HSO3-+5H+ 2Cr3++3SO42-+4H2O
环节三:课堂练习
(1)H2O2水溶液给称双氧水,医疗上利用它有杀菌消毒作用来清洗伤口,对下列A-C涉及H2O2的反应,填写下列空白:
A.
C.
D.
B.
①H2O2仅体现氧化性的反应是______(填代号,下同)
②H2O2既有氧化性又有还原性的是______
③H2O2仅体现还原性的是______
④H2O2既无氧化性又无还原性的是______
(2)已知CuO具有氧化性,能够与NH3反应生成两种单质和H2O,请写出在加热条件下CuO与NH3反应的化学方程式______
C
B
A
D
环节三:课堂练习
2. 关于氧化还原反应,下列说法正确的是( )①Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子,因此还原性Al>Mg②氧化剂具有氧化性③有单质参加的反应一定是氧化还原反应④2Fe+3Cl2△(=====)2FeCl3;Fe+S△(=====)FeS,由此可以判断氧化性:Cl2>S⑤氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原A. ②③④B. ②④C. ①②⑤D. ①②
B
环节三:小结
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
三“氧”
三“还”
氧化剂+还原剂
氧化产物+还原产物
被还原
被氧化
第三节
氧化还原反应
第2课时
氧化剂还原剂
第一章
学习目标
1
3
2
从价态观认识常见的氧化剂和还原剂
运用氧化还原反应模型推测物质的氧化性,还原性
探寻物质氧化性、还原性的强弱规律
环节一:导入
隔绝氧气以及具有还原性的维生素C阻碍了氧化反应进程
为什么涂了柠檬汁的苹果看起来最白?
环节一:导入
维生素C是因为有抗氧化性,本身是一种还原剂,一个维生素C分子会结合两个自由基分子。伟大的维生素C会牺牲自己和坏的自由基分子同归于尽。
还原剂
环节一:基本概念
氧化剂
还原剂
还原剂
氧化剂
失去电子
得到电子
e-
电子对偏移
电子对偏向
价升高
价降低
价升高
梵高
杨迪
2e-
+2 +2 0 +4
还原剂
氧化剂
具有还原性,本身被氧化
具有氧化性,本身被还原
环节一:回顾初中
Fe+CuSO4=FeSO4+Cu
实验现象:铁钉表面有红色物质生成,溶液由无色变为浅绿色
还原剂
氧化剂
后面两个怎么称呼?
环节一:基本概念
Fe+CuSO4=FeSO4+Cu
思考强弱规律:
还原剂
氧化剂
氧化产物
还原产物
还
氧
e-
氧化产物:
还原产物:
发生氧化反应的产物
发生还原反应的产物
环节一:强弱比较
Fe+CuSO4=FeSO4+Cu
氧化性:
还原性:
CuSO4
Fe
>
>
FeSO4
Cu
思考强弱规律:
还原剂
氧化剂
氧化产物
还原产物
环节二:强弱比较
还原剂
氧化产物
氧化剂
还原产物
还原性
氧化性
前强制后弱
环节二:强弱比较
有什么用呢?
①判断某氧化还原反应中,氧化性、还原性的相对强弱。
②判断某氧化还原反应能否正常进行。
环节二:强弱比较
0 +2 +3 0
化合价升高,被氧化
化合价降低,被还原
氧化性:Cu(NO3)2 > Al(NO3)3
还原性:Al > Cu
现象:铝丝表面有红色物质生成,溶液由蓝色逐渐变淡至无色
环节二:强弱比较
0 +1 +2 0
化合价升高,被氧化
化合价降低,被还原
氧化性:AgNO3 > Cu(NO3)2
还原性:Cu > Ag
现象:铜丝表面有银白色物质生成,溶液由无色逐渐变为蓝色。
环节二:强弱比较
氧化性:
还原性:
Cu(NO3)2 > Al(NO3)3
AgNO3 > Cu(NO3)2
AgNO3 > Cu(NO3)2 > Al(NO3)3
Al > Cu
Cu > Ag
Al > Cu > Ag
【拓展】
环节二:强弱比较
根据下列反应判断有关物质还原性由强到弱的顺序是( ) H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2 3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
A. H2SO3>I->Fe2+>NO B. I->Fe2+>H2SO3>NO
C. Fe2+>I->H2SO3>NO D. NO>Fe2+>H2SO3>I-
【典例讲解】
由第一个方程式得还原性:H2SO3>I-,
由第二个方程式得还原性:I->Fe2+
由第三个方程式得还原性:Fe2+>NO
H2SO3 > I- > Fe2+
环节二:课堂练习
1. 铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:
①Tl3++2Ag=Tl++2Ag+,
②Ag++Fe2+=Ag+Fe3+,
③Fe+2Fe3+=3Fe2+。下列离子氧化性比较顺序正确的是( )
A. Tl3+>Fe3+>Ag+ B. Fe3+>Ag+>Tl3+
C. Tl+>Ag+>Fe2+ D. Tl3+>Ag+>Fe3+
D
环节二:课堂练习
B
2.根据下列反应,推断氧化性强弱顺序正确的是( ) ①2Fe2++Cl2=2Fe3++2 Cl-
②HClO+HCl=Cl2↑+H2O
③Cu+2Fe3+=2Fe2++Cu2+
A. Cl2>HClO>Cu2+ B. HClO>Cl2>Fe3+
C. Cl2>Cu2+>Fe3+ D. Fe3+>Cu2+>HClO
环节二:课堂练习
A
3.已知:①向KMnO4晶体中滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉 KI试纸上,试纸变蓝色。下列判断正确的是( ) A. 上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B. 上述实验中,共有两个氧化还原反应
C. 实验①生成的气体不能使湿润的淀粉 KI试纸变蓝 D. 实验②证明Fe2+既有氧化性又有还原性
环节二:课堂练习
4.取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下: ①滴加适量H2O2,紫红色褪去,并有气泡产生;②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;③最后通入足量的SO2气体。请回答下列问题:(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________________________(2)实验③中的现象为__________________。(3)实验①、②中反应的离子方程式分别是________________、_____________________________
PbO2>KMnO4>H2O2
溶液紫红色褪色,有白色沉淀生成
2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O
环节二:小结
升、失、氧、还(剂)
降、得、还、氧(剂)
环节三:氧化剂还原剂
常见的氧化剂
(1)活泼的非金属单质:Cl2、Br2、O2、I2、S等
(2)元素处于高价时的氧化物:CO2、NO2、SO3、MnO2、PbO2等
(3)元素处于高价时的含氧酸:浓H2SO4、HNO3等
环节三:氧化剂还原剂
常见的氧化剂
(4)元素处于高价时的盐:KClO3、 KMnO4、FeCl3、K2Cr2O7等
(5)过氧化物:Na2O2、H2O2等
(6)次氯酸及其盐:HClO、Ca(ClO)2、NaClO等
环节三:氧化剂还原剂
常见的还原剂
①活泼的金属单质:Na、Mg、Al、Zn、Fe(金属活动顺序表)
②某些非金属单质:H2、C、Si
③元素处于低价时的氧化物:CO、SO2
环节三:氧化剂还原剂
常见的还原剂
④元素处于低价时的酸:HCl、HI、H2S、H2SO3等
⑤元素处于低价时的盐:Na2S、KI、Na2SO3、FeSO4等
环节三:氧化剂还原剂
在同一氧化还原反应中一定有氧化剂和还原剂,氧化剂和还原剂可以是不同的物质也可以是同种物质。
【拓展】
化合价降低
化合价升高
氧化剂
还原剂
还原产物
氧化产物
歧化反应
环节三:对应产物的判断
常见氧化剂 对应还原产物 常见还原剂 对应氧化产物
含氧有机物()
环节三:对应产物的判断
1. KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2。该反应
的离子方程式:___________________________________________________。
2MnO4- + 5C2O42- + 16H+ 2Mn2+ + 10CO2↑ + 8H2O
【典例讲解】
2.+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,反
应的离子方程式为________________________________________。
Cr2O72-+3HSO3-+5H+ 2Cr3++3SO42-+4H2O
环节三:课堂练习
(1)H2O2水溶液给称双氧水,医疗上利用它有杀菌消毒作用来清洗伤口,对下列A-C涉及H2O2的反应,填写下列空白:
A.
C.
D.
B.
①H2O2仅体现氧化性的反应是______(填代号,下同)
②H2O2既有氧化性又有还原性的是______
③H2O2仅体现还原性的是______
④H2O2既无氧化性又无还原性的是______
(2)已知CuO具有氧化性,能够与NH3反应生成两种单质和H2O,请写出在加热条件下CuO与NH3反应的化学方程式______
C
B
A
D
环节三:课堂练习
2. 关于氧化还原反应,下列说法正确的是( )①Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子,因此还原性Al>Mg②氧化剂具有氧化性③有单质参加的反应一定是氧化还原反应④2Fe+3Cl2△(=====)2FeCl3;Fe+S△(=====)FeS,由此可以判断氧化性:Cl2>S⑤氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原A. ②③④B. ②④C. ①②⑤D. ①②
B
环节三:小结
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
三“氧”
三“还”
氧化剂+还原剂
氧化产物+还原产物
被还原
被氧化
