河南省开封重点中学2023-2024学年高三上学期第一次化学试题(无答案)
文档属性
| 名称 | 河南省开封重点中学2023-2024学年高三上学期第一次化学试题(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-08 14:41:27 | ||
图片预览


文档简介
化学
一、选择题:本题共14小题,每小题3分,共计42分。在每小题列出的四个选项中,只有一项是符合题目要求的。
1.朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影。”结合这段文字及所学的化学知识判断下列说法正确的是
A.荷塘上方的薄雾是水蒸气
B.月光通过薄雾时产生了丁达尔效应
C.薄雾中的微粒直径大约是
D.“大漠孤烟直”中“孤烟”的组成成分和这种薄雾的组成成分相同
2.在相同温度下,向三个相同的如图所示的容器中分别充入等质量的三种气体,则容器中三种气体的体积(V)从大到小的顺序是
A. B.
C. D.
3.2022年世界冬奥会和冬残奥会在北京举行,其中短道速滑项目队员所穿的速滑冰刀可用不锈钢制成,下列叙述错误的是
A.不锈钢是最常见的一种合金钢
B.不锈钢在大气中比较稳定,不容易生锈,具有很强的抗腐蚀能力
C.不锈钢中常添加一种或几种合金元素,从而使其具有各种特殊性能
D.不锈钢中只含有金属元素,不含有非金属元素
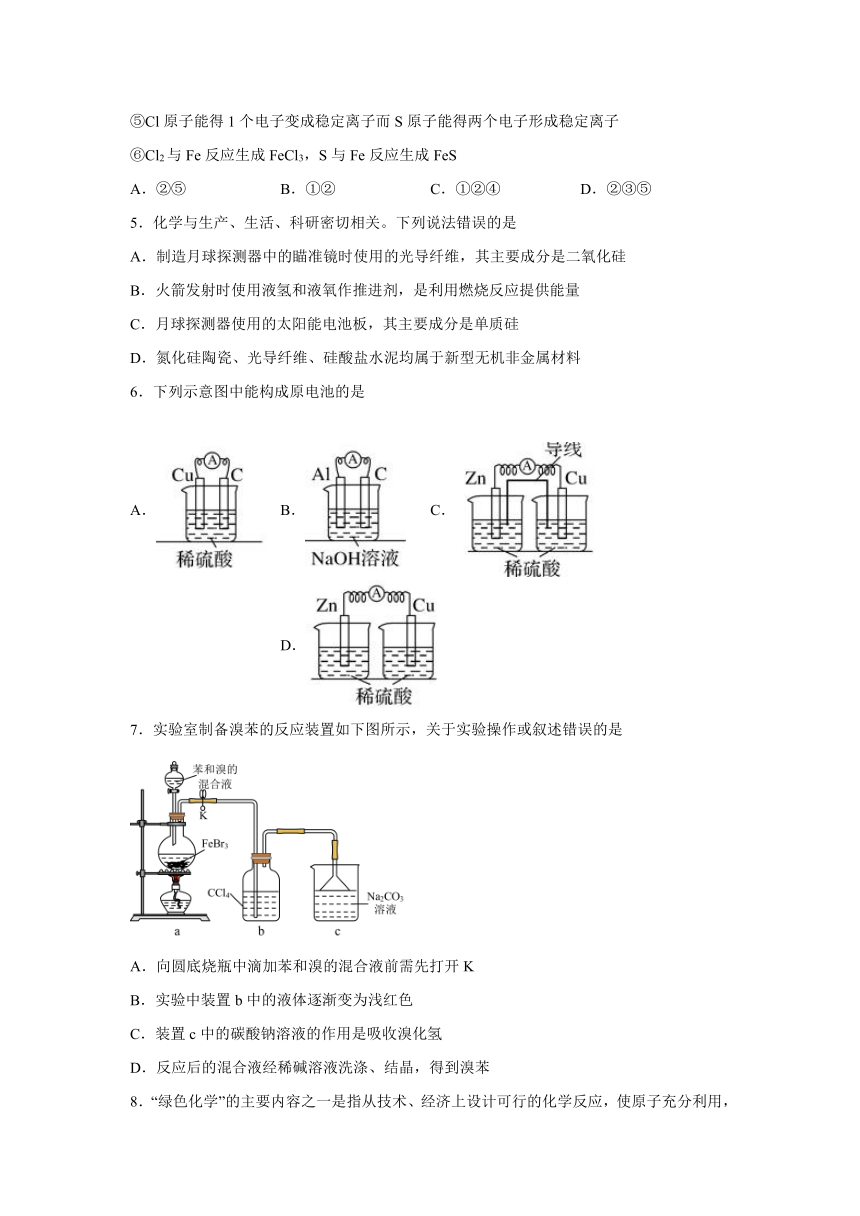
4.下列不能说明氯的非金属性比硫强的事实是
①HCl比H2S稳定
②HCl和H2S的水溶液前者的酸性强
③HClO4酸性比H2SO3强
④Cl2能与H2S反应生成S
⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子形成稳定离子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①② C.①②④ D.②③⑤
5.化学与生产、生活、科研密切相关。下列说法错误的是
A.制造月球探测器中的瞄准镜时使用的光导纤维,其主要成分是二氧化硅
B.火箭发射时使用液氢和液氧作推进剂,是利用燃烧反应提供能量
C.月球探测器使用的太阳能电池板,其主要成分是单质硅
D.氮化硅陶瓷、光导纤维、硅酸盐水泥均属于新型无机非金属材料
6.下列示意图中能构成原电池的是
A. B. C. D.
7.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B.实验中装置b中的液体逐渐变为浅红色
C.装置c中的碳酸钠溶液的作用是吸收溴化氢
D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
8.“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”理念的是
A.制:(浓)
B.制:;(稀)
C.制:(浓)
D.制:(稀)
9.下列关于盖斯定律描述不正确的是
A.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关
B.盖斯定律遵守能量守恒定律
C.利用盖斯定律可间接计算通过实验难测定的反应的反应热
D.利用盖斯定律可以计算有副反应发生的反应的反应热
10.室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
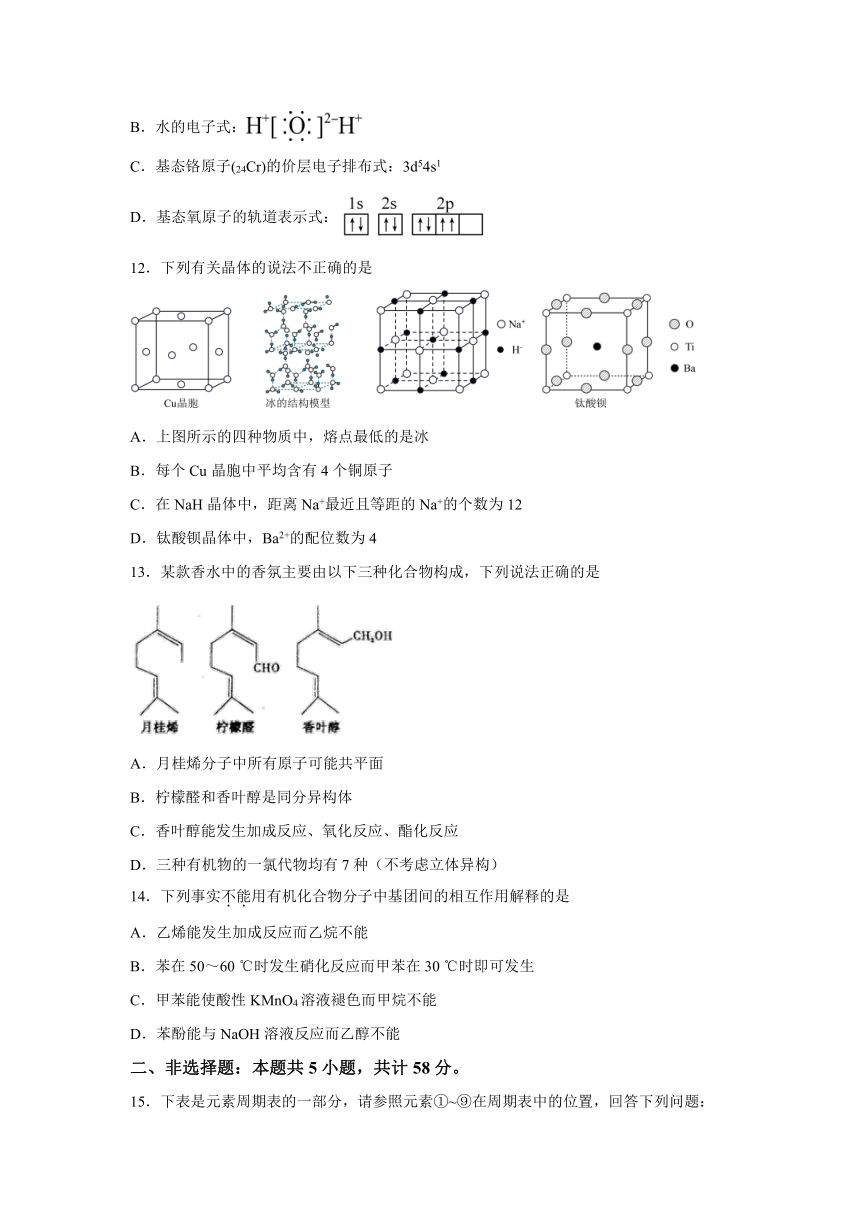
11.下列化学用语正确的是
A.Cl-的结构示意图:
B.水的电子式:
C.基态铬原子(24Cr)的价层电子排布式:3d54s1
D.基态氧原子的轨道表示式:
12.下列有关晶体的说法不正确的是
A.上图所示的四种物质中,熔点最低的是冰
B.每个Cu晶胞中平均含有4个铜原子
C.在NaH晶体中,距离Na+最近且等距的Na+的个数为12
D.钛酸钡晶体中,Ba2+的配位数为4
13.某款香水中的香氛主要由以下三种化合物构成,下列说法正确的是
A.月桂烯分子中所有原子可能共平面
B.柠檬醛和香叶醇是同分异构体
C.香叶醇能发生加成反应、氧化反应、酯化反应
D.三种有机物的一氯代物均有7种(不考虑立体异构)
14.下列事实不能用有机化合物分子中基团间的相互作用解释的是
A.乙烯能发生加成反应而乙烷不能
B.苯在50~60 ℃时发生硝化反应而甲苯在30 ℃时即可发生
C.甲苯能使酸性KMnO4溶液褪色而甲烷不能
D.苯酚能与NaOH溶液反应而乙醇不能
二、非选择题:本题共5小题,共计58分。
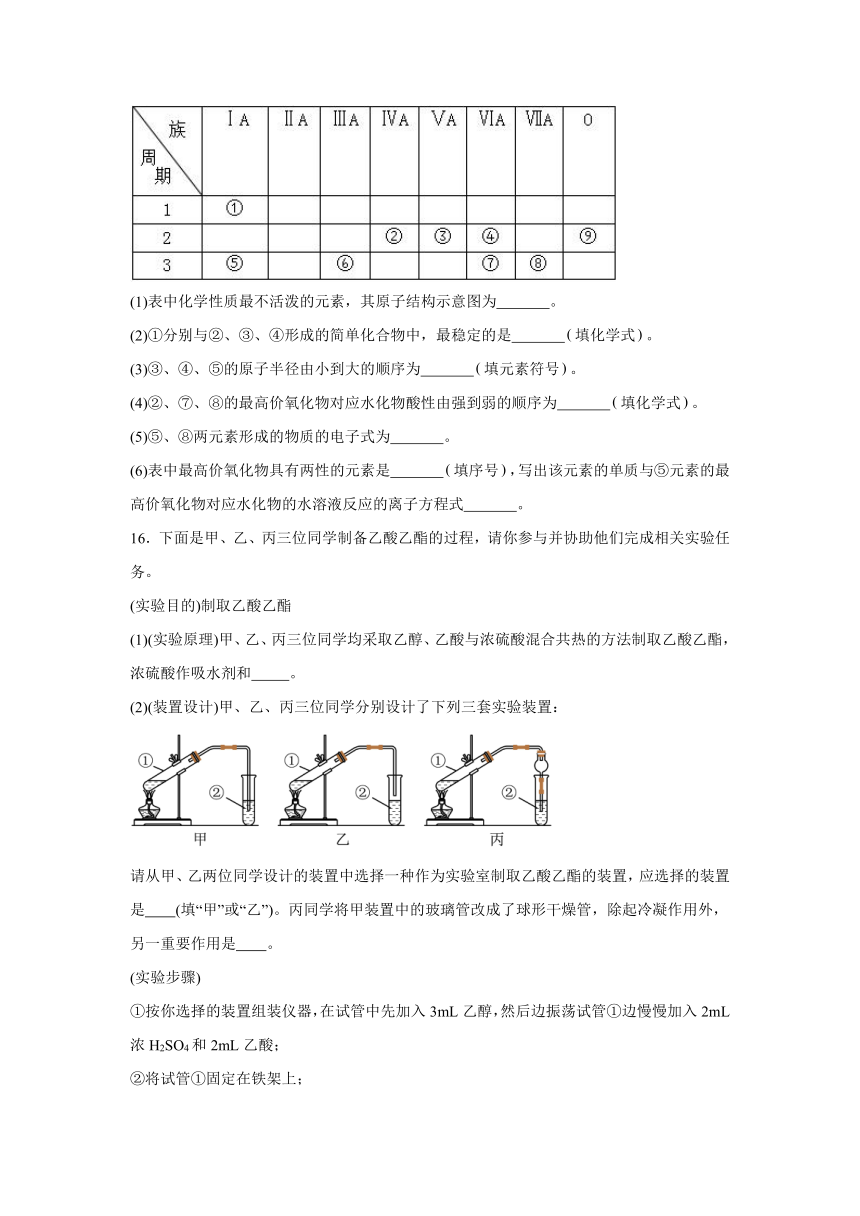
15.下表是元素周期表的一部分,请参照元素①~⑨在周期表中的位置,回答下列问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)①分别与②、③、④形成的简单化合物中,最稳定的是 填化学式。
(3)③、④、⑤的原子半径由小到大的顺序为 填元素符号。
(4)②、⑦、⑧的最高价氧化物对应水化物酸性由强到弱的顺序为 填化学式。
(5)⑤、⑧两元素形成的物质的电子式为 。
(6)表中最高价氧化物具有两性的元素是 填序号,写出该元素的单质与⑤元素的最高价氧化物对应水化物的水溶液反应的离子方程式 。
16.下面是甲、乙、丙三位同学制备乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
(实验目的)制取乙酸乙酯
(1)(实验原理)甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,浓硫酸作吸水剂和 。
(2)(装置设计)甲、乙、丙三位同学分别设计了下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,应选择的装置是 (填“甲”或“乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是 。
(实验步骤)
①按你选择的装置组装仪器,在试管中先加入3mL乙醇,然后边振荡试管①边慢慢加入2mL浓H2SO4和2mL乙酸;
②将试管①固定在铁架上;
③在试管②中加入适量的饱和Na2CO3溶液;
④用酒精灯对试管①缓慢加热;
⑤当观察到试管②中有明显现象时停止实验。
(3)(问题讨论)
a.试管②中盛放饱和Na2CO3溶液,关于该溶液的说法正确的是 (填选项字母)。
A.它可以中和乙酸,溶解乙醇
B.它可以降低乙酸乙酯在水中的溶解度,提高水溶液的密度以加速乙酸乙酯与水溶液的分层
C.它能提高该反应的速率
D.它可以用饱和NaHCO3溶液或NaOH溶液代替
b.写出制备乙酸乙酯的化学方程式: 。
17.物质G是能阻断血栓形成的药物的中间体,它的一种合成路线如下所示:
已知:Ⅰ.
Ⅱ.;
Ⅲ.同一个碳原子上连有两个羟基不稳定,会失水形成炭基。
回答下列问题:
(1) 的名称是 , 的反应类型是 。
(2)B的分子式为,则C的结构简式为 。
(3)1molE分子与新制氢氧化铜完全反应,理论上可以生成 mol。写出E生成F的化学方程式: 。
(4)W分子比E分子组成多一个,满足下列条件的W的同分异构体有 种。
①包含2个六元环,不含甲基;
W可水解,W与NaOH溶液共热时,1molW最多消耗3molNaOH
(5)已知Bamberger重排反应为 ,参考图中合成路线,以 和 、乙酸为原料,用最简路线合成 ,无机试剂任选 。
18.分析化学中的滴定法除了酸碱中和滴定,还有沉淀滴定、络合滴定、氧化还原滴定等。沉淀滴定法可用于NaCl溶液中的测定。实验过程包括准备标准溶液和滴定待测溶液。已知:
①是一种难溶于水的砖红色沉淀;
②溶液中同时存在和时,滴入溶液,先生成AgCl沉淀;
③。
I.准备标准溶液
准确称取基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。
II.滴定待测溶液
a.取待测NaCl溶液25.00mL于锥形瓶中。
b.加入1mL5%溶液。
c.边不断晃动锥形瓶边用标准溶液滴定,当接近终点时,半滴半滴地滴入溶液,并用力摇晃。记下达终点时消耗标准溶液的体积。
d.重复上述操作两次。三次测定数据如下表。
实验序号 1 2 3
消耗标准溶液体积/mL 20.45 20.02 19.98
e.数据处理。
回答下列问题:
(1)将称得的配制成标准溶液。所使用的仪器除烧杯和玻璃棒外还有 。
(2)滴定终点的现象是 。
(3)计算所消耗的标准溶液平均体积为 mL,测得 。
(4)若用该方法测定溶液中的,待测液的pH不宜超过7.2,理由是 。
(5)下列关于实验的说法合理的是___________。
A.为使终点现象更加明显,可改加1mL10%溶液
B.滴定过程中可用蒸馏水将锥形瓶壁上黏附的溶液冲下
C.若在配制标准溶液时,烧杯中的溶液有少量溅出,则测定结果偏高
D.若未等滴定管液面稳定就读数会导致测定结果偏高
19.某化学兴趣小组同学,拟在实验室中探究原电池的组成条件,以及影响电流的因素。实验材料:相同大小的铜片、铁片、锌片,导线、电流计、烧杯、1mol L-1硫酸、3mol L-1硫酸、无水乙醇。
探究I:探究原电池的组成条件:
(1)下列装置中,能使电流计指针发生偏转的有 (填字母)。
A. B.
C. D.
探究II:探究影响电流大小的因素:
(2)实验装置和所得数据如表:
实验编号 甲 乙 丙 丁
实验装置
电极间距离/cm 2 2 2 3
电流/μA 46.2 x1 65.3 x2
①实验乙和丙,可以研究 对电流大小的影响;若x1=54.5μA,通过对照实验乙和丙,说明在其他条件相同时, 形成的电池工作时,电流强度越大。
②实验甲和乙,研究 对电流大小的影响;其中x1的值可能为 (填字母)。
A.36.5 B.52.6 C.60.8 D.70.6
③实验丁中测得x2=54.5μA,由对照实验丙和丁说明,在其他条件相同时, ;请你再提出以一个影响电池电流大小的因素: 。
(3)若实验丙中溶液的体积为100mL,在10min内收集到标况下224mLH2,则用硫酸浓度表示的化学反应速率为
一、选择题:本题共14小题,每小题3分,共计42分。在每小题列出的四个选项中,只有一项是符合题目要求的。
1.朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影。”结合这段文字及所学的化学知识判断下列说法正确的是
A.荷塘上方的薄雾是水蒸气
B.月光通过薄雾时产生了丁达尔效应
C.薄雾中的微粒直径大约是
D.“大漠孤烟直”中“孤烟”的组成成分和这种薄雾的组成成分相同
2.在相同温度下,向三个相同的如图所示的容器中分别充入等质量的三种气体,则容器中三种气体的体积(V)从大到小的顺序是
A. B.
C. D.
3.2022年世界冬奥会和冬残奥会在北京举行,其中短道速滑项目队员所穿的速滑冰刀可用不锈钢制成,下列叙述错误的是
A.不锈钢是最常见的一种合金钢
B.不锈钢在大气中比较稳定,不容易生锈,具有很强的抗腐蚀能力
C.不锈钢中常添加一种或几种合金元素,从而使其具有各种特殊性能
D.不锈钢中只含有金属元素,不含有非金属元素
4.下列不能说明氯的非金属性比硫强的事实是
①HCl比H2S稳定
②HCl和H2S的水溶液前者的酸性强
③HClO4酸性比H2SO3强
④Cl2能与H2S反应生成S
⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子形成稳定离子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①② C.①②④ D.②③⑤
5.化学与生产、生活、科研密切相关。下列说法错误的是
A.制造月球探测器中的瞄准镜时使用的光导纤维,其主要成分是二氧化硅
B.火箭发射时使用液氢和液氧作推进剂,是利用燃烧反应提供能量
C.月球探测器使用的太阳能电池板,其主要成分是单质硅
D.氮化硅陶瓷、光导纤维、硅酸盐水泥均属于新型无机非金属材料
6.下列示意图中能构成原电池的是
A. B. C. D.
7.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B.实验中装置b中的液体逐渐变为浅红色
C.装置c中的碳酸钠溶液的作用是吸收溴化氢
D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
8.“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”理念的是
A.制:(浓)
B.制:;(稀)
C.制:(浓)
D.制:(稀)
9.下列关于盖斯定律描述不正确的是
A.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关
B.盖斯定律遵守能量守恒定律
C.利用盖斯定律可间接计算通过实验难测定的反应的反应热
D.利用盖斯定律可以计算有副反应发生的反应的反应热
10.室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
11.下列化学用语正确的是
A.Cl-的结构示意图:
B.水的电子式:
C.基态铬原子(24Cr)的价层电子排布式:3d54s1
D.基态氧原子的轨道表示式:
12.下列有关晶体的说法不正确的是
A.上图所示的四种物质中,熔点最低的是冰
B.每个Cu晶胞中平均含有4个铜原子
C.在NaH晶体中,距离Na+最近且等距的Na+的个数为12
D.钛酸钡晶体中,Ba2+的配位数为4
13.某款香水中的香氛主要由以下三种化合物构成,下列说法正确的是
A.月桂烯分子中所有原子可能共平面
B.柠檬醛和香叶醇是同分异构体
C.香叶醇能发生加成反应、氧化反应、酯化反应
D.三种有机物的一氯代物均有7种(不考虑立体异构)
14.下列事实不能用有机化合物分子中基团间的相互作用解释的是
A.乙烯能发生加成反应而乙烷不能
B.苯在50~60 ℃时发生硝化反应而甲苯在30 ℃时即可发生
C.甲苯能使酸性KMnO4溶液褪色而甲烷不能
D.苯酚能与NaOH溶液反应而乙醇不能
二、非选择题:本题共5小题,共计58分。
15.下表是元素周期表的一部分,请参照元素①~⑨在周期表中的位置,回答下列问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)①分别与②、③、④形成的简单化合物中,最稳定的是 填化学式。
(3)③、④、⑤的原子半径由小到大的顺序为 填元素符号。
(4)②、⑦、⑧的最高价氧化物对应水化物酸性由强到弱的顺序为 填化学式。
(5)⑤、⑧两元素形成的物质的电子式为 。
(6)表中最高价氧化物具有两性的元素是 填序号,写出该元素的单质与⑤元素的最高价氧化物对应水化物的水溶液反应的离子方程式 。
16.下面是甲、乙、丙三位同学制备乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
(实验目的)制取乙酸乙酯
(1)(实验原理)甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,浓硫酸作吸水剂和 。
(2)(装置设计)甲、乙、丙三位同学分别设计了下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,应选择的装置是 (填“甲”或“乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是 。
(实验步骤)
①按你选择的装置组装仪器,在试管中先加入3mL乙醇,然后边振荡试管①边慢慢加入2mL浓H2SO4和2mL乙酸;
②将试管①固定在铁架上;
③在试管②中加入适量的饱和Na2CO3溶液;
④用酒精灯对试管①缓慢加热;
⑤当观察到试管②中有明显现象时停止实验。
(3)(问题讨论)
a.试管②中盛放饱和Na2CO3溶液,关于该溶液的说法正确的是 (填选项字母)。
A.它可以中和乙酸,溶解乙醇
B.它可以降低乙酸乙酯在水中的溶解度,提高水溶液的密度以加速乙酸乙酯与水溶液的分层
C.它能提高该反应的速率
D.它可以用饱和NaHCO3溶液或NaOH溶液代替
b.写出制备乙酸乙酯的化学方程式: 。
17.物质G是能阻断血栓形成的药物的中间体,它的一种合成路线如下所示:
已知:Ⅰ.
Ⅱ.;
Ⅲ.同一个碳原子上连有两个羟基不稳定,会失水形成炭基。
回答下列问题:
(1) 的名称是 , 的反应类型是 。
(2)B的分子式为,则C的结构简式为 。
(3)1molE分子与新制氢氧化铜完全反应,理论上可以生成 mol。写出E生成F的化学方程式: 。
(4)W分子比E分子组成多一个,满足下列条件的W的同分异构体有 种。
①包含2个六元环,不含甲基;
W可水解,W与NaOH溶液共热时,1molW最多消耗3molNaOH
(5)已知Bamberger重排反应为 ,参考图中合成路线,以 和 、乙酸为原料,用最简路线合成 ,无机试剂任选 。
18.分析化学中的滴定法除了酸碱中和滴定,还有沉淀滴定、络合滴定、氧化还原滴定等。沉淀滴定法可用于NaCl溶液中的测定。实验过程包括准备标准溶液和滴定待测溶液。已知:
①是一种难溶于水的砖红色沉淀;
②溶液中同时存在和时,滴入溶液,先生成AgCl沉淀;
③。
I.准备标准溶液
准确称取基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。
II.滴定待测溶液
a.取待测NaCl溶液25.00mL于锥形瓶中。
b.加入1mL5%溶液。
c.边不断晃动锥形瓶边用标准溶液滴定,当接近终点时,半滴半滴地滴入溶液,并用力摇晃。记下达终点时消耗标准溶液的体积。
d.重复上述操作两次。三次测定数据如下表。
实验序号 1 2 3
消耗标准溶液体积/mL 20.45 20.02 19.98
e.数据处理。
回答下列问题:
(1)将称得的配制成标准溶液。所使用的仪器除烧杯和玻璃棒外还有 。
(2)滴定终点的现象是 。
(3)计算所消耗的标准溶液平均体积为 mL,测得 。
(4)若用该方法测定溶液中的,待测液的pH不宜超过7.2,理由是 。
(5)下列关于实验的说法合理的是___________。
A.为使终点现象更加明显,可改加1mL10%溶液
B.滴定过程中可用蒸馏水将锥形瓶壁上黏附的溶液冲下
C.若在配制标准溶液时,烧杯中的溶液有少量溅出,则测定结果偏高
D.若未等滴定管液面稳定就读数会导致测定结果偏高
19.某化学兴趣小组同学,拟在实验室中探究原电池的组成条件,以及影响电流的因素。实验材料:相同大小的铜片、铁片、锌片,导线、电流计、烧杯、1mol L-1硫酸、3mol L-1硫酸、无水乙醇。
探究I:探究原电池的组成条件:
(1)下列装置中,能使电流计指针发生偏转的有 (填字母)。
A. B.
C. D.
探究II:探究影响电流大小的因素:
(2)实验装置和所得数据如表:
实验编号 甲 乙 丙 丁
实验装置
电极间距离/cm 2 2 2 3
电流/μA 46.2 x1 65.3 x2
①实验乙和丙,可以研究 对电流大小的影响;若x1=54.5μA,通过对照实验乙和丙,说明在其他条件相同时, 形成的电池工作时,电流强度越大。
②实验甲和乙,研究 对电流大小的影响;其中x1的值可能为 (填字母)。
A.36.5 B.52.6 C.60.8 D.70.6
③实验丁中测得x2=54.5μA,由对照实验丙和丁说明,在其他条件相同时, ;请你再提出以一个影响电池电流大小的因素: 。
(3)若实验丙中溶液的体积为100mL,在10min内收集到标况下224mLH2,则用硫酸浓度表示的化学反应速率为
同课章节目录
