化学人教版(2019)必修第一册4.1.3原子结构与元素的性质 课件(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.1.3原子结构与元素的性质 课件(共19张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 31.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-08 22:27:32 | ||
图片预览





文档简介
(共19张PPT)
第四章 第一节 原子结构和元素周期表
学
习
目
标
通过碱金属单质和卤素单质的性质的学习,能利用原子结构理论预测陌生元素的性质,培养学生证据推理与模型认知的化学核心素养;
1
2
掌握碱金属元素卤族元素的原子结构与性质的关系,运用原子结构理论解释元素性质,培养学生宏观辨识与微观探析的化学核心素养。
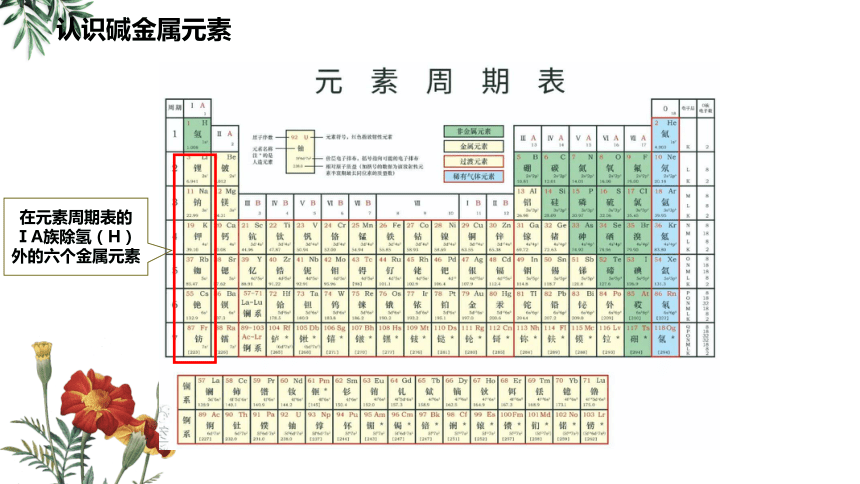
认识碱金属元素
在元素周期表的ⅠA族除氢(H)外的六个金属元素
元素周期表中的同族元素放在一起研究,他们之间存在着什么内在联系呢?人们常说原子结构决定元素性质,我们可从它们的结构和性质的关系来进行探讨。
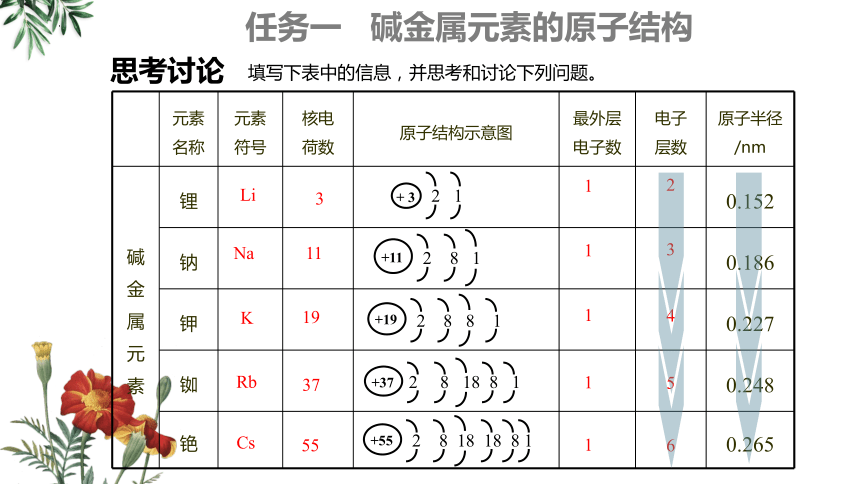
元素 名称 元素 符号 核电 荷数 原子结构示意图 最外层 电子数 电子 层数 原子半径/nm
碱金属元素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
思考讨论
填写下表中的信息,并思考和讨论下列问题。
Li
Na
K
Rb
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
+ 3
2 1
+11
2 8 1
+19
2 8 8 1
+37
2 8 18 8 1
+55
2 8 18 18 8 1
任务一 碱金属元素的原子结构
温习旧知
一般金属元素最外层电子数≤4,易失电子,具有金属性;
非金属元素最外层电子数≥4,易得电子,具有非金属性。
原子失电子的能力
原子得电子的能力
(1)在同周期表中,从上到下碱金属元素原子的核电荷数、原子半径的变化有什么特点?
(2)观察碱金属的原子结构示意图,他们的原子核外电子排布有什么特点?从哪一点能推断出碱金属元素的化学性质具有相似性?
最外层均有1个电子,容易失去,均有较强还原性
从Li到Cs随核电荷数的增加,电子层数增多,原子半径增大
任务二 碱金属元素的化学性质
问题和预测
(1)回忆:回忆第二章学过的知识,金属钠有哪些化学性质?
钠在空气中燃烧
钠与水的反应
(2)结合金属锂、钠和钾的原子结构特点,预测锂和钾可能具有哪些与钠相似的化学性质?
实验探究
钠 钾
和氧气反应
化学方程式
钠、钾与氧气反应比较
先熔化,再剧烈燃烧,火焰呈黄色,生成淡黄色的固体
比钠燃烧更剧烈,火焰呈紫色
观察实验现象
从Li到K,和氧气反应越来越剧烈,产物种类越来越多
观察实验现象
钠 钾
与水反应 在水面上、___成银白色小球、在水面上四处 、滴入酚酞溶液呈 色 在水面上、 成银白色小球、在水面上四处 、滴入酚酞溶液呈 色,有轻微爆炸现象
化学方程式
浮
熔
游动
红
钠、钾与水的反应比较
浮
熔
游动
红
2Na+2H2O===2NaOH+H2↑
2K+2H2O===2KOH+H2↑
产物碱性:
LiOH <NaOH <KOH < RbOH < CsOH
逐渐剧烈
2Li + 2H2O = 2LiOH + H2 ↑ (较慢)
2Na + 2H2O = 2NaOH + H2 ↑ (激烈)
2K + 2H2O = 2KOH + H2 ↑ (很激烈)
2M + 2H2O = 2MOH + H2 ↑
分析和结论
(1)通过实验、观察,讨论并总结钠、钾有哪些相似的化学性质?与你最初根据原子结构特点进行的预测是否一致?
(2)从实验现象比较钾、钠与水反应的难易程度,由此,你能推断出锂与水反应的难易程度吗?
(3)通过比较碱金属与水反应的难易程度,你能发现与它们的原子结构有什么关系吗?由此,你能推断出碱金属元素化学性质的相似性和递变规律吗?
从原子结构的角度分析碱金属元素的化学性质的相似性、递变性的实质
相似性:碱金属元素的原子最外层都只有1个电子,在反应中容易失去,所以他们的化学性质相似,都能与氧气、水反应。
递变性:随着核电荷数的增加,碱金属元素的原子电子层增加,原子半径增大,所以原子失电子能力增强,原子核对最外层电子的引力逐渐减弱,原子失去最外层电子的能力逐渐增强,即由锂到铯,金属性逐渐增强。
通过刚才对碱金属原子结构和化学性质的分析,明确了碱金属元素的化学性质具有相似性和递变性,这能为我们比较金属性强弱提供哪些方法呢?
(1)其单质与水(或酸)反应的剧烈程度。
(2)最高价氧化物的水化物-----氢氧化物的碱性强弱。
金属性强弱的判断:
(3)根据金属活动顺序表进行理论判断
任务三 碱金属元素的物理性质
密度
逐渐增大
反常
熔点逐渐降低
沸点逐渐降低
最轻的金属,保存在石蜡里
任务四 碱金属的用途
锂电池是一种高能电池。锂有机化学中重要的催化剂。锂是制造氢弹不可缺少的材料,是优质的高能燃料(已经用于宇宙飞船、人造卫星和超声速飞机)。
钾和钠的合金(液态)——核反应堆的传热介质。由于高压钠灯具有光效高、寿命长,可接受的显色性以及不诱虫,不易使被照物褪色等特点,这就使高压钠灯被广泛的应用于普通照明的各个角落,以逐步地取代相对而言耗能大的荧光高压汞灯。
第四章 第一节 原子结构和元素周期表
学
习
目
标
通过碱金属单质和卤素单质的性质的学习,能利用原子结构理论预测陌生元素的性质,培养学生证据推理与模型认知的化学核心素养;
1
2
掌握碱金属元素卤族元素的原子结构与性质的关系,运用原子结构理论解释元素性质,培养学生宏观辨识与微观探析的化学核心素养。
认识碱金属元素
在元素周期表的ⅠA族除氢(H)外的六个金属元素
元素周期表中的同族元素放在一起研究,他们之间存在着什么内在联系呢?人们常说原子结构决定元素性质,我们可从它们的结构和性质的关系来进行探讨。
元素 名称 元素 符号 核电 荷数 原子结构示意图 最外层 电子数 电子 层数 原子半径/nm
碱金属元素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
思考讨论
填写下表中的信息,并思考和讨论下列问题。
Li
Na
K
Rb
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
+ 3
2 1
+11
2 8 1
+19
2 8 8 1
+37
2 8 18 8 1
+55
2 8 18 18 8 1
任务一 碱金属元素的原子结构
温习旧知
一般金属元素最外层电子数≤4,易失电子,具有金属性;
非金属元素最外层电子数≥4,易得电子,具有非金属性。
原子失电子的能力
原子得电子的能力
(1)在同周期表中,从上到下碱金属元素原子的核电荷数、原子半径的变化有什么特点?
(2)观察碱金属的原子结构示意图,他们的原子核外电子排布有什么特点?从哪一点能推断出碱金属元素的化学性质具有相似性?
最外层均有1个电子,容易失去,均有较强还原性
从Li到Cs随核电荷数的增加,电子层数增多,原子半径增大
任务二 碱金属元素的化学性质
问题和预测
(1)回忆:回忆第二章学过的知识,金属钠有哪些化学性质?
钠在空气中燃烧
钠与水的反应
(2)结合金属锂、钠和钾的原子结构特点,预测锂和钾可能具有哪些与钠相似的化学性质?
实验探究
钠 钾
和氧气反应
化学方程式
钠、钾与氧气反应比较
先熔化,再剧烈燃烧,火焰呈黄色,生成淡黄色的固体
比钠燃烧更剧烈,火焰呈紫色
观察实验现象
从Li到K,和氧气反应越来越剧烈,产物种类越来越多
观察实验现象
钠 钾
与水反应 在水面上、___成银白色小球、在水面上四处 、滴入酚酞溶液呈 色 在水面上、 成银白色小球、在水面上四处 、滴入酚酞溶液呈 色,有轻微爆炸现象
化学方程式
浮
熔
游动
红
钠、钾与水的反应比较
浮
熔
游动
红
2Na+2H2O===2NaOH+H2↑
2K+2H2O===2KOH+H2↑
产物碱性:
LiOH <NaOH <KOH < RbOH < CsOH
逐渐剧烈
2Li + 2H2O = 2LiOH + H2 ↑ (较慢)
2Na + 2H2O = 2NaOH + H2 ↑ (激烈)
2K + 2H2O = 2KOH + H2 ↑ (很激烈)
2M + 2H2O = 2MOH + H2 ↑
分析和结论
(1)通过实验、观察,讨论并总结钠、钾有哪些相似的化学性质?与你最初根据原子结构特点进行的预测是否一致?
(2)从实验现象比较钾、钠与水反应的难易程度,由此,你能推断出锂与水反应的难易程度吗?
(3)通过比较碱金属与水反应的难易程度,你能发现与它们的原子结构有什么关系吗?由此,你能推断出碱金属元素化学性质的相似性和递变规律吗?
从原子结构的角度分析碱金属元素的化学性质的相似性、递变性的实质
相似性:碱金属元素的原子最外层都只有1个电子,在反应中容易失去,所以他们的化学性质相似,都能与氧气、水反应。
递变性:随着核电荷数的增加,碱金属元素的原子电子层增加,原子半径增大,所以原子失电子能力增强,原子核对最外层电子的引力逐渐减弱,原子失去最外层电子的能力逐渐增强,即由锂到铯,金属性逐渐增强。
通过刚才对碱金属原子结构和化学性质的分析,明确了碱金属元素的化学性质具有相似性和递变性,这能为我们比较金属性强弱提供哪些方法呢?
(1)其单质与水(或酸)反应的剧烈程度。
(2)最高价氧化物的水化物-----氢氧化物的碱性强弱。
金属性强弱的判断:
(3)根据金属活动顺序表进行理论判断
任务三 碱金属元素的物理性质
密度
逐渐增大
反常
熔点逐渐降低
沸点逐渐降低
最轻的金属,保存在石蜡里
任务四 碱金属的用途
锂电池是一种高能电池。锂有机化学中重要的催化剂。锂是制造氢弹不可缺少的材料,是优质的高能燃料(已经用于宇宙飞船、人造卫星和超声速飞机)。
钾和钠的合金(液态)——核反应堆的传热介质。由于高压钠灯具有光效高、寿命长,可接受的显色性以及不诱虫,不易使被照物褪色等特点,这就使高压钠灯被广泛的应用于普通照明的各个角落,以逐步地取代相对而言耗能大的荧光高压汞灯。
