江苏省南通市海安市高级中学2023-2024学年高二上学期阶段测试(一)化学试题(含答案)
文档属性
| 名称 | 江苏省南通市海安市高级中学2023-2024学年高二上学期阶段测试(一)化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-09 08:21:05 | ||
图片预览



文档简介
海安市高级中学2023-2024学年高二上学期阶段测试(一)
化 学
本试卷分第I 卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试用时75分钟。
相对原子质量: H1 C12 N14 O16 Na23 S32 Cl35.5 Fe 56 Cu64
I 卷(选择题)
一、单项选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.研究发现,腐蚀严重的青铜器大都存在CuCl。CuCl在青铜器腐蚀过程中起催化作用。下列关于 CuCl 叙述错误的是
A.加快了反应的速率 B.增大了平衡常数
C.改变了反应的历程 D.降低了反应的活化能
2.下列事实不能用勒夏特列原理解释的是
A.对于平衡体系2HI(g)H (g)+l (g), 增大压强(缩小容积)可使颜色变深
B.合成氨工业上,采用高压以提高NH 的产率
C.氯水宜保存在低温、避光条件下
D. 向氯水中加入适量石灰石,可增强漂白效果
3.COCl2(g)CO(g)+Cl (g)△H>0, 当反应达到平衡时,下列措施:①升温;②恒容通入惰性气体;③增加CO 浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体,能提高COCl 转化率的是
A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
4.下列说法不正确的是
A.同温同压下, H (g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H的数值相同
B.准确测量中和反应反应热的整个实验过程中,至少测定3次温度
C.测量中和反应反应热的实验过程中,玻璃搅拌器若用铜代替,则测量出的中和热数值偏小
D.一定条件下,将0.5 mol N (g) 和1 .5molH2(g) 置于密闭容器中充分反应生成NH (g) 放
热19.3kJ, 其热化学方程式为N (g)+3H (g) 2NH (g) △H=-38.6k·mol-1
5. 已知[Co(H O) ] +呈粉红色,[CoCl]2-呈蓝色,[ZnCl4]2-为无色。现将CoCl 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
[Co(H O)s] ++4CT[CoCla]2-+6H O △H 用该溶液做实验,溶液的颜色变化如下:
以下结论和解释正确的是
A. 等物质的量的[Co(H O)6] + 和[CoCl ] -中。键数之比为3:2
B. 由实验①可推知△H<0
C. 实验②是由于c(H O)增大,导致平衡逆向移动
D. 由实验③可知配离子的稳定性: [ZnCl ] ->[CoCl4] -
6.室温下,下列实验探究方案不能达到探究目的的是
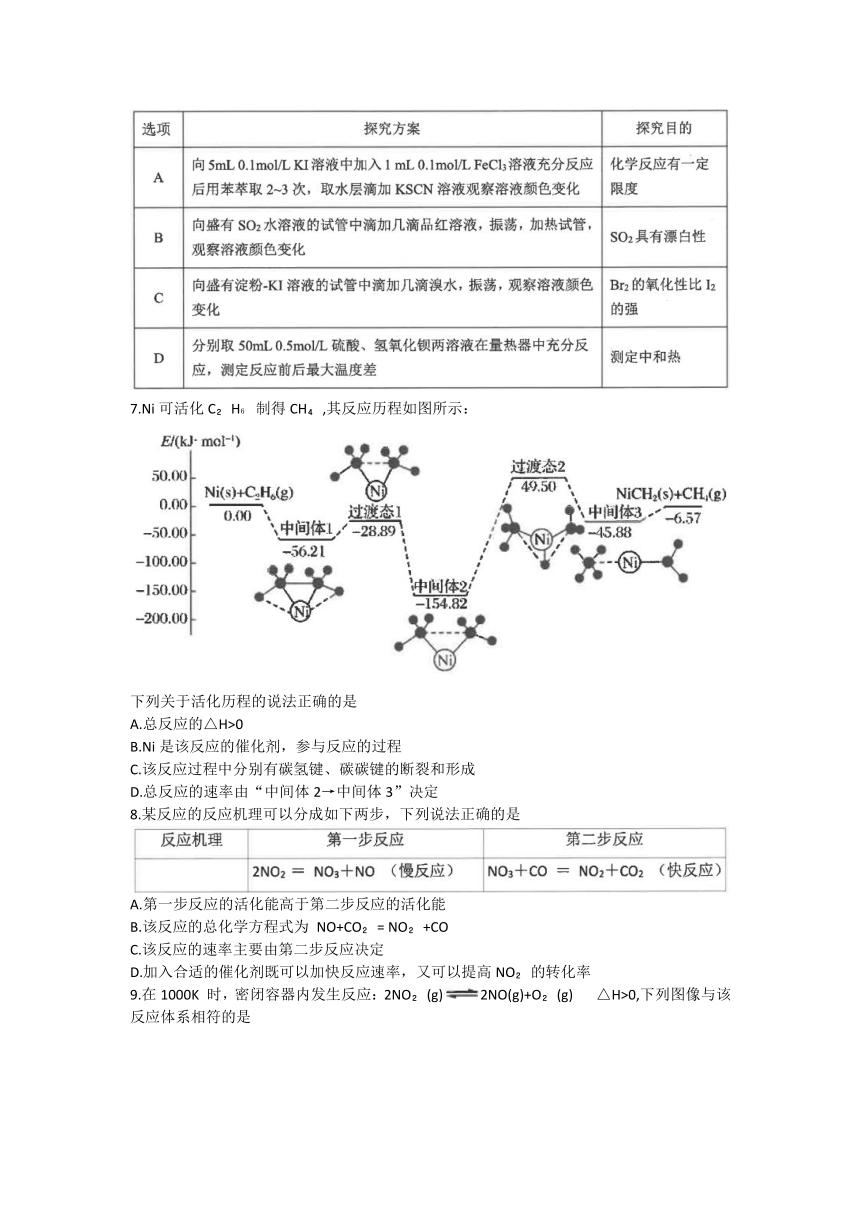
7.Ni可活化C H 制得CH ,其反应历程如图所示:
下列关于活化历程的说法正确的是
A.总反应的△H>0
B.Ni是该反应的催化剂,参与反应的过程
C.该反应过程中分别有碳氢键、碳碳键的断裂和形成
D.总反应的速率由“中间体2→中间体3”决定
8.某反应的反应机理可以分成如下两步,下列说法正确的是
A.第一步反应的活化能高于第二步反应的活化能
B.该反应的总化学方程式为 NO+CO = NO +CO
C.该反应的速率主要由第二步反应决定
D.加入合适的催化剂既可以加快反应速率,又可以提高NO 的转化率
9.在1000K 时,密闭容器内发生反应:2NO (g)2NO(g)+O (g) △H>0,下列图像与该反应体系相符的是
A.图1表示温度对反应的影响 B.图2表示压强对物质平衡百分含量的影响
C. 图3表示恒压再充入 NO D. 图4表示体积压缩至原来的一半
10. 甲酸在一定条件下可分解生成CO 和 H O, 在有、无催化剂条件下的能量与反应历程的关系如图所示。下列说法正确的是
反应历程途径1 反应历程途径2
A. 途径1的活化能为Ea1, 其大小与△H 有关
B. 途径1使用了催化剂,途径2没有使用催化剂,但△H1=△H
C. 途径2要经过三步才完成,而途径1只要一步就完成,所以途径1反应速率更快
D. 途径2中第二步反应的速率比第三步反应要慢
11.某温度下,在1L 恒容密闭容器中2.0molX 发生反应2X(s)Y(g)+2Z(g),有关数据
如下:
下列说法错误的是
A.1min 时, Z 的浓度大于0.2 mol·L-1
B.2 min 时,加入0.20 molZ, 此时v 正(Z)C.3 min 时,Y 的体积分数约为33.3%
D.5 min 时,X 的物质的量为1.4 mol
12.某反应A(g)+B(g)→C(g)+D(g) 的速率方程为v=kcm(A) ·cn(B), 其中k是反应速率常数,受温度、催化剂的影响。其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为 0.8/k。改变反应物浓度时,反应的瞬时速率如表所示;
下列说法不正确的是
A.上述表格中的c =0.75、v =6.4
B.该反应的速率常数k=6.4×10-3min-1
C.在过量的B 存在时,反应掉75%的A 所需的时间是250 min
D. 升温、加入催化剂、缩小容积(加压),均可使k增大导致反应的瞬时速率加快
13.甲、乙为两个容积均为1L 的恒容密闭容器,向甲中充入1molCH4 和1molCO , 乙中充入1molCH 和m mol CO , 加入催化剂,只发生反应: CH (g)+CO (g)2Co(g)+2H2(g), 测得CH 的平衡转化率随温度的变化如图所示。下列说法不正确的是
A.该反应的正反应是吸热反应
B.a、b、c三点处,容器内气体总压强: p(a)C.873 K 向甲的平衡体系中再充入CO 、CH 各0.4 mol,CO、H 各1.2 mol, 重新达到平衡前,v正>v逆
D.TK 时,该反应的平衡常数小于12.96
14. 合成氨及其衍生工业是化工生产的重要门类,请结合图示判断下列说法不正确的是
A. 合成氨采用400~500℃是为了提高原料转化率和反应速率
B. 湿润的淀粉-KI试纸不可以鉴别气体2和溴蒸气
C.生成固体1的化学方程式为NaCl+NH +CO +H O=NaHCO3↓+NH Cl
D. 相同条件下,1L 气体1和气体2的混合气与1LNH 在一定条件下转化为对环境无害的物质,混合气中二者的体积比为1:1
Ⅱ 卷 ( 非选择题 )
15. (14分)化学反应原理对化学反应的研究具有指导意义。
(1)目前城市机动车废气的排放已成为城市大气污染的重要来源。气缸中生成NO 的反应为: N (g)+O (g)2NO(g)
①汽车启动后,气缸内温度越高,单位时间内NO 排放量越大,可能的原因是 。
② 可用 NH 催化还原NO 消除污染,写出该反应的化学方程式 。
③CO还原NO的反应机理及相对能量如下图(TS 表示过渡态):
反应过程中速率最慢步骤的热化学方程式为 。
(2)已知热化学方程式:
I.SO2(g)+l (g)+2H O(g)= 2HI(g)+H SO (1) △H1= xkJ·mol-1
Ⅱ.2H SO (I)=2H O(g)+2SO (g)+O (g) △H = ykJ·mol-1
Ⅲ.H (g)+l (g)=2HI(g) △H = zkJ·mol-1
则:2H O(g)= 2H (g)+O (g) △H= kJ·mol-1。
(3)已知部分共价键的键能与热化学方程式信息如下表:
则20(g)=O (g) 的△H 为 。
(4)氢气可通过水煤气法获得,反应为CO(g)+H O(g)CO (g)+H (g)。 一定温度下,控制进气比n(CO):n(H2O)不同,测得平衡时某反应物的转化率如右图所示。
①图中表示的是 (填“CO”或“H O”)的转化率。
② n(CO):n(H O)=0.2 时,图中对应物质的转化率为 。
16. (13分)实验室研究从炼铜烟灰(主要成分为CuO、Cu O、ZnO、PbO 及其硫酸盐)中分别回收铜、锌、铅元素的流程如图。
(1)酸浸过程中,金属元素均由氧化物转化为硫酸盐,其中生成 CuSO 的化学方程式为
CuO+H SO =CuSO +H O 、 。
(2)铁屑加入初期,置换速率随时间延长而加快,其可能原因为反应放热,温度升高; 。 铁屑完全消耗后,铜的产率随时间延长而下降,其可能原因为 。
(3)已知: PbSO4 难溶于水; PbSO +2CI-PbCl+SO42- 。一定条件下,在不同浓度的 NaCl 溶液中,温度对铅浸出率的影响、 PbCl 的溶解度曲线分别如图1、图2所示。
浸出后溶液循环浸取酸浸渣并析出PbCl 的实验结果如下表所示。
①为提高原料NaCl溶液利用率,请补充完整利用酸浸渣制备化学纯(纯度≥98.5%)PbCl 晶体的实 验方案:取一定质量的酸浸渣, ,
将所得晶体洗涤、干燥。(可选用的试剂:5mol·L-1 NaCl溶液,1 mol·L-1NaCl溶液,NaCl 固体)
② 循环一定次数后的溶液中加入适量CaCl 溶液,过滤并加水稀释至其中NaCl 浓度为1mol·L-1的目的是 。
17. (13分)将CO 转化为有机燃料是实现碳资源可持续利用的有效途径。
(1)催化加氢制甲醇。向容积为2L的恒容、绝热密闭容器中通入2molCO 和3 mol Hz, 发生如下反应: CO (g)+3H (g)CH OH(g)+H O(g) △H=-49.5k·mol-1。
① 反应在5min 时达平衡,测得此时容器内CO (g)与 CH OH(g) 的物质的量之比为3:1,则前5min 内,该反应的平均反应速率v(H )= 。
②下列可用来判断该反应已达到平衡状态的有 (填字母)。
A.v正(CO )=v逆(H O) B.容器中c(CH OH)=c(H O)
C.混合气体的密度保持不变 D.容器内的温度保持不变
③ 两分子甲醇可进一步脱水制得二甲醚:
2CH OH(g)=CH OCH (g)+H O(g) △H=-23.4kJ·mol- ,
则 2CO (g)+6H (g)=CH OCH (g)+3H O(g) 的△H= 。
(2)催化加氢制甲烷。向恒压、密闭容器中通入1mol CO 和 4mol Hz, 在催化剂作用下发生反应:
反应I:CO (g)+4H (g)=CH (g)+2H O(g) △H=-164.7kJ·mol-
反应Ⅱ:CO (g)+H (g)=CO(g)+H O(g) △H=41.2kJ·mol-
反应Ⅲ:2CO(g)+2H (g)= CO (g)+CH (g) △H=-247.1k·mol-
上述反应达平衡时,容器中CO 、CH 和 CO 的物质的量随温度的变化关系如图所示。
① 曲线A表示 的物质的量随温度的变化。
②800℃时曲线B代表物质的物质的量远大于400℃时的物质的量,其原因是 。
③ 曲线C 代表物质的物质的量随温度的升高,先逐渐增大后逐渐减小。在200~600℃间,曲线C 逐渐上升的原因是 。
18. (18分)工业上通过将CO、CO 与氢气反应,实现碳中和。
(1)已知反应2CO (g)+6H (g)==c H (g)+4H O(g) △H。根据理论计算,在恒压、起始物质的量之比n(CO ):n(H )=1;3 条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图1所示。
① 该反应的平衡常数表达式为 ,该反应的△H (填“>”或“<”)0。
② 图中曲线 b 、c分别表示的是平衡时 和 的物质的量分数变化。
( 2 ) 用CO 和H 合成CH OH 的反应为Co(g)+2H (g)CH OH(g) △H <0,按照相同的物质的量投料,测得CO 在不同温度下的平衡转化率与压强的关系如左下图2所示。
①图中 T1、T2、T 由大到小的关系为 。
②图中 b、c、d 点逆反应速率由小到大的关系为 。
③图中 b、c、d 点平衡常数的大小关系为 。
(3)合成二甲醚:
反应I:CO (g)+H (g)=co(g)+H O(g)
反应Ⅱ:2CO (g)+6H (g)=CH OCH (g)+3H O(g)
在恒压、CO 和H 的起始量一定的条件下,CO 平衡转化率和平衡时CH OCH 的选择性随温度的变化如右上图所示。其中:CH OCH 的选择性=×100%。
① 温度高于300 ℃,CO 平衡转化率随温度升高而上升的原因是 。
② 220 ℃时,若起始投入3 mol CO ,6mol H , 在催化剂作用下 CO 与 H 反应一段时间后,测得 CO 平衡转化率为40%,CH OCH 的选择性为50%(图中A 点),达到平衡时理论上共消耗H 的物质的量为 mol。不改变反应时间和温度,一定能提高CH OCH 选择性的措施有 。
③ 合成二甲醚时较适宜的温度为260 ℃,其原因是 。
化 学
本试卷分第I 卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试用时75分钟。
相对原子质量: H1 C12 N14 O16 Na23 S32 Cl35.5 Fe 56 Cu64
I 卷(选择题)
一、单项选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.研究发现,腐蚀严重的青铜器大都存在CuCl。CuCl在青铜器腐蚀过程中起催化作用。下列关于 CuCl 叙述错误的是
A.加快了反应的速率 B.增大了平衡常数
C.改变了反应的历程 D.降低了反应的活化能
2.下列事实不能用勒夏特列原理解释的是
A.对于平衡体系2HI(g)H (g)+l (g), 增大压强(缩小容积)可使颜色变深
B.合成氨工业上,采用高压以提高NH 的产率
C.氯水宜保存在低温、避光条件下
D. 向氯水中加入适量石灰石,可增强漂白效果
3.COCl2(g)CO(g)+Cl (g)△H>0, 当反应达到平衡时,下列措施:①升温;②恒容通入惰性气体;③增加CO 浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体,能提高COCl 转化率的是
A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
4.下列说法不正确的是
A.同温同压下, H (g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H的数值相同
B.准确测量中和反应反应热的整个实验过程中,至少测定3次温度
C.测量中和反应反应热的实验过程中,玻璃搅拌器若用铜代替,则测量出的中和热数值偏小
D.一定条件下,将0.5 mol N (g) 和1 .5molH2(g) 置于密闭容器中充分反应生成NH (g) 放
热19.3kJ, 其热化学方程式为N (g)+3H (g) 2NH (g) △H=-38.6k·mol-1
5. 已知[Co(H O) ] +呈粉红色,[CoCl]2-呈蓝色,[ZnCl4]2-为无色。现将CoCl 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
[Co(H O)s] ++4CT[CoCla]2-+6H O △H 用该溶液做实验,溶液的颜色变化如下:
以下结论和解释正确的是
A. 等物质的量的[Co(H O)6] + 和[CoCl ] -中。键数之比为3:2
B. 由实验①可推知△H<0
C. 实验②是由于c(H O)增大,导致平衡逆向移动
D. 由实验③可知配离子的稳定性: [ZnCl ] ->[CoCl4] -
6.室温下,下列实验探究方案不能达到探究目的的是
7.Ni可活化C H 制得CH ,其反应历程如图所示:
下列关于活化历程的说法正确的是
A.总反应的△H>0
B.Ni是该反应的催化剂,参与反应的过程
C.该反应过程中分别有碳氢键、碳碳键的断裂和形成
D.总反应的速率由“中间体2→中间体3”决定
8.某反应的反应机理可以分成如下两步,下列说法正确的是
A.第一步反应的活化能高于第二步反应的活化能
B.该反应的总化学方程式为 NO+CO = NO +CO
C.该反应的速率主要由第二步反应决定
D.加入合适的催化剂既可以加快反应速率,又可以提高NO 的转化率
9.在1000K 时,密闭容器内发生反应:2NO (g)2NO(g)+O (g) △H>0,下列图像与该反应体系相符的是
A.图1表示温度对反应的影响 B.图2表示压强对物质平衡百分含量的影响
C. 图3表示恒压再充入 NO D. 图4表示体积压缩至原来的一半
10. 甲酸在一定条件下可分解生成CO 和 H O, 在有、无催化剂条件下的能量与反应历程的关系如图所示。下列说法正确的是
反应历程途径1 反应历程途径2
A. 途径1的活化能为Ea1, 其大小与△H 有关
B. 途径1使用了催化剂,途径2没有使用催化剂,但△H1=△H
C. 途径2要经过三步才完成,而途径1只要一步就完成,所以途径1反应速率更快
D. 途径2中第二步反应的速率比第三步反应要慢
11.某温度下,在1L 恒容密闭容器中2.0molX 发生反应2X(s)Y(g)+2Z(g),有关数据
如下:
下列说法错误的是
A.1min 时, Z 的浓度大于0.2 mol·L-1
B.2 min 时,加入0.20 molZ, 此时v 正(Z)
D.5 min 时,X 的物质的量为1.4 mol
12.某反应A(g)+B(g)→C(g)+D(g) 的速率方程为v=kcm(A) ·cn(B), 其中k是反应速率常数,受温度、催化剂的影响。其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为 0.8/k。改变反应物浓度时,反应的瞬时速率如表所示;
下列说法不正确的是
A.上述表格中的c =0.75、v =6.4
B.该反应的速率常数k=6.4×10-3min-1
C.在过量的B 存在时,反应掉75%的A 所需的时间是250 min
D. 升温、加入催化剂、缩小容积(加压),均可使k增大导致反应的瞬时速率加快
13.甲、乙为两个容积均为1L 的恒容密闭容器,向甲中充入1molCH4 和1molCO , 乙中充入1molCH 和m mol CO , 加入催化剂,只发生反应: CH (g)+CO (g)2Co(g)+2H2(g), 测得CH 的平衡转化率随温度的变化如图所示。下列说法不正确的是
A.该反应的正反应是吸热反应
B.a、b、c三点处,容器内气体总压强: p(a)
D.TK 时,该反应的平衡常数小于12.96
14. 合成氨及其衍生工业是化工生产的重要门类,请结合图示判断下列说法不正确的是
A. 合成氨采用400~500℃是为了提高原料转化率和反应速率
B. 湿润的淀粉-KI试纸不可以鉴别气体2和溴蒸气
C.生成固体1的化学方程式为NaCl+NH +CO +H O=NaHCO3↓+NH Cl
D. 相同条件下,1L 气体1和气体2的混合气与1LNH 在一定条件下转化为对环境无害的物质,混合气中二者的体积比为1:1
Ⅱ 卷 ( 非选择题 )
15. (14分)化学反应原理对化学反应的研究具有指导意义。
(1)目前城市机动车废气的排放已成为城市大气污染的重要来源。气缸中生成NO 的反应为: N (g)+O (g)2NO(g)
①汽车启动后,气缸内温度越高,单位时间内NO 排放量越大,可能的原因是 。
② 可用 NH 催化还原NO 消除污染,写出该反应的化学方程式 。
③CO还原NO的反应机理及相对能量如下图(TS 表示过渡态):
反应过程中速率最慢步骤的热化学方程式为 。
(2)已知热化学方程式:
I.SO2(g)+l (g)+2H O(g)= 2HI(g)+H SO (1) △H1= xkJ·mol-1
Ⅱ.2H SO (I)=2H O(g)+2SO (g)+O (g) △H = ykJ·mol-1
Ⅲ.H (g)+l (g)=2HI(g) △H = zkJ·mol-1
则:2H O(g)= 2H (g)+O (g) △H= kJ·mol-1。
(3)已知部分共价键的键能与热化学方程式信息如下表:
则20(g)=O (g) 的△H 为 。
(4)氢气可通过水煤气法获得,反应为CO(g)+H O(g)CO (g)+H (g)。 一定温度下,控制进气比n(CO):n(H2O)不同,测得平衡时某反应物的转化率如右图所示。
①图中表示的是 (填“CO”或“H O”)的转化率。
② n(CO):n(H O)=0.2 时,图中对应物质的转化率为 。
16. (13分)实验室研究从炼铜烟灰(主要成分为CuO、Cu O、ZnO、PbO 及其硫酸盐)中分别回收铜、锌、铅元素的流程如图。
(1)酸浸过程中,金属元素均由氧化物转化为硫酸盐,其中生成 CuSO 的化学方程式为
CuO+H SO =CuSO +H O 、 。
(2)铁屑加入初期,置换速率随时间延长而加快,其可能原因为反应放热,温度升高; 。 铁屑完全消耗后,铜的产率随时间延长而下降,其可能原因为 。
(3)已知: PbSO4 难溶于水; PbSO +2CI-PbCl+SO42- 。一定条件下,在不同浓度的 NaCl 溶液中,温度对铅浸出率的影响、 PbCl 的溶解度曲线分别如图1、图2所示。
浸出后溶液循环浸取酸浸渣并析出PbCl 的实验结果如下表所示。
①为提高原料NaCl溶液利用率,请补充完整利用酸浸渣制备化学纯(纯度≥98.5%)PbCl 晶体的实 验方案:取一定质量的酸浸渣, ,
将所得晶体洗涤、干燥。(可选用的试剂:5mol·L-1 NaCl溶液,1 mol·L-1NaCl溶液,NaCl 固体)
② 循环一定次数后的溶液中加入适量CaCl 溶液,过滤并加水稀释至其中NaCl 浓度为1mol·L-1的目的是 。
17. (13分)将CO 转化为有机燃料是实现碳资源可持续利用的有效途径。
(1)催化加氢制甲醇。向容积为2L的恒容、绝热密闭容器中通入2molCO 和3 mol Hz, 发生如下反应: CO (g)+3H (g)CH OH(g)+H O(g) △H=-49.5k·mol-1。
① 反应在5min 时达平衡,测得此时容器内CO (g)与 CH OH(g) 的物质的量之比为3:1,则前5min 内,该反应的平均反应速率v(H )= 。
②下列可用来判断该反应已达到平衡状态的有 (填字母)。
A.v正(CO )=v逆(H O) B.容器中c(CH OH)=c(H O)
C.混合气体的密度保持不变 D.容器内的温度保持不变
③ 两分子甲醇可进一步脱水制得二甲醚:
2CH OH(g)=CH OCH (g)+H O(g) △H=-23.4kJ·mol- ,
则 2CO (g)+6H (g)=CH OCH (g)+3H O(g) 的△H= 。
(2)催化加氢制甲烷。向恒压、密闭容器中通入1mol CO 和 4mol Hz, 在催化剂作用下发生反应:
反应I:CO (g)+4H (g)=CH (g)+2H O(g) △H=-164.7kJ·mol-
反应Ⅱ:CO (g)+H (g)=CO(g)+H O(g) △H=41.2kJ·mol-
反应Ⅲ:2CO(g)+2H (g)= CO (g)+CH (g) △H=-247.1k·mol-
上述反应达平衡时,容器中CO 、CH 和 CO 的物质的量随温度的变化关系如图所示。
① 曲线A表示 的物质的量随温度的变化。
②800℃时曲线B代表物质的物质的量远大于400℃时的物质的量,其原因是 。
③ 曲线C 代表物质的物质的量随温度的升高,先逐渐增大后逐渐减小。在200~600℃间,曲线C 逐渐上升的原因是 。
18. (18分)工业上通过将CO、CO 与氢气反应,实现碳中和。
(1)已知反应2CO (g)+6H (g)==c H (g)+4H O(g) △H。根据理论计算,在恒压、起始物质的量之比n(CO ):n(H )=1;3 条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图1所示。
① 该反应的平衡常数表达式为 ,该反应的△H (填“>”或“<”)0。
② 图中曲线 b 、c分别表示的是平衡时 和 的物质的量分数变化。
( 2 ) 用CO 和H 合成CH OH 的反应为Co(g)+2H (g)CH OH(g) △H <0,按照相同的物质的量投料,测得CO 在不同温度下的平衡转化率与压强的关系如左下图2所示。
①图中 T1、T2、T 由大到小的关系为 。
②图中 b、c、d 点逆反应速率由小到大的关系为 。
③图中 b、c、d 点平衡常数的大小关系为 。
(3)合成二甲醚:
反应I:CO (g)+H (g)=co(g)+H O(g)
反应Ⅱ:2CO (g)+6H (g)=CH OCH (g)+3H O(g)
在恒压、CO 和H 的起始量一定的条件下,CO 平衡转化率和平衡时CH OCH 的选择性随温度的变化如右上图所示。其中:CH OCH 的选择性=×100%。
① 温度高于300 ℃,CO 平衡转化率随温度升高而上升的原因是 。
② 220 ℃时,若起始投入3 mol CO ,6mol H , 在催化剂作用下 CO 与 H 反应一段时间后,测得 CO 平衡转化率为40%,CH OCH 的选择性为50%(图中A 点),达到平衡时理论上共消耗H 的物质的量为 mol。不改变反应时间和温度,一定能提高CH OCH 选择性的措施有 。
③ 合成二甲醚时较适宜的温度为260 ℃,其原因是 。
同课章节目录
