河南省开封市龙亭区2024届高三上学期开学教学质量检测化学试题(含答案)
文档属性
| 名称 | 河南省开封市龙亭区2024届高三上学期开学教学质量检测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-09 16:45:53 | ||
图片预览



文档简介
开封市龙亭区2024届高三上学期开学教学质量检测
化学
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:高考范围。
5.可能用到的相对原子质量:H 1 C 12 O 16 S 32
一、选择题:本题共15小题,每小题3分,共计45分。在每小题列出的四个选项中,只有一项是符合题目要求的。
1.镓、锗是战略性物质,主要应用于光电子、通信等。下列说法错误的是( )
A.镓、锗单质均能导电 B.镓、锗均属于副族元素
C.镓、锗处于同一周期 D.镓、锗单质均能被氧化
2.常温下,下列两种物质混合于容器中,易发生氧化还原反应的是( )
A.活性炭 B.溴水 C.溶液 D.
3.实验安全至关重要。下列实验室事故处理方法正确的是( )
A.电器起火,立即用大量水扑灭
B.皮肤溅上少量浓硫酸,立即用溶液中和
C.强碱液溅进眼里,先用水冲洗,再用稀盐酸冲洗
D.金属钠着火时,立即用沙子或石棉布盖灭
4.氢化钙常用作还原剂、干燥剂和生氢剂,用作生氢剂时的反应原理为(未配平)。下列有关说法中正确的是( )
A.的电子式为 B.含有非极性键
C.中的氢元素被还原 D.每生成转移
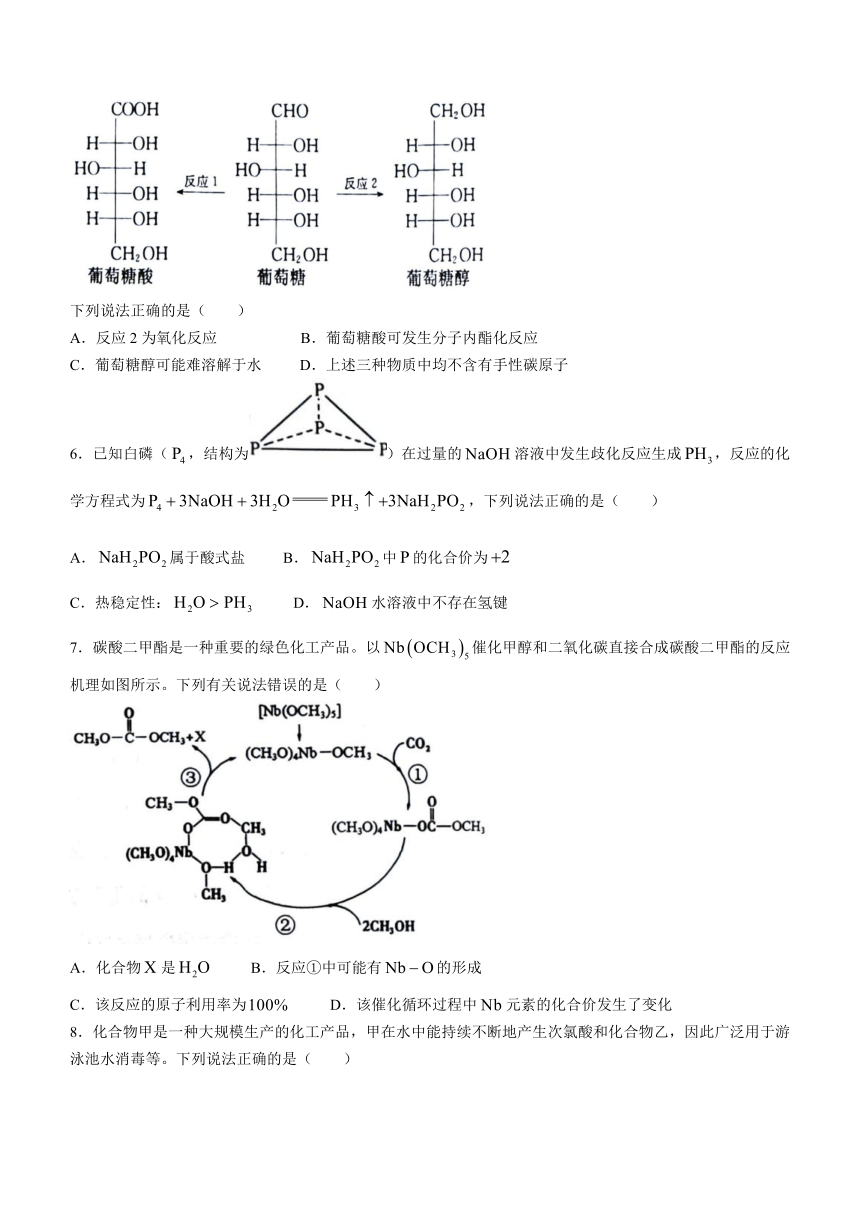
5.一定条件下,葡萄糖可转化为葡萄糖酸(反应1)或葡萄糖醇(反应2),其结构如图所示:
下列说法正确的是( )
A.反应2为氧化反应 B.葡萄糖酸可发生分子内酯化反应
C.葡萄糖醇可能难溶解于水 D.上述三种物质中均不含有手性碳原子
6.已知白磷(,结构为)在过量的溶液中发生歧化反应生成,反应的化学方程式为,下列说法正确的是( )
A.属于酸式盐 B.中的化合价为
C.热稳定性: D.水溶液中不存在氢键
7.碳酸二甲酯是一种重要的绿色化工产品。以催化甲醇和二氧化碳直接合成碳酸二甲酯的反应机理如图所示。下列有关说法错误的是( )
A.化合物是 B.反应①中可能有的形成
C.该反应的原子利用率为 D.该催化循环过程中元素的化合价发生了变化
8.化合物甲是一种大规模生产的化工产品,甲在水中能持续不断地产生次氯酸和化合物乙,因此广泛用于游泳池水消毒等。下列说法正确的是( )
A.第一电离能: B.分子的空间结构为形
C.基态原子核外未成对电子数: D.反应过程中原子的杂化方式发生了变化
9.利用重量法测定中的数值,下列实验仪器一定不需要的是( )
A.天平 B.分液漏斗 C.电加热箱 D.瓷坩埚
10.某化学兴趣小组模拟侯氏制碱法进行实验,流程如图所示:
设表示阿伏加德罗常数的值,下列说法错误的是( )
A.中含有个键 B.气体可以循环利用
C.中含有配位键 D.与水溶液中,离子种类相同
11.W、X、Y、Z为四种短周期主族元素,且原子核外层的电子数分别为0、5、6、8,四种元素的原子最外层电子数之和为16。下列说法错误的是( )
A.原子半径: B.与可分别形成分子
C.可作高温结构陶瓷的原料 D.均为酸性氧化物
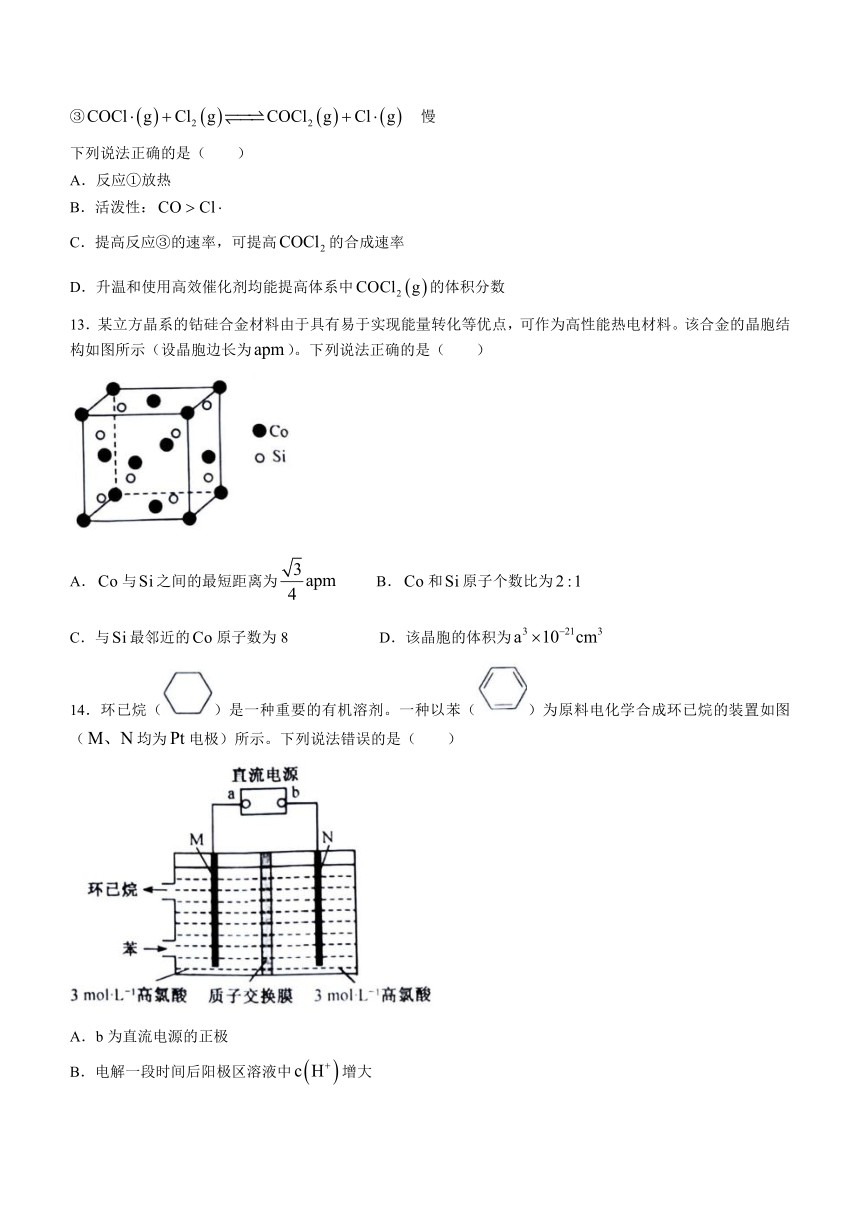
12.研究表明,与反应制备的反应历程如下:
① 快
② 快
③ 慢
下列说法正确的是( )
A.反应①放热
B.活泼性:
C.提高反应③的速率,可提高的合成速率
D.升温和使用高效催化剂均能提高体系中的体积分数
13.某立方晶系的钴硅合金材料由于具有易于实现能量转化等优点,可作为高性能热电材料。该合金的晶胞结构如图所示(设晶胞边长为)。下列说法正确的是( )
A.与之间的最短距离为 B.和原子个数比为
C.与最邻近的原子数为8 D.该晶胞的体积为
14.环已烷()是一种重要的有机溶剂。一种以苯()为原料电化学合成环已烷的装置如图(均为电极)所示。下列说法错误的是( )
A.b为直流电源的正极
B.电解一段时间后阳极区溶液中增大
C.极的电极反应式为
D.若极产生(标准状况)气体,则电路中转移电子
15.常温下,向溶液中滴加的溶液。实验过程中,溶液的与所滴加的溶液体积的关系如图所示。已知常温下,的,。下列说法正确的是( )
A.a点处溶液中:
B.b点所对应的溶液体积为
C.c点处溶液中:
D.处过程中,水的电离度先增大后减小
二、非选择题:本题共4小题,共55分。
16.(12分)无水碘化锂()广泛应用于有机合成,也是构成电池电解液的核心物质。某小组利用水合肼(是非电解质,沸点为具有强还原性)还原法制备。回答下列问题:
(1)水合肼的制备,装置(夹持和加热仪器已省略)如图所示:
①仪器的名称为________,冷凝水从________(填“a”或“b”)通入。
②写出装置中制备水合肼反应的离子方程式:________________(除了生成水合肼外,还有和生成)。
③分液漏斗滴液速率不宜过快或过多,其原因是________________.
④上述得到的水合肼粗品含有较多水,若进一步提纯水合肼,其操作为________.
(2)三水碘化锂的制备:将水合肼缓慢加入加含有和的混合液中,搅拌,反应完全后,过滤浓缩反应后的混合液,可得到三水碘化锂。制备过程中发生两个反应:,水合肼将还原为,同时生成无毒气体单质,写出与水合肼反应的化学方程式:________________.
(3)脱水制备,有如下三种方法。与方法三相比,方法一、二的缺点是________________(任写出两条)。
方法一:将三水碘化锂放在碘化氢气氛中干燥,同时在熔融盐上方通入干燥氢气吸收生成的碘;
方法二:将三水碘化锂溶于有机溶剂中,在催化还原电极和金属锂电极作用下进行电化学电解,除去有机溶剂得到无水碘化锂;
方法三:将三水碘化锂和有机溶剂按一定质量比混合均匀得到碘化锂有机溶剂混合液,将混合液进行蒸馏共沸脱水得到无水碘化锂。
17.(14分)利用稀硫酸酸化的软锰矿浆(主要成分为,另含有少量铁、铝、铜、镍等金属的化合物)眖除废气中的,同时经过以下流程制备。回答下列问题:
(1)氨水中,有________种氢键,任意表示出其中一种氢键:________________.
(2)滤渣a的主要成分为________(写化学式),证明“除铁铝”时沉淀完全:取少量滤液,滴加________(填试剂),观察到________________(填现象)。
(3)已知。在除铜镍的过程中,当沉淀完全(溶液中的离子浓度小于或等于)时,此时溶液中的浓度为________。
(4)写出用石灰乳从滤液a中回收的化学方程式:________________.
(5)写出“氧化”过程中生成的化学方程式:________________.
(6)工业上用碘-淀粉溶液测定燃煤尾气中的含量。现有浓度为的碘-淀粉溶液,当通入尾气体积为(已折算为标准状况)时,溶液蓝色消失。尾气中的体积分数为________.
18.(14分)氮的氧化物都具有不同程度的毒性,研究氮的氧化物之间的相互转化具有重要意义。回答下列问题:
(1)已知和经反应Ⅰ和反应Ⅱ转化为,其能量变化如图1所示:
图1
Ⅰ.,平衡常数;
Ⅱ.________________ ,平衡常数;
①写出第Ⅱ步反应的化学方程式:________________.
②反应的________(填“>”或“<”)0,平衡常数________(用含的代数式表示)。下列措施既能提高该反应的平衡转化率,又能加快生成的反应速率的是________(填字母)。
a.升高温度 b.缩小容器体积 c.加入催化剂
(2)由实验测得反应Ⅱ的的关系如图2所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为________(填字母)。
图2
(3)时,在刚性反应容器中投料比为的与发生反应,其中二聚为的反应可以迅速达到平衡。体系的总压强随时间的变化如表所示。
0 40 80 160 260 700 800
32.8 30.7 29.9 29.4 29.2 28.8 28.8
①时,若测得体系中的分压,则内________。
②达到平衡时的分压的转化率为________%(计算结果保留一位小数,下同)。反应的平衡常数________(为以分压表示的平衡常数)。
19.(15分)碘海醇(I)是造影剂的原料,其一种合成路线如下:
回答下列问题:
(1)A的化学名称为________.
(2)的过程中,碳原子的杂化方式由________转化为________.
(3)中含氧官能团的名称为________.
(4)C中不同化学环境的氢原子有________种,的反应类型为________.
(5)的分子式为,写出的结构简式:________.
(6)B的同分异构体中,红外光谱显示只有一种官能团的二取代芳香族化合物有________种(不含立体异构,B除外),写出其中能发生银镜反应的结构简式:________(任写一种)。
(7)以和为原料制备的合成路线如下图所示,N与足量银氨溶液反应的化学方程式为________________.
开封市龙亭区2024届高三上学期开学教学质量检测
化学参考答案、提示及评分细则
1.B 镓、锗属于金属,具有导电性,A项正确;镓、锗均属于主族元素,B项错误;镓、锗均在第4周期,C项正确;镓、锗均能与氧气反应,D项正确。
2.D A项为吸附过程,B项为萃取过程,C项发生反应为,D项发生反应为。
3.D 电器起火,不能用水扑灭,A项错误;皮肤溅上少量浓硫酸,应立即用水冲洗,再涂上稀的小苏打溶液,B项错误;强碱溅进眼里,应先用水冲洗,再用稀硼酸溶液冲洗,C项错误;金属钠着火时,立即用沙子或石棉布盖灭,可隔绝空气,D项正确。
4.C 的电子式为,A项错误;中含有离子键和极性键,B项错误;中为价,反应后为0价,被还原,C项正确;每生成转移,D项错误。
5.B 反应2为还原反应,A项错误;葡萄糖酸中含有羧基和羟基,能发生分子内的酯化反应,B项正确;葡萄糖醇易溶解于水中,C项错误;上述三种物质中均含有手性碳原子,D项错误。
6.C 因为是过量的,故属于正盐,A项错误;中的化合价为价,B项错误;非金属性:,故热稳定性:,C项正确;水溶液中存在水与水分子间的氢键,D项错误。
7.C 甲醇和二氧化碳合成目标产物碳酸二甲酯的同时,还有生成,反应的原子利用率不是,C项错误,其他选项均正确。
8.B N的第一电离能比的大,A项错误;的结构式为为杂化,空间结构为形,B项正确;基态原子核外未成对电子数:,C项错误;甲、乙中C原子杂化方式均为原子杂化方式均为,甲生成乙的过程中原子杂化方式不变,D项错误。
9.B 重量法测定中的数值,需要称量(天平)、加热(电加热箱、瓷坩埚),分液漏斗一定用不上,B项符合题意。
10.A 中含有个键,A项错误;气体为,可以循环利用,B项正确;中含有配位键,C项正确;与水溶液中,均含有,D项正确。
11.D 由题意可推出分别为,原子半径:,A项正确;H与可分别形成化合物,B项正确;与可形成,可用作高温结构陶瓷的原料,C项正确;不是酸性氧化物,D项错误。
12.C 反应①吸热,A项错误;活泼性:,B项错误;反应③是慢反应,慢反应决定总反应速率,要提高的合成速率,关键是提高反应③的速率,C项正确;催化剂不能使平衡移动,使用合适的催化剂不能改变该反应体系中的体积分数,D项错误。
13.A 与之间的最短距离为体对角线的,A项正确;根据均摊法可知,每个晶胞中,原子有4个,原子有8个,B项错误;与最邻近的原子数为4,C项错误;因是立方晶胞,且晶胞参数为,故体积为,D项错误。
14.D 由苯生成环己烷可知,极为阴极,极为阳极,则为电源的正极,A项正确;阳极电解水,生成移向极,浓度增大,增大,B项正确;极的电极反应式为,C项正确;极产生的是,产生(标准状况),转移电子,D项错误。
15.D a点处溶液呈酸性,,由电荷守恒可知,溶液中:,A项错误;b点所对应的溶液体积小于,B项错误;点处溶液中:,C项错误;过程中,水的电离度先增大后减小,D项正确。
16.(1)①三颈烧瓶;b
②
③防止将生成的水合肼氧化
④蒸馏(精馏)或萃取后再蒸馏(精馏)
(2)
(3)条件苛刻、操作复杂难控制、安全性差、耗能多、成本高等,合理即可
部分答案提示:
(1)③水合肼具有还原性,次氯酸钠具有氧化性,故滴液速率过快或过多,生成的水合肼会被氧化。
(3)分析方法一、二、三可知,方法一、二条件苛刻、操作复杂难控制、成本高等。
17.(1)4;任画一种
(2);溶液(或苯酚溶液,1分);溶液不变红(或溶液不显色,1分)
(3)
(4)
(5)
(6)
部分答案提示:
(1)氨水中,水与水、氨与氨之间、水与氨、氨与水之间均能形成氢键,共4种。
(6)在水中,与的反应为,,所以尾气中的体积分数为。
18.(1)① ②;;
(2)b
(3)①0.1 ②58.5;1.6
部分答案提示:
(1)①已知和经反应Ⅰ和反应Ⅱ转化为,已知反应Ⅰ:,可推知反应Ⅱ为。②结合图1可知,总反应为放热反应,反应Ⅰ的,反应Ⅱ的,反应Ⅰ+反应Ⅱ可得到的。升高温度,反应速率加快,平衡左移,平衡转化率减小,a项不符合题意;减小容器体积,压强增大,反应速率加快,平衡右移,平衡转化率增大,b项符合题意;加入催化剂,提高反应速率,但不能提高平衡转化率,c项不符合题意。
(2)反应Ⅱ为放热反应,升温,反应速率增大,平衡左移,量增加,故为b点。
(3)①根据题意,初始压强时,的分压,则的压强变化为,的压强变化为[根据反应],故内。
②体系存在两个平衡体系,设的转化率为
初压 8.2 24.6 0
转化
平衡
解得。
反应的平衡常数。
19.(1)1,3-二甲苯(间二甲苯)
(2);
(3)羟基、肽键(酰胺键)
(4)3;取代反应
(5)
(6)5;、、等任写一种
(7)
部分答案提示:
(5)由转化关系可知,和G发生取代反应生成,结合的分子式可以推知G的结构简式为。
(6)B的结构简式为,根据题意,其同分异构体含有苯环,且为二取代苯,因只含一种官能团,故分子中含有或,含有的同分异构体还有邻位和对位2种,含有的有邻、间、对3种,共5种。
(7)流程如下:
故N与足量银氨溶液反应的化学方程式为。
化学
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:高考范围。
5.可能用到的相对原子质量:H 1 C 12 O 16 S 32
一、选择题:本题共15小题,每小题3分,共计45分。在每小题列出的四个选项中,只有一项是符合题目要求的。
1.镓、锗是战略性物质,主要应用于光电子、通信等。下列说法错误的是( )
A.镓、锗单质均能导电 B.镓、锗均属于副族元素
C.镓、锗处于同一周期 D.镓、锗单质均能被氧化
2.常温下,下列两种物质混合于容器中,易发生氧化还原反应的是( )
A.活性炭 B.溴水 C.溶液 D.
3.实验安全至关重要。下列实验室事故处理方法正确的是( )
A.电器起火,立即用大量水扑灭
B.皮肤溅上少量浓硫酸,立即用溶液中和
C.强碱液溅进眼里,先用水冲洗,再用稀盐酸冲洗
D.金属钠着火时,立即用沙子或石棉布盖灭
4.氢化钙常用作还原剂、干燥剂和生氢剂,用作生氢剂时的反应原理为(未配平)。下列有关说法中正确的是( )
A.的电子式为 B.含有非极性键
C.中的氢元素被还原 D.每生成转移
5.一定条件下,葡萄糖可转化为葡萄糖酸(反应1)或葡萄糖醇(反应2),其结构如图所示:
下列说法正确的是( )
A.反应2为氧化反应 B.葡萄糖酸可发生分子内酯化反应
C.葡萄糖醇可能难溶解于水 D.上述三种物质中均不含有手性碳原子
6.已知白磷(,结构为)在过量的溶液中发生歧化反应生成,反应的化学方程式为,下列说法正确的是( )
A.属于酸式盐 B.中的化合价为
C.热稳定性: D.水溶液中不存在氢键
7.碳酸二甲酯是一种重要的绿色化工产品。以催化甲醇和二氧化碳直接合成碳酸二甲酯的反应机理如图所示。下列有关说法错误的是( )
A.化合物是 B.反应①中可能有的形成
C.该反应的原子利用率为 D.该催化循环过程中元素的化合价发生了变化
8.化合物甲是一种大规模生产的化工产品,甲在水中能持续不断地产生次氯酸和化合物乙,因此广泛用于游泳池水消毒等。下列说法正确的是( )
A.第一电离能: B.分子的空间结构为形
C.基态原子核外未成对电子数: D.反应过程中原子的杂化方式发生了变化
9.利用重量法测定中的数值,下列实验仪器一定不需要的是( )
A.天平 B.分液漏斗 C.电加热箱 D.瓷坩埚
10.某化学兴趣小组模拟侯氏制碱法进行实验,流程如图所示:
设表示阿伏加德罗常数的值,下列说法错误的是( )
A.中含有个键 B.气体可以循环利用
C.中含有配位键 D.与水溶液中,离子种类相同
11.W、X、Y、Z为四种短周期主族元素,且原子核外层的电子数分别为0、5、6、8,四种元素的原子最外层电子数之和为16。下列说法错误的是( )
A.原子半径: B.与可分别形成分子
C.可作高温结构陶瓷的原料 D.均为酸性氧化物
12.研究表明,与反应制备的反应历程如下:
① 快
② 快
③ 慢
下列说法正确的是( )
A.反应①放热
B.活泼性:
C.提高反应③的速率,可提高的合成速率
D.升温和使用高效催化剂均能提高体系中的体积分数
13.某立方晶系的钴硅合金材料由于具有易于实现能量转化等优点,可作为高性能热电材料。该合金的晶胞结构如图所示(设晶胞边长为)。下列说法正确的是( )
A.与之间的最短距离为 B.和原子个数比为
C.与最邻近的原子数为8 D.该晶胞的体积为
14.环已烷()是一种重要的有机溶剂。一种以苯()为原料电化学合成环已烷的装置如图(均为电极)所示。下列说法错误的是( )
A.b为直流电源的正极
B.电解一段时间后阳极区溶液中增大
C.极的电极反应式为
D.若极产生(标准状况)气体,则电路中转移电子
15.常温下,向溶液中滴加的溶液。实验过程中,溶液的与所滴加的溶液体积的关系如图所示。已知常温下,的,。下列说法正确的是( )
A.a点处溶液中:
B.b点所对应的溶液体积为
C.c点处溶液中:
D.处过程中,水的电离度先增大后减小
二、非选择题:本题共4小题,共55分。
16.(12分)无水碘化锂()广泛应用于有机合成,也是构成电池电解液的核心物质。某小组利用水合肼(是非电解质,沸点为具有强还原性)还原法制备。回答下列问题:
(1)水合肼的制备,装置(夹持和加热仪器已省略)如图所示:
①仪器的名称为________,冷凝水从________(填“a”或“b”)通入。
②写出装置中制备水合肼反应的离子方程式:________________(除了生成水合肼外,还有和生成)。
③分液漏斗滴液速率不宜过快或过多,其原因是________________.
④上述得到的水合肼粗品含有较多水,若进一步提纯水合肼,其操作为________.
(2)三水碘化锂的制备:将水合肼缓慢加入加含有和的混合液中,搅拌,反应完全后,过滤浓缩反应后的混合液,可得到三水碘化锂。制备过程中发生两个反应:,水合肼将还原为,同时生成无毒气体单质,写出与水合肼反应的化学方程式:________________.
(3)脱水制备,有如下三种方法。与方法三相比,方法一、二的缺点是________________(任写出两条)。
方法一:将三水碘化锂放在碘化氢气氛中干燥,同时在熔融盐上方通入干燥氢气吸收生成的碘;
方法二:将三水碘化锂溶于有机溶剂中,在催化还原电极和金属锂电极作用下进行电化学电解,除去有机溶剂得到无水碘化锂;
方法三:将三水碘化锂和有机溶剂按一定质量比混合均匀得到碘化锂有机溶剂混合液,将混合液进行蒸馏共沸脱水得到无水碘化锂。
17.(14分)利用稀硫酸酸化的软锰矿浆(主要成分为,另含有少量铁、铝、铜、镍等金属的化合物)眖除废气中的,同时经过以下流程制备。回答下列问题:
(1)氨水中,有________种氢键,任意表示出其中一种氢键:________________.
(2)滤渣a的主要成分为________(写化学式),证明“除铁铝”时沉淀完全:取少量滤液,滴加________(填试剂),观察到________________(填现象)。
(3)已知。在除铜镍的过程中,当沉淀完全(溶液中的离子浓度小于或等于)时,此时溶液中的浓度为________。
(4)写出用石灰乳从滤液a中回收的化学方程式:________________.
(5)写出“氧化”过程中生成的化学方程式:________________.
(6)工业上用碘-淀粉溶液测定燃煤尾气中的含量。现有浓度为的碘-淀粉溶液,当通入尾气体积为(已折算为标准状况)时,溶液蓝色消失。尾气中的体积分数为________.
18.(14分)氮的氧化物都具有不同程度的毒性,研究氮的氧化物之间的相互转化具有重要意义。回答下列问题:
(1)已知和经反应Ⅰ和反应Ⅱ转化为,其能量变化如图1所示:
图1
Ⅰ.,平衡常数;
Ⅱ.________________ ,平衡常数;
①写出第Ⅱ步反应的化学方程式:________________.
②反应的________(填“>”或“<”)0,平衡常数________(用含的代数式表示)。下列措施既能提高该反应的平衡转化率,又能加快生成的反应速率的是________(填字母)。
a.升高温度 b.缩小容器体积 c.加入催化剂
(2)由实验测得反应Ⅱ的的关系如图2所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为________(填字母)。
图2
(3)时,在刚性反应容器中投料比为的与发生反应,其中二聚为的反应可以迅速达到平衡。体系的总压强随时间的变化如表所示。
0 40 80 160 260 700 800
32.8 30.7 29.9 29.4 29.2 28.8 28.8
①时,若测得体系中的分压,则内________。
②达到平衡时的分压的转化率为________%(计算结果保留一位小数,下同)。反应的平衡常数________(为以分压表示的平衡常数)。
19.(15分)碘海醇(I)是造影剂的原料,其一种合成路线如下:
回答下列问题:
(1)A的化学名称为________.
(2)的过程中,碳原子的杂化方式由________转化为________.
(3)中含氧官能团的名称为________.
(4)C中不同化学环境的氢原子有________种,的反应类型为________.
(5)的分子式为,写出的结构简式:________.
(6)B的同分异构体中,红外光谱显示只有一种官能团的二取代芳香族化合物有________种(不含立体异构,B除外),写出其中能发生银镜反应的结构简式:________(任写一种)。
(7)以和为原料制备的合成路线如下图所示,N与足量银氨溶液反应的化学方程式为________________.
开封市龙亭区2024届高三上学期开学教学质量检测
化学参考答案、提示及评分细则
1.B 镓、锗属于金属,具有导电性,A项正确;镓、锗均属于主族元素,B项错误;镓、锗均在第4周期,C项正确;镓、锗均能与氧气反应,D项正确。
2.D A项为吸附过程,B项为萃取过程,C项发生反应为,D项发生反应为。
3.D 电器起火,不能用水扑灭,A项错误;皮肤溅上少量浓硫酸,应立即用水冲洗,再涂上稀的小苏打溶液,B项错误;强碱溅进眼里,应先用水冲洗,再用稀硼酸溶液冲洗,C项错误;金属钠着火时,立即用沙子或石棉布盖灭,可隔绝空气,D项正确。
4.C 的电子式为,A项错误;中含有离子键和极性键,B项错误;中为价,反应后为0价,被还原,C项正确;每生成转移,D项错误。
5.B 反应2为还原反应,A项错误;葡萄糖酸中含有羧基和羟基,能发生分子内的酯化反应,B项正确;葡萄糖醇易溶解于水中,C项错误;上述三种物质中均含有手性碳原子,D项错误。
6.C 因为是过量的,故属于正盐,A项错误;中的化合价为价,B项错误;非金属性:,故热稳定性:,C项正确;水溶液中存在水与水分子间的氢键,D项错误。
7.C 甲醇和二氧化碳合成目标产物碳酸二甲酯的同时,还有生成,反应的原子利用率不是,C项错误,其他选项均正确。
8.B N的第一电离能比的大,A项错误;的结构式为为杂化,空间结构为形,B项正确;基态原子核外未成对电子数:,C项错误;甲、乙中C原子杂化方式均为原子杂化方式均为,甲生成乙的过程中原子杂化方式不变,D项错误。
9.B 重量法测定中的数值,需要称量(天平)、加热(电加热箱、瓷坩埚),分液漏斗一定用不上,B项符合题意。
10.A 中含有个键,A项错误;气体为,可以循环利用,B项正确;中含有配位键,C项正确;与水溶液中,均含有,D项正确。
11.D 由题意可推出分别为,原子半径:,A项正确;H与可分别形成化合物,B项正确;与可形成,可用作高温结构陶瓷的原料,C项正确;不是酸性氧化物,D项错误。
12.C 反应①吸热,A项错误;活泼性:,B项错误;反应③是慢反应,慢反应决定总反应速率,要提高的合成速率,关键是提高反应③的速率,C项正确;催化剂不能使平衡移动,使用合适的催化剂不能改变该反应体系中的体积分数,D项错误。
13.A 与之间的最短距离为体对角线的,A项正确;根据均摊法可知,每个晶胞中,原子有4个,原子有8个,B项错误;与最邻近的原子数为4,C项错误;因是立方晶胞,且晶胞参数为,故体积为,D项错误。
14.D 由苯生成环己烷可知,极为阴极,极为阳极,则为电源的正极,A项正确;阳极电解水,生成移向极,浓度增大,增大,B项正确;极的电极反应式为,C项正确;极产生的是,产生(标准状况),转移电子,D项错误。
15.D a点处溶液呈酸性,,由电荷守恒可知,溶液中:,A项错误;b点所对应的溶液体积小于,B项错误;点处溶液中:,C项错误;过程中,水的电离度先增大后减小,D项正确。
16.(1)①三颈烧瓶;b
②
③防止将生成的水合肼氧化
④蒸馏(精馏)或萃取后再蒸馏(精馏)
(2)
(3)条件苛刻、操作复杂难控制、安全性差、耗能多、成本高等,合理即可
部分答案提示:
(1)③水合肼具有还原性,次氯酸钠具有氧化性,故滴液速率过快或过多,生成的水合肼会被氧化。
(3)分析方法一、二、三可知,方法一、二条件苛刻、操作复杂难控制、成本高等。
17.(1)4;任画一种
(2);溶液(或苯酚溶液,1分);溶液不变红(或溶液不显色,1分)
(3)
(4)
(5)
(6)
部分答案提示:
(1)氨水中,水与水、氨与氨之间、水与氨、氨与水之间均能形成氢键,共4种。
(6)在水中,与的反应为,,所以尾气中的体积分数为。
18.(1)① ②;;
(2)b
(3)①0.1 ②58.5;1.6
部分答案提示:
(1)①已知和经反应Ⅰ和反应Ⅱ转化为,已知反应Ⅰ:,可推知反应Ⅱ为。②结合图1可知,总反应为放热反应,反应Ⅰ的,反应Ⅱ的,反应Ⅰ+反应Ⅱ可得到的。升高温度,反应速率加快,平衡左移,平衡转化率减小,a项不符合题意;减小容器体积,压强增大,反应速率加快,平衡右移,平衡转化率增大,b项符合题意;加入催化剂,提高反应速率,但不能提高平衡转化率,c项不符合题意。
(2)反应Ⅱ为放热反应,升温,反应速率增大,平衡左移,量增加,故为b点。
(3)①根据题意,初始压强时,的分压,则的压强变化为,的压强变化为[根据反应],故内。
②体系存在两个平衡体系,设的转化率为
初压 8.2 24.6 0
转化
平衡
解得。
反应的平衡常数。
19.(1)1,3-二甲苯(间二甲苯)
(2);
(3)羟基、肽键(酰胺键)
(4)3;取代反应
(5)
(6)5;、、等任写一种
(7)
部分答案提示:
(5)由转化关系可知,和G发生取代反应生成,结合的分子式可以推知G的结构简式为。
(6)B的结构简式为,根据题意,其同分异构体含有苯环,且为二取代苯,因只含一种官能团,故分子中含有或,含有的同分异构体还有邻位和对位2种,含有的有邻、间、对3种,共5种。
(7)流程如下:
故N与足量银氨溶液反应的化学方程式为。
同课章节目录
