2023年秋高中化学选择性必修2(苏教版2019)分层作业7 元素第一电离能的周期性变化 元素电负性的周期性变化(含解析)
文档属性
| 名称 | 2023年秋高中化学选择性必修2(苏教版2019)分层作业7 元素第一电离能的周期性变化 元素电负性的周期性变化(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 121.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-09 17:48:42 | ||
图片预览




文档简介
分层作业7 元素第一电离能的周期性变化 元素电负性的周期性变化
A级 必备知识基础练
1.下列电子排布式所表示的原子中,第二电离能与第一电离能差值最大的是( )
A.[Ne]3s1 B.1s22s22p2
C.[Ne]3s23p5 D.1s22s22p63s23p3
2.[2023河北唐山开滦第一中学期末]下列有关微粒性质的排列顺序中,错误的是( )
A.元素的电负性:PB.元素的第一电离能:CC.离子半径:O2->Na+>Mg2+
D.原子的未成对电子数:Mn>Si>Cl
3.下列关于元素的第一电离能的说法不正确的是( )
A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活动性强于钠
B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大
C.最外层电子排布式为ns2np6(若只有K层时为1s2)的原子,第一电离能较大
D.对同一元素(原子核外有3个以上电子)而言,电离能:I14.13Al、15P、16S、17Cl是周期表中的短周期主族元素。下列有关说法正确的是( )
A.元素Al在周期表中位于第4周期ⅢA族
B.元素P的简单气态氢化物的化学式为PH4
C.第一电离能:I1(Al)D.最高价氧化物对应水化物的酸性:H3PO45.[2023河北邢台一中月考]下列有关元素周期表的说法正确的是( )
A.按照核外电子排布,可把元素周期表划分为s、p、d、f四个区
B.元素周期表中,氟元素的电负性最大,第一电离能也最大
C.元素周期表的各个周期总是从ns能级开始,以np能级结束
D.元素周期表中,从ⅢB族到ⅡB族的10个纵列的元素全部是金属元素
6.下列表示卤族元素某种性质随核电荷数的变化趋势曲线中正确的是( )
7.一般来说,同周期内不同元素的第一电离能I1随着原子序数的增大而增大,但个别元素的I1出现反常现象。下列关系正确的是( )
A.I1(氮)>I1(氧) B.I1(氟)C.I1(镁)I1(镁)
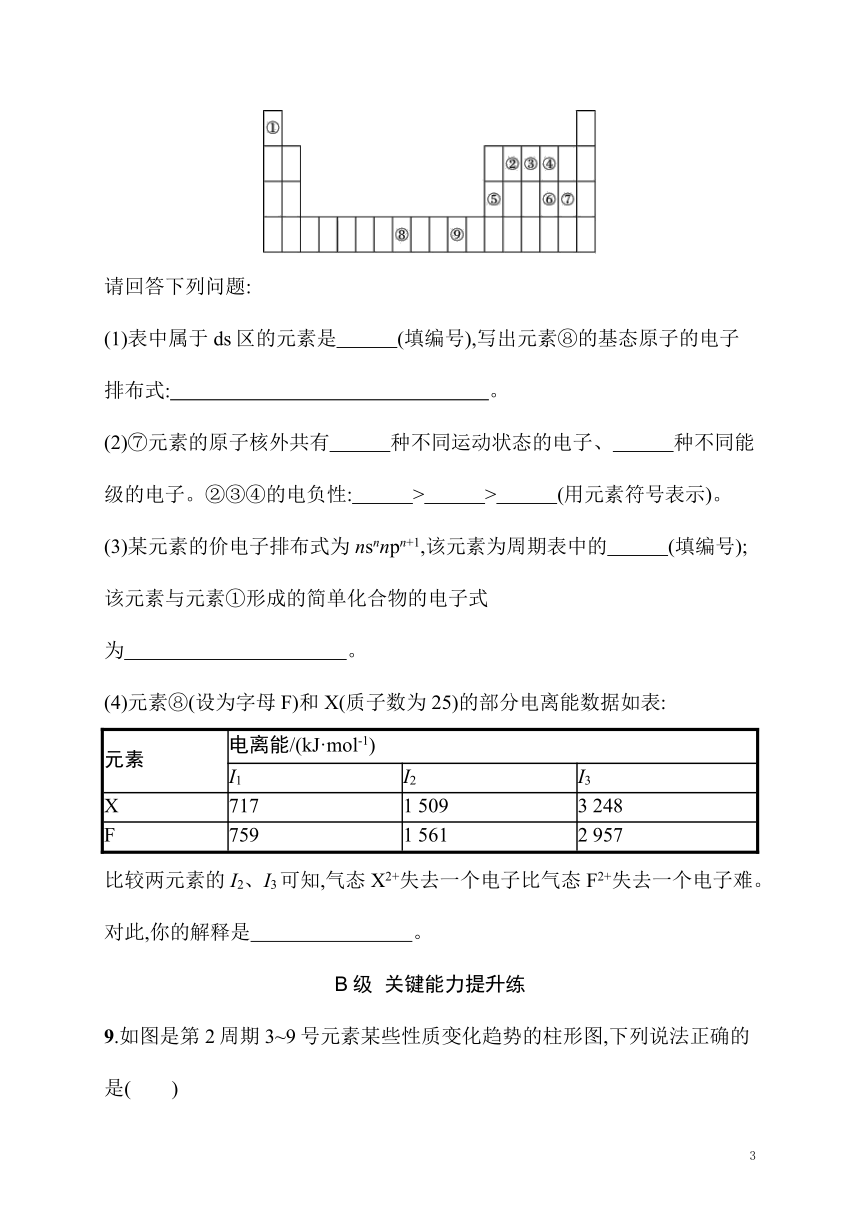
8.下表为周期表的一部分,其中的编号代表不同的元素。
请回答下列问题:
(1)表中属于ds区的元素是 (填编号),写出元素⑧的基态原子的电子排布式: 。
(2)⑦元素的原子核外共有 种不同运动状态的电子、 种不同能级的电子。②③④的电负性: > > (用元素符号表示)。
(3)某元素的价电子排布式为nsnnpn+1,该元素为周期表中的 (填编号);该元素与元素①形成的简单化合物的电子式为 。
(4)元素⑧(设为字母F)和X(质子数为25)的部分电离能数据如表:
元素 电离能/(kJ·mol-1)
I1 I2 I3
X 717 1 509 3 248
F 759 1 561 2 957
比较两元素的I2、I3可知,气态X2+失去一个电子比气态F2+失去一个电子难。对此,你的解释是 。
B级 关键能力提升练
9.如图是第2周期3~9号元素某些性质变化趋势的柱形图,下列说法正确的是( )
A.y轴表示的可能是第一电离能
B.y轴表示的可能是电负性
C.y轴表示的可能是原子半径
D.y轴表示的可能是元素的最高正价
10.a~e为短周期元素,其原子序数与其某种化合价的关系如图所示。下列说法正确的是( )
A.气态氢化物的还原性:a>d
B.c与e形成的化合物为离子化合物
C.第一电离能:b>c
D.d和e都不存在同素异形体
11.如图为元素周期表中短周期的一部分,下列说法不正确的是( )
A.离子半径:M->Z2->Y-
B.电负性:Y>M>Z
C.气态氢化物的稳定性:Y>M>Z
D.Y元素基态原子的简化电子排布式:[X]2s22p5
12.A、B、C、D、E为原子序数依次增大的短周期元素,化合物BA3与ABC3相遇会产生白烟,D为短周期金属性最强的元素,且元素原子的核外电子总数满足A+E=B+D。下列叙述正确的是( )
A.非金属性:B>C>E>A>D
B.原子半径:D>E>B>C>A
C.第一电离能:DD.元素E的含氧酸均为强酸
13.[2023河北衡水第十三中学质检]已知短周期主族元素X、Y、Z、W的原子序数依次增大,X元素原子s轨道上的电子数是p轨道上电子数的2倍,Y元素原子s轨道上的电子数与p轨道上电子数之比为5∶6,Z元素的单质在氧气中燃烧产生大量白烟,W元素原子中成对电子数与未成对电子数之比为16∶1。请回答下列问题:
(1)基态X原子的电子排布式为 ;Y元素位于元素周期表中的 区;基态W原子外围电子轨道表示式为 。
(2)四种元素中电负性最小的元素为 (填元素符号)。
(3)Z元素原子的轨道数为 ,核外电子的运动状态有 种,电子占据的最高能量的电子层符号为 。
(4)X、Z、W三元素的简单气态氢化物稳定性最强的是 (填化学式,下同),最高价氧化物对应水化物的酸性由弱到强的顺序是 。
C级 学科素养拔高练
14.钡餐是一种造影剂,用于在X射线照射下显示消化道有无病变。钡餐造影是用口服的途径摄入造影剂,可对整个消化道,尤其是上消化道进行更清晰的放射性检查。用于消化道检查的钡餐是药用硫酸钡,因为它不溶于水和脂质,不会被胃肠道黏膜吸收,因此对人基本无毒性。其中钡元素与钙元素、锶元素是同主族元素,与铯元素同周期。
(1)钡元素在周期表中的位置处于第 周期 族。该元素的外围电子排布式为 。
(2)钡元素的各级电离能(kJ·mol-1)数值如下:
I1 502.8
I2 965.1
I3 3 600
I4 4 700
①由钡元素的各级电离能判断该元素常见的化合价为 价,这是由于 。
②试比较下列元素的第一电离能大小:I1(钡) I1(锶),I1(钡) I1(铯)。
(3)比较下列微粒的半径大小:
r(钡) r(锶),r(钡) r(铯),
r(Ba2+) r(Sr2+),r(Ba2+) r(Cs+)。
(4)钡元素与氯元素的电负性数值如下:
①由电负性数值可以判断钡元素属于 (填“金属”或“非金属”)元素。
②BaCl2中的化学键为 键。
答案:
1.A 解析 A项,[Ne]3s1失去3s1上的一个电子后,变为全充满的相对稳定结构,第二电离能与第一电离能差值较大;B项,1s22s22p2第一电离能与第二电离能均为失去2p能级电子需要的能量,相差不大;C项,[Ne]3s23p5第一电离能与第二电离能均为失去3p能级电子需要的能量,相差不大;D项,1s22s22p63s23p3第一电离能与第二电离能均为失去3p能级电子需要的能量,相差不大。
2.B 解析 同一周期,主族元素的电负性从左到右依次增大;同一主族,元素的电负性从上到下呈现减小的趋势,所以元素的电负性:PNa+>Mg2+,故C正确;Mn、Si、Cl原子的未成对电子数分别为5、2、1,即原子的未成对电子数:Mn>Si>Cl,故D正确。
3.B 解析 钾元素的第一电离能小于钠元素的第一电离能,说明钾失电子能力比钠强,所以钾的活动性强于钠,A项正确;同一周期元素原子半径随着原子序数的增大而减小,第一电离能随着原子序数的增大而呈增大趋势,ⅡA、ⅤA族元素的第一电离能大于同周期相邻元素的第一电离能,B项错误;最外层电子排布为ns2np6(若只有K层时为1s2)的原子达到稳定结构,很难失去电子,所以其第一电离能较大,C项正确;原子的逐级电离能随着原子失去电子数的增多而增大,D项正确。
4.D 解析 Al为13号元素,周期表中位于第3周期ⅢA族,故A错误;P位于ⅤA族,最低负价为-3价,所以简单气态氢化物的化学式为PH3,故B错误;P的3p能级轨道半充满,较稳定,第一电离能大于相邻元素,即I1(P)>I1(S),故C错误;非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性P5.D 解析 按照核外电子排布可将元素周期表划分为s区、p区、d区、f区、ds区,A错误;氟元素的电负性最大,氦元素的第一电离能最大,B错误;元素周期表的各个周期总是从ns能级开始,不一定以np能级结束,如第1周期从1s能级开始,以1s能级结束,C错误;元素周期表中从ⅢB族到ⅡB族10个纵列的元素都是过渡元素,过渡元素全部为金属元素,D正确。
6.A 解析 根据卤族元素的原子结构和性质,可知电负性随核电荷数的递增而减小,A项正确;F元素无正价,B项错误;同一主族元素中,随着核电荷数的增大,第一电离能减小,C项错误;同主族元素,随着核电荷数的递增,电子层数增加,原子半径增大,D项错误。
7.A 解析 N原子2p轨道处于半充满状态,较稳定,其I1会出现反常,A项正确;F和O位于同一周期,I1(氟)>I1(氧),B项错误;镁的3s轨道全充满,较稳定,I1出现反常,C项错误;镁和钙最外层ns轨道均为全充满,但钙比镁多一个电子层,钙的原子半径较大,因而I1(钙)8.答案 (1)⑨ [Ar]3d64s2(或1s22s22p63s23p63d64s2)
(2)17 5 O N C
(3)③
(4)Mn2+的3d轨道电子排布为半充满状态,较稳定,而Fe2+的3d轨道电子数为6,不是较稳定状态
解析 由元素在周期表中的位置,可以确定①②③④⑤⑥⑦⑧⑨分别为H、C、N、O、Al、S、Cl、Fe、Cu。
(1)表中属于ds区的元素是⑨,元素⑧为26号元素铁,基态原子的电子排布式为[Ar]3d64s2或1s22s22p63s23p63d64s2。
(2)⑦为17号元素氯,元素的原子核外共有17种不同运动状态的电子,电子排布式为1s22s22p63s23p5,有5种不同能级的电子。
②③④分别为C、N、O,电负性:O>N>C。判断依据是同周期元素从左往右非金属性依次增强,电负性依次增大。
(3)某元素的价电子排布式为nsnnpn+1,则n=2,该元素为氮元素,为周期表中的③;该元素与元素①形成的简单化合物为NH3,电子式为。
(4)F为Fe、X为Mn,可从Fe2+、Mn2+的价电子排布式进行分析,气态X2+失去一个电子比气态F2+失去一个电子难是因为Mn2+的3d轨道电子排布为半充满状态,较稳定,而Fe2+的3d轨道电子数为6,不是较稳定状态。
9.B 解析 第2周期Be原子2s轨道为全充满结构,N原子2p轨道为半充满结构,较为稳定,故第一电离能Be>B、N>O,A错误;同周期元素从左到右电负性逐渐增大,B正确;同周期元素从左到右原子半径逐渐减小,C错误;O、F无最高正价,D错误。
10.C 解析 根据图像可知a、b、c、d、e原子序数依次增大,根据原子序数和化合价推断a是氮元素,b是镁元素,c是铝元素,d是磷元素,e是氯元素。根据元素周期律,同主族元素从上到下非金属性逐渐减弱,气态氢化物的还原性:a11.A 解析 四种元素均为短周期元素,根据题图在周期表中的位置可知X为He元素、Y为F元素、Z为S元素、M为Cl元素。离子半径:Z2->M->Y-,A项错误;同周期元素从左到右电负性增大,同主族元素从上到下电负性呈减小趋势,则电负性:Y>M>Z,B项正确;元素的非金属性越强形成的气态氢化物越稳定,非金属性:Y>M>Z,则形成的气态氢化物的稳定性:Y>M>Z,C项正确;Y为F元素,原子序数为9,核外电子排布式为1s22s22p5,简化电子排布式为[He]2s22p5,D项正确。
12.B 解析 原子序数依次增大的短周期元素,化合物BA3与ABC3相遇会产生白烟,应该是NH3和挥发性酸反应生成铵盐,此种酸应为HNO3,由此可知:A为H元素,B为N元素,C为O元素;D为短周期金属性最强的元素,则D为Na元素;元素原子的核外电子总数满足A+E=B+D=7+11=18,E的原子核外电子总数为17,则E为Cl元素。同周期元素从左向右非金属性逐渐增强,可知O元素非金属性强于N元素,由氯和氧形成的化合物中氧元素显负价,可知O元素非金属性强于Cl,再结合HClO4的酸性强于HNO3,且Na为金属元素,可知非金属性:O>Cl>N>H>Na,A错误;同周期主族元素从左向右原子半径依次减小,同主族元素自上而下原子半径依次增大,原子半径:Na>Cl>N>O>H,B正确;N原子2p轨道是半充满结构,第一电离能比O大,而Na为活泼金属,第一电离能较小,则第一电离能:Na13.答案 (1)1s22s22p2 s
(2)Na
(3)9 15 M
(4)HCl H2CO3解析 X元素原子s轨道上的电子数是p轨道上电子数的2倍,则该元素为第2周期元素,原子2p轨道上有2个电子,X为C元素,Y元素原子s轨道上的电子数与p轨道上电子数之比为5∶6,则Y原子的核外电子排布式为1s22s22p63s1,Y为Na元素;Z元素的单质在氧气中燃烧产生大量白烟,则Z为P元素;W元素原子中成对电子数与未成对电子数之比为16∶1,则基态W原子的核外电子排布式为1s22s22p63s23p5,W为Cl元素。
(1)X为C元素,基态C原子的电子排布式为1s22s22p2;Y元素为Na,原子序数为11,位于第3周期ⅠA族;W为Cl元素,其外围电子轨道表示式为。
(2)根据元素周期律,同周期主族元素从左到右,电负性依次增强,同主族元素从上到下呈减弱趋势,所以四种元素中,电负性最小的是Na。
(3)Z元素为P,原子序数为15,基态原子电子排布式为1s22s22p63s23p3,其轨道数为9,每个电子的运动状态均不相同,共15个电子就有15种运动状态,电子占据的最高能量的电子层为第3电子层,符号为M。
(4)简单气态氢化物的稳定性与非金属性有关,根据元素周期律,同周期元素从左到右非金属性依次增强,同主族元素从上到下非金属性依次减弱,三种元素非金属性最强的是Cl,简单气态氢化物稳定性最强的是HCl,最高价氧化物对应水化物的酸性由弱到强的顺序是H2CO314.答案 (1)6 ⅡA 6s2
(2)①+2 核外电子分层排布 ②< >
(3)> < > <
(4)①金属 ②离子
解析 (1)根据题干中的描述,可知钡元素在周期表中的位置位于第6周期ⅡA族。由该元素在元素周期表中的位置可以判断,其外围电子排布式为6s2。
(2)①由钡元素的第二级电离能和第三级电离能出现突跃,可判断该元素常见的化合价为+2价,这是由核外电子分层排布决定的。
②同一主族的元素,从上到下第一电离能逐渐减小,同一周期的元素,从左到右第一电离能呈增大趋势,因此I1(钡)I1(铯)。
(3)同一主族的元素,从上到下原子半径逐渐增大,同一周期的元素,从左到右原子半径逐渐减小,因此,r(钡)>r(锶),r(钡)(4)由于Ba的电负性数值小于1.8,因此该元素为金属元素,钡元素与氯元素的电负性差值大于1.7,因此两者形成离子键。
8
A级 必备知识基础练
1.下列电子排布式所表示的原子中,第二电离能与第一电离能差值最大的是( )
A.[Ne]3s1 B.1s22s22p2
C.[Ne]3s23p5 D.1s22s22p63s23p3
2.[2023河北唐山开滦第一中学期末]下列有关微粒性质的排列顺序中,错误的是( )
A.元素的电负性:P
D.原子的未成对电子数:Mn>Si>Cl
3.下列关于元素的第一电离能的说法不正确的是( )
A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活动性强于钠
B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大
C.最外层电子排布式为ns2np6(若只有K层时为1s2)的原子,第一电离能较大
D.对同一元素(原子核外有3个以上电子)而言,电离能:I1
A.元素Al在周期表中位于第4周期ⅢA族
B.元素P的简单气态氢化物的化学式为PH4
C.第一电离能:I1(Al)
A.按照核外电子排布,可把元素周期表划分为s、p、d、f四个区
B.元素周期表中,氟元素的电负性最大,第一电离能也最大
C.元素周期表的各个周期总是从ns能级开始,以np能级结束
D.元素周期表中,从ⅢB族到ⅡB族的10个纵列的元素全部是金属元素
6.下列表示卤族元素某种性质随核电荷数的变化趋势曲线中正确的是( )
7.一般来说,同周期内不同元素的第一电离能I1随着原子序数的增大而增大,但个别元素的I1出现反常现象。下列关系正确的是( )
A.I1(氮)>I1(氧) B.I1(氟)
8.下表为周期表的一部分,其中的编号代表不同的元素。
请回答下列问题:
(1)表中属于ds区的元素是 (填编号),写出元素⑧的基态原子的电子排布式: 。
(2)⑦元素的原子核外共有 种不同运动状态的电子、 种不同能级的电子。②③④的电负性: > > (用元素符号表示)。
(3)某元素的价电子排布式为nsnnpn+1,该元素为周期表中的 (填编号);该元素与元素①形成的简单化合物的电子式为 。
(4)元素⑧(设为字母F)和X(质子数为25)的部分电离能数据如表:
元素 电离能/(kJ·mol-1)
I1 I2 I3
X 717 1 509 3 248
F 759 1 561 2 957
比较两元素的I2、I3可知,气态X2+失去一个电子比气态F2+失去一个电子难。对此,你的解释是 。
B级 关键能力提升练
9.如图是第2周期3~9号元素某些性质变化趋势的柱形图,下列说法正确的是( )
A.y轴表示的可能是第一电离能
B.y轴表示的可能是电负性
C.y轴表示的可能是原子半径
D.y轴表示的可能是元素的最高正价
10.a~e为短周期元素,其原子序数与其某种化合价的关系如图所示。下列说法正确的是( )
A.气态氢化物的还原性:a>d
B.c与e形成的化合物为离子化合物
C.第一电离能:b>c
D.d和e都不存在同素异形体
11.如图为元素周期表中短周期的一部分,下列说法不正确的是( )
A.离子半径:M->Z2->Y-
B.电负性:Y>M>Z
C.气态氢化物的稳定性:Y>M>Z
D.Y元素基态原子的简化电子排布式:[X]2s22p5
12.A、B、C、D、E为原子序数依次增大的短周期元素,化合物BA3与ABC3相遇会产生白烟,D为短周期金属性最强的元素,且元素原子的核外电子总数满足A+E=B+D。下列叙述正确的是( )
A.非金属性:B>C>E>A>D
B.原子半径:D>E>B>C>A
C.第一电离能:D
13.[2023河北衡水第十三中学质检]已知短周期主族元素X、Y、Z、W的原子序数依次增大,X元素原子s轨道上的电子数是p轨道上电子数的2倍,Y元素原子s轨道上的电子数与p轨道上电子数之比为5∶6,Z元素的单质在氧气中燃烧产生大量白烟,W元素原子中成对电子数与未成对电子数之比为16∶1。请回答下列问题:
(1)基态X原子的电子排布式为 ;Y元素位于元素周期表中的 区;基态W原子外围电子轨道表示式为 。
(2)四种元素中电负性最小的元素为 (填元素符号)。
(3)Z元素原子的轨道数为 ,核外电子的运动状态有 种,电子占据的最高能量的电子层符号为 。
(4)X、Z、W三元素的简单气态氢化物稳定性最强的是 (填化学式,下同),最高价氧化物对应水化物的酸性由弱到强的顺序是 。
C级 学科素养拔高练
14.钡餐是一种造影剂,用于在X射线照射下显示消化道有无病变。钡餐造影是用口服的途径摄入造影剂,可对整个消化道,尤其是上消化道进行更清晰的放射性检查。用于消化道检查的钡餐是药用硫酸钡,因为它不溶于水和脂质,不会被胃肠道黏膜吸收,因此对人基本无毒性。其中钡元素与钙元素、锶元素是同主族元素,与铯元素同周期。
(1)钡元素在周期表中的位置处于第 周期 族。该元素的外围电子排布式为 。
(2)钡元素的各级电离能(kJ·mol-1)数值如下:
I1 502.8
I2 965.1
I3 3 600
I4 4 700
①由钡元素的各级电离能判断该元素常见的化合价为 价,这是由于 。
②试比较下列元素的第一电离能大小:I1(钡) I1(锶),I1(钡) I1(铯)。
(3)比较下列微粒的半径大小:
r(钡) r(锶),r(钡) r(铯),
r(Ba2+) r(Sr2+),r(Ba2+) r(Cs+)。
(4)钡元素与氯元素的电负性数值如下:
①由电负性数值可以判断钡元素属于 (填“金属”或“非金属”)元素。
②BaCl2中的化学键为 键。
答案:
1.A 解析 A项,[Ne]3s1失去3s1上的一个电子后,变为全充满的相对稳定结构,第二电离能与第一电离能差值较大;B项,1s22s22p2第一电离能与第二电离能均为失去2p能级电子需要的能量,相差不大;C项,[Ne]3s23p5第一电离能与第二电离能均为失去3p能级电子需要的能量,相差不大;D项,1s22s22p63s23p3第一电离能与第二电离能均为失去3p能级电子需要的能量,相差不大。
2.B 解析 同一周期,主族元素的电负性从左到右依次增大;同一主族,元素的电负性从上到下呈现减小的趋势,所以元素的电负性:P
3.B 解析 钾元素的第一电离能小于钠元素的第一电离能,说明钾失电子能力比钠强,所以钾的活动性强于钠,A项正确;同一周期元素原子半径随着原子序数的增大而减小,第一电离能随着原子序数的增大而呈增大趋势,ⅡA、ⅤA族元素的第一电离能大于同周期相邻元素的第一电离能,B项错误;最外层电子排布为ns2np6(若只有K层时为1s2)的原子达到稳定结构,很难失去电子,所以其第一电离能较大,C项正确;原子的逐级电离能随着原子失去电子数的增多而增大,D项正确。
4.D 解析 Al为13号元素,周期表中位于第3周期ⅢA族,故A错误;P位于ⅤA族,最低负价为-3价,所以简单气态氢化物的化学式为PH3,故B错误;P的3p能级轨道半充满,较稳定,第一电离能大于相邻元素,即I1(P)>I1(S),故C错误;非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性P
6.A 解析 根据卤族元素的原子结构和性质,可知电负性随核电荷数的递增而减小,A项正确;F元素无正价,B项错误;同一主族元素中,随着核电荷数的增大,第一电离能减小,C项错误;同主族元素,随着核电荷数的递增,电子层数增加,原子半径增大,D项错误。
7.A 解析 N原子2p轨道处于半充满状态,较稳定,其I1会出现反常,A项正确;F和O位于同一周期,I1(氟)>I1(氧),B项错误;镁的3s轨道全充满,较稳定,I1出现反常,C项错误;镁和钙最外层ns轨道均为全充满,但钙比镁多一个电子层,钙的原子半径较大,因而I1(钙)
(2)17 5 O N C
(3)③
(4)Mn2+的3d轨道电子排布为半充满状态,较稳定,而Fe2+的3d轨道电子数为6,不是较稳定状态
解析 由元素在周期表中的位置,可以确定①②③④⑤⑥⑦⑧⑨分别为H、C、N、O、Al、S、Cl、Fe、Cu。
(1)表中属于ds区的元素是⑨,元素⑧为26号元素铁,基态原子的电子排布式为[Ar]3d64s2或1s22s22p63s23p63d64s2。
(2)⑦为17号元素氯,元素的原子核外共有17种不同运动状态的电子,电子排布式为1s22s22p63s23p5,有5种不同能级的电子。
②③④分别为C、N、O,电负性:O>N>C。判断依据是同周期元素从左往右非金属性依次增强,电负性依次增大。
(3)某元素的价电子排布式为nsnnpn+1,则n=2,该元素为氮元素,为周期表中的③;该元素与元素①形成的简单化合物为NH3,电子式为。
(4)F为Fe、X为Mn,可从Fe2+、Mn2+的价电子排布式进行分析,气态X2+失去一个电子比气态F2+失去一个电子难是因为Mn2+的3d轨道电子排布为半充满状态,较稳定,而Fe2+的3d轨道电子数为6,不是较稳定状态。
9.B 解析 第2周期Be原子2s轨道为全充满结构,N原子2p轨道为半充满结构,较为稳定,故第一电离能Be>B、N>O,A错误;同周期元素从左到右电负性逐渐增大,B正确;同周期元素从左到右原子半径逐渐减小,C错误;O、F无最高正价,D错误。
10.C 解析 根据图像可知a、b、c、d、e原子序数依次增大,根据原子序数和化合价推断a是氮元素,b是镁元素,c是铝元素,d是磷元素,e是氯元素。根据元素周期律,同主族元素从上到下非金属性逐渐减弱,气态氢化物的还原性:a
12.B 解析 原子序数依次增大的短周期元素,化合物BA3与ABC3相遇会产生白烟,应该是NH3和挥发性酸反应生成铵盐,此种酸应为HNO3,由此可知:A为H元素,B为N元素,C为O元素;D为短周期金属性最强的元素,则D为Na元素;元素原子的核外电子总数满足A+E=B+D=7+11=18,E的原子核外电子总数为17,则E为Cl元素。同周期元素从左向右非金属性逐渐增强,可知O元素非金属性强于N元素,由氯和氧形成的化合物中氧元素显负价,可知O元素非金属性强于Cl,再结合HClO4的酸性强于HNO3,且Na为金属元素,可知非金属性:O>Cl>N>H>Na,A错误;同周期主族元素从左向右原子半径依次减小,同主族元素自上而下原子半径依次增大,原子半径:Na>Cl>N>O>H,B正确;N原子2p轨道是半充满结构,第一电离能比O大,而Na为活泼金属,第一电离能较小,则第一电离能:Na
(2)Na
(3)9 15 M
(4)HCl H2CO3
(1)X为C元素,基态C原子的电子排布式为1s22s22p2;Y元素为Na,原子序数为11,位于第3周期ⅠA族;W为Cl元素,其外围电子轨道表示式为。
(2)根据元素周期律,同周期主族元素从左到右,电负性依次增强,同主族元素从上到下呈减弱趋势,所以四种元素中,电负性最小的是Na。
(3)Z元素为P,原子序数为15,基态原子电子排布式为1s22s22p63s23p3,其轨道数为9,每个电子的运动状态均不相同,共15个电子就有15种运动状态,电子占据的最高能量的电子层为第3电子层,符号为M。
(4)简单气态氢化物的稳定性与非金属性有关,根据元素周期律,同周期元素从左到右非金属性依次增强,同主族元素从上到下非金属性依次减弱,三种元素非金属性最强的是Cl,简单气态氢化物稳定性最强的是HCl,最高价氧化物对应水化物的酸性由弱到强的顺序是H2CO3
(2)①+2 核外电子分层排布 ②< >
(3)> < > <
(4)①金属 ②离子
解析 (1)根据题干中的描述,可知钡元素在周期表中的位置位于第6周期ⅡA族。由该元素在元素周期表中的位置可以判断,其外围电子排布式为6s2。
(2)①由钡元素的第二级电离能和第三级电离能出现突跃,可判断该元素常见的化合价为+2价,这是由核外电子分层排布决定的。
②同一主族的元素,从上到下第一电离能逐渐减小,同一周期的元素,从左到右第一电离能呈增大趋势,因此I1(钡)
(3)同一主族的元素,从上到下原子半径逐渐增大,同一周期的元素,从左到右原子半径逐渐减小,因此,r(钡)>r(锶),r(钡)
8
