化学人教版(2019)必修第一册4.1.3元素周期表(共32张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.1.3元素周期表(共32张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 58.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-09 20:35:48 | ||
图片预览






文档简介
(共32张PPT)
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第3课时 元素周期表
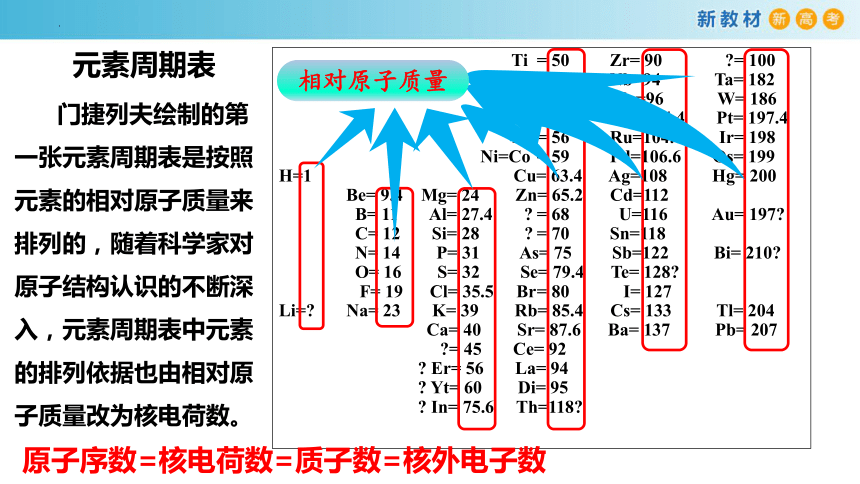
元素周期表发展史
1869年第1张元素周期表
门捷列夫与元素周期表
Ti = 50 Zr= 90 = 100
V = 51 Nb=94 Ta= 182
Cr = 52 Mo=96 W= 186
Mn= 55 Rh=104.4 Pt= 197.4
Fe = 56 Ru=104.4 Ir= 198
Ni=Co = 59 Pd=106.6 Os= 199
H=1 Cu= 63.4 Ag=108 Hg= 200
Be= 9.4 Mg= 24 Zn= 65.2 Cd=112
B= 11 Al= 27.4 = 68 U=116 Au= 197
C= 12 Si= 28 = 70 Sn=118
N= 14 P= 31 As= 75 Sb=122 Bi= 210
O= 16 S= 32 Se= 79.4 Te= 128
F= 19 Cl= 35.5 Br = 80 I= 127
Li= Na= 23 K= 39 Rb= 85.4 Cs= 133 Tl= 204
Ca= 40 Sr= 87.6 Ba= 137 Pb= 207
= 45 Ce= 92
Er= 56 La= 94
Yt= 60 Di= 95
In= 75.6 Th=118
相对原子质量
门捷列夫绘制的第一张元素周期表是按照元素的相对原子质量来排列的,随着科学家对原子结构认识的不断深入,元素周期表中元素的排列依据也由相对原子质量改为核电荷数。
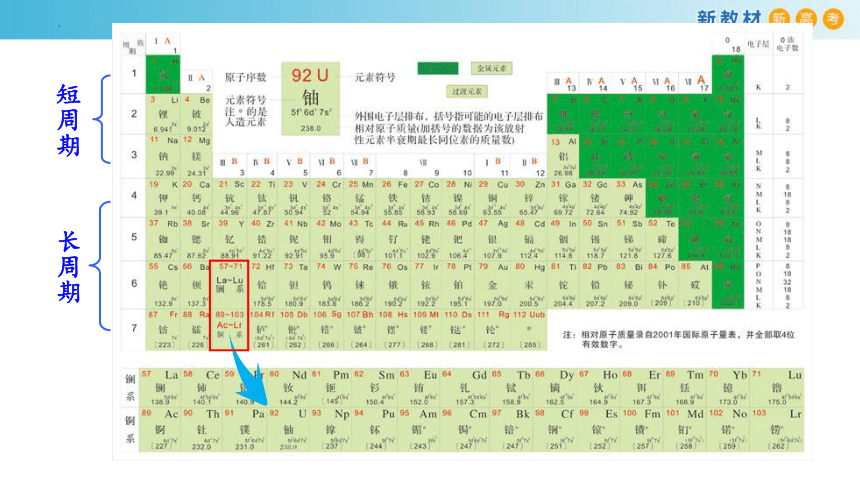
原子序数=核电荷数=质子数=核外电子数
元素周期表
目录
元素周期表的结构
01
元素的位置与原子结构的关系
02
习
学
目
标
通过了解元素周期表的结构(周期族),认识原子结构与元素周期表中位置间的关系,培养“宏观辨识与证据推理”的核心素养。
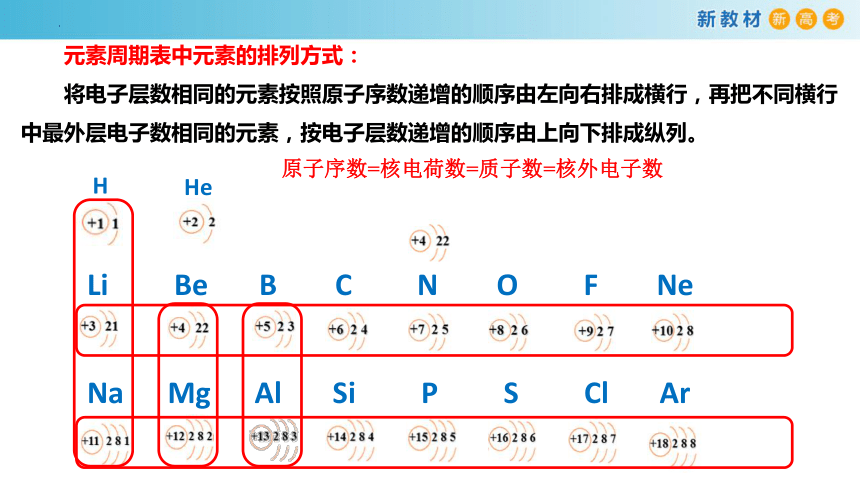
元素周期表中元素的排列方式:
将电子层数相同的元素按照原子序数递增的顺序由左向右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上向下排成纵列。
H
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
He
原子序数=核电荷数=质子数=核外电子数
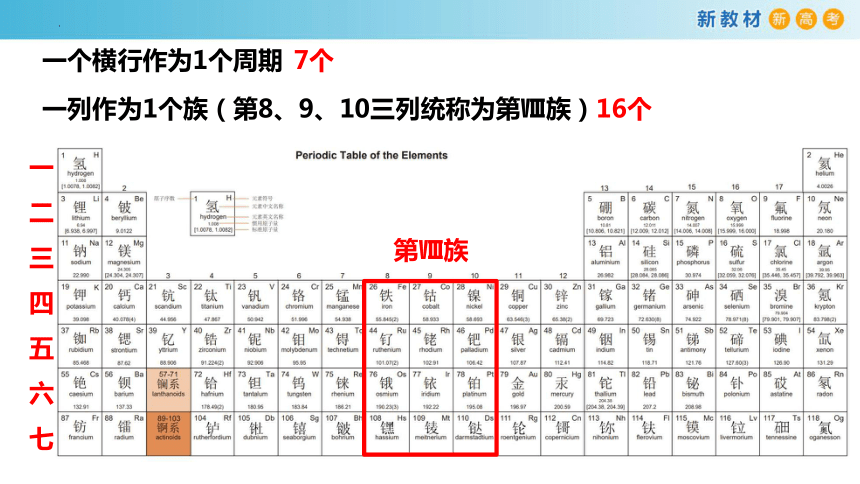
一个横行作为1个周期
7个
一
二
三
四
五
六
七
一列作为1个族(第8、9、10三列统称为第Ⅷ族)
16个
第Ⅷ族
NO.1
元素周期表的结构
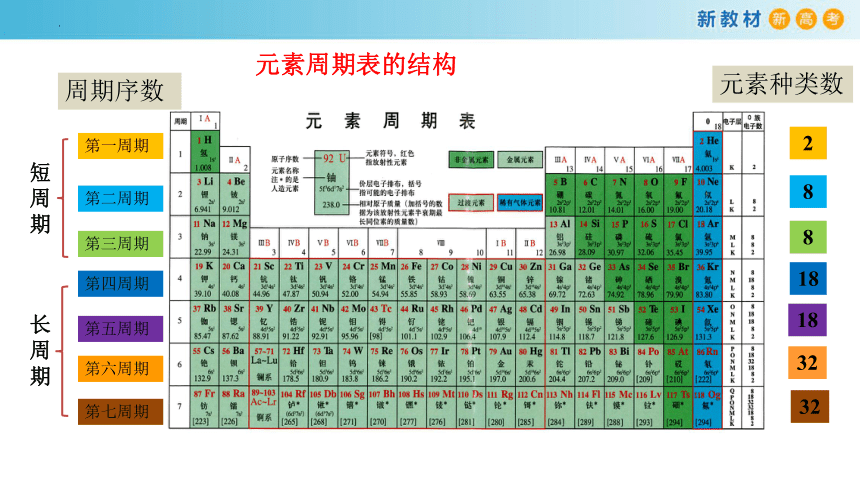
周期序数
第一周期
第二周期
第三周期
第四周期
第五周期
第六周期
第七周期
元素种类数
2
8
8
18
18
32
32
短周期
长周期
元素周期表的结构
短周期
长周期
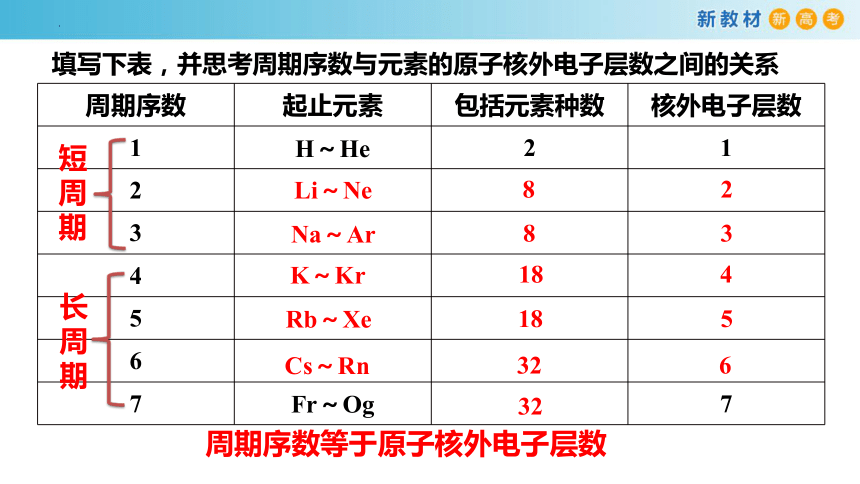
填写下表,并思考周期序数与元素的原子核外电子层数之间的关系
周期序数 起止元素 包括元素种数 核外电子层数
1 H~He 2 1
2
3
4
5
6
7 Fr~Og 7
Li~Ne
8
2
Na~Ar
8
3
K~Kr
18
4
Rb~Xe
18
5
Cs~Rn
32
6
32
周期序数等于原子核外电子层数
短周期
长周期
主族A
副族B
元素周期表的结构
主族:由长周期元素和短周期元素共同组成的族 大写罗马数字加A
ⅠA
第Ⅷ族
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
副族:完全由长周期元素组成的族 大写罗马数字加B(第Ⅷ族以外)
ⅠB
ⅡB
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
稀有气体元素化学性质不活泼,其化合价定为0,统称0族
0族
碱金属元素
卤族元素
ⅠA~
ⅡA
ⅢA~ⅦA
ⅢB~ⅦB
Ⅷ
Ⅰ B~Ⅱ B
族排列顺序
主族(7个)
副族(7个)
零族(1个)
ⅠA, ⅡA, ⅢA, ⅣA, ⅤA, ⅥA, ⅦA,ⅧA
ⅢB, ⅣB, ⅤB, ⅥB, ⅦB, ⅠB, ⅡB
稀有气体元素
族
ⅠA(除H外)----碱金属元素
ⅡA----碱土金属元素
ⅦA----卤族元素
其他族的常见名称
主族序数=最外层电子数
Ⅷ
第Ⅷ族(1个)
例1.在下面的虚线框中用实线画出元素周期表第一至第六周期的轮廓,并画出金属与非金属的分界线和第Ⅷ族的轮廓。
6个横行
6个周期
18个纵行,16个族
第Ⅷ族
金属与非金属分界线
练习:指出Si在周期表中的位置
ⅣA族
三
Si在周期表中的位置为:第三周期第ⅣA族
它们分别位于周期表的第几周期第几主族
已知碳元素、镁元素和溴元素的原子结构示意图:
碳元素:
镁元素:
溴元素:
第 2 周期 第 ⅣA 族
第 3 周期 第 ⅡA 族
第 4 周期 第 ⅦA 族
课堂练习
归纳总结
NO.2
元素的位置
与
原子结构的关系
元素的位置与原子结构的互相推断
本方法常用于确定原子序数≤20的元素。
(1)三个等式
①周期序数=电子层数
②主族序数=最外层电子数
③原子序数=核电荷数=质子数=原子的核外电子数
例:①X元素是第三周期第ⅠA族元素
则该元素原子有___个电子层,最外层电子数是___,即___为元素。
②Y元素的原子序数是16,则该元素的原子结构示意图是
其在周期表中的位置是_____________________。
3
1
钠
第三周期第ⅥA族
(2)利用“阴上阳下”推断原子序数的关系
具有相同电子层结构的离子,如aX(n+1)+、bYn+、cZ(n+1)-、dMn-的电子层结构相同,在周期表中位置关系为
…
…
bY
aX
cZ
dM
a-(n+1)=b-n=c+(n+1)=d+n
则它们的原子序数关系为a>b>d>c
(3) 根据原子序数确定元素在周期表中位置的方法——0族定位法
0族元素的周期序数和原子序数
0族元素 He Ne Ar Kr Xe Rn Og
周期序数 一 二 三 四 五 六 七
原子序数 2 10 18 36 54 86 118
①比大小定周期:
比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻近的0族元素,那么该元素就和原子序数大的0族元素处于同一周期。如64号元素,54<64<86,其应在第六周期。
②求差值定族数
a.若某元素的原子序数比相邻近的0族元素多1或2,则该元素应处在0族元素所在周期的下一个周期的第ⅠA族或第ⅡA族。如88号元素,88-86=2,则其应在第七周期第ⅡA族。
b.若某元素的原子序数比相邻近的0族元素少1~5时,则该元素应处在0族元素同周期的第ⅦA~第ⅢA族。如84号元素,86-84=2,应在第六周期第ⅥA族。
注意
(1)短周期中因无副族元素,故所得差值即为主族序数;
(2)11~17纵列数的个位数与族序数相等。
例2:下列各图为元素周期表的一部分,表中的数字为原子序数,其中M为37的是( )
35
37
38
27
【解析】已知M的原子序数为37,比稀有气体36号元素多1,则位于周期表中第五周期第ⅠA族。
A项17号、53号元素为第ⅦA族元素,则图中M为稀有气体Kr,错误;B项19号、55号元素处于第ⅠA族,则图中M应处于第ⅡA族,错误;C项20号、56号元素处于第ⅡA族,20号元素为钙元素,处于第四周期第ⅡA族,则M位于周期表中第五周期第ⅠA族,正确;D项26号、28号元素为第Ⅷ族元素,图中M处于第Ⅷ族,错误。
(1)同周期第ⅡA族和第ⅢA族元素原子序数差
第二、三周期元素,原子序数差为1
第四、五周期元素,原子序数差为11
第六、七周期元素,原子序数差为25
(2)同主族相邻两元素原子序数差
2
8
8
18
18
32
8
8
18
18
32
32
包括元素种数
2种
8种
8种
18种
18种
32种
32种
(2)同主族相邻两元素原子序数差
①若为ⅠA、ⅡA族元素,
则原子序数差等于上周期元素所在周期的元素种类数;
②若为ⅢA族至0族元素,
则原子序数差等于下周期元素所在周期的元素种类数。
8
8
18
18
18
32
32
例3. 有关元素周期表中的原子序数之差错误的是( )
A.同周期的第ⅠA族和0族元素的原子序数之差可能为17
B.同主族两相邻元素的原子序数之差为2、8、18、32
C.两粒子,如果核外电子排布相同,则一定属于同种元素
D.同周期第ⅡA、ⅢA族元素原子序数之差可能为25
C
例4.在元素周期表中前四周期的五种元素的位置关系如图所示。若B元素的核电荷数为Z,则五种元素的原子序数之和为( )
A.5Z B.5Z+18 C.5Z+10 D.5Z+8
例5.原子序数为31的元素R,在周期表中的位置为( )
A.第三周期ⅤA族 B.第四周期ⅢA族 C.第五周期ⅢA族 D.第四周期ⅤA族
例6.短周期元素X、Y、Z在元素周期表中的位置如图所示,回答下列问题。
(1)元素X的单质分子是________(写化学式)。
(2)Y位于元素周期表中的第______周期________族。
(3)比Z原子序数大的同主族且相邻周期的元素的原子序数是________。
C
B
He
二 ⅦA
34
归纳总结
元素在周期表中的位置与原子结构的相互推断
(1)元素的位置与原子结构的关系
(2)由元素的原子序数推断元素在周期表中的位置
常用0族元素定位法:
比大小定周期
求差值定族数
0族元素 He Ne Ar Kr Xe Rn Og
所在周期序数 1 2 3 4 5 6 7
原子序数 2 10 18 36 54 86 118
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第3课时 元素周期表
元素周期表发展史
1869年第1张元素周期表
门捷列夫与元素周期表
Ti = 50 Zr= 90 = 100
V = 51 Nb=94 Ta= 182
Cr = 52 Mo=96 W= 186
Mn= 55 Rh=104.4 Pt= 197.4
Fe = 56 Ru=104.4 Ir= 198
Ni=Co = 59 Pd=106.6 Os= 199
H=1 Cu= 63.4 Ag=108 Hg= 200
Be= 9.4 Mg= 24 Zn= 65.2 Cd=112
B= 11 Al= 27.4 = 68 U=116 Au= 197
C= 12 Si= 28 = 70 Sn=118
N= 14 P= 31 As= 75 Sb=122 Bi= 210
O= 16 S= 32 Se= 79.4 Te= 128
F= 19 Cl= 35.5 Br = 80 I= 127
Li= Na= 23 K= 39 Rb= 85.4 Cs= 133 Tl= 204
Ca= 40 Sr= 87.6 Ba= 137 Pb= 207
= 45 Ce= 92
Er= 56 La= 94
Yt= 60 Di= 95
In= 75.6 Th=118
相对原子质量
门捷列夫绘制的第一张元素周期表是按照元素的相对原子质量来排列的,随着科学家对原子结构认识的不断深入,元素周期表中元素的排列依据也由相对原子质量改为核电荷数。
原子序数=核电荷数=质子数=核外电子数
元素周期表
目录
元素周期表的结构
01
元素的位置与原子结构的关系
02
习
学
目
标
通过了解元素周期表的结构(周期族),认识原子结构与元素周期表中位置间的关系,培养“宏观辨识与证据推理”的核心素养。
元素周期表中元素的排列方式:
将电子层数相同的元素按照原子序数递增的顺序由左向右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上向下排成纵列。
H
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
He
原子序数=核电荷数=质子数=核外电子数
一个横行作为1个周期
7个
一
二
三
四
五
六
七
一列作为1个族(第8、9、10三列统称为第Ⅷ族)
16个
第Ⅷ族
NO.1
元素周期表的结构
周期序数
第一周期
第二周期
第三周期
第四周期
第五周期
第六周期
第七周期
元素种类数
2
8
8
18
18
32
32
短周期
长周期
元素周期表的结构
短周期
长周期
填写下表,并思考周期序数与元素的原子核外电子层数之间的关系
周期序数 起止元素 包括元素种数 核外电子层数
1 H~He 2 1
2
3
4
5
6
7 Fr~Og 7
Li~Ne
8
2
Na~Ar
8
3
K~Kr
18
4
Rb~Xe
18
5
Cs~Rn
32
6
32
周期序数等于原子核外电子层数
短周期
长周期
主族A
副族B
元素周期表的结构
主族:由长周期元素和短周期元素共同组成的族 大写罗马数字加A
ⅠA
第Ⅷ族
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
副族:完全由长周期元素组成的族 大写罗马数字加B(第Ⅷ族以外)
ⅠB
ⅡB
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
稀有气体元素化学性质不活泼,其化合价定为0,统称0族
0族
碱金属元素
卤族元素
ⅠA~
ⅡA
ⅢA~ⅦA
ⅢB~ⅦB
Ⅷ
Ⅰ B~Ⅱ B
族排列顺序
主族(7个)
副族(7个)
零族(1个)
ⅠA, ⅡA, ⅢA, ⅣA, ⅤA, ⅥA, ⅦA,ⅧA
ⅢB, ⅣB, ⅤB, ⅥB, ⅦB, ⅠB, ⅡB
稀有气体元素
族
ⅠA(除H外)----碱金属元素
ⅡA----碱土金属元素
ⅦA----卤族元素
其他族的常见名称
主族序数=最外层电子数
Ⅷ
第Ⅷ族(1个)
例1.在下面的虚线框中用实线画出元素周期表第一至第六周期的轮廓,并画出金属与非金属的分界线和第Ⅷ族的轮廓。
6个横行
6个周期
18个纵行,16个族
第Ⅷ族
金属与非金属分界线
练习:指出Si在周期表中的位置
ⅣA族
三
Si在周期表中的位置为:第三周期第ⅣA族
它们分别位于周期表的第几周期第几主族
已知碳元素、镁元素和溴元素的原子结构示意图:
碳元素:
镁元素:
溴元素:
第 2 周期 第 ⅣA 族
第 3 周期 第 ⅡA 族
第 4 周期 第 ⅦA 族
课堂练习
归纳总结
NO.2
元素的位置
与
原子结构的关系
元素的位置与原子结构的互相推断
本方法常用于确定原子序数≤20的元素。
(1)三个等式
①周期序数=电子层数
②主族序数=最外层电子数
③原子序数=核电荷数=质子数=原子的核外电子数
例:①X元素是第三周期第ⅠA族元素
则该元素原子有___个电子层,最外层电子数是___,即___为元素。
②Y元素的原子序数是16,则该元素的原子结构示意图是
其在周期表中的位置是_____________________。
3
1
钠
第三周期第ⅥA族
(2)利用“阴上阳下”推断原子序数的关系
具有相同电子层结构的离子,如aX(n+1)+、bYn+、cZ(n+1)-、dMn-的电子层结构相同,在周期表中位置关系为
…
…
bY
aX
cZ
dM
a-(n+1)=b-n=c+(n+1)=d+n
则它们的原子序数关系为a>b>d>c
(3) 根据原子序数确定元素在周期表中位置的方法——0族定位法
0族元素的周期序数和原子序数
0族元素 He Ne Ar Kr Xe Rn Og
周期序数 一 二 三 四 五 六 七
原子序数 2 10 18 36 54 86 118
①比大小定周期:
比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻近的0族元素,那么该元素就和原子序数大的0族元素处于同一周期。如64号元素,54<64<86,其应在第六周期。
②求差值定族数
a.若某元素的原子序数比相邻近的0族元素多1或2,则该元素应处在0族元素所在周期的下一个周期的第ⅠA族或第ⅡA族。如88号元素,88-86=2,则其应在第七周期第ⅡA族。
b.若某元素的原子序数比相邻近的0族元素少1~5时,则该元素应处在0族元素同周期的第ⅦA~第ⅢA族。如84号元素,86-84=2,应在第六周期第ⅥA族。
注意
(1)短周期中因无副族元素,故所得差值即为主族序数;
(2)11~17纵列数的个位数与族序数相等。
例2:下列各图为元素周期表的一部分,表中的数字为原子序数,其中M为37的是( )
35
37
38
27
【解析】已知M的原子序数为37,比稀有气体36号元素多1,则位于周期表中第五周期第ⅠA族。
A项17号、53号元素为第ⅦA族元素,则图中M为稀有气体Kr,错误;B项19号、55号元素处于第ⅠA族,则图中M应处于第ⅡA族,错误;C项20号、56号元素处于第ⅡA族,20号元素为钙元素,处于第四周期第ⅡA族,则M位于周期表中第五周期第ⅠA族,正确;D项26号、28号元素为第Ⅷ族元素,图中M处于第Ⅷ族,错误。
(1)同周期第ⅡA族和第ⅢA族元素原子序数差
第二、三周期元素,原子序数差为1
第四、五周期元素,原子序数差为11
第六、七周期元素,原子序数差为25
(2)同主族相邻两元素原子序数差
2
8
8
18
18
32
8
8
18
18
32
32
包括元素种数
2种
8种
8种
18种
18种
32种
32种
(2)同主族相邻两元素原子序数差
①若为ⅠA、ⅡA族元素,
则原子序数差等于上周期元素所在周期的元素种类数;
②若为ⅢA族至0族元素,
则原子序数差等于下周期元素所在周期的元素种类数。
8
8
18
18
18
32
32
例3. 有关元素周期表中的原子序数之差错误的是( )
A.同周期的第ⅠA族和0族元素的原子序数之差可能为17
B.同主族两相邻元素的原子序数之差为2、8、18、32
C.两粒子,如果核外电子排布相同,则一定属于同种元素
D.同周期第ⅡA、ⅢA族元素原子序数之差可能为25
C
例4.在元素周期表中前四周期的五种元素的位置关系如图所示。若B元素的核电荷数为Z,则五种元素的原子序数之和为( )
A.5Z B.5Z+18 C.5Z+10 D.5Z+8
例5.原子序数为31的元素R,在周期表中的位置为( )
A.第三周期ⅤA族 B.第四周期ⅢA族 C.第五周期ⅢA族 D.第四周期ⅤA族
例6.短周期元素X、Y、Z在元素周期表中的位置如图所示,回答下列问题。
(1)元素X的单质分子是________(写化学式)。
(2)Y位于元素周期表中的第______周期________族。
(3)比Z原子序数大的同主族且相邻周期的元素的原子序数是________。
C
B
He
二 ⅦA
34
归纳总结
元素在周期表中的位置与原子结构的相互推断
(1)元素的位置与原子结构的关系
(2)由元素的原子序数推断元素在周期表中的位置
常用0族元素定位法:
比大小定周期
求差值定族数
0族元素 He Ne Ar Kr Xe Rn Og
所在周期序数 1 2 3 4 5 6 7
原子序数 2 10 18 36 54 86 118
