2023年秋高中化学选择性必修2(苏教版2019)分层作业13 范德华力 氢键(含解析)
文档属性
| 名称 | 2023年秋高中化学选择性必修2(苏教版2019)分层作业13 范德华力 氢键(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 111.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-09 18:58:00 | ||
图片预览




文档简介
分层作业13 范德华力 氢键
A级 必备知识基础练
1.下列关于范德华力的叙述正确的是( )
A.是一种较弱的化学键
B.分子间存在的较强的电性作用
C.直接影响所有物质的熔、沸点
D.稀有气体的原子间存在范德华力
2.下列几种氢键:①O—H…O;②N—H…N;③F—H…F;④O—H…N。氢键从强到弱的顺序正确的是( )
A.③>①>④>②
B.①>②>③>④
C.③>②>①>④
D.①>④>③>②
3.下列每组物质能形成分子间氢键的是( )
A.HClO4和H2SO4
B.CH3COOH和H2Se
C.C2H5OH和NaOH
D.H2O2和HI
4.下列说法错误的是( )
A.卤化氢中,HF的沸点最高是由于HF分子间存在氢键
B.H2O的沸点比HF的高,可能与氢键有关
C.氨水中含有分子间氢键
D.氢键X—H…Y的三个原子总在一条直线上
5.下列物质的熔、沸点高低顺序不正确的是( )
A.F2B.CF4>CCl4>CBr4>CI4
C.H2O>H2Te>H2Se>H2S
D.CH46.下列叙述与范德华力无关的是( )
A.气体物质降温时能凝华或凝固
B.通常状况下氯化氢为气体
C.氟、氯、溴、碘单质的熔、沸点依次升高
D.氯化钠的熔点较高
7.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的微粒间的主要相互作用依次是( )
A.氢键、分子间作用力、非极性键
B.氢键、氢键、极性键
C.氢键、极性键、分子间作用力
D.分子间作用力、氢键、非极性键
8.下列两组命题中,Ⅱ组中命题正确,且能用Ⅰ组中的命题加以解释的是( )
选项 Ⅰ组 Ⅱ组
A 相对分子质量:HCl>HF 沸点:HCl>HF
B 键能:H—O键>H—S键 沸点:H2O>H2S
C 分子间作用力:H2O>H2S 稳定性:H2O>H2S
D 相对分子质量:HI>HCl 沸点:HI>HCl
9.现有几组物质的熔点数据如表:
A组 B组 C组 D组
金刚石:>3 500 ℃ Li:181 ℃ HF:-84 ℃ NaCl:801 ℃
硅晶体:1 415 ℃ Na:98 ℃ HCl:-114 ℃ KCl:776 ℃
硼晶体:2 300 ℃ K:63 ℃ HBr:-87 ℃ RbCl:718 ℃
二氧化硅:1 713 ℃ Rb:39 ℃ HI:-51 ℃ CsCl:645 ℃
据此回答下列问题:
(1)A组晶体熔化时克服的微粒间作用力是 ;
(2)B组晶体共同的物理性质是 (填序号);
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于 ;
(4)D组晶体类型为 ;
(5)元素As与N同族。预测As的氢化物分子的立体结构为 ,其沸点比NH3的
(填“高”或“低”)。
B级 关键能力提升练
10.如图中每条折线表示元素周期表中ⅣA~ⅦA族中的某一族元素简单氢化物的沸点变化,其中a点代表的是( )
A.H2S B.HCl
C.PH3 D.SiH4
11.下列物质的性质或数据与氢键无关的是( )
A.H2O的沸点高于H2S
B.邻羟基苯甲酸()的熔点为159 ℃,对羟基苯甲酸()的熔点为213 ℃
C.丙烷不溶于水,而乙醇可与水以任意比混溶
D.HF分解时吸收的热量比HCl分解时吸收的热量多
12.[2023河北邢台高二期末]共价键、离子键、范德华力、氢键等都是微观粒子之间的不同作用力,下列物质在熔化时破坏的作用力相同的是( )
A.硼和金刚石 B.NaCl和AlN
C.干冰和冰 D.Fe和S
13.已知各种硝基苯酚的性质如表:
名称 结构简式 25 ℃水中 溶解度/g
邻硝基 苯酚 0.2 45 100
间硝基 苯酚 1.4 96 194
对硝基 苯酚 1.7 114 295
下列关于各种硝基苯酚的叙述不正确的是( )
A.邻硝基苯酚分子内形成氢键,使其熔、沸点低于另外两种硝基苯酚
B.间硝基苯酚分子间能形成氢键,也能与水分子形成氢键
C.对硝基苯酚分子间能形成氢键,使其熔、沸点较高
D.三种硝基苯酚都能形成分子内氢键
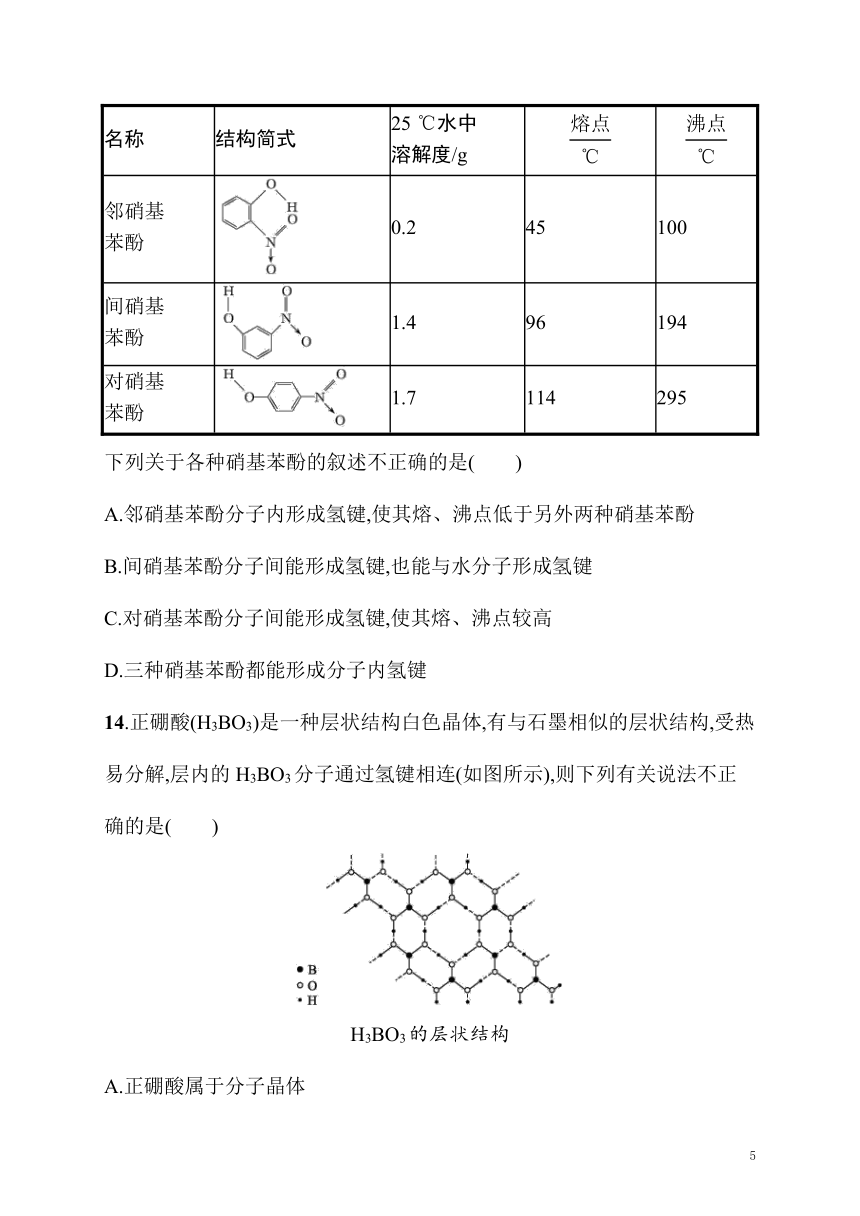
14.正硼酸(H3BO3)是一种层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法不正确的是( )
H3BO3的层状结构
A.正硼酸属于分子晶体
B.正硼酸分子的稳定性与氢键无关
C.含有1 mol H3BO3分子的正硼酸晶体中含有3 mol氢键
D.层间的H3BO3分子通过共价键相连
15.有五个系列同族元素的物质,101.3 kPa时测得它们的沸点(℃)如表所示:
序号 沸点/℃
① He-268.9 (a)-245.9 Ar-185.7 Kr-152.9
② F2-188.1 Cl2-34.6 (b)-58.8 I2-184.4
③ (c)19.4 HCl-84.0 HBr-67.0 HI-35.3
④ H2O 100.0 H2S-61.0 (d)-42.0 H2Te-1.8
⑤ CH4 -161.0 SiH4 -112.0 GeH4 -90.0 (e)-52.0
对应表中内容,下列叙述正确的是( )
A.a、b、c代表的化学物质中均含化学键
B.系列②物质均有氧化性;系列③物质对应水溶液均是强酸
C.系列④中各化合物的稳定性顺序为H2O>H2S>H2Se>H2Te
D.表中物质HF和H2O,由于氢键的影响,其分子特别稳定
16.如图是元素周期表的一部分,所列字母分别代表一种化学元素。下列说法不正确的是( )
A.b的第一电离能大于c的第一电离能
B.d在c的常见单质中燃烧,产物中既含有离子键也含有共价键
C.e与a组成的化合物沸点比水低,原因是水分子之间可形成氢键
D.f元素的基态原子失去4s能级上的所有电子后所形成的离子最稳定
17.短周期的5种非金属元素,其中A、B、C的外围电子排布可表示为A:asa,B:bsbbpb,C:csccp2c,D与B同主族,E在C的下一周期,且是同周期元素中电负性最大的元素。
回答下列问题:
(1)A、B、C、E四种元素中的两种元素可形成多种分子,下列分子①BC2、②BA4、③A2C2、④BE4,其中存在非极性键的是 (填序号)。
(2)C的最简单氢化物比下一周期同主族元素的氢化物沸点要高,其原因是 。
(3)B、C两元素都能和A元素组成常见的溶剂,其分子式为 、 。
(4)BA4、BE4和DE4的沸点从高到低的顺序为 (填化学式)。
C级 学科素养拔高练
18.水是自然界中普遍存在的一种物质,也是维持生命活动所必需的一种物质。
信息一:水的性质存在许多反常现象,如固态密度小于液态密度使冰浮在水面上,沸点相对较高使水在常温常压下呈液态等。
信息二:在20 ℃、1个大气压下,水可以结成冰,称为“热冰”(如图):
试根据以上信息回答下列问题:
(1)s轨道与s轨道重叠形成的共价键可用符号表示为σs-s,p轨道以“头碰头”方式重叠形成的共价键可用符号表示为σp-p,则H2O分子中含有的共价键用符号表示为 。
(2)下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是 (填字母,下同)。
A.金刚石
B.干冰
C.食盐
D.固态氨
(3)已知:2H2OH3O++OH-,在OH-、H2O、H3O+、H2O2中均含有的化学键是 。
A.极性键 B.非极性键
C.配位键 D.氢键
(4)写出短周期元素原子形成的与H3O+具有相同电子数和原子数的分子或离子: 。
(5)水的分解温度远高于其沸点的原因是 。
答案:
1.D 解析 范德华力是存在于分子间的较弱的相互作用,它不是化学键且比化学键弱得多,A、B错误;范德华力只能影响由分子构成物质的熔、沸点,像离子晶体、金属晶体、共价晶体的熔、沸点均与范德华力无关,C错误;稀有气体为单原子分子,分子之间靠范德华力相结合,D正确。
2.A 解析 F、O、N元素的电负性依次降低,F—H、O—H、N—H键的极性依次降低,故F—H…F中的氢键最强,其次是O—H…O,再次是O—H…N,最弱是N—H…N。
3.A 解析 HClO4和H2SO4可形成分子间氢键,A正确;Se的非金属性较弱,H2Se不能形成分子间氢键,B错误;NaOH是离子化合物,不能形成分子间氢键,C错误;HI中碘元素的非金属性较弱,不能形成分子间氢键,D错误。
4.D 解析 因为HF分子之间存在氢键,所以HF是卤化氢中沸点最高的,A正确;H2O分子之间存在氢键,使H2O在常温下呈液态,HF在常温下呈气态,是因为H2O分子间的氢键比HF分子间的氢键多,B正确;氨水中除NH3分子之间存在氢键外,NH3与H2O、H2O与H2O之间都存在氢键,C正确;氢键中的X—H…Y三原子应尽可能地在一条直线上,但在特定条件下,如分子内氢键,可能不在一条直线上,D错误。
5.B 解析 本题中的各组物质均由分子组成,它们熔、沸点的高低由分子间作用力大小决定,分子间作用力越大,熔、沸点越高,反之越低。对于组成和结构相似的分子,相对分子质量越大,分子间作用力越大。卤素单质随相对分子质量的增大,分子间作用力逐渐增大,熔、沸点升高,A正确;同理,从CF4到CI4,从CH4到SnH4,熔、沸点都升高,B错误,D正确;H2O的沸点反常,常温下为液态,是因为水分子间存在氢键,S、Se、Te元素的氢化物在常温下都为气态,故H2O的熔、沸点在其中是最高的,C正确。
6.D
7.B 解析 因为O的电负性较大,在雪花、水中存在O—H…O氢键,故在实现“雪花→水→水蒸气”的变化阶段主要破坏水分子间的氢键,而由“水蒸气→氧气和氢气”的过程中则破坏了O—H极性共价键。
8.D 解析 由于相对分子质量:HCl>HF,所以范德华力:HCl>HF,但HF分子间存在氢键,而HCl分子间不存在氢键,所以沸点:HClH—S键,但沸点与共价键的键能无关,H2O分子间存在氢键,所以沸点:H2O>H2S,B中Ⅰ组命题不能解释Ⅱ组命题;由于相对分子质量:H2S>H2O,所以范德华力:H2S>H2O,但H2O分子间存在氢键,所以分子间作用力:H2O>H2S,由于键能:H—O键>H—S键,所以稳定性:H2O>H2S,分子的稳定性与分子间作用力无关,所以C中Ⅰ组命题不能解释Ⅱ组命题;由于相对分子质量:HI>HCl,所以范德华力:HI>HCl,沸点:HI>HCl,D中Ⅰ组命题能解释Ⅱ组命题。
9.答案 (1)共价键
(2)①②③④
(3)HF分子间存在氢键
(4)离子晶体
(5)三角锥形 低
10.D 解析 由题图可知a点所在曲线上氢化物的沸点没有反常现象,说明不是ⅤA、ⅥA、ⅦA族的氢化物,则只能为ⅣA族的氢化物,即a为SiH4。
11.D 解析 水分子间存在氢键,导致其沸点高于H2S,A与氢键有关;邻羟基苯甲酸形成分子内氢键,对羟基苯甲酸可形成分子间氢键,分子间氢键增大了分子间作用力,使对羟基苯甲酸的熔、沸点比邻羟基苯甲酸的高,B与氢键有关;乙醇分子结构中含有羟基,可以与水分子形成分子间氢键,从而增大了乙醇在水中的溶解度,使其能与水以任意比混溶,而丙烷不能与水分子形成氢键,在水中的溶解度比乙醇小得多,C与氢键有关;HF分解时吸收的热量比HCl分解时吸收的热量多的原因是H—F键的键能比H—Cl键的键能大,D与氢键无关。
12.A 解析 金刚石和硼单质都属于共价晶体,熔化时破坏共价键,A符合题意;NaCl属于离子晶体,熔化时破坏离子键,AlN属于共价晶体,铝原子与氮原子之间通过共价键结合,熔化时破坏共价键,B不符合题意;干冰和冰都属于分子晶体,干冰分子间存在范德华力,冰中H2O分子间存在范德华力和氢键,熔化时干冰破坏范德华力,冰破坏范德华力和氢键,C不符合题意;Fe是金属晶体,熔化时破坏金属键,S单质是分子晶体,熔化时破坏分子间作用力,D不符合题意。
13.D 解析 当分子形成分子内氢键时,熔、沸点降低,A正确;间硝基苯酚中与N原子相连的O原子易与水分子中的H原子形成氢键,B正确;对硝基苯酚能形成分子间氢键,使其熔、沸点升高,C正确、D错误。
14.D 解析 正硼酸晶体中存在H3BO3分子,且该晶体中存在氢键,说明正硼酸晶体由分子构成,正硼酸是分子晶体,故A正确;正硼酸分子的稳定性与分子内的B—O、H—O共价键有关,正硼酸的熔、沸点与氢键有关,故B正确;一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,所以含有1 mol H3BO3分子的正硼酸晶体中含有3 mol氢键,故C正确;层间的H3BO3分子之间的作用力是范德华力,故D错误。
15.C 解析 He、Ne、Ar、Kr是同一族元素的原子,根据递变顺序,可知a为Ne;F、Cl、Br、I属于同一主族元素的原子,且b应是单质形式,即Br2,c为氢化物,即HF,则a、b、c的化学式分别为Ne、Br2、HF,稀有气体无化学键,A项错误;卤素单质均表现较强的氧化性,对应的氢化物中氢氟酸是弱酸,B项错误;O、S、Se、Te非金属性越来越弱,则对应的简单气态氢化物的稳定性越来越弱,系列④中各化合物的稳定性顺序为H2O>H2S>H2Se>H2Te,C项正确;氢键影响物理性质,分子的稳定性与共价键的强弱有关,与氢键无关,D项错误。
16.D 解析 由元素在周期表中的位置可知,a为H元素,b为N元素,c为O元素,d为Na元素,e为S元素,f为Fe元素。N的2p轨道为半充满稳定状态,其第一电离能大于O,故A正确;Na在氧气中燃烧生成过氧化钠,过氧化钠中含有离子键、共价键,故B正确;水分子之间存在氢键,硫化氢分子之间的作用力为范德华力,氢键比范德华力强,所以硫化氢的沸点低于水,C正确;Fe2+的价电子排布式为3d6,而Fe3+的价电子排布式为3d5,为半充满稳定结构,所以Fe2+不如Fe3+稳定,D错误。
17.答案 (1)③
(2)H2O分子间形成氢键
(3)C6H6 H2O
(4)SiCl4>CCl4>CH4
解析 由s轨道最多可容纳2个电子可得:a=1,b=c=2,即A为H元素,B为C元素,C为O元素。由D与B同主族,且为非金属元素得D为Si元素;由E在C的下一周期且E为同周期中电负性最大的元素可知E为Cl元素。
(1)①、②、③、④分别为CO2、CH4、H2O2、CCl4,其中H2O2中存在O—O非极性键。
(2)C的最简单氢化物为H2O,H2O分子间可形成氢键,是其沸点较高的主要原因。
(3)B、A两元素组成苯,C、A两元素组成水,两者都为常见的溶剂。
(4)BA4、BE4、DE4分别为CH4、CCl4、SiCl4,三者结构相似,相对分子质量逐渐增大,分子间作用力逐渐增强,故它们的沸点从高到低的顺序为SiCl4>CCl4>CH4。
18.答案 (1)σs-p (2)D (3)A (4)NH3
(5)水分解需破坏O—H共价键,而水沸腾只需破坏氢键和范德华力
解析 (1)水分子中的共价键是H原子中的s电子与O原子中的p电子形成的s-p σ键。
(2)“热冰”熔化时所克服的作用力是氢键和范德华力,固态氨分子间也存在氢键和范德华力。
(3)四种微粒中都含有的是H—O键,是极性共价键。
(4)短周期元素原子形成的与H3O+具有相同电子数(10电子)和原子数(4原子)的分子是NH3。
(5)水分解需破坏O—H共价键,而水沸腾只需破坏氢键和范德华力,所以水的分解温度远高于其沸点。
9
A级 必备知识基础练
1.下列关于范德华力的叙述正确的是( )
A.是一种较弱的化学键
B.分子间存在的较强的电性作用
C.直接影响所有物质的熔、沸点
D.稀有气体的原子间存在范德华力
2.下列几种氢键:①O—H…O;②N—H…N;③F—H…F;④O—H…N。氢键从强到弱的顺序正确的是( )
A.③>①>④>②
B.①>②>③>④
C.③>②>①>④
D.①>④>③>②
3.下列每组物质能形成分子间氢键的是( )
A.HClO4和H2SO4
B.CH3COOH和H2Se
C.C2H5OH和NaOH
D.H2O2和HI
4.下列说法错误的是( )
A.卤化氢中,HF的沸点最高是由于HF分子间存在氢键
B.H2O的沸点比HF的高,可能与氢键有关
C.氨水中含有分子间氢键
D.氢键X—H…Y的三个原子总在一条直线上
5.下列物质的熔、沸点高低顺序不正确的是( )
A.F2
C.H2O>H2Te>H2Se>H2S
D.CH4
A.气体物质降温时能凝华或凝固
B.通常状况下氯化氢为气体
C.氟、氯、溴、碘单质的熔、沸点依次升高
D.氯化钠的熔点较高
7.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的微粒间的主要相互作用依次是( )
A.氢键、分子间作用力、非极性键
B.氢键、氢键、极性键
C.氢键、极性键、分子间作用力
D.分子间作用力、氢键、非极性键
8.下列两组命题中,Ⅱ组中命题正确,且能用Ⅰ组中的命题加以解释的是( )
选项 Ⅰ组 Ⅱ组
A 相对分子质量:HCl>HF 沸点:HCl>HF
B 键能:H—O键>H—S键 沸点:H2O>H2S
C 分子间作用力:H2O>H2S 稳定性:H2O>H2S
D 相对分子质量:HI>HCl 沸点:HI>HCl
9.现有几组物质的熔点数据如表:
A组 B组 C组 D组
金刚石:>3 500 ℃ Li:181 ℃ HF:-84 ℃ NaCl:801 ℃
硅晶体:1 415 ℃ Na:98 ℃ HCl:-114 ℃ KCl:776 ℃
硼晶体:2 300 ℃ K:63 ℃ HBr:-87 ℃ RbCl:718 ℃
二氧化硅:1 713 ℃ Rb:39 ℃ HI:-51 ℃ CsCl:645 ℃
据此回答下列问题:
(1)A组晶体熔化时克服的微粒间作用力是 ;
(2)B组晶体共同的物理性质是 (填序号);
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于 ;
(4)D组晶体类型为 ;
(5)元素As与N同族。预测As的氢化物分子的立体结构为 ,其沸点比NH3的
(填“高”或“低”)。
B级 关键能力提升练
10.如图中每条折线表示元素周期表中ⅣA~ⅦA族中的某一族元素简单氢化物的沸点变化,其中a点代表的是( )
A.H2S B.HCl
C.PH3 D.SiH4
11.下列物质的性质或数据与氢键无关的是( )
A.H2O的沸点高于H2S
B.邻羟基苯甲酸()的熔点为159 ℃,对羟基苯甲酸()的熔点为213 ℃
C.丙烷不溶于水,而乙醇可与水以任意比混溶
D.HF分解时吸收的热量比HCl分解时吸收的热量多
12.[2023河北邢台高二期末]共价键、离子键、范德华力、氢键等都是微观粒子之间的不同作用力,下列物质在熔化时破坏的作用力相同的是( )
A.硼和金刚石 B.NaCl和AlN
C.干冰和冰 D.Fe和S
13.已知各种硝基苯酚的性质如表:
名称 结构简式 25 ℃水中 溶解度/g
邻硝基 苯酚 0.2 45 100
间硝基 苯酚 1.4 96 194
对硝基 苯酚 1.7 114 295
下列关于各种硝基苯酚的叙述不正确的是( )
A.邻硝基苯酚分子内形成氢键,使其熔、沸点低于另外两种硝基苯酚
B.间硝基苯酚分子间能形成氢键,也能与水分子形成氢键
C.对硝基苯酚分子间能形成氢键,使其熔、沸点较高
D.三种硝基苯酚都能形成分子内氢键
14.正硼酸(H3BO3)是一种层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法不正确的是( )
H3BO3的层状结构
A.正硼酸属于分子晶体
B.正硼酸分子的稳定性与氢键无关
C.含有1 mol H3BO3分子的正硼酸晶体中含有3 mol氢键
D.层间的H3BO3分子通过共价键相连
15.有五个系列同族元素的物质,101.3 kPa时测得它们的沸点(℃)如表所示:
序号 沸点/℃
① He-268.9 (a)-245.9 Ar-185.7 Kr-152.9
② F2-188.1 Cl2-34.6 (b)-58.8 I2-184.4
③ (c)19.4 HCl-84.0 HBr-67.0 HI-35.3
④ H2O 100.0 H2S-61.0 (d)-42.0 H2Te-1.8
⑤ CH4 -161.0 SiH4 -112.0 GeH4 -90.0 (e)-52.0
对应表中内容,下列叙述正确的是( )
A.a、b、c代表的化学物质中均含化学键
B.系列②物质均有氧化性;系列③物质对应水溶液均是强酸
C.系列④中各化合物的稳定性顺序为H2O>H2S>H2Se>H2Te
D.表中物质HF和H2O,由于氢键的影响,其分子特别稳定
16.如图是元素周期表的一部分,所列字母分别代表一种化学元素。下列说法不正确的是( )
A.b的第一电离能大于c的第一电离能
B.d在c的常见单质中燃烧,产物中既含有离子键也含有共价键
C.e与a组成的化合物沸点比水低,原因是水分子之间可形成氢键
D.f元素的基态原子失去4s能级上的所有电子后所形成的离子最稳定
17.短周期的5种非金属元素,其中A、B、C的外围电子排布可表示为A:asa,B:bsbbpb,C:csccp2c,D与B同主族,E在C的下一周期,且是同周期元素中电负性最大的元素。
回答下列问题:
(1)A、B、C、E四种元素中的两种元素可形成多种分子,下列分子①BC2、②BA4、③A2C2、④BE4,其中存在非极性键的是 (填序号)。
(2)C的最简单氢化物比下一周期同主族元素的氢化物沸点要高,其原因是 。
(3)B、C两元素都能和A元素组成常见的溶剂,其分子式为 、 。
(4)BA4、BE4和DE4的沸点从高到低的顺序为 (填化学式)。
C级 学科素养拔高练
18.水是自然界中普遍存在的一种物质,也是维持生命活动所必需的一种物质。
信息一:水的性质存在许多反常现象,如固态密度小于液态密度使冰浮在水面上,沸点相对较高使水在常温常压下呈液态等。
信息二:在20 ℃、1个大气压下,水可以结成冰,称为“热冰”(如图):
试根据以上信息回答下列问题:
(1)s轨道与s轨道重叠形成的共价键可用符号表示为σs-s,p轨道以“头碰头”方式重叠形成的共价键可用符号表示为σp-p,则H2O分子中含有的共价键用符号表示为 。
(2)下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是 (填字母,下同)。
A.金刚石
B.干冰
C.食盐
D.固态氨
(3)已知:2H2OH3O++OH-,在OH-、H2O、H3O+、H2O2中均含有的化学键是 。
A.极性键 B.非极性键
C.配位键 D.氢键
(4)写出短周期元素原子形成的与H3O+具有相同电子数和原子数的分子或离子: 。
(5)水的分解温度远高于其沸点的原因是 。
答案:
1.D 解析 范德华力是存在于分子间的较弱的相互作用,它不是化学键且比化学键弱得多,A、B错误;范德华力只能影响由分子构成物质的熔、沸点,像离子晶体、金属晶体、共价晶体的熔、沸点均与范德华力无关,C错误;稀有气体为单原子分子,分子之间靠范德华力相结合,D正确。
2.A 解析 F、O、N元素的电负性依次降低,F—H、O—H、N—H键的极性依次降低,故F—H…F中的氢键最强,其次是O—H…O,再次是O—H…N,最弱是N—H…N。
3.A 解析 HClO4和H2SO4可形成分子间氢键,A正确;Se的非金属性较弱,H2Se不能形成分子间氢键,B错误;NaOH是离子化合物,不能形成分子间氢键,C错误;HI中碘元素的非金属性较弱,不能形成分子间氢键,D错误。
4.D 解析 因为HF分子之间存在氢键,所以HF是卤化氢中沸点最高的,A正确;H2O分子之间存在氢键,使H2O在常温下呈液态,HF在常温下呈气态,是因为H2O分子间的氢键比HF分子间的氢键多,B正确;氨水中除NH3分子之间存在氢键外,NH3与H2O、H2O与H2O之间都存在氢键,C正确;氢键中的X—H…Y三原子应尽可能地在一条直线上,但在特定条件下,如分子内氢键,可能不在一条直线上,D错误。
5.B 解析 本题中的各组物质均由分子组成,它们熔、沸点的高低由分子间作用力大小决定,分子间作用力越大,熔、沸点越高,反之越低。对于组成和结构相似的分子,相对分子质量越大,分子间作用力越大。卤素单质随相对分子质量的增大,分子间作用力逐渐增大,熔、沸点升高,A正确;同理,从CF4到CI4,从CH4到SnH4,熔、沸点都升高,B错误,D正确;H2O的沸点反常,常温下为液态,是因为水分子间存在氢键,S、Se、Te元素的氢化物在常温下都为气态,故H2O的熔、沸点在其中是最高的,C正确。
6.D
7.B 解析 因为O的电负性较大,在雪花、水中存在O—H…O氢键,故在实现“雪花→水→水蒸气”的变化阶段主要破坏水分子间的氢键,而由“水蒸气→氧气和氢气”的过程中则破坏了O—H极性共价键。
8.D 解析 由于相对分子质量:HCl>HF,所以范德华力:HCl>HF,但HF分子间存在氢键,而HCl分子间不存在氢键,所以沸点:HCl
9.答案 (1)共价键
(2)①②③④
(3)HF分子间存在氢键
(4)离子晶体
(5)三角锥形 低
10.D 解析 由题图可知a点所在曲线上氢化物的沸点没有反常现象,说明不是ⅤA、ⅥA、ⅦA族的氢化物,则只能为ⅣA族的氢化物,即a为SiH4。
11.D 解析 水分子间存在氢键,导致其沸点高于H2S,A与氢键有关;邻羟基苯甲酸形成分子内氢键,对羟基苯甲酸可形成分子间氢键,分子间氢键增大了分子间作用力,使对羟基苯甲酸的熔、沸点比邻羟基苯甲酸的高,B与氢键有关;乙醇分子结构中含有羟基,可以与水分子形成分子间氢键,从而增大了乙醇在水中的溶解度,使其能与水以任意比混溶,而丙烷不能与水分子形成氢键,在水中的溶解度比乙醇小得多,C与氢键有关;HF分解时吸收的热量比HCl分解时吸收的热量多的原因是H—F键的键能比H—Cl键的键能大,D与氢键无关。
12.A 解析 金刚石和硼单质都属于共价晶体,熔化时破坏共价键,A符合题意;NaCl属于离子晶体,熔化时破坏离子键,AlN属于共价晶体,铝原子与氮原子之间通过共价键结合,熔化时破坏共价键,B不符合题意;干冰和冰都属于分子晶体,干冰分子间存在范德华力,冰中H2O分子间存在范德华力和氢键,熔化时干冰破坏范德华力,冰破坏范德华力和氢键,C不符合题意;Fe是金属晶体,熔化时破坏金属键,S单质是分子晶体,熔化时破坏分子间作用力,D不符合题意。
13.D 解析 当分子形成分子内氢键时,熔、沸点降低,A正确;间硝基苯酚中与N原子相连的O原子易与水分子中的H原子形成氢键,B正确;对硝基苯酚能形成分子间氢键,使其熔、沸点升高,C正确、D错误。
14.D 解析 正硼酸晶体中存在H3BO3分子,且该晶体中存在氢键,说明正硼酸晶体由分子构成,正硼酸是分子晶体,故A正确;正硼酸分子的稳定性与分子内的B—O、H—O共价键有关,正硼酸的熔、沸点与氢键有关,故B正确;一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,所以含有1 mol H3BO3分子的正硼酸晶体中含有3 mol氢键,故C正确;层间的H3BO3分子之间的作用力是范德华力,故D错误。
15.C 解析 He、Ne、Ar、Kr是同一族元素的原子,根据递变顺序,可知a为Ne;F、Cl、Br、I属于同一主族元素的原子,且b应是单质形式,即Br2,c为氢化物,即HF,则a、b、c的化学式分别为Ne、Br2、HF,稀有气体无化学键,A项错误;卤素单质均表现较强的氧化性,对应的氢化物中氢氟酸是弱酸,B项错误;O、S、Se、Te非金属性越来越弱,则对应的简单气态氢化物的稳定性越来越弱,系列④中各化合物的稳定性顺序为H2O>H2S>H2Se>H2Te,C项正确;氢键影响物理性质,分子的稳定性与共价键的强弱有关,与氢键无关,D项错误。
16.D 解析 由元素在周期表中的位置可知,a为H元素,b为N元素,c为O元素,d为Na元素,e为S元素,f为Fe元素。N的2p轨道为半充满稳定状态,其第一电离能大于O,故A正确;Na在氧气中燃烧生成过氧化钠,过氧化钠中含有离子键、共价键,故B正确;水分子之间存在氢键,硫化氢分子之间的作用力为范德华力,氢键比范德华力强,所以硫化氢的沸点低于水,C正确;Fe2+的价电子排布式为3d6,而Fe3+的价电子排布式为3d5,为半充满稳定结构,所以Fe2+不如Fe3+稳定,D错误。
17.答案 (1)③
(2)H2O分子间形成氢键
(3)C6H6 H2O
(4)SiCl4>CCl4>CH4
解析 由s轨道最多可容纳2个电子可得:a=1,b=c=2,即A为H元素,B为C元素,C为O元素。由D与B同主族,且为非金属元素得D为Si元素;由E在C的下一周期且E为同周期中电负性最大的元素可知E为Cl元素。
(1)①、②、③、④分别为CO2、CH4、H2O2、CCl4,其中H2O2中存在O—O非极性键。
(2)C的最简单氢化物为H2O,H2O分子间可形成氢键,是其沸点较高的主要原因。
(3)B、A两元素组成苯,C、A两元素组成水,两者都为常见的溶剂。
(4)BA4、BE4、DE4分别为CH4、CCl4、SiCl4,三者结构相似,相对分子质量逐渐增大,分子间作用力逐渐增强,故它们的沸点从高到低的顺序为SiCl4>CCl4>CH4。
18.答案 (1)σs-p (2)D (3)A (4)NH3
(5)水分解需破坏O—H共价键,而水沸腾只需破坏氢键和范德华力
解析 (1)水分子中的共价键是H原子中的s电子与O原子中的p电子形成的s-p σ键。
(2)“热冰”熔化时所克服的作用力是氢键和范德华力,固态氨分子间也存在氢键和范德华力。
(3)四种微粒中都含有的是H—O键,是极性共价键。
(4)短周期元素原子形成的与H3O+具有相同电子数(10电子)和原子数(4原子)的分子是NH3。
(5)水分解需破坏O—H共价键,而水沸腾只需破坏氢键和范德华力,所以水的分解温度远高于其沸点。
9
