2023年秋高中化学选择性必修2(苏教版2019)分层作业14 分子晶体(含解析)
文档属性
| 名称 | 2023年秋高中化学选择性必修2(苏教版2019)分层作业14 分子晶体(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 333.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-09 00:00:00 | ||
图片预览



文档简介
分层作业14 分子晶体
A级 必备知识基础练
1.下列有关分子晶体的说法中,一定正确的是( )
A.分子内均存在共价键
B.分子间一定存在范德华力
C.分子间一定存在氢键
D.分子晶体熔化时共价键断裂
2.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、P4、C10H8
B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5
D.CCl4、H2O、Na2O2
3.甲烷晶体的晶胞结构如图所示,下列说法正确的是( )
甲烷晶胞
A.甲烷晶胞中的球只代表1个C原子
B.晶体中1个CH4分子中有12个紧邻的CH4分子
C.甲烷晶体熔化时需克服共价键
D.1个CH4晶胞中含有8个CH4分子
4.对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是( )
A.SiX4呈空间网状结构,硬度大
B.NaX的熔点一般高于SiX4
C.NaX均易水解
D.SiX4晶体由原子构成,熔化时破坏共价键
5.下列排序正确的是( )
A.酸性:HClOB.碱性:Ba(OH)2C.熔点:MgBr2D.沸点:H2O6.通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如图所示:
下列关于这些晶体结构和性质的叙述不正确的是( )
A.同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构
B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D.二氧化硅晶体熔化时破坏共价键
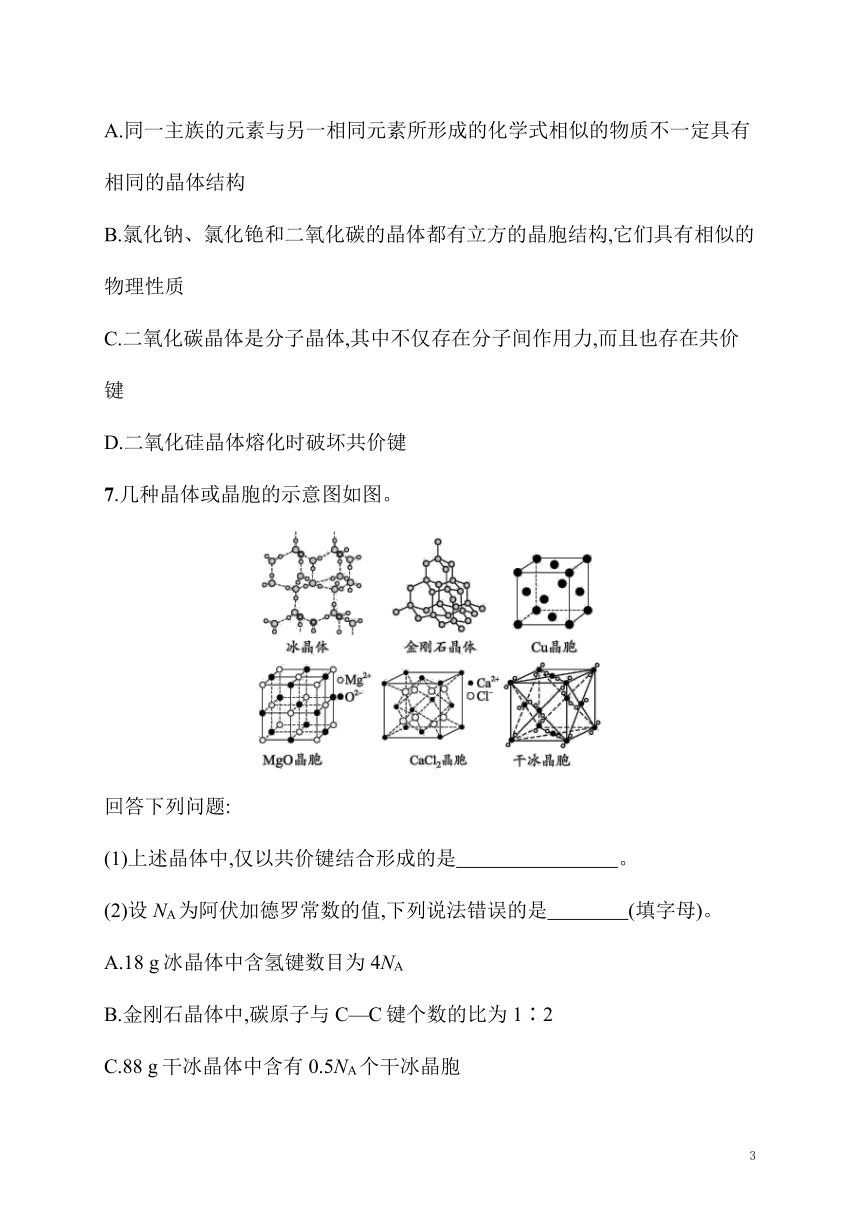
7.几种晶体或晶胞的示意图如图。
回答下列问题:
(1)上述晶体中,仅以共价键结合形成的是 。
(2)设NA为阿伏加德罗常数的值,下列说法错误的是 (填字母)。
A.18 g冰晶体中含氢键数目为4NA
B.金刚石晶体中,碳原子与C—C键个数的比为1∶2
C.88 g干冰晶体中含有0.5NA个干冰晶胞
D.在MgO晶胞中,距Mg2+最近的所有O2-可构成正八面体
(3)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是 。
(4)每个Cu晶胞中平均含有 个Cu原子,CaCl2晶体中Ca2+的配位数为 。
(5)MgO晶体的熔点 (填“大于”或“小于”)NaCl晶体,原因是 。
B级 关键能力提升练
8.常温下硫单质主要以S8形式存在,加热时S8会转化为S6、S4、S2等,当温度达到750 ℃时主要以S2形式存在,下列说法正确的是( )
A.S8转化为S6、S4、S2属于物理变化
B.无论哪种硫分子,在空气中完全燃烧时都生成SO2
C.常温条件下单质硫为共价晶体
D.把硫单质在空气中加热到750 ℃即得S2
9.我国科学家以碳60为原料,制造出一种单层碳60聚合物单晶新材料。下列有关说法不正确的是( )
A.单层聚合C60与金刚石互为同素异形体
B.C60中的12C中子数为6
C.C60和石墨均为分子晶体
D.单层聚合碳60中有非极性共价键
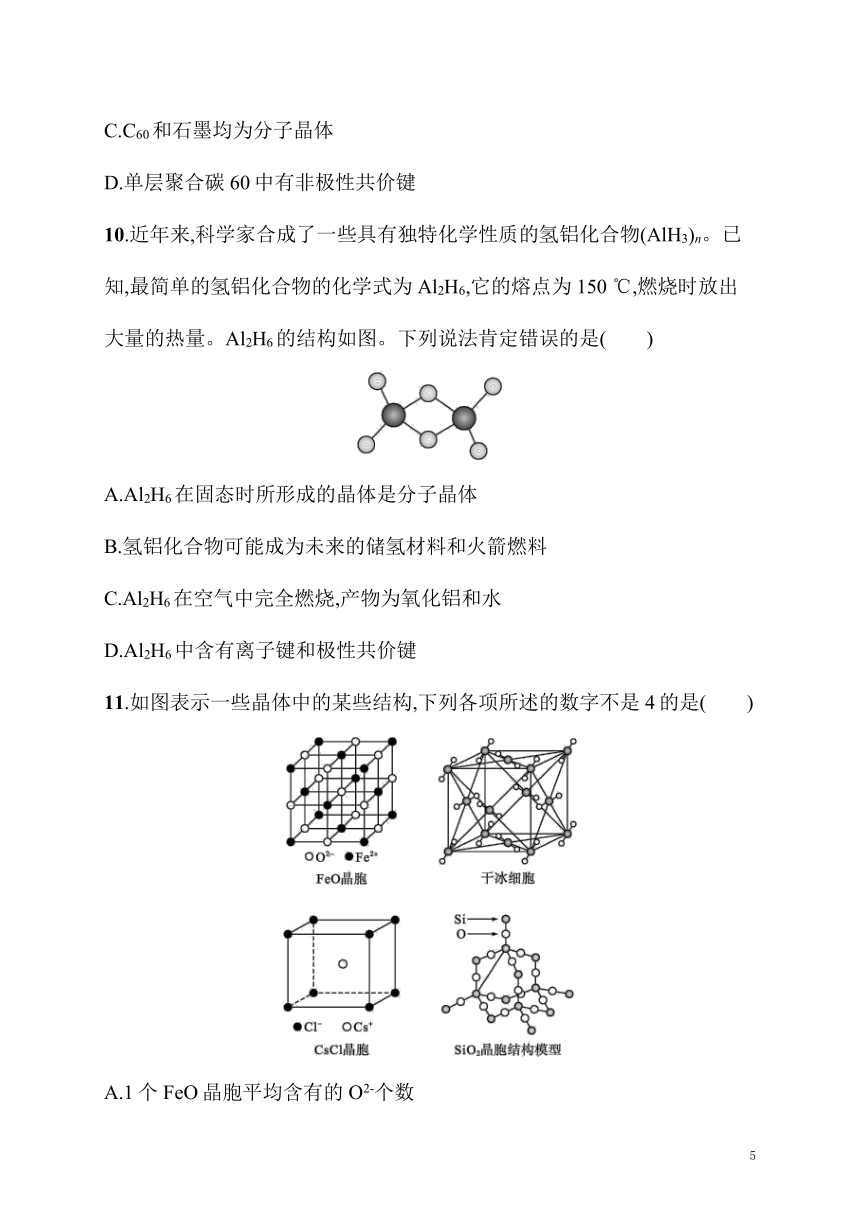
10.近年来,科学家合成了一些具有独特化学性质的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的化学式为Al2H6,它的熔点为150 ℃,燃烧时放出大量的热量。Al2H6的结构如图。下列说法肯定错误的是( )
A.Al2H6在固态时所形成的晶体是分子晶体
B.氢铝化合物可能成为未来的储氢材料和火箭燃料
C.Al2H6在空气中完全燃烧,产物为氧化铝和水
D.Al2H6中含有离子键和极性共价键
11.如图表示一些晶体中的某些结构,下列各项所述的数字不是4的是( )
A.1个FeO晶胞平均含有的O2-个数
B.1个干冰晶胞中平均含有CO2分子的个数
C.氯化铯晶体中,每个Cs+周围距离最近的Cl-个数
D.SiO2晶体中1个硅原子连接的氧原子的数目
12.氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂;立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示,下列关于这两种晶体的说法正确的是( )
A.六方相氮化硼与石墨一样可以导电
B.立方相氮化硼含有σ键和π键,所以硬度大
C.两种晶体均为分子晶体
D.六方相氮化硼晶体层内,一个硼原子与相邻氮原子构成的空间结构为平面三角形
13.科学家发现1个C60分子是由60个碳原子构成的,它的形状像足球(如图C),因此又叫足球烯。科学家还发现一种碳的单质——碳纳米管,它是由六元环形的碳原子构成的管状大分子(如图D),图A、图B分别是金刚石和石墨的结构示意图(图中小黑点或小圆圈均代表碳原子)。
请回答下列问题:
(1)金刚石、石墨、足球烯和碳纳米管的物理性质存在较大差异的原因是 。
(2)常温下,足球烯的化学性质是否比金刚石和石墨活泼 答: (填“活泼”或“一样”),理由是 。
(3)在金刚石的空间网状结构中,含有共价键形成的碳原子环,其中最小的环上有 个碳原子,每个碳原子上的任意两个C—C键间夹角都是 。
(4)燃氢汽车之所以尚未大面积推广,除较经济的制氢方法尚未完全解决外,制得H2后还需解决储存问题,在上述四种碳单质中有可能成为储氢材料的是 。
C级 学科素养拔高练
14.ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为 ,原子间存在的共价键类型有 。
图(a)
图(b)
图(c)
(2)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是 。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性 (填“增强”“不变”或“减弱”,下同)、共价性 。
(3)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为 ;其晶胞参数为1.4 nm,晶胞密度为 g·cm-3。
答案:
1.B 解析 稀有气体元素组成的分子晶体中,不存在化学键,原子间通过范德华力结合成晶体,A错误;分子间作用力包括范德华力和氢键,范德华力存在于所有的分子晶体中,而氢键只存在于含有与电负性较强的N、O、F原子结合的氢原子的分子之间或者分子内,B正确、C错误;分子晶体熔化时破坏分子间作用力,共价键不断裂,D错误。
2.B 解析 P4(白磷)为单质,不是化合物,A错误;SiO2为共价晶体,C错误;Na2O2是离子化合物,形成离子晶体,D错误。
3.B 解析 题图所示的甲烷晶胞中的球代表的是1个甲烷分子,并不是1个C原子,A错误;晶体中1个CH4分子周围紧邻的CH4分子个数,以一个顶点的CH4分子为例,则为3×8×=12,故B正确;甲烷晶体是分子晶体,熔化时克服范德华力,C错误;甲烷晶胞属于面心立方晶胞,该晶胞中甲烷分子的个数为8×+6×=4,D错误。
4.B 解析 硅的卤化物(SiX4)属于分子晶体,不是空间网状结构,其硬度较小,A错误;钠的卤化物(NaX)为离子化合物,属于离子晶体,硅的卤化物(SiX4)为共价化合物,属于分子晶体,离子晶体的熔点一般高于分子晶体的熔点,即NaX的熔点一般高于SiX4,B正确;NaX中除NaF外均不易水解,C错误;硅的卤化物(SiX4)晶体是由分子构成的,属于分子晶体,熔化时破坏分子间作用力,D错误。
5.A 解析 Ba和Ca同主族,金属性:Ba>Ca,故碱性:Ba(OH)2>Ca(OH)2,B错误;SiCl4为分子晶体,MgBr2为离子晶体,BN为共价晶体,故三种物质中SiCl4的熔点最低,C错误;H2O分子之间存在氢键,故沸点:H2O>H2S,D错误。
6.B 解析 SiO2和CO2的化学式相似,但其晶体结构不同,A项正确;二氧化碳为分子晶体,分子间存在分子间作用力,分子内部碳原子和氧原子间形成共价键,氯化钠和氯化铯为离子晶体,所以三者物理性质不同,B项不正确、C项正确;SiO2是共价晶体,熔化时会破坏共价键,D项正确。
7.答案 (1)金刚石晶体
(2)A
(3)水分子间存在氢键,而干冰分子间是范德华力,氢键比范德华力强
(4)4 8
(5)大于 两者均为离子晶体,MgO中的离子所带电荷数大于NaCl中的离子所带电荷数,且r(Mg2+)解析 (1)金刚石是共价晶体,晶体中碳原子全部以共价键结合,冰和干冰晶体中分子内部是共价键,分子间是氢键或范德华力,而MgO、CaCl2和铜晶胞中没有共价键。
(2)18 g冰中含水分子的物质的量为1 mol,在冰晶体中,每个水分子周围有4个水分子以氢键结合,而每个氢键被2个水分子共有,所以在晶体中平均每个水分子对应2个氢键,则1 mol冰晶体中含氢键数目为2NA,故A错误;金刚石晶体中,每个碳原子都和相邻的4个碳原子形成C—C键,而每个C—C键被两个碳原子所共有,所以平均每个碳原子对应C—C键个数为2,则金刚石晶体中碳原子与C—C键个数的比为1∶2,故B正确;88 g干冰晶体中含有2 mol二氧化碳分子,在干冰晶胞中,二氧化碳分子位于立方体的顶点和面心,则平均一个晶胞中含有4个二氧化碳分子,所以88 g干冰晶体中含有0.5NA个干冰晶胞,故C正确;在MgO晶胞中,距Mg2+最近的O2-位于Mg2+的上、下、左、右、前、后,这些O2-可构成正八面体,故D正确。
(3)在冰中H2O分子间存在氢键,氢键比范德华力强,所以冰的熔点远高于干冰。
(4)铜晶胞中,铜原子位于立方体的顶点和面心,所以每个铜晶胞中平均含有8×+6×=4个铜原子;从CaCl2晶胞可以看出,和每个Ca2+紧邻的Cl-有8个,即Ca2+的配位数为8。
(5)在离子晶体中,离子所带电荷数越高,离子半径越小,晶格能越大,离子晶体的熔点越高;晶体MgO和NaCl均为离子晶体,MgO中的离子所带电荷数大于NaCl中的离子所带电荷数,且r(Mg2+)8.B 解析 S8、S6、S4、S2属于不同的分子,它们之间的转化为化学变化,A错误;常温条件下单质硫为分子晶体,在空气中完全燃烧生成SO2,B正确、C错误;硫单质在空气中加热时会燃烧,被O2氧化,生成硫的氧化物,得不到S2,D错误。
9.C 解析 C60与金刚石均为碳元素形成的不同单质,二者互为同素异形体,故A正确;C60中的12C中子数为12-6=6,故B正确;石墨属于混合型晶体,故C错误;单层聚合碳60中有C—C键,属于非极性共价键,故D正确。
10.D 解析 Al2H6的熔点为150 ℃,由熔点低可知Al2H6为分子晶体,A正确;该物质燃烧放出大量的热量,可能成为未来的储氢材料和火箭燃料,B正确;由Al2H6的组成元素可知,燃烧产物为氧化铝和水,C正确;Al2H6为分子晶体,化合物中Al和H之间形成共价键,不含离子键,D错误。
11.C 解析 氧化亚铁晶胞中O2-数目为12×+1=4,A不符合题意;1个干冰晶胞中平均含有CO2分子个数为8×+6×=4,B不符合题意;氯化铯晶体中,每个Cs+周围距离最近的Cl-个数是8,C符合题意;在二氧化硅晶胞结构中,1个硅原子与4个氧原子形成4个Si—O键,D不符合题意。
12.D 解析 六方相氮化硼晶体中没有可以自由移动的电子或离子,所以不导电,A项错误;立方相氮化硼中只含有σ键,B项错误;立方相氮化硼是共价晶体,C项错误;由六方相氮化硼的晶体结构可知,每个硼原子与相邻3个氮原子构成平面三角形,D项正确。
13.答案 (1)碳原子排列的方式不同
(2)活泼 足球烯含π键,容易发生化学反应
(3)6 109°28'
(4)碳纳米管
解析 (1)都是碳元素组成的单质,但是由于碳原子在空间的排列方式不同,所以性质会有较大差异。
(2)足球烯中含有π键,所以比石墨和金刚石活泼。
(3)金刚石是共价晶体,在共价晶体里,原子间以共价键相互结合,形成三维的空间网状结构,最小的环上有6个C原子;每个碳原子与周围的4个碳原子形成正四面体结构,所以夹角为109°28'。
(4)碳纳米管表面积大,可以吸附H2,因此可能成为储氢材料。
14.答案 (1)混合型晶体 σ键、π键
(2)①SiX4属于分子晶体,相对分子质量越大,沸点越高 ②减弱 增强
(3)K3C60 2.0
解析 (1)碳的一种单质的结构如题图(a)所示,应为石墨,石墨属于混合型晶体,晶体中有σ键和π键。
(2)①四卤化硅为分子晶体,沸点与相对分子质量有关,相对分子质量越大,沸点越高。
②PbX2的熔点先降低后又稍有升高,其中PbF2为离子晶体,PbBr2、PbI2为分子晶体,可知依F、Cl、Br、I次序,PbX2中的化学键的离子性减弱、共价性增强。
(3)K位于立方体的棱上和体内,1个晶胞中的个数为12×+9=12,C60位于立方体的顶点和面心,1个晶胞中的个数为8×+6×=4,化学式为K3C60,则1个晶胞的质量为 g,其晶胞参数为1.4 nm=1.4×10-7 cm,则1个晶胞体积为(1.4×10-7)3 cm3,所以晶胞密度为 g·cm-3≈2.0 g·cm-3。
3
A级 必备知识基础练
1.下列有关分子晶体的说法中,一定正确的是( )
A.分子内均存在共价键
B.分子间一定存在范德华力
C.分子间一定存在氢键
D.分子晶体熔化时共价键断裂
2.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、P4、C10H8
B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5
D.CCl4、H2O、Na2O2
3.甲烷晶体的晶胞结构如图所示,下列说法正确的是( )
甲烷晶胞
A.甲烷晶胞中的球只代表1个C原子
B.晶体中1个CH4分子中有12个紧邻的CH4分子
C.甲烷晶体熔化时需克服共价键
D.1个CH4晶胞中含有8个CH4分子
4.对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是( )
A.SiX4呈空间网状结构,硬度大
B.NaX的熔点一般高于SiX4
C.NaX均易水解
D.SiX4晶体由原子构成,熔化时破坏共价键
5.下列排序正确的是( )
A.酸性:HClO
下列关于这些晶体结构和性质的叙述不正确的是( )
A.同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构
B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D.二氧化硅晶体熔化时破坏共价键
7.几种晶体或晶胞的示意图如图。
回答下列问题:
(1)上述晶体中,仅以共价键结合形成的是 。
(2)设NA为阿伏加德罗常数的值,下列说法错误的是 (填字母)。
A.18 g冰晶体中含氢键数目为4NA
B.金刚石晶体中,碳原子与C—C键个数的比为1∶2
C.88 g干冰晶体中含有0.5NA个干冰晶胞
D.在MgO晶胞中,距Mg2+最近的所有O2-可构成正八面体
(3)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是 。
(4)每个Cu晶胞中平均含有 个Cu原子,CaCl2晶体中Ca2+的配位数为 。
(5)MgO晶体的熔点 (填“大于”或“小于”)NaCl晶体,原因是 。
B级 关键能力提升练
8.常温下硫单质主要以S8形式存在,加热时S8会转化为S6、S4、S2等,当温度达到750 ℃时主要以S2形式存在,下列说法正确的是( )
A.S8转化为S6、S4、S2属于物理变化
B.无论哪种硫分子,在空气中完全燃烧时都生成SO2
C.常温条件下单质硫为共价晶体
D.把硫单质在空气中加热到750 ℃即得S2
9.我国科学家以碳60为原料,制造出一种单层碳60聚合物单晶新材料。下列有关说法不正确的是( )
A.单层聚合C60与金刚石互为同素异形体
B.C60中的12C中子数为6
C.C60和石墨均为分子晶体
D.单层聚合碳60中有非极性共价键
10.近年来,科学家合成了一些具有独特化学性质的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的化学式为Al2H6,它的熔点为150 ℃,燃烧时放出大量的热量。Al2H6的结构如图。下列说法肯定错误的是( )
A.Al2H6在固态时所形成的晶体是分子晶体
B.氢铝化合物可能成为未来的储氢材料和火箭燃料
C.Al2H6在空气中完全燃烧,产物为氧化铝和水
D.Al2H6中含有离子键和极性共价键
11.如图表示一些晶体中的某些结构,下列各项所述的数字不是4的是( )
A.1个FeO晶胞平均含有的O2-个数
B.1个干冰晶胞中平均含有CO2分子的个数
C.氯化铯晶体中,每个Cs+周围距离最近的Cl-个数
D.SiO2晶体中1个硅原子连接的氧原子的数目
12.氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂;立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示,下列关于这两种晶体的说法正确的是( )
A.六方相氮化硼与石墨一样可以导电
B.立方相氮化硼含有σ键和π键,所以硬度大
C.两种晶体均为分子晶体
D.六方相氮化硼晶体层内,一个硼原子与相邻氮原子构成的空间结构为平面三角形
13.科学家发现1个C60分子是由60个碳原子构成的,它的形状像足球(如图C),因此又叫足球烯。科学家还发现一种碳的单质——碳纳米管,它是由六元环形的碳原子构成的管状大分子(如图D),图A、图B分别是金刚石和石墨的结构示意图(图中小黑点或小圆圈均代表碳原子)。
请回答下列问题:
(1)金刚石、石墨、足球烯和碳纳米管的物理性质存在较大差异的原因是 。
(2)常温下,足球烯的化学性质是否比金刚石和石墨活泼 答: (填“活泼”或“一样”),理由是 。
(3)在金刚石的空间网状结构中,含有共价键形成的碳原子环,其中最小的环上有 个碳原子,每个碳原子上的任意两个C—C键间夹角都是 。
(4)燃氢汽车之所以尚未大面积推广,除较经济的制氢方法尚未完全解决外,制得H2后还需解决储存问题,在上述四种碳单质中有可能成为储氢材料的是 。
C级 学科素养拔高练
14.ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为 ,原子间存在的共价键类型有 。
图(a)
图(b)
图(c)
(2)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是 。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性 (填“增强”“不变”或“减弱”,下同)、共价性 。
(3)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为 ;其晶胞参数为1.4 nm,晶胞密度为 g·cm-3。
答案:
1.B 解析 稀有气体元素组成的分子晶体中,不存在化学键,原子间通过范德华力结合成晶体,A错误;分子间作用力包括范德华力和氢键,范德华力存在于所有的分子晶体中,而氢键只存在于含有与电负性较强的N、O、F原子结合的氢原子的分子之间或者分子内,B正确、C错误;分子晶体熔化时破坏分子间作用力,共价键不断裂,D错误。
2.B 解析 P4(白磷)为单质,不是化合物,A错误;SiO2为共价晶体,C错误;Na2O2是离子化合物,形成离子晶体,D错误。
3.B 解析 题图所示的甲烷晶胞中的球代表的是1个甲烷分子,并不是1个C原子,A错误;晶体中1个CH4分子周围紧邻的CH4分子个数,以一个顶点的CH4分子为例,则为3×8×=12,故B正确;甲烷晶体是分子晶体,熔化时克服范德华力,C错误;甲烷晶胞属于面心立方晶胞,该晶胞中甲烷分子的个数为8×+6×=4,D错误。
4.B 解析 硅的卤化物(SiX4)属于分子晶体,不是空间网状结构,其硬度较小,A错误;钠的卤化物(NaX)为离子化合物,属于离子晶体,硅的卤化物(SiX4)为共价化合物,属于分子晶体,离子晶体的熔点一般高于分子晶体的熔点,即NaX的熔点一般高于SiX4,B正确;NaX中除NaF外均不易水解,C错误;硅的卤化物(SiX4)晶体是由分子构成的,属于分子晶体,熔化时破坏分子间作用力,D错误。
5.A 解析 Ba和Ca同主族,金属性:Ba>Ca,故碱性:Ba(OH)2>Ca(OH)2,B错误;SiCl4为分子晶体,MgBr2为离子晶体,BN为共价晶体,故三种物质中SiCl4的熔点最低,C错误;H2O分子之间存在氢键,故沸点:H2O>H2S,D错误。
6.B 解析 SiO2和CO2的化学式相似,但其晶体结构不同,A项正确;二氧化碳为分子晶体,分子间存在分子间作用力,分子内部碳原子和氧原子间形成共价键,氯化钠和氯化铯为离子晶体,所以三者物理性质不同,B项不正确、C项正确;SiO2是共价晶体,熔化时会破坏共价键,D项正确。
7.答案 (1)金刚石晶体
(2)A
(3)水分子间存在氢键,而干冰分子间是范德华力,氢键比范德华力强
(4)4 8
(5)大于 两者均为离子晶体,MgO中的离子所带电荷数大于NaCl中的离子所带电荷数,且r(Mg2+)
(2)18 g冰中含水分子的物质的量为1 mol,在冰晶体中,每个水分子周围有4个水分子以氢键结合,而每个氢键被2个水分子共有,所以在晶体中平均每个水分子对应2个氢键,则1 mol冰晶体中含氢键数目为2NA,故A错误;金刚石晶体中,每个碳原子都和相邻的4个碳原子形成C—C键,而每个C—C键被两个碳原子所共有,所以平均每个碳原子对应C—C键个数为2,则金刚石晶体中碳原子与C—C键个数的比为1∶2,故B正确;88 g干冰晶体中含有2 mol二氧化碳分子,在干冰晶胞中,二氧化碳分子位于立方体的顶点和面心,则平均一个晶胞中含有4个二氧化碳分子,所以88 g干冰晶体中含有0.5NA个干冰晶胞,故C正确;在MgO晶胞中,距Mg2+最近的O2-位于Mg2+的上、下、左、右、前、后,这些O2-可构成正八面体,故D正确。
(3)在冰中H2O分子间存在氢键,氢键比范德华力强,所以冰的熔点远高于干冰。
(4)铜晶胞中,铜原子位于立方体的顶点和面心,所以每个铜晶胞中平均含有8×+6×=4个铜原子;从CaCl2晶胞可以看出,和每个Ca2+紧邻的Cl-有8个,即Ca2+的配位数为8。
(5)在离子晶体中,离子所带电荷数越高,离子半径越小,晶格能越大,离子晶体的熔点越高;晶体MgO和NaCl均为离子晶体,MgO中的离子所带电荷数大于NaCl中的离子所带电荷数,且r(Mg2+)
9.C 解析 C60与金刚石均为碳元素形成的不同单质,二者互为同素异形体,故A正确;C60中的12C中子数为12-6=6,故B正确;石墨属于混合型晶体,故C错误;单层聚合碳60中有C—C键,属于非极性共价键,故D正确。
10.D 解析 Al2H6的熔点为150 ℃,由熔点低可知Al2H6为分子晶体,A正确;该物质燃烧放出大量的热量,可能成为未来的储氢材料和火箭燃料,B正确;由Al2H6的组成元素可知,燃烧产物为氧化铝和水,C正确;Al2H6为分子晶体,化合物中Al和H之间形成共价键,不含离子键,D错误。
11.C 解析 氧化亚铁晶胞中O2-数目为12×+1=4,A不符合题意;1个干冰晶胞中平均含有CO2分子个数为8×+6×=4,B不符合题意;氯化铯晶体中,每个Cs+周围距离最近的Cl-个数是8,C符合题意;在二氧化硅晶胞结构中,1个硅原子与4个氧原子形成4个Si—O键,D不符合题意。
12.D 解析 六方相氮化硼晶体中没有可以自由移动的电子或离子,所以不导电,A项错误;立方相氮化硼中只含有σ键,B项错误;立方相氮化硼是共价晶体,C项错误;由六方相氮化硼的晶体结构可知,每个硼原子与相邻3个氮原子构成平面三角形,D项正确。
13.答案 (1)碳原子排列的方式不同
(2)活泼 足球烯含π键,容易发生化学反应
(3)6 109°28'
(4)碳纳米管
解析 (1)都是碳元素组成的单质,但是由于碳原子在空间的排列方式不同,所以性质会有较大差异。
(2)足球烯中含有π键,所以比石墨和金刚石活泼。
(3)金刚石是共价晶体,在共价晶体里,原子间以共价键相互结合,形成三维的空间网状结构,最小的环上有6个C原子;每个碳原子与周围的4个碳原子形成正四面体结构,所以夹角为109°28'。
(4)碳纳米管表面积大,可以吸附H2,因此可能成为储氢材料。
14.答案 (1)混合型晶体 σ键、π键
(2)①SiX4属于分子晶体,相对分子质量越大,沸点越高 ②减弱 增强
(3)K3C60 2.0
解析 (1)碳的一种单质的结构如题图(a)所示,应为石墨,石墨属于混合型晶体,晶体中有σ键和π键。
(2)①四卤化硅为分子晶体,沸点与相对分子质量有关,相对分子质量越大,沸点越高。
②PbX2的熔点先降低后又稍有升高,其中PbF2为离子晶体,PbBr2、PbI2为分子晶体,可知依F、Cl、Br、I次序,PbX2中的化学键的离子性减弱、共价性增强。
(3)K位于立方体的棱上和体内,1个晶胞中的个数为12×+9=12,C60位于立方体的顶点和面心,1个晶胞中的个数为8×+6×=4,化学式为K3C60,则1个晶胞的质量为 g,其晶胞参数为1.4 nm=1.4×10-7 cm,则1个晶胞体积为(1.4×10-7)3 cm3,所以晶胞密度为 g·cm-3≈2.0 g·cm-3。
3
