化学人教版(2019)必修第一册1.3氧化还原反应 课件(共47张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3氧化还原反应 课件(共47张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-11 08:33:05 | ||
图片预览








文档简介
(共47张PPT)
化
还
原
氧
反
应
第一关:氧化还原反应的基本概念
你还爱我吗
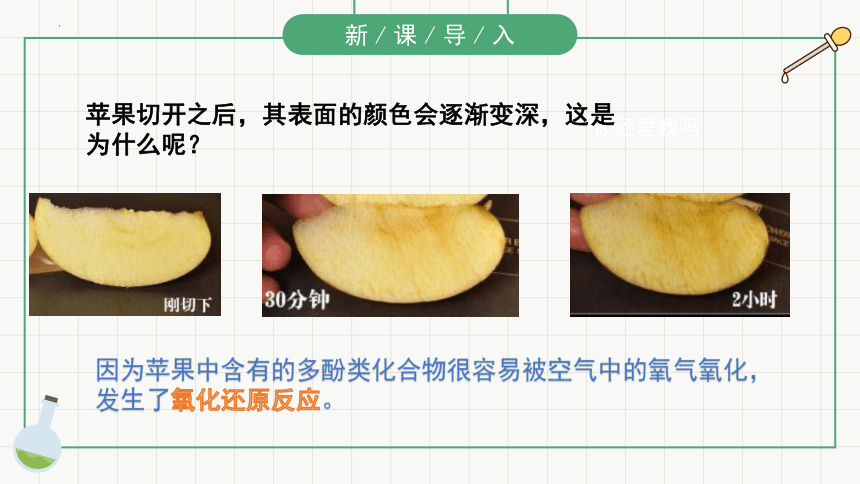
苹果切开之后,其表面的颜色会逐渐变深,这是为什么呢?
因为苹果中含有的多酚类化合物很容易被空气中的氧气氧化,发生了氧化还原反应。
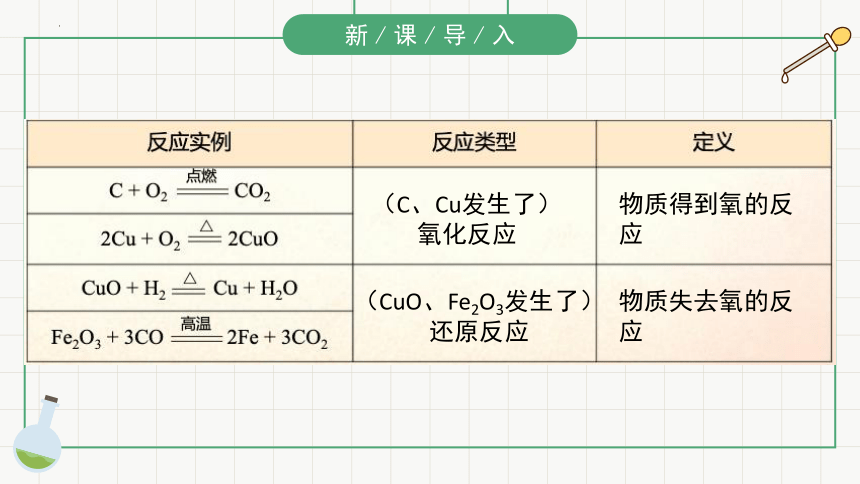
(C、Cu发生了)
氧化反应
物质失去氧的反应
物质得到氧的反应
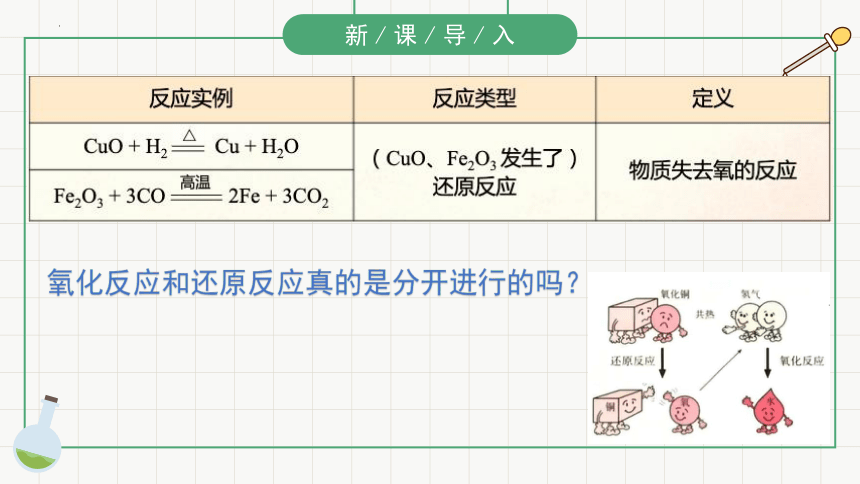
(CuO、Fe2O3发生了) 还原反应
氧化反应和还原反应真的是分开进行的吗?
氧化还原反应中不一定有氧的得失
H +CuO == Cu+H O
Fe2O3+3CO == 2Fe+3CO2
2Na+Cl2==2NaCl
HCl+Fe=FeCl2+H2
高温
点燃
判断一下,这几个反应是氧化还原反应吗?
氧化还原反应
(1)对于有氧元素参加的反应CuO+H2 Cu+H2O:
①铜元素化合价 ,发生 反应。
②氢元素化合价 ,发生 反应。
氧化还原反应
(2)对于无氧元素参加的反应Fe+CuSO4 Cu+FeSO4:
①铜元素化合价 ,发生 反应。
②铁元素化合价 ,发生 反应。
氧化还原反应
定义:凡是有元素化合价升降的反应,都是氧化还原反应
那些年曾经学过的化合价
常考变价非金属元素及常见化合价
常考变价金属元素及常见化合价
常见化合价口诀
一价氢、氯、钾、钠、银;
二价氧、钙、钡、镁、锌;
三铝、四硅、五价磷;
一二铜,二三铁、二四碳、二四六硫都齐全;
铜汞二价最常见。
判断一个化学反应是否属于氧化还原反应的方法是( )
A.观察是否发生了化合反应
B.观察是否有氧气参加反应
C.观察是否有单质参加反应
D.观察反应前后是否有元素的化合价发生变化
例1
例2
下列反应属于氧化还原反应的是( )
A. CaCO3+2HCl== CaCl2+H2O+CO2↑
B. CaCO3 == CaO+CO2↑
C. Na2O+H2O == 2NaOH
D. Mg+2HCl ==MgCl2+H2↑
变式1
第二关:氧还反应和四大基本反应
判断下列方程式是四种基本反应类型的哪一类?是不是氧化还原反应?
填空(A.一定 B.不一定 C.一定不)
(1)置换反应 ( )是氧化还原反应。
(2)复分解反应( )是氧化还原反应。
(3)化合反应和分解反应( )是氧化还原反应。
①有单质生成的分解反应( )是氧化还原反应。
②有单质参加的化合反应( )是氧化还原反应。
③有单质参加的反应( )是氧化还原反应。
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影 部分的是( )
A. Cl2 + 2KBr == Br2 + 2KCl
B. 2NaHCO3 Na2CO3 + H2O+CO2↑
C. 4NO2 + O2 + 2H2O == 4HNO3
D. 2Na2O2 + 2CO2 == 2Na2CO3 + O2
例1
人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应的关系可用图甲表示。图乙表示离子反应、氧化还原反应和置换反应三者之间的关系,则C表示( )
A.离子反应 B.氧化还原反应 C.置换反应 D.三者中的任一反应
变式1
第三关:氧化还原反应的相关概念
氧化还原反应的本质:
电子得失或者偏移
2Na+Cl2==2NaCl
点燃
氯化钠的形成过程
Na
化合价升高
失电子
Na
Cl
得电子
化合价降低
还原剂:在氧化还原反应中失去电子的物质。(化合价升高)
氧化剂:在氧化还原反应中得到电子的物质。(化合价降低)
定义
反应类型和反应产物分析
抢劫犯有抢钱的能力
有钱人有给钱的能力
抢劫犯A + 有钱人A==
有钱人B
+ 抢劫犯B
被给钱,得到给钱后的产物
被抢钱,得到抢钱后的产物
+氧化产物
被氧化,得到氧化产物
氧化剂 + 还原剂==
还原产物
被还原,得到还原产物
氧化剂有抢电子的能力(氧化性)
还原剂有给电子的能力(还原性)
①氧化剂:Cl2
氯元素化合价降低,氯原子 电子,Cl2做 剂,具有 性,发生还原反应,被还原。
②还原剂:Na
钠元素化合价升高,钠原子 电子,Na做 剂,具有 性,发生氧化反应,被氧化。
以2Na+Cl2==2NaCl为例进行分析
点燃
反应物分析
①氧化剂:Cl2
氯元素化合价降低,是因为共用电子对 氯原子,Cl2做 剂,具有 性,发生还原反应,被还原。
②还原剂:H2
氢元素化合价升高,是因为共用电子对 氢原子,H2做 剂,具有 性,发生氧化反应,被氧化。
以H2+Cl2==2HCl为例进行分析
点燃
反应物分析
氧化还原反应的本质
氧化还原反应的本质是有电子转移(电子得失或偏移)
判断氧化剂还原剂
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
Fe2O3+3CO == 2Fe+3CO2
高温
例1
在反应Fe2O3+Al==Fe+Al2O3中:
(1)____是还原剂,____是氧化剂;______是氧化产物,______是还原产物。(2)得到电子的是_____,失去电子的是_____;
具有氧化性的是___________,具有还原性的是_________;
(3)_____元素被氧化,______元素被还原。
例2
变式1
下列化学变化中,需加入氧化剂才能实现的是( )
A. CuO→Cu B. CO2→CO
C. C→CO2 D.H2SO4→BaSO4
C
变式2
【2019-2020东莞松山湖学校高一期中】
在反应:K2Cr207+14HCl===2KCl+2CrCl3+3Cl2+7H2O中:_____是氧化剂,________被氧化;
第四关:氧还反应的表示方法
双线桥法
同一元素
表示反应前后 由反应物转化为生成物时电子转移的情况。
(1)基本步骤
第一步:标价态
Fe2O3+3CO == 2Fe+3CO2
高温
第二步:连双线
第三步:注得失
Fe2O3+3CO == 2Fe+3CO2
高温
用双线桥法表示出下列反应的电子转移情况
S+ 6HNO3(浓)=H2SO4+6NO2↑+2H2O
练习
2.单线桥法
表示反应过程中 原子间的电子转移情况。
(1)基本步骤
不同元素
用单线桥法表示出下列反应的电子转移情况
S+ 6HNO3(浓)=H2SO4+6NO2↑+2H2O
练习
分析下列反应的化学方程式,是氧化还原反应的用双线桥法标出电子转移的方向和数目,指出被氧化和被还原的元素。
①2Na + Cl2 2NaCl;
②NaOH + HCl === NaCl + H2O
例1
用单线桥法标出下列反应电子转移的方向和数目。
①2H2S + SO2 === 3S↓ + 2H2O
②2Al + Fe2O3 ===Al2O3+ 2Fe
例2
高温
变式1
变式2
次
课
见
下
BYE
化
还
原
氧
反
应
第一关:氧化还原反应的基本概念
你还爱我吗
苹果切开之后,其表面的颜色会逐渐变深,这是为什么呢?
因为苹果中含有的多酚类化合物很容易被空气中的氧气氧化,发生了氧化还原反应。
(C、Cu发生了)
氧化反应
物质失去氧的反应
物质得到氧的反应
(CuO、Fe2O3发生了) 还原反应
氧化反应和还原反应真的是分开进行的吗?
氧化还原反应中不一定有氧的得失
H +CuO == Cu+H O
Fe2O3+3CO == 2Fe+3CO2
2Na+Cl2==2NaCl
HCl+Fe=FeCl2+H2
高温
点燃
判断一下,这几个反应是氧化还原反应吗?
氧化还原反应
(1)对于有氧元素参加的反应CuO+H2 Cu+H2O:
①铜元素化合价 ,发生 反应。
②氢元素化合价 ,发生 反应。
氧化还原反应
(2)对于无氧元素参加的反应Fe+CuSO4 Cu+FeSO4:
①铜元素化合价 ,发生 反应。
②铁元素化合价 ,发生 反应。
氧化还原反应
定义:凡是有元素化合价升降的反应,都是氧化还原反应
那些年曾经学过的化合价
常考变价非金属元素及常见化合价
常考变价金属元素及常见化合价
常见化合价口诀
一价氢、氯、钾、钠、银;
二价氧、钙、钡、镁、锌;
三铝、四硅、五价磷;
一二铜,二三铁、二四碳、二四六硫都齐全;
铜汞二价最常见。
判断一个化学反应是否属于氧化还原反应的方法是( )
A.观察是否发生了化合反应
B.观察是否有氧气参加反应
C.观察是否有单质参加反应
D.观察反应前后是否有元素的化合价发生变化
例1
例2
下列反应属于氧化还原反应的是( )
A. CaCO3+2HCl== CaCl2+H2O+CO2↑
B. CaCO3 == CaO+CO2↑
C. Na2O+H2O == 2NaOH
D. Mg+2HCl ==MgCl2+H2↑
变式1
第二关:氧还反应和四大基本反应
判断下列方程式是四种基本反应类型的哪一类?是不是氧化还原反应?
填空(A.一定 B.不一定 C.一定不)
(1)置换反应 ( )是氧化还原反应。
(2)复分解反应( )是氧化还原反应。
(3)化合反应和分解反应( )是氧化还原反应。
①有单质生成的分解反应( )是氧化还原反应。
②有单质参加的化合反应( )是氧化还原反应。
③有单质参加的反应( )是氧化还原反应。
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影 部分的是( )
A. Cl2 + 2KBr == Br2 + 2KCl
B. 2NaHCO3 Na2CO3 + H2O+CO2↑
C. 4NO2 + O2 + 2H2O == 4HNO3
D. 2Na2O2 + 2CO2 == 2Na2CO3 + O2
例1
人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应的关系可用图甲表示。图乙表示离子反应、氧化还原反应和置换反应三者之间的关系,则C表示( )
A.离子反应 B.氧化还原反应 C.置换反应 D.三者中的任一反应
变式1
第三关:氧化还原反应的相关概念
氧化还原反应的本质:
电子得失或者偏移
2Na+Cl2==2NaCl
点燃
氯化钠的形成过程
Na
化合价升高
失电子
Na
Cl
得电子
化合价降低
还原剂:在氧化还原反应中失去电子的物质。(化合价升高)
氧化剂:在氧化还原反应中得到电子的物质。(化合价降低)
定义
反应类型和反应产物分析
抢劫犯有抢钱的能力
有钱人有给钱的能力
抢劫犯A + 有钱人A==
有钱人B
+ 抢劫犯B
被给钱,得到给钱后的产物
被抢钱,得到抢钱后的产物
+氧化产物
被氧化,得到氧化产物
氧化剂 + 还原剂==
还原产物
被还原,得到还原产物
氧化剂有抢电子的能力(氧化性)
还原剂有给电子的能力(还原性)
①氧化剂:Cl2
氯元素化合价降低,氯原子 电子,Cl2做 剂,具有 性,发生还原反应,被还原。
②还原剂:Na
钠元素化合价升高,钠原子 电子,Na做 剂,具有 性,发生氧化反应,被氧化。
以2Na+Cl2==2NaCl为例进行分析
点燃
反应物分析
①氧化剂:Cl2
氯元素化合价降低,是因为共用电子对 氯原子,Cl2做 剂,具有 性,发生还原反应,被还原。
②还原剂:H2
氢元素化合价升高,是因为共用电子对 氢原子,H2做 剂,具有 性,发生氧化反应,被氧化。
以H2+Cl2==2HCl为例进行分析
点燃
反应物分析
氧化还原反应的本质
氧化还原反应的本质是有电子转移(电子得失或偏移)
判断氧化剂还原剂
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
Fe2O3+3CO == 2Fe+3CO2
高温
例1
在反应Fe2O3+Al==Fe+Al2O3中:
(1)____是还原剂,____是氧化剂;______是氧化产物,______是还原产物。(2)得到电子的是_____,失去电子的是_____;
具有氧化性的是___________,具有还原性的是_________;
(3)_____元素被氧化,______元素被还原。
例2
变式1
下列化学变化中,需加入氧化剂才能实现的是( )
A. CuO→Cu B. CO2→CO
C. C→CO2 D.H2SO4→BaSO4
C
变式2
【2019-2020东莞松山湖学校高一期中】
在反应:K2Cr207+14HCl===2KCl+2CrCl3+3Cl2+7H2O中:_____是氧化剂,________被氧化;
第四关:氧还反应的表示方法
双线桥法
同一元素
表示反应前后 由反应物转化为生成物时电子转移的情况。
(1)基本步骤
第一步:标价态
Fe2O3+3CO == 2Fe+3CO2
高温
第二步:连双线
第三步:注得失
Fe2O3+3CO == 2Fe+3CO2
高温
用双线桥法表示出下列反应的电子转移情况
S+ 6HNO3(浓)=H2SO4+6NO2↑+2H2O
练习
2.单线桥法
表示反应过程中 原子间的电子转移情况。
(1)基本步骤
不同元素
用单线桥法表示出下列反应的电子转移情况
S+ 6HNO3(浓)=H2SO4+6NO2↑+2H2O
练习
分析下列反应的化学方程式,是氧化还原反应的用双线桥法标出电子转移的方向和数目,指出被氧化和被还原的元素。
①2Na + Cl2 2NaCl;
②NaOH + HCl === NaCl + H2O
例1
用单线桥法标出下列反应电子转移的方向和数目。
①2H2S + SO2 === 3S↓ + 2H2O
②2Al + Fe2O3 ===Al2O3+ 2Fe
例2
高温
变式1
变式2
次
课
见
下
BYE
