化学苏教版(2019)必修第一册 5.1.2元素周期表元素周期表的应用 课件(共22张PPT)
文档属性
| 名称 | 化学苏教版(2019)必修第一册 5.1.2元素周期表元素周期表的应用 课件(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-11 10:30:13 | ||
图片预览





文档简介
(共22张PPT)
5.1.2 元素周期表 元素周期表的应用
一、元素周期表的结构
1.编排依据
元素周期表是元素周期律的具体表现形式
2.编排原则
①按原子序数递增的顺序从左到右排列。
②将电子层数相同的元素排成一个横行。
③将最外层电子相同(外围电子排布相似)的元素按电子层的递增的顺序从上到下排成纵行。
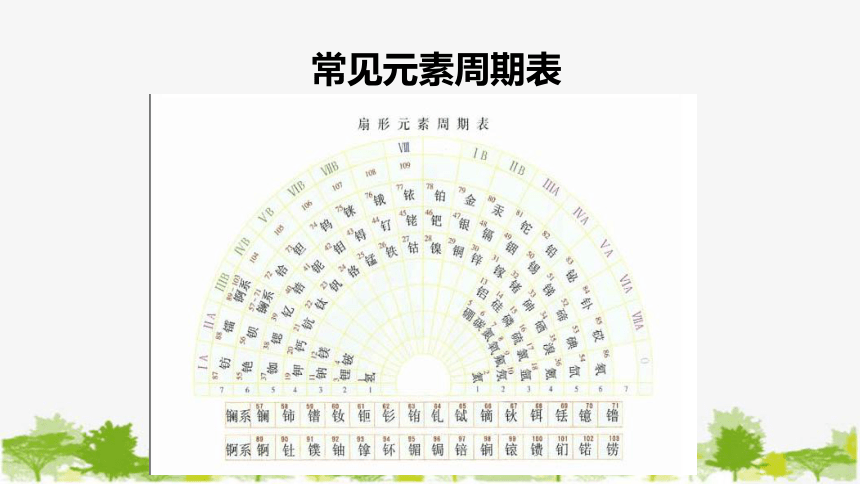
常见元素周期表
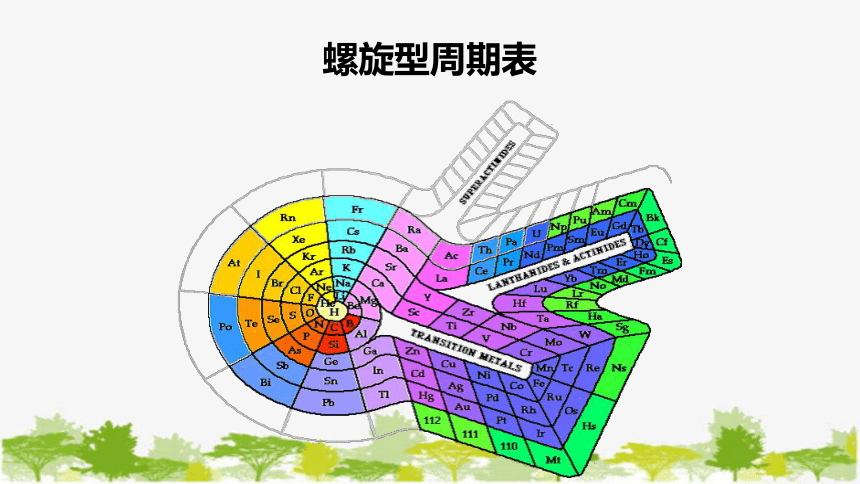
螺旋型周期表
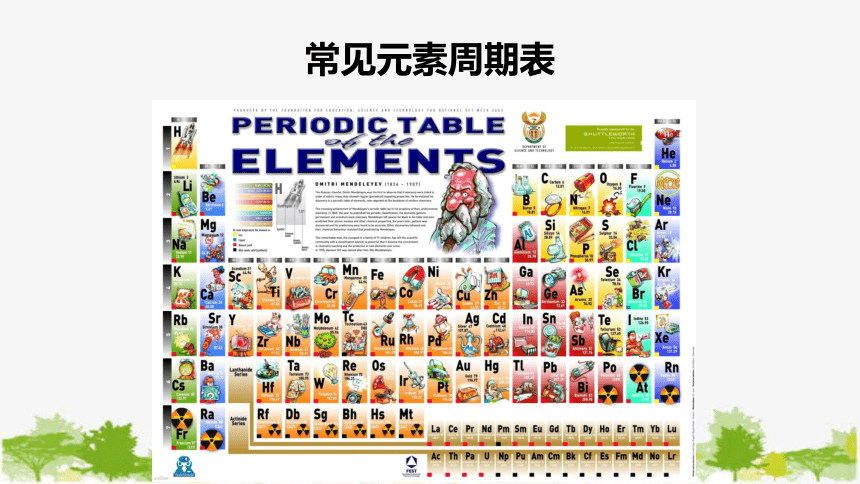
常见元素周期表
仔细阅读研究元素周期表,交流讨论以下问题:
(一)横排
1.有多少个横行?每个横行称为什么?
2.同行元素组合起来的依据是什么?电子层数与周期序数有何关系?
3.每横行各有多少种元素?首尾各是什么元素?原子序数各是多少?
短周期
长周期
第1周期:2 种元素 1H~2He
第2周期:8 种元素 3Li~10Ne
第3周期:8 种元素 11Na~18Ar
第4周期:18 种元素 19K~36Kr
第5周期:18 种元素 37Rb~54Xe
第6周期:32 种元素 55Cs~86Rn
第7周期:26种元素 87Fr~
(也叫不完全周期)
周期
(横向)
1.周期
周期序数=电子层数
仔细阅读研究元素周期表,交流讨论以下问题:
1.有多少纵行?每个纵行称为一个族吗?分析族序数在写法上有何不同?
2.据你所知,同一主族元素的原子结构有何特点,与其族序数有何关系?你能写出从左到右各族的序数吗?
族
(纵行)
主族:
副族:
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
1 2 13 14 15 16 17
第VIII 族:
稀有气体元素(第18纵行)
零族:
(七个)
ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB,ⅠB , ⅡB
3 4 5 6 7 11 12
(七个)
包含三列第8、9、10三纵行
18个纵行16个族
2.族
概念:周期表中的每一个纵行称为一族
主族元素族序数=最外层电子数
已知某主族元素的原子结构示意图如下,判断其位于第几周期,第几族?
1.第四周期,IA族 2.第三周期,ⅦA族 3.第四周期,ⅣA族
小结
二、元素的性质和元素周期表的位置关系
1.同周期元素的性质变化规律
Na
11钠
Mg
12镁
Al
13铝
Si
14硅
P
15磷
S
16硫
Cl
17氯
Ar
18氩
3
同一
周期
最 外 层 电 子 数 逐 渐 增 多
原 子 半 径 逐 渐 减 小(稀有气体除外)
金 属 性 逐 渐 减 弱,非 金 属 性 逐 渐 增 强
电子层数相同
交流与讨论
阅读表5-6,从碱金属与水反应的现象来看,你认为ⅠA族元素(氢元素除外) 金属性强弱变化规律。
碱金属 Li Na K Rb Cs
与水反应的现象 反应较为缓和,锂浮在水面上、并以稳定、适中的速度释放出气体 反应迅速并放热、钠融化成小球 反应迅速,并伴有燃烧,轻微爆炸 剧烈反应,发生爆炸 剧烈反应,发生剧烈爆炸
金属性:Li<Na<K<Rb<Cs
2、同主族元素性质的变化规律
电
子
层
数
依
次
增
多
原
子
半
径
依
次
增
大
单
质
还
原
性
增
强
金
属
性
增
强
最外层电
子
数
相同
卤族元素递变规律
完成下列实验,观察实验现象,写出相应化学方程式
单质氧化性:Cl2>Br2>I2
都分层
①:下层为橙色
②:下层为紫色
分层
下层为紫色
Cl2+2NaBr=Br2+2NaClCl2+2KI=I2+2NaCl
Br2+2KI=I2+2NaBr
电
子
层
数
依
次
增
多
原
子
半
径
依
次
增
大
非
金
属
性
减
弱
最外层电
子
数
相同
单
质
氧
化
性
减
弱
0
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
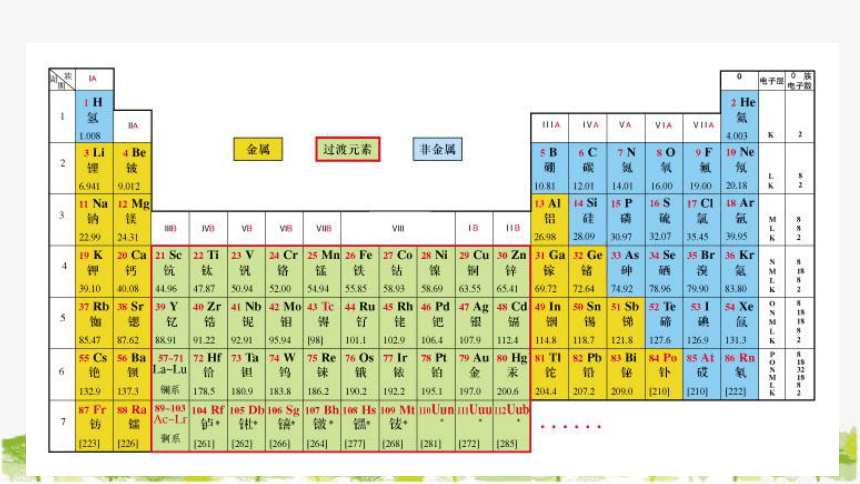
①请同学们在元素周期表中找出金属性最强的元素(放射性元素除外)和非金属性最强的元素。
金属性最强的元素位于周期表左下角(除放射性元素外)是铯(Cs);非金属性最强的元素位于周期表的右上角,是氟(F)。
②请分析虚线右上方和左下方元素是金属还是非金属。
右上方为非金属,左下方为金属。
2.位、构、性之间的关系
(1)元素的 决定了元素在周期表中的位置。
(2)元素在周期表中的位置反映了元素的 和元素的 。
原子结构
原子结构
性质
三、元素周期表的应用
(1)根据元素在周期表中的位置,推测元素的 ,预测
其主要 。
(2)寻找原料:
①在金属和非金属的分界线附近寻找 材料(如 、Ge等);
②在 元素中寻找各种优良的催化剂及耐高温、耐腐蚀的合金材料。
原子结构
性质
半导体
Si
过渡
5.1.2 元素周期表 元素周期表的应用
一、元素周期表的结构
1.编排依据
元素周期表是元素周期律的具体表现形式
2.编排原则
①按原子序数递增的顺序从左到右排列。
②将电子层数相同的元素排成一个横行。
③将最外层电子相同(外围电子排布相似)的元素按电子层的递增的顺序从上到下排成纵行。
常见元素周期表
螺旋型周期表
常见元素周期表
仔细阅读研究元素周期表,交流讨论以下问题:
(一)横排
1.有多少个横行?每个横行称为什么?
2.同行元素组合起来的依据是什么?电子层数与周期序数有何关系?
3.每横行各有多少种元素?首尾各是什么元素?原子序数各是多少?
短周期
长周期
第1周期:2 种元素 1H~2He
第2周期:8 种元素 3Li~10Ne
第3周期:8 种元素 11Na~18Ar
第4周期:18 种元素 19K~36Kr
第5周期:18 种元素 37Rb~54Xe
第6周期:32 种元素 55Cs~86Rn
第7周期:26种元素 87Fr~
(也叫不完全周期)
周期
(横向)
1.周期
周期序数=电子层数
仔细阅读研究元素周期表,交流讨论以下问题:
1.有多少纵行?每个纵行称为一个族吗?分析族序数在写法上有何不同?
2.据你所知,同一主族元素的原子结构有何特点,与其族序数有何关系?你能写出从左到右各族的序数吗?
族
(纵行)
主族:
副族:
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
1 2 13 14 15 16 17
第VIII 族:
稀有气体元素(第18纵行)
零族:
(七个)
ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB,ⅠB , ⅡB
3 4 5 6 7 11 12
(七个)
包含三列第8、9、10三纵行
18个纵行16个族
2.族
概念:周期表中的每一个纵行称为一族
主族元素族序数=最外层电子数
已知某主族元素的原子结构示意图如下,判断其位于第几周期,第几族?
1.第四周期,IA族 2.第三周期,ⅦA族 3.第四周期,ⅣA族
小结
二、元素的性质和元素周期表的位置关系
1.同周期元素的性质变化规律
Na
11钠
Mg
12镁
Al
13铝
Si
14硅
P
15磷
S
16硫
Cl
17氯
Ar
18氩
3
同一
周期
最 外 层 电 子 数 逐 渐 增 多
原 子 半 径 逐 渐 减 小(稀有气体除外)
金 属 性 逐 渐 减 弱,非 金 属 性 逐 渐 增 强
电子层数相同
交流与讨论
阅读表5-6,从碱金属与水反应的现象来看,你认为ⅠA族元素(氢元素除外) 金属性强弱变化规律。
碱金属 Li Na K Rb Cs
与水反应的现象 反应较为缓和,锂浮在水面上、并以稳定、适中的速度释放出气体 反应迅速并放热、钠融化成小球 反应迅速,并伴有燃烧,轻微爆炸 剧烈反应,发生爆炸 剧烈反应,发生剧烈爆炸
金属性:Li<Na<K<Rb<Cs
2、同主族元素性质的变化规律
电
子
层
数
依
次
增
多
原
子
半
径
依
次
增
大
单
质
还
原
性
增
强
金
属
性
增
强
最外层电
子
数
相同
卤族元素递变规律
完成下列实验,观察实验现象,写出相应化学方程式
单质氧化性:Cl2>Br2>I2
都分层
①:下层为橙色
②:下层为紫色
分层
下层为紫色
Cl2+2NaBr=Br2+2NaClCl2+2KI=I2+2NaCl
Br2+2KI=I2+2NaBr
电
子
层
数
依
次
增
多
原
子
半
径
依
次
增
大
非
金
属
性
减
弱
最外层电
子
数
相同
单
质
氧
化
性
减
弱
0
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
①请同学们在元素周期表中找出金属性最强的元素(放射性元素除外)和非金属性最强的元素。
金属性最强的元素位于周期表左下角(除放射性元素外)是铯(Cs);非金属性最强的元素位于周期表的右上角,是氟(F)。
②请分析虚线右上方和左下方元素是金属还是非金属。
右上方为非金属,左下方为金属。
2.位、构、性之间的关系
(1)元素的 决定了元素在周期表中的位置。
(2)元素在周期表中的位置反映了元素的 和元素的 。
原子结构
原子结构
性质
三、元素周期表的应用
(1)根据元素在周期表中的位置,推测元素的 ,预测
其主要 。
(2)寻找原料:
①在金属和非金属的分界线附近寻找 材料(如 、Ge等);
②在 元素中寻找各种优良的催化剂及耐高温、耐腐蚀的合金材料。
原子结构
性质
半导体
Si
过渡
