化学人教版(2019)选择性必修第一册 3.2.1水的电离 课件(共37张PPT)
文档属性
| 名称 | 化学人教版(2019)选择性必修第一册 3.2.1水的电离 课件(共37张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 398.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-11 14:40:08 | ||
图片预览









文档简介
(共37张PPT)
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH
第一课时 水的电离
【思考与讨论】
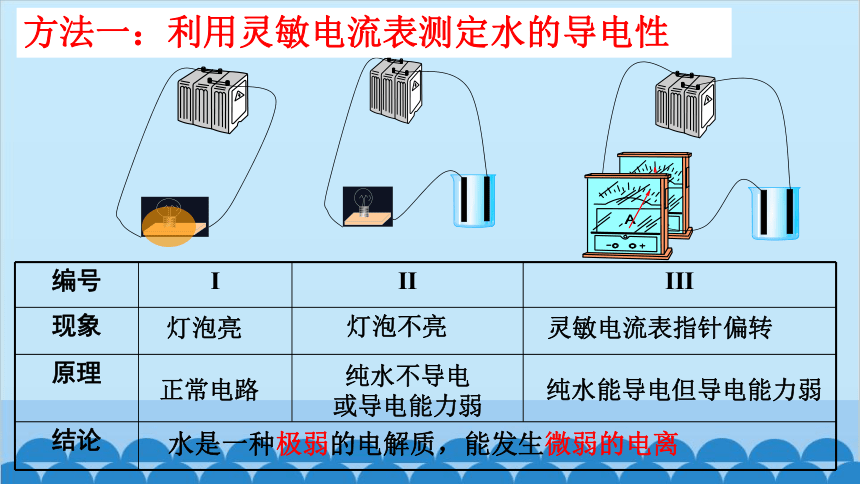
在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么,其中的溶剂水是全部以分子形式存在(如图3-5),还是部分以离子形式存在呢 怎样验证你的猜想?
编号 I II III
现象
原理
结论
灯泡亮
灯泡不亮
灵敏电流表指针偏转
方法一:利用灵敏电流表测定水的导电性
水是一种极弱的电解质,能发生微弱的电离
正常电路
纯水不导电
或导电能力弱
纯水能导电但导电能力弱
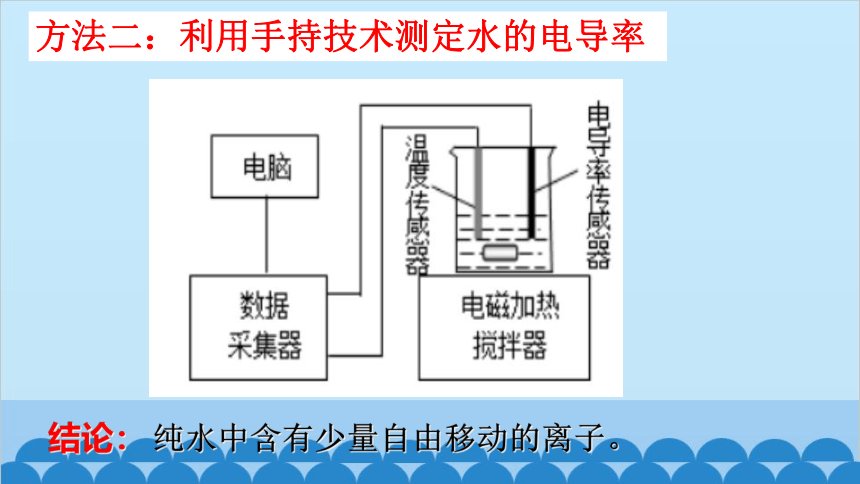
方法二:利用手持技术测定水的电导率
结论: 纯水中含有少量自由移动的离子。
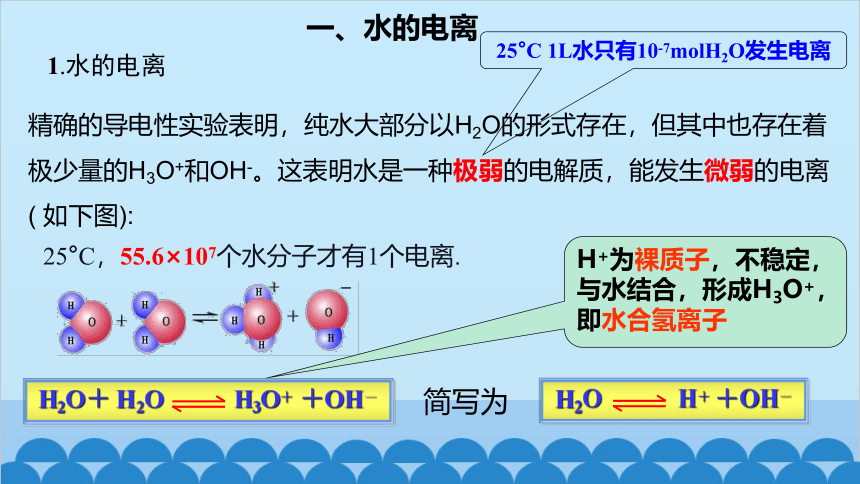
精确的导电性实验表明,纯水大部分以H2O的形式存在,但其中也存在着极少量的H3O+和OH-。这表明水是一种极弱的电解质,能发生微弱的电离( 如下图):
一、水的电离
1.水的电离
25°C 1L水只有10-7molH2O发生电离
H2O+ H2O H3O+ +OH-
简写为
H2O H+ +OH-
25°C,55.6×107个水分子才有1个电离.
H+为裸质子,不稳定,与水结合,形成H3O+,即水合氢离子
(1)定义
当水的电离达到平衡时,电离产物H+和OH-浓度之积是一个常数,叫做水的离子积常数,记作KW,水的离子积常数,简称水的离子积。KW可由实验测得,也可以通过理论计算求得。
(2)表达式KW=c(H+)·c(OH-),
25 ℃时,在室温下,纯水中的c(H+)=c(OH-)=10-7mol·L-1,KW=1.0×10-14。
2.水的离子积常数
【思考】如何衡量水的电离的限度?
分析表格中的数据,有何规律,并解释之。
Kw
100℃
50℃
25℃
20℃
0℃
温度
1.14×10-15 6.81×10-15 1×10-14 5.47×10-14 1×10-12
温度越高,Kw越大。
Kw在一定温度下是个常数,水的电离是吸热过程,升高温度,促进水的电离,Kw增大。Kw只于温度有关,与浓度无关。
不同温度下水的离子积常数
KW不仅适用于纯水,还可适用于稀的电解质水溶液。
(3)影响因素
水的离子积KW只受温度的影响,与溶液的酸碱性无关;温度升高,KW增大。
(4)适用范围
(5)Kw揭示了在任何水溶液中均存在H+和OH-,只要温度不变,Kw不变。
【思考】水的离子积也是一个平衡常数,和其他平衡常数一样,它受那些因素影响呢?
易错提醒:
1.水的离子积常数Kw=c(H+)·c(OH-),不仅适用于纯水,也适用于一切酸、碱、盐的稀溶液。在任何酸、碱、盐的稀溶液中,只要温度一定,Kw就一定。
2.在不同溶液中,c(H+)、c(OH-)可能不同,但任何溶液中由水电离产生的c(H+)、c(OH-)总是相等的。在Kw的表达式中,c(H+)、c(OH-)均表示整个溶液中H+、OH-总的物质的量浓度而不是单指由水电离出的c(H+)、c(OH-)。
3.水的离子积常数显示了在任何水溶液中均存在水的电离平衡,都有H+和OH-共存,只是相对含量不同而已。
4.水的电离是吸热过程,升高温度,水的电离平衡向电离方向移动,c(H+)和c(OH-)都增大,故Kw增大,但溶液仍呈中性;对于Kw,若未注明温度,一般认为在常温下,即25 ℃。
思考与讨论
1、酸性溶液中是否存在OH- 碱性溶液中是否存在H+ 试解释原因。
答:酸性溶液中存在OH-,碱性溶液中存在H+。因这些溶液中都存在弱电解质水的电离。
2、一定温度下,加水稀释盐酸,溶液中的c(H+)、c(OH-)都减小,对吗
答:不对;稀释盐酸,溶液中的c(H+)减小,但因为温度不变,KW=c(H+)·c(OH-)不变,所以c(OH-)增大。
3、试分析酸性溶液中c(H+)、c(OH-)的来源,在酸或碱溶液中水电离出的c(H+)与c(OH-)还相等吗?及KW的计算方法。
答:c(H+)来源于酸电离和水电离,且c(H+)酸 c(H+)水 ,c(H+)水可以忽略;c(OH-)来源于水的电离,且电离程度很小。由水电离出的c(H+)与c(OH-)仍然相等;KW=[c(H+)酸+c(H+)水]·c(OH-)水≈c(H+)酸·c(OH-)水。
思考:
常温下,将0.1molHCl气体通入水中形成1L溶液, c(H+)与c(OH-)还相等吗?KW相变不变?为什么?
c(H+)=_______________,来源于_________________
c(OH-)=_______________,来源于_________________
KW=_______________。
由水电离出的c(H+)水=_______________,
c(OH-)水=_______________。
0.1 mol/L
酸的电离和水的电离
1.0×10-13 mol/L
水的电离
1.0×10-14
1.0×10-13 mol/L
1.0×10-13 mol/L
点拨—水电离出的c(H+)或c(OH-)的计算思路
Kw表达式中c(H+)、c(OH-)均表示整个溶液中所有H+、OH-的总物质的量浓度,但是一般情况下有:
(1)酸溶液中Kw=c(H+)酸·c(OH-)水(忽略水电离出的H+的浓度)。
(2)碱溶液中Kw=c(H+)水·c(OH-)碱(忽略水电离出的OH-的浓度)
(3)外界条件改变,水的电离平衡发生移动;但由水电离出的c水(H+)与c水(OH-)一定相等。
例题.常温下,0.1 mol·L-1的NaOH溶液中由水电离出的OH-的物质的量浓度为( )
A.0.1 mol·L-1 B.1.0×10-13 mol·L-1
C.1.0×10-7 mol·L-1 D.1.0×10-6 mol·L-1
B
碱溶液中Kw =
c(H+)水 · c(OH-)碱
c(OH-)水=
c(H+)水 =
Kw
c(OH-)碱
=
1×10-14
1×10-1 mol/L
= 1×10-13 mol/L
解析:
1. 在25℃ 0.01mol/L盐酸溶液中:
c(H+) = , c(OH-) = ;
c(H+)水= , c(OH-)水= 。
2. 在25℃ 0.01mol/L NaOH溶液中:
c(H+)= , c(OH-)= ;
c(H+)水= , c(OH-)水= 。
0.01mol/L
10-12mol/L
10-12mol/L
10-12mol/L
10-12mol/L
0.01mol/L
10-12mol/L
10-12mol/L
■加酸后Kw =1×10-14酸溶液中Kw =c(H+)酸 · c(OH-)水
=c(H+)水
■加碱后Kw =1×10-14碱溶液中Kw =c(OH-)碱·c(H+)水
=c(OH-)水
KW不仅适用于纯水,还可适用于稀的电解质水溶液。
(3)影响因素
水的离子积KW只受温度的影响,与溶液的酸碱性无关;温度升高,KW增大。
(4)适用范围
(5)Kw揭示了在任何水溶液中均存在H+和OH-,只要温度不变,Kw不变。
【思考】水的离子积也是一个平衡常数,和其他平衡常数一样,它受那些因素影响呢?
3.影响水的电离平衡的因素
H2O H+ +OH-
△H>0
(1)水电离吸热,升温将促进水的电离,故平衡右移
(2)加入酸
增大c(H+),则平衡向左移动,水的电离被抑制,由于水的电离平衡仍然存在,Kw不变,则c(OH-)必然会减小。
(3)加入碱
增大c(OH-),则平衡向左移动,水的电离被抑制,由于水的电离平衡仍然存在,Kw不变,则c(H+)必然会减小。
(4)其它因素:
如向水中加入活泼金属,由于与水电离出的H+直接作用,因而促进了水的电离。
注意:KW是一个温度函数只随温度的升高而增大
影响因素 水的电离平衡移动 影响结果
方向 原因 KW c(H+)变化 c(OH-)变化 c(H+)与c(OH-)的关系
温度 升温 右移 水的电离过程吸热 增大 增大 增大 c(H+)=c(OH-)
降温 左移 减小 减小 减小 c(H+)=c(OH-)
加酸 左移 增大了c(H+) 不变 增大 减小 c(H+)>c(OH-)
加碱 左移 增大了c(OH-) 不变 减小 增大 c(H+)外加活泼金属 右移 金属消耗水电离出的H+ 不变 减小 增大 c(H+)外界条件对水电离平衡的具体影响
加入强酸
增大[OH-]
增大[H+]
减小[H+]:加入强碱弱酸盐
减小[OH-]:加入强酸弱碱盐
升高温度
降低温度
加入强酸及中强酸的酸式盐。
抑制水电离
促进水电离
加入弱酸
加入强碱
加入弱碱
【总结】
练习.温度125 ℃时,水的电离达到平衡:H2O H++OH- ΔH>0。下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)减小
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体钠,平衡逆向移动,c(H+)减小
D.将水加热,KW增大,c(H+)不变
B
解析:向水中加入稀氨水,OH-浓度增大,水的电离平衡逆向移动,A项错误;硫酸氢钠是强酸酸式盐,向水中加入少量固体硫酸氢钠,其在水溶液中完全电离:
c(H+)增大,相当于加酸;由于KW只与温度有关,所以KW不变,B项正确;向水中加入少量固体钠,由于金属钠非常活泼,可与水电离出的H+直接发生置换反应,产生H2,故促进了水的电离,使平衡正向移动,C项错误;将水加热,KW增大,c(H+)、c(OH-)同等倍数增大,D项错误。
1、在常温下,由水电离产生的c(H+) =1×10-9 mol/L的溶液,则该溶液的酸碱性如何?
答:不一定呈酸性。
2、某溶液中c(H+) =1×10-6 mol/L,该溶液一定呈酸性吗
答:可能是酸性也可能是碱性。
思考与讨论
根据常温时水的电离平衡,运用平衡移动原理分析下列问题。(1)酸性溶液中是否存在OH- 碱性溶液中是否存在H+ 试解释原因。
提示:酸性溶液中存在OH-,碱性溶液中存在H+。因这些溶液中都存在弱电解质水的电离。
【思考与讨论】
二、溶液的酸碱性与pH
(2)比较常温时下列情况中,c(H+)和c(OH-)的值或变化趋势(选填“增大”或“减小”“1×10-7 mol·L-1”“相等”)
体系 纯水 向纯水中加入少量盐酸 向纯水中加入少量氢氧化钠溶液
c(H+)
c(OH-)
c(H+)和c(OH-)的大小比较
10-7 mol·L-1
10-7 mol·L-1
相等
增大
减小
减小
增大
1.溶液的酸碱性与c(H+)、c(OH-)的关系
无论是酸溶液中还是碱溶液或盐溶液中都同时存在H+和OH-!
溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小
任意条件下,溶液酸碱性的判断依据:
若c(H+)= c(OH-),中性
若c(H+)> c(OH-),酸性,c(H+)越大,酸性越强
若c(H+)< c(OH-),碱性,c(OH-)越大,碱性越强
25℃时
中性:
c(H+)=1×10-7 mol/L
酸性:
c(H+)>1×10-7 mol/L
碱性:
c(H+)<1×10-7 mol/L
Kw表达式中,c(H+)、c(OH-)均表示整个溶液中总物质的量浓度,但是一般情况下有:
(1)酸溶液中Kw=c(H+)酸·c(OH-)水(忽略水电离出的H+的浓度),即c(H+)水=c(OH-)水=Kw/c(H+)酸。
(2)碱溶液中Kw=c(H+)水·c(OH-)碱(忽略水电离出的OH-的浓度),即c(H+)水=Kw/c(OH-)碱。
(3)纯水中,水电离出的c(H+)与水电离出的c(OH-)一定相等,即c(H+)=c(OH-)= 。
三、水电离出的c(H+)或c(OH-)的计算
(1)计算溶液中水电离出的c(H+)与c(OH-)时注意以下几点:
①因为H2O H++OH-,所以由水电离出的c(H+)=c(OH-)。
②酸溶液中的OH-和碱溶液中的H+都是水电离出的。
(2)计算溶液中水电离出的c(H+)与c(OH-)的方法:
①计算酸溶液中水电离出的c(H+)时,首先根据已知条件计算溶液中的c(H+)再根据KW=c(H+)·c(OH-)计算出溶液中的c(OH-),然后根据水电离出的c(H+)=c(OH-),确定由水电离出的c(H+)。
②计算碱溶液中水电离出的c(OH-)时,首先根据已知条件计算溶液中的c(OH-),再根据KW=c(H+)·c(OH-)计算出溶液中的c(H+),然后根据水电离出的c(OH-)=c(H+),确定由水电离出的c(OH-)。
例题.常温下,0.1 mol·L-1的NaOH溶液中由水电离出的OH-的物质的量浓度为( )
A.0.1 mol·L-1 B.1.0×10-13 mol·L-1
C.1.0×10-7 mol·L-1 D.1.0×10-6 mol·L-1
B
(1)温度一定时,水的电离常数与水的离子积常数相等。 ( )
(2)100 ℃的纯水中c(H+)=1×10-6 mol·L-1,此时水呈酸性。
( )
(3)任何温度下,利用H+和OH-浓度的相对大小均可判断溶液的酸碱性。 ( )
(4)某溶液的c(H+)>10-7 mol·L-1,则该溶液呈酸性。 ( )
1.判断正误(正确的打“√”,错误的打“×”)
×
×
×
√
(5)在蒸馏水中滴加浓硫酸,KW不变。 ( )
(6)25 ℃与60 ℃时,水的pH相等。 ( )
(7)25 ℃时NH4Cl溶液的KW大于100 ℃时NaCl溶液的KW。 ( )
(8)任何水溶液中均存在H+和OH-,且水电离出的c(H+)和c(OH-)相等。
( )
(9)室温下,0.1 mol·L-1的HCl溶液与0.1 mol·L-1的NaOH溶液中水的电离程度相同。 ( )
(10)向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,KW不变。 ( )
×
×
×
×
√
√
2.25 ℃时,水的电离达到平衡:H2O H++OH- ΔH>0。下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)减小
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体钠,平衡逆向移动,c(H+)减小
D.将水加热,KW增大,c(H+)不变
B
解析:向水中加入稀氨水,OH-浓度增大,水的电离平衡逆向移动,A项错误;硫酸氢钠是强酸酸式盐,向水中加入少量固体硫酸氢钠,其在水溶液中完全电离: c(H+)增大,由于KW只与温度有关,所以KW不变,B项正确;向水中加入少量固体钠,由于金属钠非常活泼,可与水电离出的H+直接发生置换反应,产生H2,故促进了水的电离,使平衡正向移动,C项错误;将水加热,KW增大,c(H+)、c(OH-)同等倍数增大,D项错误。
3.下列叙述正确的是( )
A.某温度下,蒸馏水中的c(H+)=2.0×10-7 mol·L-1,则该温度一定高于25 ℃
B.25 ℃时,某液体中c(H+)和c(OH-)的乘积为1×10-14,该液体一定为纯水
C.25 ℃时,向水中加入氢氧化钠固体,水的电离平衡逆向移动,水的离子积减小
D.25 ℃时,0.1 mol·L-1的盐酸与0.1 mol·L-1的NaOH溶液中,水的电离程度不同
解析:某温度下,蒸馏水中的c(H+)=2.0×10-7 mol·L-1,水的离子积为4×10-14,比25 ℃时的水的离子积大,因为水的电离吸热,则该温度必然高于25 ℃;25 ℃时,任何水溶液中c(H+)和c(OH-)的乘积均为1×10-14;水中加入氢氧化钠固体,水的电离平衡逆向移动,但水的离子积不变;同浓度的H+和OH-对水的电离的抑制程度相同。
A
4.下列溶液一定呈中性的是( )
A.使石蕊溶液呈紫色的溶液
B.c(H+)=c(OH-)的溶液
C.由强酸、强碱等物质的量反应得到的溶液
D.非电解质溶于水得到的溶液
解析:等物质的量的强酸与强碱,由于它们所含H+和OH-的物质的量未知,因此无法判断它们混合后溶液的酸碱性,故C错误;非电解质溶于水,可以使溶液显酸性、碱性或中性,如SO2溶于水生成H2SO3,溶液显酸性,NH3溶于水生成NH3·H2O,溶液显碱性,乙醇、蔗糖等溶于水,溶液显中性,故D错误。
B
5.下列关于水的离子积常数的叙述中,正确的是( )
A.因为水的离子积常数的表达式是KW=c(H+)·c(OH-),所以KW随溶液中c(H+)和c(OH-)的变化而变化
B.水的离子积常数KW与水的电离平衡常数K电离是同一个物理量
C.水的离子积常数仅仅是温度的函数,随着温度的变化而变化
D.水的离子积常数KW与水的电离平衡常数K电离是两个没有任何关系的物理量
解析:水的离子积常数KW=K电离·c(H2O),一定温度下K电离和c(H2O)都是不变的常数,所以KW仅仅是温度的函数。水的离子积常数的表达式是KW=c(H+)·c(OH-),但是只要温度一定,KW就是不变的常数。溶液中H+的浓度变大,则OH-的浓度会变小,反之亦然。
C
6.常温时,向水中加入少量NaOH溶液,水的电离改变和溶液中KW的变化正确的是( )
A.被促进 不变 B.被促进 变小
C.被抑制 不变 D.被抑制 变小
解析:NaOH溶于水电离出OH-,抑制了水的电离。水的离子积常数只与温度有关,所以KW不变。
C
7.某温度下,纯水中c(H+)=2.0×10-7 mol·L-1,则此时c(OH-)=
;温度不变,向水中滴入盐酸使c(H+)=5.0 mol·L-1,则溶液中c(OH-)= 。
解析:纯水中c(H+)始终等于c(OH-),所以c(OH-)=2.0×10-7 mol·L-1。此温度下,KW=c(H+)·c(OH-)=4.0×10-14。向水中滴加盐酸,KW不变,
2.0×10-7 mol·L-1
8.0×10-15 mol·L-1
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH
第一课时 水的电离
【思考与讨论】
在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么,其中的溶剂水是全部以分子形式存在(如图3-5),还是部分以离子形式存在呢 怎样验证你的猜想?
编号 I II III
现象
原理
结论
灯泡亮
灯泡不亮
灵敏电流表指针偏转
方法一:利用灵敏电流表测定水的导电性
水是一种极弱的电解质,能发生微弱的电离
正常电路
纯水不导电
或导电能力弱
纯水能导电但导电能力弱
方法二:利用手持技术测定水的电导率
结论: 纯水中含有少量自由移动的离子。
精确的导电性实验表明,纯水大部分以H2O的形式存在,但其中也存在着极少量的H3O+和OH-。这表明水是一种极弱的电解质,能发生微弱的电离( 如下图):
一、水的电离
1.水的电离
25°C 1L水只有10-7molH2O发生电离
H2O+ H2O H3O+ +OH-
简写为
H2O H+ +OH-
25°C,55.6×107个水分子才有1个电离.
H+为裸质子,不稳定,与水结合,形成H3O+,即水合氢离子
(1)定义
当水的电离达到平衡时,电离产物H+和OH-浓度之积是一个常数,叫做水的离子积常数,记作KW,水的离子积常数,简称水的离子积。KW可由实验测得,也可以通过理论计算求得。
(2)表达式KW=c(H+)·c(OH-),
25 ℃时,在室温下,纯水中的c(H+)=c(OH-)=10-7mol·L-1,KW=1.0×10-14。
2.水的离子积常数
【思考】如何衡量水的电离的限度?
分析表格中的数据,有何规律,并解释之。
Kw
100℃
50℃
25℃
20℃
0℃
温度
1.14×10-15 6.81×10-15 1×10-14 5.47×10-14 1×10-12
温度越高,Kw越大。
Kw在一定温度下是个常数,水的电离是吸热过程,升高温度,促进水的电离,Kw增大。Kw只于温度有关,与浓度无关。
不同温度下水的离子积常数
KW不仅适用于纯水,还可适用于稀的电解质水溶液。
(3)影响因素
水的离子积KW只受温度的影响,与溶液的酸碱性无关;温度升高,KW增大。
(4)适用范围
(5)Kw揭示了在任何水溶液中均存在H+和OH-,只要温度不变,Kw不变。
【思考】水的离子积也是一个平衡常数,和其他平衡常数一样,它受那些因素影响呢?
易错提醒:
1.水的离子积常数Kw=c(H+)·c(OH-),不仅适用于纯水,也适用于一切酸、碱、盐的稀溶液。在任何酸、碱、盐的稀溶液中,只要温度一定,Kw就一定。
2.在不同溶液中,c(H+)、c(OH-)可能不同,但任何溶液中由水电离产生的c(H+)、c(OH-)总是相等的。在Kw的表达式中,c(H+)、c(OH-)均表示整个溶液中H+、OH-总的物质的量浓度而不是单指由水电离出的c(H+)、c(OH-)。
3.水的离子积常数显示了在任何水溶液中均存在水的电离平衡,都有H+和OH-共存,只是相对含量不同而已。
4.水的电离是吸热过程,升高温度,水的电离平衡向电离方向移动,c(H+)和c(OH-)都增大,故Kw增大,但溶液仍呈中性;对于Kw,若未注明温度,一般认为在常温下,即25 ℃。
思考与讨论
1、酸性溶液中是否存在OH- 碱性溶液中是否存在H+ 试解释原因。
答:酸性溶液中存在OH-,碱性溶液中存在H+。因这些溶液中都存在弱电解质水的电离。
2、一定温度下,加水稀释盐酸,溶液中的c(H+)、c(OH-)都减小,对吗
答:不对;稀释盐酸,溶液中的c(H+)减小,但因为温度不变,KW=c(H+)·c(OH-)不变,所以c(OH-)增大。
3、试分析酸性溶液中c(H+)、c(OH-)的来源,在酸或碱溶液中水电离出的c(H+)与c(OH-)还相等吗?及KW的计算方法。
答:c(H+)来源于酸电离和水电离,且c(H+)酸 c(H+)水 ,c(H+)水可以忽略;c(OH-)来源于水的电离,且电离程度很小。由水电离出的c(H+)与c(OH-)仍然相等;KW=[c(H+)酸+c(H+)水]·c(OH-)水≈c(H+)酸·c(OH-)水。
思考:
常温下,将0.1molHCl气体通入水中形成1L溶液, c(H+)与c(OH-)还相等吗?KW相变不变?为什么?
c(H+)=_______________,来源于_________________
c(OH-)=_______________,来源于_________________
KW=_______________。
由水电离出的c(H+)水=_______________,
c(OH-)水=_______________。
0.1 mol/L
酸的电离和水的电离
1.0×10-13 mol/L
水的电离
1.0×10-14
1.0×10-13 mol/L
1.0×10-13 mol/L
点拨—水电离出的c(H+)或c(OH-)的计算思路
Kw表达式中c(H+)、c(OH-)均表示整个溶液中所有H+、OH-的总物质的量浓度,但是一般情况下有:
(1)酸溶液中Kw=c(H+)酸·c(OH-)水(忽略水电离出的H+的浓度)。
(2)碱溶液中Kw=c(H+)水·c(OH-)碱(忽略水电离出的OH-的浓度)
(3)外界条件改变,水的电离平衡发生移动;但由水电离出的c水(H+)与c水(OH-)一定相等。
例题.常温下,0.1 mol·L-1的NaOH溶液中由水电离出的OH-的物质的量浓度为( )
A.0.1 mol·L-1 B.1.0×10-13 mol·L-1
C.1.0×10-7 mol·L-1 D.1.0×10-6 mol·L-1
B
碱溶液中Kw =
c(H+)水 · c(OH-)碱
c(OH-)水=
c(H+)水 =
Kw
c(OH-)碱
=
1×10-14
1×10-1 mol/L
= 1×10-13 mol/L
解析:
1. 在25℃ 0.01mol/L盐酸溶液中:
c(H+) = , c(OH-) = ;
c(H+)水= , c(OH-)水= 。
2. 在25℃ 0.01mol/L NaOH溶液中:
c(H+)= , c(OH-)= ;
c(H+)水= , c(OH-)水= 。
0.01mol/L
10-12mol/L
10-12mol/L
10-12mol/L
10-12mol/L
0.01mol/L
10-12mol/L
10-12mol/L
■加酸后Kw =1×10-14酸溶液中Kw =c(H+)酸 · c(OH-)水
=c(H+)水
■加碱后Kw =1×10-14碱溶液中Kw =c(OH-)碱·c(H+)水
=c(OH-)水
KW不仅适用于纯水,还可适用于稀的电解质水溶液。
(3)影响因素
水的离子积KW只受温度的影响,与溶液的酸碱性无关;温度升高,KW增大。
(4)适用范围
(5)Kw揭示了在任何水溶液中均存在H+和OH-,只要温度不变,Kw不变。
【思考】水的离子积也是一个平衡常数,和其他平衡常数一样,它受那些因素影响呢?
3.影响水的电离平衡的因素
H2O H+ +OH-
△H>0
(1)水电离吸热,升温将促进水的电离,故平衡右移
(2)加入酸
增大c(H+),则平衡向左移动,水的电离被抑制,由于水的电离平衡仍然存在,Kw不变,则c(OH-)必然会减小。
(3)加入碱
增大c(OH-),则平衡向左移动,水的电离被抑制,由于水的电离平衡仍然存在,Kw不变,则c(H+)必然会减小。
(4)其它因素:
如向水中加入活泼金属,由于与水电离出的H+直接作用,因而促进了水的电离。
注意:KW是一个温度函数只随温度的升高而增大
影响因素 水的电离平衡移动 影响结果
方向 原因 KW c(H+)变化 c(OH-)变化 c(H+)与c(OH-)的关系
温度 升温 右移 水的电离过程吸热 增大 增大 增大 c(H+)=c(OH-)
降温 左移 减小 减小 减小 c(H+)=c(OH-)
加酸 左移 增大了c(H+) 不变 增大 减小 c(H+)>c(OH-)
加碱 左移 增大了c(OH-) 不变 减小 增大 c(H+)
加入强酸
增大[OH-]
增大[H+]
减小[H+]:加入强碱弱酸盐
减小[OH-]:加入强酸弱碱盐
升高温度
降低温度
加入强酸及中强酸的酸式盐。
抑制水电离
促进水电离
加入弱酸
加入强碱
加入弱碱
【总结】
练习.温度125 ℃时,水的电离达到平衡:H2O H++OH- ΔH>0。下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)减小
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体钠,平衡逆向移动,c(H+)减小
D.将水加热,KW增大,c(H+)不变
B
解析:向水中加入稀氨水,OH-浓度增大,水的电离平衡逆向移动,A项错误;硫酸氢钠是强酸酸式盐,向水中加入少量固体硫酸氢钠,其在水溶液中完全电离:
c(H+)增大,相当于加酸;由于KW只与温度有关,所以KW不变,B项正确;向水中加入少量固体钠,由于金属钠非常活泼,可与水电离出的H+直接发生置换反应,产生H2,故促进了水的电离,使平衡正向移动,C项错误;将水加热,KW增大,c(H+)、c(OH-)同等倍数增大,D项错误。
1、在常温下,由水电离产生的c(H+) =1×10-9 mol/L的溶液,则该溶液的酸碱性如何?
答:不一定呈酸性。
2、某溶液中c(H+) =1×10-6 mol/L,该溶液一定呈酸性吗
答:可能是酸性也可能是碱性。
思考与讨论
根据常温时水的电离平衡,运用平衡移动原理分析下列问题。(1)酸性溶液中是否存在OH- 碱性溶液中是否存在H+ 试解释原因。
提示:酸性溶液中存在OH-,碱性溶液中存在H+。因这些溶液中都存在弱电解质水的电离。
【思考与讨论】
二、溶液的酸碱性与pH
(2)比较常温时下列情况中,c(H+)和c(OH-)的值或变化趋势(选填“增大”或“减小”“1×10-7 mol·L-1”“相等”)
体系 纯水 向纯水中加入少量盐酸 向纯水中加入少量氢氧化钠溶液
c(H+)
c(OH-)
c(H+)和c(OH-)的大小比较
10-7 mol·L-1
10-7 mol·L-1
相等
增大
减小
减小
增大
1.溶液的酸碱性与c(H+)、c(OH-)的关系
无论是酸溶液中还是碱溶液或盐溶液中都同时存在H+和OH-!
溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小
任意条件下,溶液酸碱性的判断依据:
若c(H+)= c(OH-),中性
若c(H+)> c(OH-),酸性,c(H+)越大,酸性越强
若c(H+)< c(OH-),碱性,c(OH-)越大,碱性越强
25℃时
中性:
c(H+)=1×10-7 mol/L
酸性:
c(H+)>1×10-7 mol/L
碱性:
c(H+)<1×10-7 mol/L
Kw表达式中,c(H+)、c(OH-)均表示整个溶液中总物质的量浓度,但是一般情况下有:
(1)酸溶液中Kw=c(H+)酸·c(OH-)水(忽略水电离出的H+的浓度),即c(H+)水=c(OH-)水=Kw/c(H+)酸。
(2)碱溶液中Kw=c(H+)水·c(OH-)碱(忽略水电离出的OH-的浓度),即c(H+)水=Kw/c(OH-)碱。
(3)纯水中,水电离出的c(H+)与水电离出的c(OH-)一定相等,即c(H+)=c(OH-)= 。
三、水电离出的c(H+)或c(OH-)的计算
(1)计算溶液中水电离出的c(H+)与c(OH-)时注意以下几点:
①因为H2O H++OH-,所以由水电离出的c(H+)=c(OH-)。
②酸溶液中的OH-和碱溶液中的H+都是水电离出的。
(2)计算溶液中水电离出的c(H+)与c(OH-)的方法:
①计算酸溶液中水电离出的c(H+)时,首先根据已知条件计算溶液中的c(H+)再根据KW=c(H+)·c(OH-)计算出溶液中的c(OH-),然后根据水电离出的c(H+)=c(OH-),确定由水电离出的c(H+)。
②计算碱溶液中水电离出的c(OH-)时,首先根据已知条件计算溶液中的c(OH-),再根据KW=c(H+)·c(OH-)计算出溶液中的c(H+),然后根据水电离出的c(OH-)=c(H+),确定由水电离出的c(OH-)。
例题.常温下,0.1 mol·L-1的NaOH溶液中由水电离出的OH-的物质的量浓度为( )
A.0.1 mol·L-1 B.1.0×10-13 mol·L-1
C.1.0×10-7 mol·L-1 D.1.0×10-6 mol·L-1
B
(1)温度一定时,水的电离常数与水的离子积常数相等。 ( )
(2)100 ℃的纯水中c(H+)=1×10-6 mol·L-1,此时水呈酸性。
( )
(3)任何温度下,利用H+和OH-浓度的相对大小均可判断溶液的酸碱性。 ( )
(4)某溶液的c(H+)>10-7 mol·L-1,则该溶液呈酸性。 ( )
1.判断正误(正确的打“√”,错误的打“×”)
×
×
×
√
(5)在蒸馏水中滴加浓硫酸,KW不变。 ( )
(6)25 ℃与60 ℃时,水的pH相等。 ( )
(7)25 ℃时NH4Cl溶液的KW大于100 ℃时NaCl溶液的KW。 ( )
(8)任何水溶液中均存在H+和OH-,且水电离出的c(H+)和c(OH-)相等。
( )
(9)室温下,0.1 mol·L-1的HCl溶液与0.1 mol·L-1的NaOH溶液中水的电离程度相同。 ( )
(10)向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,KW不变。 ( )
×
×
×
×
√
√
2.25 ℃时,水的电离达到平衡:H2O H++OH- ΔH>0。下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)减小
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体钠,平衡逆向移动,c(H+)减小
D.将水加热,KW增大,c(H+)不变
B
解析:向水中加入稀氨水,OH-浓度增大,水的电离平衡逆向移动,A项错误;硫酸氢钠是强酸酸式盐,向水中加入少量固体硫酸氢钠,其在水溶液中完全电离: c(H+)增大,由于KW只与温度有关,所以KW不变,B项正确;向水中加入少量固体钠,由于金属钠非常活泼,可与水电离出的H+直接发生置换反应,产生H2,故促进了水的电离,使平衡正向移动,C项错误;将水加热,KW增大,c(H+)、c(OH-)同等倍数增大,D项错误。
3.下列叙述正确的是( )
A.某温度下,蒸馏水中的c(H+)=2.0×10-7 mol·L-1,则该温度一定高于25 ℃
B.25 ℃时,某液体中c(H+)和c(OH-)的乘积为1×10-14,该液体一定为纯水
C.25 ℃时,向水中加入氢氧化钠固体,水的电离平衡逆向移动,水的离子积减小
D.25 ℃时,0.1 mol·L-1的盐酸与0.1 mol·L-1的NaOH溶液中,水的电离程度不同
解析:某温度下,蒸馏水中的c(H+)=2.0×10-7 mol·L-1,水的离子积为4×10-14,比25 ℃时的水的离子积大,因为水的电离吸热,则该温度必然高于25 ℃;25 ℃时,任何水溶液中c(H+)和c(OH-)的乘积均为1×10-14;水中加入氢氧化钠固体,水的电离平衡逆向移动,但水的离子积不变;同浓度的H+和OH-对水的电离的抑制程度相同。
A
4.下列溶液一定呈中性的是( )
A.使石蕊溶液呈紫色的溶液
B.c(H+)=c(OH-)的溶液
C.由强酸、强碱等物质的量反应得到的溶液
D.非电解质溶于水得到的溶液
解析:等物质的量的强酸与强碱,由于它们所含H+和OH-的物质的量未知,因此无法判断它们混合后溶液的酸碱性,故C错误;非电解质溶于水,可以使溶液显酸性、碱性或中性,如SO2溶于水生成H2SO3,溶液显酸性,NH3溶于水生成NH3·H2O,溶液显碱性,乙醇、蔗糖等溶于水,溶液显中性,故D错误。
B
5.下列关于水的离子积常数的叙述中,正确的是( )
A.因为水的离子积常数的表达式是KW=c(H+)·c(OH-),所以KW随溶液中c(H+)和c(OH-)的变化而变化
B.水的离子积常数KW与水的电离平衡常数K电离是同一个物理量
C.水的离子积常数仅仅是温度的函数,随着温度的变化而变化
D.水的离子积常数KW与水的电离平衡常数K电离是两个没有任何关系的物理量
解析:水的离子积常数KW=K电离·c(H2O),一定温度下K电离和c(H2O)都是不变的常数,所以KW仅仅是温度的函数。水的离子积常数的表达式是KW=c(H+)·c(OH-),但是只要温度一定,KW就是不变的常数。溶液中H+的浓度变大,则OH-的浓度会变小,反之亦然。
C
6.常温时,向水中加入少量NaOH溶液,水的电离改变和溶液中KW的变化正确的是( )
A.被促进 不变 B.被促进 变小
C.被抑制 不变 D.被抑制 变小
解析:NaOH溶于水电离出OH-,抑制了水的电离。水的离子积常数只与温度有关,所以KW不变。
C
7.某温度下,纯水中c(H+)=2.0×10-7 mol·L-1,则此时c(OH-)=
;温度不变,向水中滴入盐酸使c(H+)=5.0 mol·L-1,则溶液中c(OH-)= 。
解析:纯水中c(H+)始终等于c(OH-),所以c(OH-)=2.0×10-7 mol·L-1。此温度下,KW=c(H+)·c(OH-)=4.0×10-14。向水中滴加盐酸,KW不变,
2.0×10-7 mol·L-1
8.0×10-15 mol·L-1
