化学人教版(2019)选择性必修第一册 3.2.2溶液的H的计算 课件(共35张PPT)
文档属性
| 名称 | 化学人教版(2019)选择性必修第一册 3.2.2溶液的H的计算 课件(共35张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 475.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-11 00:00:00 | ||
图片预览










文档简介
(共35张PPT)
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH
第三课时 溶液pH的计算
有关溶液pH的计算
1、单一溶液的计算:
①强酸溶液,如HnA的浓度为c mol/L,则有
C(H+)=nc mol/L, pH=-lgc(H+)= -lgnc
②强碱溶液,如B(OH)n的浓度为 c mol/L,则有 C(H+)= 10-14/nc, pH= -lgc(H+) = 14+lgnc
③一元弱酸溶液 : c(H+)=√Ka·c
④一元弱碱溶液: c(OH-)=√Kb·c
酸性:求c(酸)→c(H+) →pH
碱性:求c(碱)→c(OH-) → c(H+) → pH
pH+pOH=14
常温 c(H+)· c(OH-) =1× 10-14
KW
例1:甲溶液的pH=3,乙溶液的pH=1,则甲溶液中c(H+)与乙溶液中c(H+)之比为 ( )
A.100 B. 1/100 C. 3 D. 1/3
pH相差a, c(H+)相差10a
B
例2:下列溶液在常温下酸性最强的是 ( )
A. pH=4的溶液
B. 1L 溶液里溶有22.4mL(STP)HCl的溶液
C. c(OH-)=10-12mol/L的溶液
D. c(H+)=10-3mol/L的溶液
C
例3:(1)0.1mol/L盐酸、硫酸、醋酸c(H+) 、pH大小关系如何?
pH(醋酸) > pH(盐酸 ) > pH(硫酸)
c(醋酸) > c(盐酸 ) > c(硫酸)
(2) pH=1 的盐酸、硫酸、醋酸中的c(H+)及酸的物质的量浓度关系如何?
c(H+)醋酸 < c(H+)盐酸 < c(H+)硫酸
c(H+)醋酸 = c(H+)盐酸 = c(H+)硫酸
解:
解:
例题1:在25℃时,pH值等于3的盐酸溶液稀释到原来的100倍,pH 值等于多少?
解:
pH=-lgC(H+)
=-lg 1.0 ×10-5
=5
关键:抓住氢离子进行计算!
C(H+)= =1.0 ×10-5mol/L
2、强酸、强碱的稀释:
强酸的稀释
例2:取1mL pH=3的硫酸溶液加水稀释到100mL,溶液的pH变为多少?
解:
c(H+) =
pH = - lgc(H+) = - lg10-5 = 5
10-3 mol/L×10-3 L
=10-5 mol/L
10-1 L
=
n(H+)
V[H2SO4(aq)]
若上述溶液加水稀释到体积为原来的1000倍,
则溶液的pH变为多少?
若稀释到体积为原来的105倍,则溶液的pH
变为多少?
102
103
pH = 6
pH = 8
pH 接近于7
7
3
pH
V水
例题1:在25℃时,pH值等于12的强碱溶液稀释到原来的100倍,pH 等于多少?
解:
稀释前:C(OH-) =
pH=-lgC(H+)
关键:抓住氢氧根离子离子进行计算!
稀释后: C(OH-)=
C(H+) =
=10
=1 ×10-2mol/L
=1 ×10-4mol/L
=
=1 ×10-10mol/L
强碱的稀释
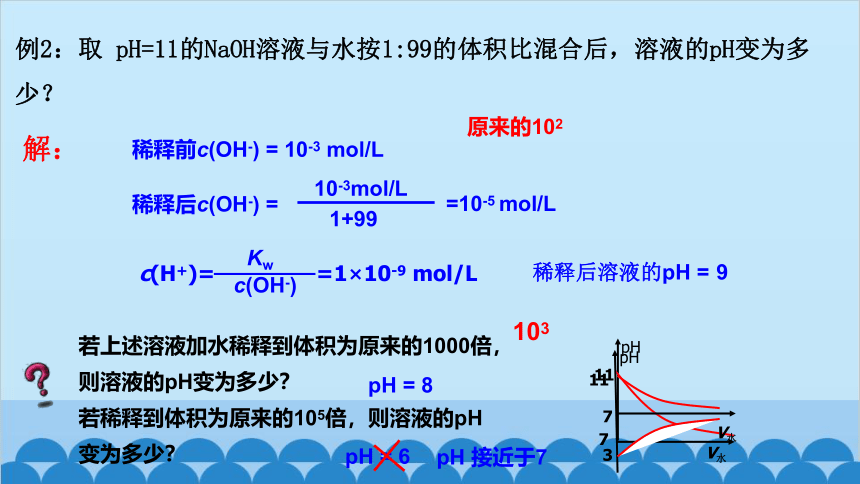
例2:取 pH=11的NaOH溶液与水按1:99的体积比混合后,溶液的pH变为多少?
解:
稀释前c(OH-) = 10-3 mol/L
10-3mol/L
=10-5 mol/L
1+99
若上述溶液加水稀释到体积为原来的1000倍,
则溶液的pH变为多少?
若稀释到体积为原来的105倍,则溶液的pH
变为多少?
103
pH = 8
pH = 6
pH 接近于7
原来的102
稀释后c(OH-) =
稀释后溶液的pH = 9
Kw
c(OH-)
c(H+)= =1×10-9 mol/L
11
7
pH
V水
11
7
pH
V水
3
注意:pH=6或8时,不可忽略水的电离,只能接近7,酸碱溶液无限稀释,pH只能约等于7或接近7:酸不能大于7;碱不能小于7
结论:强酸(碱)每稀释10倍,pH值向7靠拢一个单位。
强酸pH=a,加水稀释10n倍后,pH=a+n;
强碱pH=b,加水稀释10n倍后,pH=b-n.
弱酸稀释
例:pH=2的盐酸稀释10倍后pH=?
pH=2的醋酸稀释10倍后pH=?
结论:稀释10倍pH变化(增大)<1
<3
3
盐酸
醋酸
V水
3
2
pH
10倍
稀释相同倍数时
pH:盐酸>醋酸
稀释到相同pH时
稀释的倍数:
醋酸>盐酸
弱酸、弱碱的稀释
弱酸、弱碱的稀释
例3、pH=3的HAc加水稀释到原来10倍,溶液的pH值范围是_________;
pH=12氨水加水稀释到原来10倍,溶液的pH值范围是___________。
结论:弱酸(碱)每稀释10倍,pH值向7靠拢不到一个单位;
弱酸pH=a,加水稀释10n倍后,pH<a+n;
弱碱pH=b,加水稀释10n倍后,pH>b-n.
3<pH<4
11<pH<12
归纳
酸或碱的稀释与pH的关系
强酸pH=a,加水稀释10n倍,则pH=a+n;
弱酸pH=a,加水稀释10n倍,则pH强碱pH=b,加水稀释10n倍,则pH=b-n;
弱碱pH=b,加水稀释10n倍,则pH>b-n;
酸、碱溶液无限稀释时,pH只能接近7,但酸不能大于7,碱不能小于7;
对于浓度(或pH)相同的强酸和弱酸,稀释相同倍数,强酸的pH变化幅度大。 (强碱、弱碱相似)
3、强酸与强酸混合
例题:在25℃时,pH值等于1的盐酸溶液和pH值等于4的硫酸溶液等体积混合pH值等于多少?
解:
pH=-lgC(H+)
=-lg(1×10—1+1×10—4)/(1+1)
=-lg5×10—2
=2-lg5
=1.3.
关键:抓住氢离子进行计算!
15
4、强碱与强碱混合
解:
=-lg2+11
=10.7
例题:在25℃时,pH值等于9和pH值等于11的两种氢氧化钠溶液等体积混合pH值等于多少?
C(OH—)=( 1 × 10—5+1×10—3)/(1+1)
C(H+)=10-14/C(OH-)
pH=-lg10-14/(10-3/2)
关键:抓住氢氧根离子离子进行计算!
注:对于混合碱的计算而言,必须先算出混合后的c(OH-),再由KW算出c(H+),再求pH值,不能直接求c(H+)
17
结论:
1、两种强酸溶液的pH相差≥2时,等体积混合,溶液的pH值等于浓溶液的pH+0.3。
总结论:
两种强酸(碱)溶液等体积混合,溶液的pH值以原浓溶液的pH向7靠拢0.3个单位。
2、两种强碱溶液的pH相差≥2时,等体积混合,溶液的pH值等于浓溶液的pH_0.3。
5、强酸与强碱混合
例题:在25℃时,100mlO.4mol/L的盐酸与等体积0.6mol/L的氢氧化钠溶液混合后,溶液的pH值等于多少?
解:
NaOH+HCl=NaCl+H2O
0.04
0.06
关键:碱过量抓住氢氧根离子进行计算!
C(OH—)=0.1(0.6-0.4)/0.2
C(H+)=10-14/C(OH—)= 10-14/0.1
pH=-lg10-13=
13
方法:
1、先要判断酸碱谁过量。
2、再按过量的计算
①若酸过量,求c(H+),再算pH值。
②若碱过量,先求c(OH-),再求c(H+),最后算pH值;或者求出c(OH-)后,接着求pOH,再根据pH=14-pOH得出。
做一做:取物质的量浓度相同的NaOH和HCl溶液,以2:3体积比混合,所得溶液的pH=2,则原溶液的物质的量浓度为( )
0.05mol/L
21
思路:抓住量多的离子
若 n(H+) = n(OH-) 溶液为中性, pH = 7
若 n(H+) > n(OH-) 溶液为酸性, pH < 7
若 n(H+) < n(OH-) 溶液为碱性, pH > 7
若是酸过量则应先求出反应后溶液中剩余酸的c(H+),再求pH 。
若是碱过量,则先求出反应后溶液中剩碱的C(OH-),再求pH 。
注意:若V1=V2或是V酸=V碱,当两溶液中C(H+)或C(OH-)相差102以上时,可忽略离子浓度很小溶液中溶质,看作是将离子浓度大的溶液加水稀释,使体积增大1倍。
取80 mL NaOH溶液加入到120 mL盐酸中,所得溶液的pH为2。如果混合前NaOH溶液和盐酸的物质的量浓度相同,则它们的浓度是多少?
解:
(1)酸过量:则c(H+)=
c(H+)V1- c(OH-)V2
V1+V2
0.12c(H+) – 0.08c(OH-)
0.12+0.08
10-2 =
c(H+) = c(OH-) = 0.05moL/L
(1)pH为12的NaOH溶液和pH为2的醋酸溶液等体积相混合,则混合液呈_____性
(2)pH为12的氨水和pH为2的盐酸等体积相混合,则混合液呈 ____性
(3)pH为2的盐酸和pH为12的某碱等体积相混合,则混合液PH_____7
(4)pH为12的NaOH溶液和pH为2的某酸溶液等体积相混合,则混合液PH ___7
酸
碱
≥
≤
6、弱酸强碱或强酸弱碱混合
常温下,酸、碱溶液等体积混合,且酸与碱溶液的pH之和为14:
若为强酸与强碱,则pH=7;
若为强酸与弱碱,则pH>7;
若为弱酸与强碱,则pH<7。
有关溶液pH的计算口诀:
碱按碱,酸按酸,同强混合在中间;
异强混合看过量,无限稀释7为限。
再练一下:把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则酸和碱的体积比是( )
1:10
有关溶液pH的计算总结:
一、一种溶液PH值的计算:
1、强酸或强碱溶液的PH值计算。
2、强酸或强碱溶液的稀释和无限稀释PH计算
3、弱酸或弱碱溶液的稀释和无限稀释PH计算(只能计算PH变化范围)
二、两种溶液等体积混合的PH计算:
1、两种PH不同强酸溶液等体积混合 (不反应)
2、两种PH不同强碱溶液等体积混合(不反应)
3、两种强酸和强碱等体积混合(要反应)
(1)某溶液的pH=7,该溶液一定显中性。 ( )
(2)用pH试纸测定氯水的pH为3。 ( )
(3)一定温度下,pH=a的氨水,稀释10倍后,其pH=b,则a=b+1。 ( )
(4)25 ℃时,某溶液中水电离出的c(H+)=10-13,则该溶液的pH一定为13。 ( )
(5)室温下,pH=3的盐酸跟pH=11的氨水等体积混合后,pH一定大于7。 ( )
(6)室温下,pH=3的磷酸跟pH=11的氢氧化钾溶液等体积混合后,pH一定大于7。 ( )
1.判断正误(正确的打“√”,错误的打“×”)
√
×
×
×
×
×
2.(1)常温下,某H2SO4溶液的浓度是0.005 mol·L-1,此溶液的pH为 。用水稀释到原来体积的100倍,pH为 。再继续稀释到溶液体积的104倍,pH 。
(2)常温下,pH=3的盐酸与pH=5的硫酸溶液等体积混合后溶液的pH为 。
(3)常温下,pH=10和pH=12的两种NaOH溶液等体积混合后溶液的pH为 。
(4)常温下,pH=12的NaOH溶液和pH=4的HCl溶液等体积混合后,溶液的pH为 。
2
4
接近7
3.3
11.7
11.7
3.常温下,将pH为8的NaOH溶液与pH为10的NaOH溶液等体积混合后,溶液的氢离子浓度最接近于( )
A.2×10-10 mol·L-1
A
4.将体积为10 mL、pH为3的乙酸溶液和盐酸分别加水稀释至a mL和b mL,测得稀释后pH均为5,则稀释后溶液的体积( )
A.a=b=100 mL B.a>b
C.a=b=1 000 mL D.a解析:稀释后,弱酸溶液中n(H+)增加,强酸溶液中n(H+)不变,要使稀释后两溶液中c(H+)仍相同,则弱酸溶液中加入水的体积大于强酸的,即a>b。
B
5.将pH=2的盐酸平均分为2份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量氢氧化钠溶液后,pH都升高了1,则加入的水与氢氧化钠溶液的体积比为( )
A.9∶1 B.10∶1 C.11∶1 D.12∶1
C
解析:设每份盐酸的体积为1 L,将pH=2的盐酸加水,pH升高1,说明加入水的体积为9 L;另一份加入与盐酸物质的量浓度相同的适量氢氧化钠溶液后,pH升高1,可设加入氢氧化钠溶液的体积为x,则0.01 mol·L-1×1 L-0.01 mol·L-1×x=0.001 mol·L-1×(1+x),解得
6.25 ℃,若10体积的某强碱溶液与1体积的某强酸溶液混合后,溶液呈中性,则混合之前,该强碱溶液的pH与强酸溶液的pH之间该满足的关系是 。
解析:由题意知,本题为酸、碱混合后完全中和,根据中和反应的实质可知,酸中n(H+)与碱中n(OH-)相等,故有c(H+)酸V(酸)=c(OH-)碱V(碱),由此关系列式可求得结果。
mol·L-1=10-(14-b) mol·L-1。
因为混合后溶液呈中性,所以c(H+)酸V(酸)=c(OH-)碱V(碱),即
10-a×V=10-(14-b)×10V
10-a=10-(13-b)
解得a=13-b,a+b=13,即酸溶液的pH与碱溶液的pH之和为13。
酸溶液的pH与碱溶液的pH之和为13
7.(1)现有pH=2的稀盐酸100 mL,要使它的pH=3,如果加入蒸馏水,需加水 mL;如果加入pH=4的稀盐酸,需加入此稀盐酸 mL(假定溶液体积有加和性,下同)。
(2)将pH=8的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH= 。
(3)将0.1 mol·L-1盐酸和0.06 mol·L-1氢氧化钡溶液等体积混合后,该混合溶液的pH= 。
(4)25 ℃时,pH=a的X体积的某强酸溶液与pH=b的Y体积的某强碱溶液混合后,溶液呈中性,已知a+b=15,则X∶Y= 。
900
1 000
10.7
12
10∶1
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH
第三课时 溶液pH的计算
有关溶液pH的计算
1、单一溶液的计算:
①强酸溶液,如HnA的浓度为c mol/L,则有
C(H+)=nc mol/L, pH=-lgc(H+)= -lgnc
②强碱溶液,如B(OH)n的浓度为 c mol/L,则有 C(H+)= 10-14/nc, pH= -lgc(H+) = 14+lgnc
③一元弱酸溶液 : c(H+)=√Ka·c
④一元弱碱溶液: c(OH-)=√Kb·c
酸性:求c(酸)→c(H+) →pH
碱性:求c(碱)→c(OH-) → c(H+) → pH
pH+pOH=14
常温 c(H+)· c(OH-) =1× 10-14
KW
例1:甲溶液的pH=3,乙溶液的pH=1,则甲溶液中c(H+)与乙溶液中c(H+)之比为 ( )
A.100 B. 1/100 C. 3 D. 1/3
pH相差a, c(H+)相差10a
B
例2:下列溶液在常温下酸性最强的是 ( )
A. pH=4的溶液
B. 1L 溶液里溶有22.4mL(STP)HCl的溶液
C. c(OH-)=10-12mol/L的溶液
D. c(H+)=10-3mol/L的溶液
C
例3:(1)0.1mol/L盐酸、硫酸、醋酸c(H+) 、pH大小关系如何?
pH(醋酸) > pH(盐酸 ) > pH(硫酸)
c(醋酸) > c(盐酸 ) > c(硫酸)
(2) pH=1 的盐酸、硫酸、醋酸中的c(H+)及酸的物质的量浓度关系如何?
c(H+)醋酸 < c(H+)盐酸 < c(H+)硫酸
c(H+)醋酸 = c(H+)盐酸 = c(H+)硫酸
解:
解:
例题1:在25℃时,pH值等于3的盐酸溶液稀释到原来的100倍,pH 值等于多少?
解:
pH=-lgC(H+)
=-lg 1.0 ×10-5
=5
关键:抓住氢离子进行计算!
C(H+)= =1.0 ×10-5mol/L
2、强酸、强碱的稀释:
强酸的稀释
例2:取1mL pH=3的硫酸溶液加水稀释到100mL,溶液的pH变为多少?
解:
c(H+) =
pH = - lgc(H+) = - lg10-5 = 5
10-3 mol/L×10-3 L
=10-5 mol/L
10-1 L
=
n(H+)
V[H2SO4(aq)]
若上述溶液加水稀释到体积为原来的1000倍,
则溶液的pH变为多少?
若稀释到体积为原来的105倍,则溶液的pH
变为多少?
102
103
pH = 6
pH = 8
pH 接近于7
7
3
pH
V水
例题1:在25℃时,pH值等于12的强碱溶液稀释到原来的100倍,pH 等于多少?
解:
稀释前:C(OH-) =
pH=-lgC(H+)
关键:抓住氢氧根离子离子进行计算!
稀释后: C(OH-)=
C(H+) =
=10
=1 ×10-2mol/L
=1 ×10-4mol/L
=
=1 ×10-10mol/L
强碱的稀释
例2:取 pH=11的NaOH溶液与水按1:99的体积比混合后,溶液的pH变为多少?
解:
稀释前c(OH-) = 10-3 mol/L
10-3mol/L
=10-5 mol/L
1+99
若上述溶液加水稀释到体积为原来的1000倍,
则溶液的pH变为多少?
若稀释到体积为原来的105倍,则溶液的pH
变为多少?
103
pH = 8
pH = 6
pH 接近于7
原来的102
稀释后c(OH-) =
稀释后溶液的pH = 9
Kw
c(OH-)
c(H+)= =1×10-9 mol/L
11
7
pH
V水
11
7
pH
V水
3
注意:pH=6或8时,不可忽略水的电离,只能接近7,酸碱溶液无限稀释,pH只能约等于7或接近7:酸不能大于7;碱不能小于7
结论:强酸(碱)每稀释10倍,pH值向7靠拢一个单位。
强酸pH=a,加水稀释10n倍后,pH=a+n;
强碱pH=b,加水稀释10n倍后,pH=b-n.
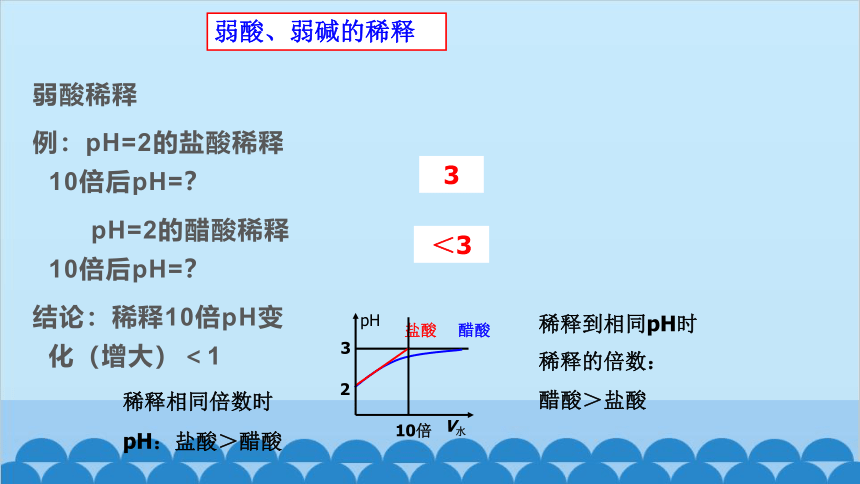
弱酸稀释
例:pH=2的盐酸稀释10倍后pH=?
pH=2的醋酸稀释10倍后pH=?
结论:稀释10倍pH变化(增大)<1
<3
3
盐酸
醋酸
V水
3
2
pH
10倍
稀释相同倍数时
pH:盐酸>醋酸
稀释到相同pH时
稀释的倍数:
醋酸>盐酸
弱酸、弱碱的稀释
弱酸、弱碱的稀释
例3、pH=3的HAc加水稀释到原来10倍,溶液的pH值范围是_________;
pH=12氨水加水稀释到原来10倍,溶液的pH值范围是___________。
结论:弱酸(碱)每稀释10倍,pH值向7靠拢不到一个单位;
弱酸pH=a,加水稀释10n倍后,pH<a+n;
弱碱pH=b,加水稀释10n倍后,pH>b-n.
3<pH<4
11<pH<12
归纳
酸或碱的稀释与pH的关系
强酸pH=a,加水稀释10n倍,则pH=a+n;
弱酸pH=a,加水稀释10n倍,则pH
弱碱pH=b,加水稀释10n倍,则pH>b-n;
酸、碱溶液无限稀释时,pH只能接近7,但酸不能大于7,碱不能小于7;
对于浓度(或pH)相同的强酸和弱酸,稀释相同倍数,强酸的pH变化幅度大。 (强碱、弱碱相似)
3、强酸与强酸混合
例题:在25℃时,pH值等于1的盐酸溶液和pH值等于4的硫酸溶液等体积混合pH值等于多少?
解:
pH=-lgC(H+)
=-lg(1×10—1+1×10—4)/(1+1)
=-lg5×10—2
=2-lg5
=1.3.
关键:抓住氢离子进行计算!
15
4、强碱与强碱混合
解:
=-lg2+11
=10.7
例题:在25℃时,pH值等于9和pH值等于11的两种氢氧化钠溶液等体积混合pH值等于多少?
C(OH—)=( 1 × 10—5+1×10—3)/(1+1)
C(H+)=10-14/C(OH-)
pH=-lg10-14/(10-3/2)
关键:抓住氢氧根离子离子进行计算!
注:对于混合碱的计算而言,必须先算出混合后的c(OH-),再由KW算出c(H+),再求pH值,不能直接求c(H+)
17
结论:
1、两种强酸溶液的pH相差≥2时,等体积混合,溶液的pH值等于浓溶液的pH+0.3。
总结论:
两种强酸(碱)溶液等体积混合,溶液的pH值以原浓溶液的pH向7靠拢0.3个单位。
2、两种强碱溶液的pH相差≥2时,等体积混合,溶液的pH值等于浓溶液的pH_0.3。
5、强酸与强碱混合
例题:在25℃时,100mlO.4mol/L的盐酸与等体积0.6mol/L的氢氧化钠溶液混合后,溶液的pH值等于多少?
解:
NaOH+HCl=NaCl+H2O
0.04
0.06
关键:碱过量抓住氢氧根离子进行计算!
C(OH—)=0.1(0.6-0.4)/0.2
C(H+)=10-14/C(OH—)= 10-14/0.1
pH=-lg10-13=
13
方法:
1、先要判断酸碱谁过量。
2、再按过量的计算
①若酸过量,求c(H+),再算pH值。
②若碱过量,先求c(OH-),再求c(H+),最后算pH值;或者求出c(OH-)后,接着求pOH,再根据pH=14-pOH得出。
做一做:取物质的量浓度相同的NaOH和HCl溶液,以2:3体积比混合,所得溶液的pH=2,则原溶液的物质的量浓度为( )
0.05mol/L
21
思路:抓住量多的离子
若 n(H+) = n(OH-) 溶液为中性, pH = 7
若 n(H+) > n(OH-) 溶液为酸性, pH < 7
若 n(H+) < n(OH-) 溶液为碱性, pH > 7
若是酸过量则应先求出反应后溶液中剩余酸的c(H+),再求pH 。
若是碱过量,则先求出反应后溶液中剩碱的C(OH-),再求pH 。
注意:若V1=V2或是V酸=V碱,当两溶液中C(H+)或C(OH-)相差102以上时,可忽略离子浓度很小溶液中溶质,看作是将离子浓度大的溶液加水稀释,使体积增大1倍。
取80 mL NaOH溶液加入到120 mL盐酸中,所得溶液的pH为2。如果混合前NaOH溶液和盐酸的物质的量浓度相同,则它们的浓度是多少?
解:
(1)酸过量:则c(H+)=
c(H+)V1- c(OH-)V2
V1+V2
0.12c(H+) – 0.08c(OH-)
0.12+0.08
10-2 =
c(H+) = c(OH-) = 0.05moL/L
(1)pH为12的NaOH溶液和pH为2的醋酸溶液等体积相混合,则混合液呈_____性
(2)pH为12的氨水和pH为2的盐酸等体积相混合,则混合液呈 ____性
(3)pH为2的盐酸和pH为12的某碱等体积相混合,则混合液PH_____7
(4)pH为12的NaOH溶液和pH为2的某酸溶液等体积相混合,则混合液PH ___7
酸
碱
≥
≤
6、弱酸强碱或强酸弱碱混合
常温下,酸、碱溶液等体积混合,且酸与碱溶液的pH之和为14:
若为强酸与强碱,则pH=7;
若为强酸与弱碱,则pH>7;
若为弱酸与强碱,则pH<7。
有关溶液pH的计算口诀:
碱按碱,酸按酸,同强混合在中间;
异强混合看过量,无限稀释7为限。
再练一下:把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则酸和碱的体积比是( )
1:10
有关溶液pH的计算总结:
一、一种溶液PH值的计算:
1、强酸或强碱溶液的PH值计算。
2、强酸或强碱溶液的稀释和无限稀释PH计算
3、弱酸或弱碱溶液的稀释和无限稀释PH计算(只能计算PH变化范围)
二、两种溶液等体积混合的PH计算:
1、两种PH不同强酸溶液等体积混合 (不反应)
2、两种PH不同强碱溶液等体积混合(不反应)
3、两种强酸和强碱等体积混合(要反应)
(1)某溶液的pH=7,该溶液一定显中性。 ( )
(2)用pH试纸测定氯水的pH为3。 ( )
(3)一定温度下,pH=a的氨水,稀释10倍后,其pH=b,则a=b+1。 ( )
(4)25 ℃时,某溶液中水电离出的c(H+)=10-13,则该溶液的pH一定为13。 ( )
(5)室温下,pH=3的盐酸跟pH=11的氨水等体积混合后,pH一定大于7。 ( )
(6)室温下,pH=3的磷酸跟pH=11的氢氧化钾溶液等体积混合后,pH一定大于7。 ( )
1.判断正误(正确的打“√”,错误的打“×”)
√
×
×
×
×
×
2.(1)常温下,某H2SO4溶液的浓度是0.005 mol·L-1,此溶液的pH为 。用水稀释到原来体积的100倍,pH为 。再继续稀释到溶液体积的104倍,pH 。
(2)常温下,pH=3的盐酸与pH=5的硫酸溶液等体积混合后溶液的pH为 。
(3)常温下,pH=10和pH=12的两种NaOH溶液等体积混合后溶液的pH为 。
(4)常温下,pH=12的NaOH溶液和pH=4的HCl溶液等体积混合后,溶液的pH为 。
2
4
接近7
3.3
11.7
11.7
3.常温下,将pH为8的NaOH溶液与pH为10的NaOH溶液等体积混合后,溶液的氢离子浓度最接近于( )
A.2×10-10 mol·L-1
A
4.将体积为10 mL、pH为3的乙酸溶液和盐酸分别加水稀释至a mL和b mL,测得稀释后pH均为5,则稀释后溶液的体积( )
A.a=b=100 mL B.a>b
C.a=b=1 000 mL D.a
B
5.将pH=2的盐酸平均分为2份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量氢氧化钠溶液后,pH都升高了1,则加入的水与氢氧化钠溶液的体积比为( )
A.9∶1 B.10∶1 C.11∶1 D.12∶1
C
解析:设每份盐酸的体积为1 L,将pH=2的盐酸加水,pH升高1,说明加入水的体积为9 L;另一份加入与盐酸物质的量浓度相同的适量氢氧化钠溶液后,pH升高1,可设加入氢氧化钠溶液的体积为x,则0.01 mol·L-1×1 L-0.01 mol·L-1×x=0.001 mol·L-1×(1+x),解得
6.25 ℃,若10体积的某强碱溶液与1体积的某强酸溶液混合后,溶液呈中性,则混合之前,该强碱溶液的pH与强酸溶液的pH之间该满足的关系是 。
解析:由题意知,本题为酸、碱混合后完全中和,根据中和反应的实质可知,酸中n(H+)与碱中n(OH-)相等,故有c(H+)酸V(酸)=c(OH-)碱V(碱),由此关系列式可求得结果。
mol·L-1=10-(14-b) mol·L-1。
因为混合后溶液呈中性,所以c(H+)酸V(酸)=c(OH-)碱V(碱),即
10-a×V=10-(14-b)×10V
10-a=10-(13-b)
解得a=13-b,a+b=13,即酸溶液的pH与碱溶液的pH之和为13。
酸溶液的pH与碱溶液的pH之和为13
7.(1)现有pH=2的稀盐酸100 mL,要使它的pH=3,如果加入蒸馏水,需加水 mL;如果加入pH=4的稀盐酸,需加入此稀盐酸 mL(假定溶液体积有加和性,下同)。
(2)将pH=8的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH= 。
(3)将0.1 mol·L-1盐酸和0.06 mol·L-1氢氧化钡溶液等体积混合后,该混合溶液的pH= 。
(4)25 ℃时,pH=a的X体积的某强酸溶液与pH=b的Y体积的某强碱溶液混合后,溶液呈中性,已知a+b=15,则X∶Y= 。
900
1 000
10.7
12
10∶1
