化学人教版(2019)选择性必修第一册 3.1.3电离平衡常数及其计算 课件(共35张PPT)
文档属性
| 名称 | 化学人教版(2019)选择性必修第一册 3.1.3电离平衡常数及其计算 课件(共35张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-11 14:46:30 | ||
图片预览







文档简介
(共35张PPT)
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
第二课时 电离平衡常数
1.含义:在一定条件下,当弱电解质在水溶液中达到电离平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离的分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,用K表示。弱酸和弱碱的电离常数分别用Ka和Kb表示.
四、电离平衡常数
2.表示方法:
c(A -)、 c(B十)、 c(HA)和c(BOH) 均为达到电离平衡后各粒子在溶液中的浓度值
(1)一元弱酸HA的电离常数:根据HA H++A-,
可表示为
(2)一元弱碱BOH的电离常数:根据BOH B++OH-,
可表示为
Ka=
c ( H+) .c( A-)
c(HA)
Kb=
c ( B+).c( OH- )
c(BOH)
(3)多元弱酸、多元弱碱的电离平衡常数。
多元弱酸的电离是分步进行的,每步各有电离平衡常数,通常用K1、K2等来分别表示。例如,
H2CO3 H++HCO3- Ka1= ;
HCO3- H++CO32- Ka2= 。
多元弱酸各步电离常数的大小比较为Ka1 Ka2,因此,多元弱酸的酸性主要由第一步电离决定。由于多元弱碱为难溶碱,所以一般不用电离平衡常数,而用以后要学到的难溶物的溶度积常数。
c(HCO3-)
c(H+)
c(H+)
c(H2CO3)
c(HCO3-)
c(CO32-)
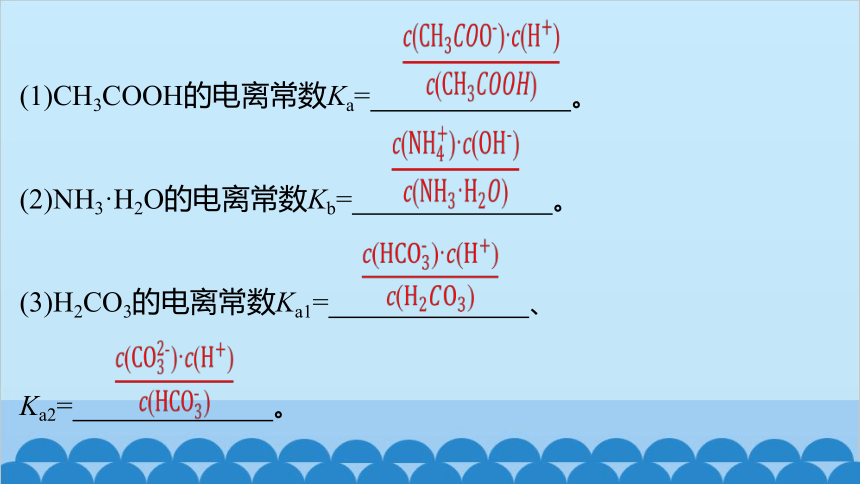
(1)CH3COOH的电离常数Ka= 。
(2)NH3·H2O的电离常数Kb= 。
(3)H2CO3的电离常数Ka1= 、
Ka2= 。
3.特点:
(1)电离平衡常数与浓度无关,只与温度有关,升高温度,K 值增大。
(2)多元弱酸的各级电离常数逐渐减小。
多元弱酸各步电离常数大小比较:K1>>K2>>K3,因此多元弱酸的酸性主要由第一步电离决定的
(记住:分步进行,一步定性)。
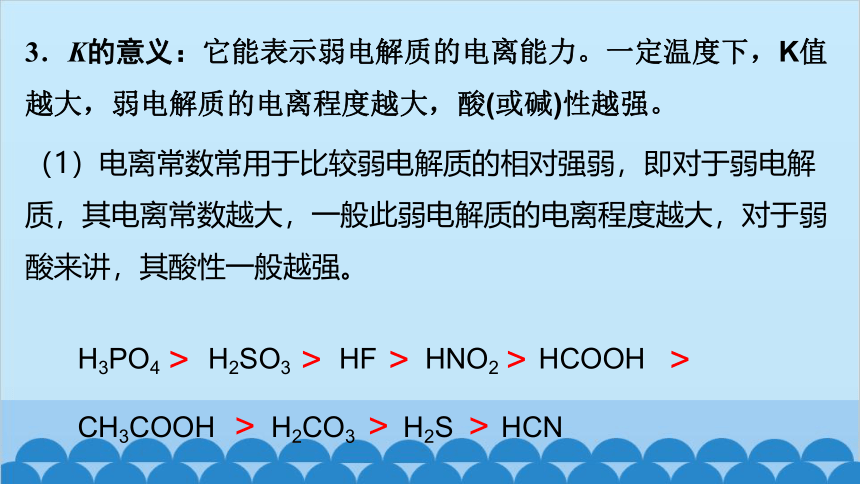
3.K的意义:它能表示弱电解质的电离能力。一定温度下,K值越大,弱电解质的电离程度越大,酸(或碱)性越强。
(1)电离常数常用于比较弱电解质的相对强弱,即对于弱电解质,其电离常数越大,一般此弱电解质的电离程度越大,对于弱酸来讲,其酸性一般越强。
H3PO4 H2SO3 HF HNO2 HCOOH CH3COOH H2CO3 H2S HCN
>
>
>
>
>
>
>
>
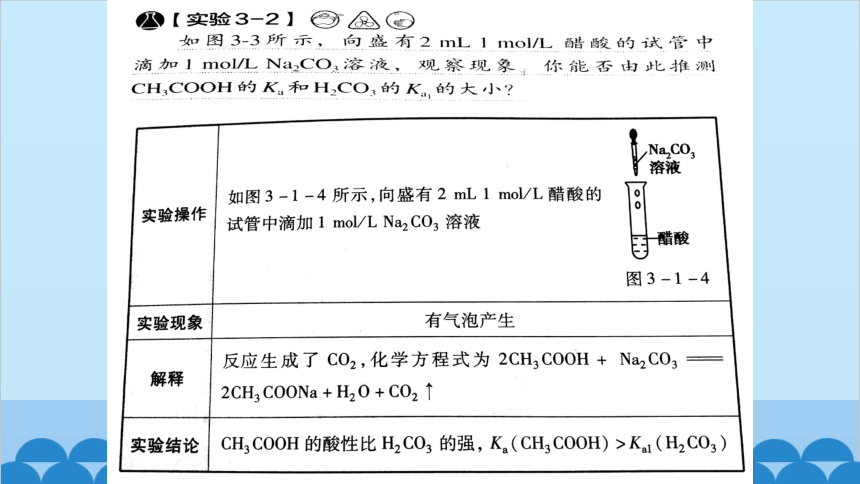
向盛有2 mL 1 mol·L-1醋酸的试管中滴加1 mol·L-1 Na2CO3溶液。观察现象。你能否由此推测CH3COOH的Ka和H2CO3的Ka1的大小?
【实验3-2】
提示:有无色气体产生的变化现象。说明醋酸的酸性强于碳酸,即CH3COOH的Ka大于H2CO3的Ka1。
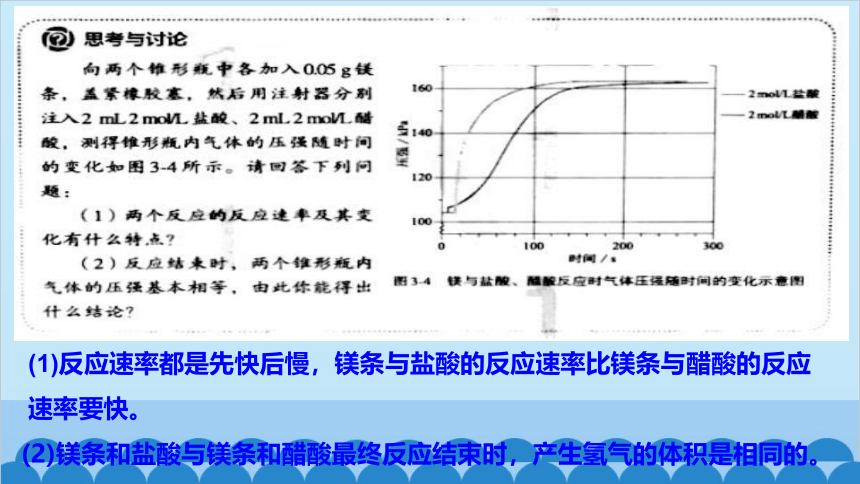
(2)镁条和盐酸与镁条和醋酸最终反应结束时,产生氢气的体积是相同的。
(1)反应速率都是先快后慢,镁条与盐酸的反应速率比镁条与醋酸的反应速率要快。
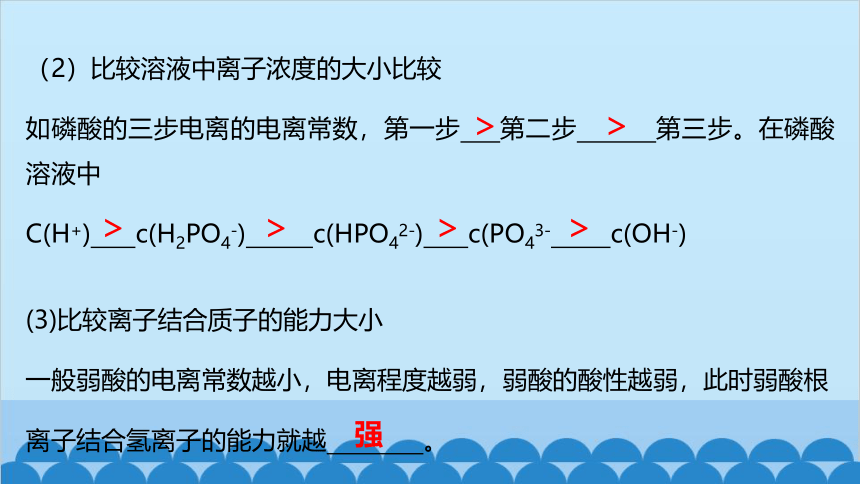
(2)比较溶液中离子浓度的大小比较
如磷酸的三步电离的电离常数,第一步 第二步 第三步。在磷酸溶液中
C(H+) c(H2PO4-) c(HPO42-) c(PO43- c(OH-)
>
>
>
>
>
>
(3)比较离子结合质子的能力大小
一般弱酸的电离常数越小,电离程度越弱,弱酸的酸性越弱,此时弱酸根离子结合氢离子的能力就越 。
强
(1)电离常数的大小由物质本身的性质决定,同一温度下,不同弱电解质的电离常数不同,K值越大,电离程度越大。对应弱电解质越易电离,相应的酸(或碱)性越强。如25 ℃时,Ka(CH3COOH)>Ka(HCN),则HCN的酸性比CH3COOH的酸性弱。
(2)同一弱电解质在同一温度下改变浓度时,其电离常数不变。
(3)电离常数K只随温度的变化而变化,升高温度,K值增大。
(4)多元弱酸电离常数:K1 K2 K3,其酸性主要由第一步电离决定,K值越大,相应酸的酸性越强。计算多元弱酸中的c(H+),或比较多元弱酸酸性的相对强弱时,通常只考虑第一步电离。多元弱碱的情况与多元弱酸相似。
5.规律与应用
6.影响弱电解质电离常数的因素:
内因:弱电解质的本性:电解质越弱,Ka(或Kb)越小,越难电离,酸 (碱)的酸(碱)性越弱。
外因:只与T有关
T越大, Ka(Kb)越大。
CH3COOH 25℃ 0℃
电离平衡常数 Ka=1.75×10-5 Ka=1.65×10-5
25℃ CH3COOH HCN
电离平衡常数 Ka=1.75×10-5 Ka=4.9×10-10
1.两种酸HA与HB的电离常数分别为K1、K2,若K1答案:可以。对于组成相似的弱酸,电离常数越大,酸性越强,故酸性:HB>HA。
6.有关电离常数的计算
2.18 ℃时,H2A(酸):Ka1=4.3×10-7,Ka2=2.1×10-12;
H2B(酸):Ka1=1.0×10-7,Ka2=6.3×10-13。在浓度相同的两种溶液中,用“>”“<”或“=”填空。
(1)H+的浓度:H2A H2B。
(2)酸根离子的浓度:c(A2-) c(B2-)。
(3)酸分子的浓度:c(H2A) c(H2B)。
(4)溶液的导电能力:H2A H2B。
>
>
<
>
解析:H2A和H2B都是二元弱酸,二元弱酸的电离分两步,第一步比第二步电离程度大得多,溶液的酸性(即H+浓度)、酸式酸根离子的浓度、酸分子的浓度、溶液的导电能力均由第一步电离决定。同温、同浓度的H2A、H2B溶液,H2A的第一步电离常数大于H2B的第一步电离常数,故H+浓度是H2A>H2B,酸分子的浓度是c(H2A)H2B。酸根离子A2-、B2-的浓度取决于两酸的第二步电离,H2A的第二步电离常数大于H2B的第二步电离常数,故c(A2-)>c(B2-)。
NH3·H2O NH4 + + OH -
例题:在某温度时,溶质的物质的量浓度为0.2mol·L-1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10-3 mol·L-1,计算NH3·H2O的Kb
c0(mol·L-1) 0.2 0 0
△c(mol·L-1) 1.7×10-3 1.7×10-3 1.7×10-3
c平(mol·L-1) 0.2-1.7×10-3 1.7×10-3 1.7×10-3
c(NH3·H2O )
c(NH4+) ·c(OH --)
Kb=
0.2
(1.7×10-3) ·(1.7×10-3)
=
c平(NH3·H2O)= (0.2-1.7×10-3 ) mol·L-1≈0.2 mol·L-1
≈1.4 ×10-5
1.已知起始时c(HX)和电离产生的c(H+),求电离平衡常数。
HX H+ + X-
起始: c(HX) 0 0
平衡: c(HX)-c(H+) c(H+) c(X-)
有关电离平衡常数的计算(以弱酸HX为例)
2.已知起始时c(HX)和电离平衡常数,求溶液中c(H+)。
HX H+ + X-
起始: c(HX) 0 0
平衡: c(HX)-c(H+) c(H+) c(X-)
例题 25 ℃时,在0.5 L 0.2 mol·L-1的HA溶液中,有0.001 mol的HA电离。
(1)求该温度下HA的电离常数。
(2)计算25 ℃时,0.1 mol·L-1的该酸溶液中的c(H+)。
答案:(1)2.02×10-5 (2)1.42×10-3 mol·L-1
解析:(1)由题意可得:
HA H+ + A-
起始物质的量/mol 0.1 0 0
已电离物质的量/mol 0.001 0.001 0.001
平衡时物质的量/mol 0.099 0.001 0.001
练习 某酸HX是一种弱酸,25 ℃时电离常数Ka=4×10-4。
(1)写出该酸的电离常数表达式:Ka= 。
(2)25 ℃时,往HX溶液中加入1 mol·L-1的盐酸,能 (填“抑制”或“促进”)HX的电离,Ka值将 (填“增大”“减小”或“不变”)。
(3)若HX的起始浓度为0.010 mol·L-1,则平衡时c(H+)= [提示:因Ka很小,平衡时的c(HX)仍可近似为0.010 mol·L-1]。
(2)抑制 不变 (3)2×10-3 mol·L-1
(1)强电解质稀溶液中不存在溶质分子,弱电解质稀溶液中存在溶质分子。 ( )
(2)CaCO3难溶于水,其属于弱电解质。 ( )
(3)离子化合物一定是强电解质,共价化合物一定是弱电解质。 ( )
(4)电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡。 ( )
(5)一定温度下,醋酸的浓度越大,电离常数也越大。 ( )
1.判断正误(正确的打“√”,错误的打“×”)
√
×
×
×
×
2.在25 ℃时,0.1 mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液,已知四种酸的电离常数分别为4.6×10-4、1.8×10-4、4.9×10-10、Ka1=4.3×10-7和Ka2=5.6×10-11,溶液中氢离子浓度最小的是( )
A.HNO2 B.HCOOH C.HCN D.H2CO3
C
解析:根据电离平衡常数大小可以判断弱酸(或弱碱)的相对强弱,弱酸的Ka(多元弱酸则比较Ka1)越小,其电离程度越小,c(H+)越小,由题中数据可知,HCN酸性最弱,c(H+)最小。
3.在氨水中存在下列电离平衡:NH3·H2O NH4++OH-,下列情况能引起电离平衡向正向移动的有( )
①加NH4Cl固体 ②加NaOH溶液 ③通HCl④加CH3COOH溶液 ⑤加水 ⑥加压
A.①③⑤ B.①④⑥ C.③④⑤ D.①②④
解析:①加入NH4Cl固体相当于加入NH4+,平衡左移;②相当于加入OH-,平衡左移;③通HCl,相当于加入H+,中和OH-,平衡右移;④加CH3COOH溶液,相当于加H+,中和OH-,平衡右移;⑤加水,稀释,越稀越电离,平衡右移;⑥加压,无气体参加和生成,无影响。
C
D
5.向两支分别盛有0.1 mol·L-1醋酸和0.1 mol·L-1硼酸溶液的试管中滴加等浓度Na2CO3溶液,观察现象。
[问题1] 查阅资料发现,醋酸、碳酸和硼酸在25 ℃的电离平衡常数分别是1.75×10-5、4.5×10-7(第一步电离)和5.8×10-10。它们的酸性强弱顺序是怎样的?有何规律?
提示:醋酸>碳酸>硼酸。K值越大,酸性越强。
[问题2] 根据问题1的分析,预测你能看到什么现象?
提示:试管1中有无色气体产生,试管2中没有明显现象。
6.下列关于电离常数(K)的说法中正确的是( )
A.电离常数(K)越小,表示弱电解质的电离能力越弱
B.电离常数(K)与温度无关
C.不同浓度的同一弱电解质,其电离常数(K)不同
D.多元弱酸各步电离常数相互关系为K1 解析:加热能促进弱电解质的电离,故电离常数(K)增大,B错误;电离常数只与温度有关,与浓度无关,C错误;多元弱酸各步电离常数的大小关系为K1 K2 K3,D错误。
A
7.已知:25 ℃时,HCOOH的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。下列说法不正确的是( )
A.向Na2CO3溶液中加入甲酸有气泡产生
B.25℃时,向甲酸中加入NaOH溶液,HCOOH的电离程度和K均增大
C.向0.1 mol·L-1甲酸中加入蒸馏水,c(H+)减小
D.向碳酸中加入NaHCO3固体,c(H+)减小
解析:酸的电离平衡常数越大,酸的酸性越强,向Na2CO3溶液中加入甲酸有气泡产生, A正确; 25 ℃时,向甲酸中加入NaOH溶液,NaOH中和H+而促进HCOOH电离,则HCOOH电离程度增大,电离平衡常数只与温度有关,温度不变电离平衡常数K不变, B错误;向0.1 mol·L-1甲酸中加入蒸馏水,促进HCOOH电离,但是HCOOH电离增大程度小于溶液体积增大程度,所以溶液中c(H+)减小, C正确;向碳酸溶液中加入NaHCO3固体,c(HCO3-)增大而抑制碳酸电离,导致溶液c(H+)减小, D正确。
B
8.下表是常温下某些一元弱酸的电离常数:
弱酸 HCN HF CH3COOH HNO2
电离常数 6.2×10-10 6.8×10-4 1.8×10-5 6.4×10-6
则0.1 mol·L-1的下列溶液中,c(H+)最大的是( )
A.HCN B.HF C.CH3COOH D.HNO2
解析:一元弱酸的电离常数越大,电离程度越大,同浓度时,电离产生的c(H+)越大。
B
9.如图所示是醋酸溶于水时,电离过程中,醋酸分子电离成离子的速率、离子结合成醋酸分子的速率随时间的变化曲线。请回答下列问题:
(1)va表示__________ ___ _的速率;vb表示___________ _的速率。
(2)在时间由t0到t1过程中,va的变化是________,vb的变化是________。
(3)当时间达t1后,va与vb的关系是________,此时醋酸达到_______ _状态。
醋酸分子电离成离子
离子结合成醋酸分子
减小
增大
相等
电离平衡
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
第二课时 电离平衡常数
1.含义:在一定条件下,当弱电解质在水溶液中达到电离平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离的分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,用K表示。弱酸和弱碱的电离常数分别用Ka和Kb表示.
四、电离平衡常数
2.表示方法:
c(A -)、 c(B十)、 c(HA)和c(BOH) 均为达到电离平衡后各粒子在溶液中的浓度值
(1)一元弱酸HA的电离常数:根据HA H++A-,
可表示为
(2)一元弱碱BOH的电离常数:根据BOH B++OH-,
可表示为
Ka=
c ( H+) .c( A-)
c(HA)
Kb=
c ( B+).c( OH- )
c(BOH)
(3)多元弱酸、多元弱碱的电离平衡常数。
多元弱酸的电离是分步进行的,每步各有电离平衡常数,通常用K1、K2等来分别表示。例如,
H2CO3 H++HCO3- Ka1= ;
HCO3- H++CO32- Ka2= 。
多元弱酸各步电离常数的大小比较为Ka1 Ka2,因此,多元弱酸的酸性主要由第一步电离决定。由于多元弱碱为难溶碱,所以一般不用电离平衡常数,而用以后要学到的难溶物的溶度积常数。
c(HCO3-)
c(H+)
c(H+)
c(H2CO3)
c(HCO3-)
c(CO32-)
(1)CH3COOH的电离常数Ka= 。
(2)NH3·H2O的电离常数Kb= 。
(3)H2CO3的电离常数Ka1= 、
Ka2= 。
3.特点:
(1)电离平衡常数与浓度无关,只与温度有关,升高温度,K 值增大。
(2)多元弱酸的各级电离常数逐渐减小。
多元弱酸各步电离常数大小比较:K1>>K2>>K3,因此多元弱酸的酸性主要由第一步电离决定的
(记住:分步进行,一步定性)。
3.K的意义:它能表示弱电解质的电离能力。一定温度下,K值越大,弱电解质的电离程度越大,酸(或碱)性越强。
(1)电离常数常用于比较弱电解质的相对强弱,即对于弱电解质,其电离常数越大,一般此弱电解质的电离程度越大,对于弱酸来讲,其酸性一般越强。
H3PO4 H2SO3 HF HNO2 HCOOH CH3COOH H2CO3 H2S HCN
>
>
>
>
>
>
>
>
向盛有2 mL 1 mol·L-1醋酸的试管中滴加1 mol·L-1 Na2CO3溶液。观察现象。你能否由此推测CH3COOH的Ka和H2CO3的Ka1的大小?
【实验3-2】
提示:有无色气体产生的变化现象。说明醋酸的酸性强于碳酸,即CH3COOH的Ka大于H2CO3的Ka1。
(2)镁条和盐酸与镁条和醋酸最终反应结束时,产生氢气的体积是相同的。
(1)反应速率都是先快后慢,镁条与盐酸的反应速率比镁条与醋酸的反应速率要快。
(2)比较溶液中离子浓度的大小比较
如磷酸的三步电离的电离常数,第一步 第二步 第三步。在磷酸溶液中
C(H+) c(H2PO4-) c(HPO42-) c(PO43- c(OH-)
>
>
>
>
>
>
(3)比较离子结合质子的能力大小
一般弱酸的电离常数越小,电离程度越弱,弱酸的酸性越弱,此时弱酸根离子结合氢离子的能力就越 。
强
(1)电离常数的大小由物质本身的性质决定,同一温度下,不同弱电解质的电离常数不同,K值越大,电离程度越大。对应弱电解质越易电离,相应的酸(或碱)性越强。如25 ℃时,Ka(CH3COOH)>Ka(HCN),则HCN的酸性比CH3COOH的酸性弱。
(2)同一弱电解质在同一温度下改变浓度时,其电离常数不变。
(3)电离常数K只随温度的变化而变化,升高温度,K值增大。
(4)多元弱酸电离常数:K1 K2 K3,其酸性主要由第一步电离决定,K值越大,相应酸的酸性越强。计算多元弱酸中的c(H+),或比较多元弱酸酸性的相对强弱时,通常只考虑第一步电离。多元弱碱的情况与多元弱酸相似。
5.规律与应用
6.影响弱电解质电离常数的因素:
内因:弱电解质的本性:电解质越弱,Ka(或Kb)越小,越难电离,酸 (碱)的酸(碱)性越弱。
外因:只与T有关
T越大, Ka(Kb)越大。
CH3COOH 25℃ 0℃
电离平衡常数 Ka=1.75×10-5 Ka=1.65×10-5
25℃ CH3COOH HCN
电离平衡常数 Ka=1.75×10-5 Ka=4.9×10-10
1.两种酸HA与HB的电离常数分别为K1、K2,若K1
6.有关电离常数的计算
2.18 ℃时,H2A(酸):Ka1=4.3×10-7,Ka2=2.1×10-12;
H2B(酸):Ka1=1.0×10-7,Ka2=6.3×10-13。在浓度相同的两种溶液中,用“>”“<”或“=”填空。
(1)H+的浓度:H2A H2B。
(2)酸根离子的浓度:c(A2-) c(B2-)。
(3)酸分子的浓度:c(H2A) c(H2B)。
(4)溶液的导电能力:H2A H2B。
>
>
<
>
解析:H2A和H2B都是二元弱酸,二元弱酸的电离分两步,第一步比第二步电离程度大得多,溶液的酸性(即H+浓度)、酸式酸根离子的浓度、酸分子的浓度、溶液的导电能力均由第一步电离决定。同温、同浓度的H2A、H2B溶液,H2A的第一步电离常数大于H2B的第一步电离常数,故H+浓度是H2A>H2B,酸分子的浓度是c(H2A)
NH3·H2O NH4 + + OH -
例题:在某温度时,溶质的物质的量浓度为0.2mol·L-1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10-3 mol·L-1,计算NH3·H2O的Kb
c0(mol·L-1) 0.2 0 0
△c(mol·L-1) 1.7×10-3 1.7×10-3 1.7×10-3
c平(mol·L-1) 0.2-1.7×10-3 1.7×10-3 1.7×10-3
c(NH3·H2O )
c(NH4+) ·c(OH --)
Kb=
0.2
(1.7×10-3) ·(1.7×10-3)
=
c平(NH3·H2O)= (0.2-1.7×10-3 ) mol·L-1≈0.2 mol·L-1
≈1.4 ×10-5
1.已知起始时c(HX)和电离产生的c(H+),求电离平衡常数。
HX H+ + X-
起始: c(HX) 0 0
平衡: c(HX)-c(H+) c(H+) c(X-)
有关电离平衡常数的计算(以弱酸HX为例)
2.已知起始时c(HX)和电离平衡常数,求溶液中c(H+)。
HX H+ + X-
起始: c(HX) 0 0
平衡: c(HX)-c(H+) c(H+) c(X-)
例题 25 ℃时,在0.5 L 0.2 mol·L-1的HA溶液中,有0.001 mol的HA电离。
(1)求该温度下HA的电离常数。
(2)计算25 ℃时,0.1 mol·L-1的该酸溶液中的c(H+)。
答案:(1)2.02×10-5 (2)1.42×10-3 mol·L-1
解析:(1)由题意可得:
HA H+ + A-
起始物质的量/mol 0.1 0 0
已电离物质的量/mol 0.001 0.001 0.001
平衡时物质的量/mol 0.099 0.001 0.001
练习 某酸HX是一种弱酸,25 ℃时电离常数Ka=4×10-4。
(1)写出该酸的电离常数表达式:Ka= 。
(2)25 ℃时,往HX溶液中加入1 mol·L-1的盐酸,能 (填“抑制”或“促进”)HX的电离,Ka值将 (填“增大”“减小”或“不变”)。
(3)若HX的起始浓度为0.010 mol·L-1,则平衡时c(H+)= [提示:因Ka很小,平衡时的c(HX)仍可近似为0.010 mol·L-1]。
(2)抑制 不变 (3)2×10-3 mol·L-1
(1)强电解质稀溶液中不存在溶质分子,弱电解质稀溶液中存在溶质分子。 ( )
(2)CaCO3难溶于水,其属于弱电解质。 ( )
(3)离子化合物一定是强电解质,共价化合物一定是弱电解质。 ( )
(4)电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡。 ( )
(5)一定温度下,醋酸的浓度越大,电离常数也越大。 ( )
1.判断正误(正确的打“√”,错误的打“×”)
√
×
×
×
×
2.在25 ℃时,0.1 mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液,已知四种酸的电离常数分别为4.6×10-4、1.8×10-4、4.9×10-10、Ka1=4.3×10-7和Ka2=5.6×10-11,溶液中氢离子浓度最小的是( )
A.HNO2 B.HCOOH C.HCN D.H2CO3
C
解析:根据电离平衡常数大小可以判断弱酸(或弱碱)的相对强弱,弱酸的Ka(多元弱酸则比较Ka1)越小,其电离程度越小,c(H+)越小,由题中数据可知,HCN酸性最弱,c(H+)最小。
3.在氨水中存在下列电离平衡:NH3·H2O NH4++OH-,下列情况能引起电离平衡向正向移动的有( )
①加NH4Cl固体 ②加NaOH溶液 ③通HCl④加CH3COOH溶液 ⑤加水 ⑥加压
A.①③⑤ B.①④⑥ C.③④⑤ D.①②④
解析:①加入NH4Cl固体相当于加入NH4+,平衡左移;②相当于加入OH-,平衡左移;③通HCl,相当于加入H+,中和OH-,平衡右移;④加CH3COOH溶液,相当于加H+,中和OH-,平衡右移;⑤加水,稀释,越稀越电离,平衡右移;⑥加压,无气体参加和生成,无影响。
C
D
5.向两支分别盛有0.1 mol·L-1醋酸和0.1 mol·L-1硼酸溶液的试管中滴加等浓度Na2CO3溶液,观察现象。
[问题1] 查阅资料发现,醋酸、碳酸和硼酸在25 ℃的电离平衡常数分别是1.75×10-5、4.5×10-7(第一步电离)和5.8×10-10。它们的酸性强弱顺序是怎样的?有何规律?
提示:醋酸>碳酸>硼酸。K值越大,酸性越强。
[问题2] 根据问题1的分析,预测你能看到什么现象?
提示:试管1中有无色气体产生,试管2中没有明显现象。
6.下列关于电离常数(K)的说法中正确的是( )
A.电离常数(K)越小,表示弱电解质的电离能力越弱
B.电离常数(K)与温度无关
C.不同浓度的同一弱电解质,其电离常数(K)不同
D.多元弱酸各步电离常数相互关系为K1
A
7.已知:25 ℃时,HCOOH的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。下列说法不正确的是( )
A.向Na2CO3溶液中加入甲酸有气泡产生
B.25℃时,向甲酸中加入NaOH溶液,HCOOH的电离程度和K均增大
C.向0.1 mol·L-1甲酸中加入蒸馏水,c(H+)减小
D.向碳酸中加入NaHCO3固体,c(H+)减小
解析:酸的电离平衡常数越大,酸的酸性越强,向Na2CO3溶液中加入甲酸有气泡产生, A正确; 25 ℃时,向甲酸中加入NaOH溶液,NaOH中和H+而促进HCOOH电离,则HCOOH电离程度增大,电离平衡常数只与温度有关,温度不变电离平衡常数K不变, B错误;向0.1 mol·L-1甲酸中加入蒸馏水,促进HCOOH电离,但是HCOOH电离增大程度小于溶液体积增大程度,所以溶液中c(H+)减小, C正确;向碳酸溶液中加入NaHCO3固体,c(HCO3-)增大而抑制碳酸电离,导致溶液c(H+)减小, D正确。
B
8.下表是常温下某些一元弱酸的电离常数:
弱酸 HCN HF CH3COOH HNO2
电离常数 6.2×10-10 6.8×10-4 1.8×10-5 6.4×10-6
则0.1 mol·L-1的下列溶液中,c(H+)最大的是( )
A.HCN B.HF C.CH3COOH D.HNO2
解析:一元弱酸的电离常数越大,电离程度越大,同浓度时,电离产生的c(H+)越大。
B
9.如图所示是醋酸溶于水时,电离过程中,醋酸分子电离成离子的速率、离子结合成醋酸分子的速率随时间的变化曲线。请回答下列问题:
(1)va表示__________ ___ _的速率;vb表示___________ _的速率。
(2)在时间由t0到t1过程中,va的变化是________,vb的变化是________。
(3)当时间达t1后,va与vb的关系是________,此时醋酸达到_______ _状态。
醋酸分子电离成离子
离子结合成醋酸分子
减小
增大
相等
电离平衡
