2023—2024学年鲁教版化学九年级上册第五单元 定量研究化学反应 课后练习题(含答案)
文档属性
| 名称 | 2023—2024学年鲁教版化学九年级上册第五单元 定量研究化学反应 课后练习题(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 408.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-11 13:13:01 | ||
图片预览



文档简介
2023—2024学年鲁教版化学九年级上册第五单元 定量研究化学反应 课后练习题含答案
鲁教版第五单元 定量研究化学反应
一、选择题。
1、某化合物在纯氧气中燃烧,只生成二氧化碳和水,则该化合物中一定含有的元素是( )
A. 碳、氧两种元素 B. 氢、氧两种元素
C. 碳、氢两种元素 D. 碳、氢、氧三种元素
2、推理是学习化学的一种重要方法,但不合理的推理会得出错误的结论。以下推理正确的是( )
A.分子可以构成物质,物质一定是由分子构成的
B.离子是带电荷的微粒,带电荷的微粒一定是离子
C.最外层电子数相同的原子化学性质相似,氦原子和镁原子的化学性质也相似
D.含碳元素的物质充分燃烧会生成CO2,燃烧能生成CO2的物质一定含碳元素
3、通常情祝下,铜和稀硫酸不反应。但是把一小块铜片放入适量稀硫酸中,同时加入X再加热,可以发生如下反应:。下列说法正确的是( )
A.该反应不遵守质量守恒定律 B.反应后溶液会由蓝色变为无色
C.反应后溶液的质量减少 D.反应物X的化学式是
4、在反应4A+3B=2C中,若2.7g A完全反应生成5.1g的C,已知B的相对分子质量是32,则C的相对分子质量为( )
A.34 B.68 C.102 D.204
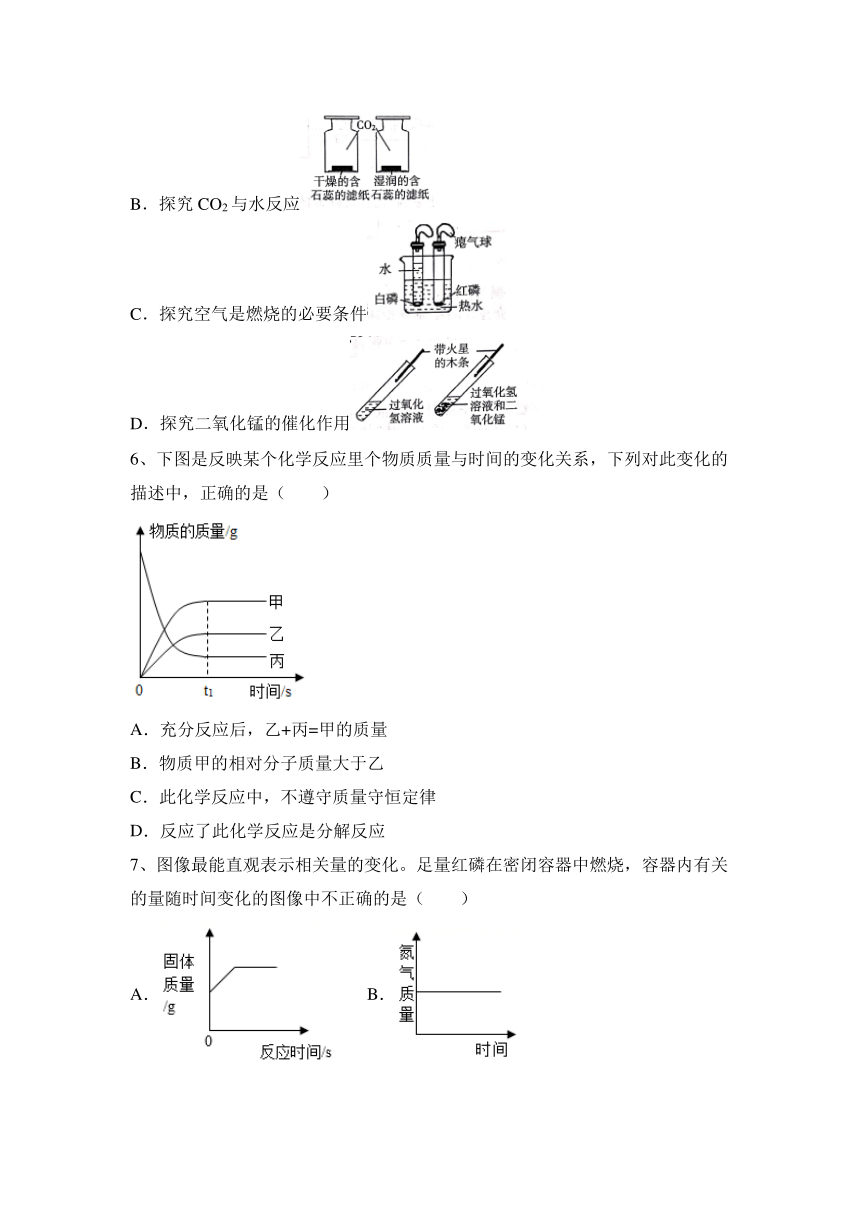
5、对比实验是实验探究的重要方法,下列对比实验设计不能实现相应实验目的的是( )
A.区分硬水和软水
B.探究CO2与水反应
C.探究空气是燃烧的必要条件
D.探究二氧化锰的催化作用
6、下图是反映某个化学反应里个物质质量与时间的变化关系,下列对此变化的描述中,正确的是( )
A.充分反应后,乙+丙=甲的质量
B.物质甲的相对分子质量大于乙
C.此化学反应中,不遵守质量守恒定律
D.反应了此化学反应是分解反应
7、图像最能直观表示相关量的变化。足量红磷在密闭容器中燃烧,容器内有关的量随时间变化的图像中不正确的是( )
A. B.
C. D.
8、一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示。下列关于以上反应的说法中,正确的是( )
A.X的值为44
B.W由碳、氢两种元素组成
C.该反应属于置换反应
D.反应中生成二氧化碳和水质量比为13:8
9、已知2A+3B=C+3D,用足量的A和49g B恰好完全反应,其生成57g C和1g D,若B的相对分子质量为98,则A的相对分子质量为( )
A.16 B.27 C.44 D.56
10、纸火锅的材料是普通的纸张,使用时没有被点燃的原因是( )
A.纸火锅的纸不是可燃物
B.纸火锅里的汤使纸与空气隔绝
C.纸火锅被加热时使纸的着火点升高了
D.纸火锅里的汤汽化吸热,使温度达不到纸的着火点
11、有关质量守恒定律的说法,正确的是( )
A.铁在氧气中燃烧后固体质量增大,遵守质量守恒定律
B.5gA和5gB混合发生化合反应一定能生成10gC
C.化学反应前后,原子数目、分子数目一定不变
D.蜡烛燃烧生成二氧化碳则蜡烛组成中一定含有碳元素和氧元素
12、高纯度的单晶硅是制做电子集成电路的基础材料。工业上制备高纯硅的化学反应原理为:
①SiO2+2CSi +2CO↑、②Si+3HClHSiCl3+H2、③HSiCl3+H2Si+3X,反应①制得粗硅,通过反应②③进一步得到高纯硅;三氯硅烷(HSiCl3)的沸点是31.8℃。下列有关说法不正确的是( )
A.反应③中X的化学式为HCl
B.三氯硅烷由氢、硅、氯三种元素组成
C.三氯硅烷中硅、氯元素的质量比为1∶3
D.反应②③实现了硅元素的富集,将粗硅转化为高纯硅
13、A、B、C三种物质各15g,它们化合时只能生成30g新物质D.若增加10gA,则反应停止后,原反应物中只余C.根据上述条件推断下列说法中正确的是( )
A.第一次反应停止后,B剩余9g B.第二次反应后,D的质量为50g
C.反应中A和B的质量比是3:2 D.反应中A和C的质量比是5:3
14、向沸水中加入一块白磷,白磷不能燃烧的原因是( )
A.没有点燃 B.未与氧气接触
C.温度没有达到着火点 D.水的温度太低
15、科学家研究得到一种物质,其分子结构像一只小狗(如图),于是取名叫狗烯,狗烯的化学式为C26H26。下列关于狗烯的说法正确的是( )
A.狗烯中碳元素与氢元素的质量比为:1:1
B.狗烯中碳元素和氢元素的质量分数相等
C.狗烯在氧气中充分燃烧生成二氧化碳和水
D.狗烯由26个碳原子和26个氢原子构成
16、科学研究表明,氨气在常压下就可液化为液氨,液氨可用作汽车的清洁燃料,其燃烧时的主要反应为4NH3+3O22X+6H2O.下列说法中不正确的是( )
A.氨气在常压下液化是物理变化 B.X的化学式为
C.液氨具有可燃性属于化学性质 D.反应前后三种元素化合价都发生变化
二、填空题。
17、用符号或化学式表示:
(1)铝离子_____;
(2)两个铵根离子_____;
(3)钡的氧化物_____;
(4)氖气_____;
(5)氧化铁中铁元素的化合价为+3价_____;
(6)在空气中燃烧产生白烟的非金属单质_____;
(7)高粱玉米和薯类经发酵蒸馏可得到的绿色燃料是_____。
18、下图是同学们构建的关于氧气的部分知识网络,请你由图回答:
(1)写出实验室固液常温型制取氧气的化学方程式___________ ;
(2)Ⅰ、Ⅱ两类有氧气参加的化学反应的相同点是___________(写一条);
(3)从正反两方面举例说明氧气与人类生活的关系:
正面:___________,反面:___________。
19、金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+BA2B.某校一课外小组的甲、乙、丙三个学生分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是8.0g。有关实验数据记录如下。试求丙学生实验中a:b的值可能是多少______?
A的用量 B的用量 A2B的质量
甲 7.0g 1.0g 5.0g
乙 4.0g 4.0g 5.0g
丙 ag bg 3.0g
20、燃烧条件:达到着火点
步骤 现象 结论
取一张A4纸,裁成两半,折成两只同样的纸船。将一只纸船放在铁架台的铁圈上,用酒精灯加热,记录纸船从加热到燃烧需要的时间 纸船立即 。 可燃物燃烧温度需要达到_ __。
向另一只纸船中小心注入约一半的水,放在铁架台的铁圈上,用酒精灯加热,记录纸船从加热到燃烧需要的时间 纸船到水快蒸干时才燃烧
21、写出下列反应的化学方程式。
(1)碳在充足的氧气中燃烧:___________ 。
(2)磷在氧气中燃烧:___________ 。
(3)高锰酸钾加热制取氧气:___________ 。
三、实验题。
22、某化学兴趣小组利用镁条在空气中燃烧的实验验证质量守恒定律。
(1)请写出镁条与氧气反应的化学方程式__________ 。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律。我_________(填“同意”或“不同意”)小明的观点,因为__________
__________ 。
(3)小红按如图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】
①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【作出猜想】黄色固体为Mg3N2。
【实验探究】请设计实验,验证猜想。
实验操作 实验现象 实验结论
取少量黄色固体于试管中,加入少量_________,将湿润红色石蕊试纸放在试管口 _________ 黄色固体为氮化镁
【反思交流】
①若用镁条代替红磷完成测定空气中氧气含量的实验,不考虑其他因素的影响,进入水的体积会_________(填“大于”、“小于”或“等于”)瓶内空气总体积的。
②空气中的氮气的含量远大于氧气的含量,可是镁条在空气中燃烧的产物氧化镁却远多于氮化镁,合理的解释是__________ 。
四、计算类题。
23、化学兴趣小组的同学们要测定某过氧化氢溶液的溶质质量分数。他们称取50.0 g过氧化氢溶液放入盛有2.0 g二氧化锰的烧杯(烧杯质量为76.0 g)中。待完全反应后,称量反应后物质连同烧杯的质量为126.4 g(氧气逸出带出的水分忽略不计)。请计算回答。
(1)反应后产生氧气的质量是 g。
(2)该过氧化氢溶液的溶质质量分数是多少 (写出计算过程)
2023—2024学年鲁教版化学九年级上册第五单元 定量研究化学反应 课后练习题含答案
鲁教版第五单元 定量研究化学反应
一、选择题。
1、某化合物在纯氧气中燃烧,只生成二氧化碳和水,则该化合物中一定含有的元素是( )
A. 碳、氧两种元素 B. 氢、氧两种元素
C. 碳、氢两种元素 D. 碳、氢、氧三种元素
【答案】C
2、推理是学习化学的一种重要方法,但不合理的推理会得出错误的结论。以下推理正确的是( )
A.分子可以构成物质,物质一定是由分子构成的
B.离子是带电荷的微粒,带电荷的微粒一定是离子
C.最外层电子数相同的原子化学性质相似,氦原子和镁原子的化学性质也相似
D.含碳元素的物质充分燃烧会生成CO2,燃烧能生成CO2的物质一定含碳元素
【答案】D
3、通常情祝下,铜和稀硫酸不反应。但是把一小块铜片放入适量稀硫酸中,同时加入X再加热,可以发生如下反应:。下列说法正确的是( )
A.该反应不遵守质量守恒定律 B.反应后溶液会由蓝色变为无色
C.反应后溶液的质量减少 D.反应物X的化学式是
【答案】 D
4、在反应4A+3B=2C中,若2.7g A完全反应生成5.1g的C,已知B的相对分子质量是32,则C的相对分子质量为( )
A.34 B.68 C.102 D.204
【答案】C
5、对比实验是实验探究的重要方法,下列对比实验设计不能实现相应实验目的的是( )
A.区分硬水和软水
B.探究CO2与水反应
C.探究空气是燃烧的必要条件
D.探究二氧化锰的催化作用
【答案】C
6、下图是反映某个化学反应里个物质质量与时间的变化关系,下列对此变化的描述中,正确的是( )
A.充分反应后,乙+丙=甲的质量
B.物质甲的相对分子质量大于乙
C.此化学反应中,不遵守质量守恒定律
D.反应了此化学反应是分解反应
【答案】D
7、图像最能直观表示相关量的变化。足量红磷在密闭容器中燃烧,容器内有关的量随时间变化的图像中不正确的是( )
A. B.
C. D.
【答案】C
8、一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示。下列关于以上反应的说法中,正确的是( )
A.X的值为44
B.W由碳、氢两种元素组成
C.该反应属于置换反应
D.反应中生成二氧化碳和水质量比为13:8
【答案】 B
9、已知2A+3B=C+3D,用足量的A和49g B恰好完全反应,其生成57g C和1g D,若B的相对分子质量为98,则A的相对分子质量为( )
A.16 B.27 C.44 D.56
【答案】B
10、纸火锅的材料是普通的纸张,使用时没有被点燃的原因是( )
A.纸火锅的纸不是可燃物
B.纸火锅里的汤使纸与空气隔绝
C.纸火锅被加热时使纸的着火点升高了
D.纸火锅里的汤汽化吸热,使温度达不到纸的着火点
【答案】D
11、有关质量守恒定律的说法,正确的是( )
A.铁在氧气中燃烧后固体质量增大,遵守质量守恒定律
B.5gA和5gB混合发生化合反应一定能生成10gC
C.化学反应前后,原子数目、分子数目一定不变
D.蜡烛燃烧生成二氧化碳则蜡烛组成中一定含有碳元素和氧元素
【答案】A
12、高纯度的单晶硅是制做电子集成电路的基础材料。工业上制备高纯硅的化学反应原理为:
①SiO2+2CSi +2CO↑、②Si+3HClHSiCl3+H2、③HSiCl3+H2Si+3X,反应①制得粗硅,通过反应②③进一步得到高纯硅;三氯硅烷(HSiCl3)的沸点是31.8℃。下列有关说法不正确的是( )
A.反应③中X的化学式为HCl
B.三氯硅烷由氢、硅、氯三种元素组成
C.三氯硅烷中硅、氯元素的质量比为1∶3
D.反应②③实现了硅元素的富集,将粗硅转化为高纯硅
【答案】 C
13、A、B、C三种物质各15g,它们化合时只能生成30g新物质D.若增加10gA,则反应停止后,原反应物中只余C.根据上述条件推断下列说法中正确的是( )
A.第一次反应停止后,B剩余9g B.第二次反应后,D的质量为50g
C.反应中A和B的质量比是3:2 D.反应中A和C的质量比是5:3
【答案】B
14、向沸水中加入一块白磷,白磷不能燃烧的原因是( )
A.没有点燃 B.未与氧气接触
C.温度没有达到着火点 D.水的温度太低
【答案】B
15、科学家研究得到一种物质,其分子结构像一只小狗(如图),于是取名叫狗烯,狗烯的化学式为C26H26。下列关于狗烯的说法正确的是( )
A.狗烯中碳元素与氢元素的质量比为:1:1
B.狗烯中碳元素和氢元素的质量分数相等
C.狗烯在氧气中充分燃烧生成二氧化碳和水
D.狗烯由26个碳原子和26个氢原子构成
【答案】C
16、科学研究表明,氨气在常压下就可液化为液氨,液氨可用作汽车的清洁燃料,其燃烧时的主要反应为4NH3+3O22X+6H2O.下列说法中不正确的是( )
A.氨气在常压下液化是物理变化 B.X的化学式为
C.液氨具有可燃性属于化学性质 D.反应前后三种元素化合价都发生变化
【答案】 D
二、填空题。
17、用符号或化学式表示:
(1)铝离子_____;
(2)两个铵根离子_____;
(3)钡的氧化物_____;
(4)氖气_____;
(5)氧化铁中铁元素的化合价为+3价_____;
(6)在空气中燃烧产生白烟的非金属单质_____;
(7)高粱玉米和薯类经发酵蒸馏可得到的绿色燃料是_____。
【答案】Al3+; 2NH4+; BaO; Ne; P; C2H5OH。
18、下图是同学们构建的关于氧气的部分知识网络,请你由图回答:
(1)写出实验室固液常温型制取氧气的化学方程式___________ ;
(2)Ⅰ、Ⅱ两类有氧气参加的化学反应的相同点是___________(写一条);
(3)从正反两方面举例说明氧气与人类生活的关系:
正面:___________,反面:___________。
【答案】(1)
(2)都属于氧化反应(或都放热)
(3) 供给呼吸 铁生锈
19、金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+BA2B.某校一课外小组的甲、乙、丙三个学生分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是8.0g。有关实验数据记录如下。试求丙学生实验中a:b的值可能是多少______?
A的用量 B的用量 A2B的质量
甲 7.0g 1.0g 5.0g
乙 4.0g 4.0g 5.0g
丙 ag bg 3.0g
【答案】3:7或37:3。
20、燃烧条件:达到着火点
步骤 现象 结论
取一张A4纸,裁成两半,折成两只同样的纸船。将一只纸船放在铁架台的铁圈上,用酒精灯加热,记录纸船从加热到燃烧需要的时间 纸船立即 。 可燃物燃烧温度需要达到_ __。
向另一只纸船中小心注入约一半的水,放在铁架台的铁圈上,用酒精灯加热,记录纸船从加热到燃烧需要的时间 纸船到水快蒸干时才燃烧
【答案】燃烧 着火点
21、写出下列反应的化学方程式。
(1)碳在充足的氧气中燃烧:___________ 。
(2)磷在氧气中燃烧:___________ 。
(3)高锰酸钾加热制取氧气:___________ 。
【答案】(1)
(2)4P+5O22P2O5
(3)2KMnO4K2MnO4+MnO2+O2↑
三、实验题。
22、某化学兴趣小组利用镁条在空气中燃烧的实验验证质量守恒定律。
(1)请写出镁条与氧气反应的化学方程式__________ 。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律。我_________(填“同意”或“不同意”)小明的观点,因为__________
__________ 。
(3)小红按如图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】
①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【作出猜想】黄色固体为Mg3N2。
【实验探究】请设计实验,验证猜想。
实验操作 实验现象 实验结论
取少量黄色固体于试管中,加入少量_________,将湿润红色石蕊试纸放在试管口 _________ 黄色固体为氮化镁
【反思交流】
①若用镁条代替红磷完成测定空气中氧气含量的实验,不考虑其他因素的影响,进入水的体积会_________(填“大于”、“小于”或“等于”)瓶内空气总体积的。
②空气中的氮气的含量远大于氧气的含量,可是镁条在空气中燃烧的产物氧化镁却远多于氮化镁,合理的解释是__________ 。
【答案】(1)
(2) 不同意 所有的化学变化都遵循质量守恒定律,镁燃烧是镁与空气中氧气发生化合反应生成氧化镁
(3) 蒸馏水 红色的石蕊试纸变蓝 大于
氧气的化学性质比氮气更活泼,镁条更容易与氧气发生反应
四、计算类题。
23、化学兴趣小组的同学们要测定某过氧化氢溶液的溶质质量分数。他们称取50.0 g过氧化氢溶液放入盛有2.0 g二氧化锰的烧杯(烧杯质量为76.0 g)中。待完全反应后,称量反应后物质连同烧杯的质量为126.4 g(氧气逸出带出的水分忽略不计)。请计算回答。
(1)反应后产生氧气的质量是 g。
(2)该过氧化氢溶液的溶质质量分数是多少 (写出计算过程)
【答案】(1)1.6
(2)解:设生成1.6 g氧气需要过氧化氢的质量为x。
2H2O2 2H2+O2↑
68 32
x 1.6 g
= 解得x=3.4 g
该过氧化氢溶液的溶质质量分数为×100%=6.8%
答:该过氧化氢溶液的溶质质量分数为6.8%。
鲁教版第五单元 定量研究化学反应
一、选择题。
1、某化合物在纯氧气中燃烧,只生成二氧化碳和水,则该化合物中一定含有的元素是( )
A. 碳、氧两种元素 B. 氢、氧两种元素
C. 碳、氢两种元素 D. 碳、氢、氧三种元素
2、推理是学习化学的一种重要方法,但不合理的推理会得出错误的结论。以下推理正确的是( )
A.分子可以构成物质,物质一定是由分子构成的
B.离子是带电荷的微粒,带电荷的微粒一定是离子
C.最外层电子数相同的原子化学性质相似,氦原子和镁原子的化学性质也相似
D.含碳元素的物质充分燃烧会生成CO2,燃烧能生成CO2的物质一定含碳元素
3、通常情祝下,铜和稀硫酸不反应。但是把一小块铜片放入适量稀硫酸中,同时加入X再加热,可以发生如下反应:。下列说法正确的是( )
A.该反应不遵守质量守恒定律 B.反应后溶液会由蓝色变为无色
C.反应后溶液的质量减少 D.反应物X的化学式是
4、在反应4A+3B=2C中,若2.7g A完全反应生成5.1g的C,已知B的相对分子质量是32,则C的相对分子质量为( )
A.34 B.68 C.102 D.204
5、对比实验是实验探究的重要方法,下列对比实验设计不能实现相应实验目的的是( )
A.区分硬水和软水
B.探究CO2与水反应
C.探究空气是燃烧的必要条件
D.探究二氧化锰的催化作用
6、下图是反映某个化学反应里个物质质量与时间的变化关系,下列对此变化的描述中,正确的是( )
A.充分反应后,乙+丙=甲的质量
B.物质甲的相对分子质量大于乙
C.此化学反应中,不遵守质量守恒定律
D.反应了此化学反应是分解反应
7、图像最能直观表示相关量的变化。足量红磷在密闭容器中燃烧,容器内有关的量随时间变化的图像中不正确的是( )
A. B.
C. D.
8、一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示。下列关于以上反应的说法中,正确的是( )
A.X的值为44
B.W由碳、氢两种元素组成
C.该反应属于置换反应
D.反应中生成二氧化碳和水质量比为13:8
9、已知2A+3B=C+3D,用足量的A和49g B恰好完全反应,其生成57g C和1g D,若B的相对分子质量为98,则A的相对分子质量为( )
A.16 B.27 C.44 D.56
10、纸火锅的材料是普通的纸张,使用时没有被点燃的原因是( )
A.纸火锅的纸不是可燃物
B.纸火锅里的汤使纸与空气隔绝
C.纸火锅被加热时使纸的着火点升高了
D.纸火锅里的汤汽化吸热,使温度达不到纸的着火点
11、有关质量守恒定律的说法,正确的是( )
A.铁在氧气中燃烧后固体质量增大,遵守质量守恒定律
B.5gA和5gB混合发生化合反应一定能生成10gC
C.化学反应前后,原子数目、分子数目一定不变
D.蜡烛燃烧生成二氧化碳则蜡烛组成中一定含有碳元素和氧元素
12、高纯度的单晶硅是制做电子集成电路的基础材料。工业上制备高纯硅的化学反应原理为:
①SiO2+2CSi +2CO↑、②Si+3HClHSiCl3+H2、③HSiCl3+H2Si+3X,反应①制得粗硅,通过反应②③进一步得到高纯硅;三氯硅烷(HSiCl3)的沸点是31.8℃。下列有关说法不正确的是( )
A.反应③中X的化学式为HCl
B.三氯硅烷由氢、硅、氯三种元素组成
C.三氯硅烷中硅、氯元素的质量比为1∶3
D.反应②③实现了硅元素的富集,将粗硅转化为高纯硅
13、A、B、C三种物质各15g,它们化合时只能生成30g新物质D.若增加10gA,则反应停止后,原反应物中只余C.根据上述条件推断下列说法中正确的是( )
A.第一次反应停止后,B剩余9g B.第二次反应后,D的质量为50g
C.反应中A和B的质量比是3:2 D.反应中A和C的质量比是5:3
14、向沸水中加入一块白磷,白磷不能燃烧的原因是( )
A.没有点燃 B.未与氧气接触
C.温度没有达到着火点 D.水的温度太低
15、科学家研究得到一种物质,其分子结构像一只小狗(如图),于是取名叫狗烯,狗烯的化学式为C26H26。下列关于狗烯的说法正确的是( )
A.狗烯中碳元素与氢元素的质量比为:1:1
B.狗烯中碳元素和氢元素的质量分数相等
C.狗烯在氧气中充分燃烧生成二氧化碳和水
D.狗烯由26个碳原子和26个氢原子构成
16、科学研究表明,氨气在常压下就可液化为液氨,液氨可用作汽车的清洁燃料,其燃烧时的主要反应为4NH3+3O22X+6H2O.下列说法中不正确的是( )
A.氨气在常压下液化是物理变化 B.X的化学式为
C.液氨具有可燃性属于化学性质 D.反应前后三种元素化合价都发生变化
二、填空题。
17、用符号或化学式表示:
(1)铝离子_____;
(2)两个铵根离子_____;
(3)钡的氧化物_____;
(4)氖气_____;
(5)氧化铁中铁元素的化合价为+3价_____;
(6)在空气中燃烧产生白烟的非金属单质_____;
(7)高粱玉米和薯类经发酵蒸馏可得到的绿色燃料是_____。
18、下图是同学们构建的关于氧气的部分知识网络,请你由图回答:
(1)写出实验室固液常温型制取氧气的化学方程式___________ ;
(2)Ⅰ、Ⅱ两类有氧气参加的化学反应的相同点是___________(写一条);
(3)从正反两方面举例说明氧气与人类生活的关系:
正面:___________,反面:___________。
19、金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+BA2B.某校一课外小组的甲、乙、丙三个学生分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是8.0g。有关实验数据记录如下。试求丙学生实验中a:b的值可能是多少______?
A的用量 B的用量 A2B的质量
甲 7.0g 1.0g 5.0g
乙 4.0g 4.0g 5.0g
丙 ag bg 3.0g
20、燃烧条件:达到着火点
步骤 现象 结论
取一张A4纸,裁成两半,折成两只同样的纸船。将一只纸船放在铁架台的铁圈上,用酒精灯加热,记录纸船从加热到燃烧需要的时间 纸船立即 。 可燃物燃烧温度需要达到_ __。
向另一只纸船中小心注入约一半的水,放在铁架台的铁圈上,用酒精灯加热,记录纸船从加热到燃烧需要的时间 纸船到水快蒸干时才燃烧
21、写出下列反应的化学方程式。
(1)碳在充足的氧气中燃烧:___________ 。
(2)磷在氧气中燃烧:___________ 。
(3)高锰酸钾加热制取氧气:___________ 。
三、实验题。
22、某化学兴趣小组利用镁条在空气中燃烧的实验验证质量守恒定律。
(1)请写出镁条与氧气反应的化学方程式__________ 。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律。我_________(填“同意”或“不同意”)小明的观点,因为__________
__________ 。
(3)小红按如图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】
①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【作出猜想】黄色固体为Mg3N2。
【实验探究】请设计实验,验证猜想。
实验操作 实验现象 实验结论
取少量黄色固体于试管中,加入少量_________,将湿润红色石蕊试纸放在试管口 _________ 黄色固体为氮化镁
【反思交流】
①若用镁条代替红磷完成测定空气中氧气含量的实验,不考虑其他因素的影响,进入水的体积会_________(填“大于”、“小于”或“等于”)瓶内空气总体积的。
②空气中的氮气的含量远大于氧气的含量,可是镁条在空气中燃烧的产物氧化镁却远多于氮化镁,合理的解释是__________ 。
四、计算类题。
23、化学兴趣小组的同学们要测定某过氧化氢溶液的溶质质量分数。他们称取50.0 g过氧化氢溶液放入盛有2.0 g二氧化锰的烧杯(烧杯质量为76.0 g)中。待完全反应后,称量反应后物质连同烧杯的质量为126.4 g(氧气逸出带出的水分忽略不计)。请计算回答。
(1)反应后产生氧气的质量是 g。
(2)该过氧化氢溶液的溶质质量分数是多少 (写出计算过程)
2023—2024学年鲁教版化学九年级上册第五单元 定量研究化学反应 课后练习题含答案
鲁教版第五单元 定量研究化学反应
一、选择题。
1、某化合物在纯氧气中燃烧,只生成二氧化碳和水,则该化合物中一定含有的元素是( )
A. 碳、氧两种元素 B. 氢、氧两种元素
C. 碳、氢两种元素 D. 碳、氢、氧三种元素
【答案】C
2、推理是学习化学的一种重要方法,但不合理的推理会得出错误的结论。以下推理正确的是( )
A.分子可以构成物质,物质一定是由分子构成的
B.离子是带电荷的微粒,带电荷的微粒一定是离子
C.最外层电子数相同的原子化学性质相似,氦原子和镁原子的化学性质也相似
D.含碳元素的物质充分燃烧会生成CO2,燃烧能生成CO2的物质一定含碳元素
【答案】D
3、通常情祝下,铜和稀硫酸不反应。但是把一小块铜片放入适量稀硫酸中,同时加入X再加热,可以发生如下反应:。下列说法正确的是( )
A.该反应不遵守质量守恒定律 B.反应后溶液会由蓝色变为无色
C.反应后溶液的质量减少 D.反应物X的化学式是
【答案】 D
4、在反应4A+3B=2C中,若2.7g A完全反应生成5.1g的C,已知B的相对分子质量是32,则C的相对分子质量为( )
A.34 B.68 C.102 D.204
【答案】C
5、对比实验是实验探究的重要方法,下列对比实验设计不能实现相应实验目的的是( )
A.区分硬水和软水
B.探究CO2与水反应
C.探究空气是燃烧的必要条件
D.探究二氧化锰的催化作用
【答案】C
6、下图是反映某个化学反应里个物质质量与时间的变化关系,下列对此变化的描述中,正确的是( )
A.充分反应后,乙+丙=甲的质量
B.物质甲的相对分子质量大于乙
C.此化学反应中,不遵守质量守恒定律
D.反应了此化学反应是分解反应
【答案】D
7、图像最能直观表示相关量的变化。足量红磷在密闭容器中燃烧,容器内有关的量随时间变化的图像中不正确的是( )
A. B.
C. D.
【答案】C
8、一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示。下列关于以上反应的说法中,正确的是( )
A.X的值为44
B.W由碳、氢两种元素组成
C.该反应属于置换反应
D.反应中生成二氧化碳和水质量比为13:8
【答案】 B
9、已知2A+3B=C+3D,用足量的A和49g B恰好完全反应,其生成57g C和1g D,若B的相对分子质量为98,则A的相对分子质量为( )
A.16 B.27 C.44 D.56
【答案】B
10、纸火锅的材料是普通的纸张,使用时没有被点燃的原因是( )
A.纸火锅的纸不是可燃物
B.纸火锅里的汤使纸与空气隔绝
C.纸火锅被加热时使纸的着火点升高了
D.纸火锅里的汤汽化吸热,使温度达不到纸的着火点
【答案】D
11、有关质量守恒定律的说法,正确的是( )
A.铁在氧气中燃烧后固体质量增大,遵守质量守恒定律
B.5gA和5gB混合发生化合反应一定能生成10gC
C.化学反应前后,原子数目、分子数目一定不变
D.蜡烛燃烧生成二氧化碳则蜡烛组成中一定含有碳元素和氧元素
【答案】A
12、高纯度的单晶硅是制做电子集成电路的基础材料。工业上制备高纯硅的化学反应原理为:
①SiO2+2CSi +2CO↑、②Si+3HClHSiCl3+H2、③HSiCl3+H2Si+3X,反应①制得粗硅,通过反应②③进一步得到高纯硅;三氯硅烷(HSiCl3)的沸点是31.8℃。下列有关说法不正确的是( )
A.反应③中X的化学式为HCl
B.三氯硅烷由氢、硅、氯三种元素组成
C.三氯硅烷中硅、氯元素的质量比为1∶3
D.反应②③实现了硅元素的富集,将粗硅转化为高纯硅
【答案】 C
13、A、B、C三种物质各15g,它们化合时只能生成30g新物质D.若增加10gA,则反应停止后,原反应物中只余C.根据上述条件推断下列说法中正确的是( )
A.第一次反应停止后,B剩余9g B.第二次反应后,D的质量为50g
C.反应中A和B的质量比是3:2 D.反应中A和C的质量比是5:3
【答案】B
14、向沸水中加入一块白磷,白磷不能燃烧的原因是( )
A.没有点燃 B.未与氧气接触
C.温度没有达到着火点 D.水的温度太低
【答案】B
15、科学家研究得到一种物质,其分子结构像一只小狗(如图),于是取名叫狗烯,狗烯的化学式为C26H26。下列关于狗烯的说法正确的是( )
A.狗烯中碳元素与氢元素的质量比为:1:1
B.狗烯中碳元素和氢元素的质量分数相等
C.狗烯在氧气中充分燃烧生成二氧化碳和水
D.狗烯由26个碳原子和26个氢原子构成
【答案】C
16、科学研究表明,氨气在常压下就可液化为液氨,液氨可用作汽车的清洁燃料,其燃烧时的主要反应为4NH3+3O22X+6H2O.下列说法中不正确的是( )
A.氨气在常压下液化是物理变化 B.X的化学式为
C.液氨具有可燃性属于化学性质 D.反应前后三种元素化合价都发生变化
【答案】 D
二、填空题。
17、用符号或化学式表示:
(1)铝离子_____;
(2)两个铵根离子_____;
(3)钡的氧化物_____;
(4)氖气_____;
(5)氧化铁中铁元素的化合价为+3价_____;
(6)在空气中燃烧产生白烟的非金属单质_____;
(7)高粱玉米和薯类经发酵蒸馏可得到的绿色燃料是_____。
【答案】Al3+; 2NH4+; BaO; Ne; P; C2H5OH。
18、下图是同学们构建的关于氧气的部分知识网络,请你由图回答:
(1)写出实验室固液常温型制取氧气的化学方程式___________ ;
(2)Ⅰ、Ⅱ两类有氧气参加的化学反应的相同点是___________(写一条);
(3)从正反两方面举例说明氧气与人类生活的关系:
正面:___________,反面:___________。
【答案】(1)
(2)都属于氧化反应(或都放热)
(3) 供给呼吸 铁生锈
19、金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+BA2B.某校一课外小组的甲、乙、丙三个学生分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是8.0g。有关实验数据记录如下。试求丙学生实验中a:b的值可能是多少______?
A的用量 B的用量 A2B的质量
甲 7.0g 1.0g 5.0g
乙 4.0g 4.0g 5.0g
丙 ag bg 3.0g
【答案】3:7或37:3。
20、燃烧条件:达到着火点
步骤 现象 结论
取一张A4纸,裁成两半,折成两只同样的纸船。将一只纸船放在铁架台的铁圈上,用酒精灯加热,记录纸船从加热到燃烧需要的时间 纸船立即 。 可燃物燃烧温度需要达到_ __。
向另一只纸船中小心注入约一半的水,放在铁架台的铁圈上,用酒精灯加热,记录纸船从加热到燃烧需要的时间 纸船到水快蒸干时才燃烧
【答案】燃烧 着火点
21、写出下列反应的化学方程式。
(1)碳在充足的氧气中燃烧:___________ 。
(2)磷在氧气中燃烧:___________ 。
(3)高锰酸钾加热制取氧气:___________ 。
【答案】(1)
(2)4P+5O22P2O5
(3)2KMnO4K2MnO4+MnO2+O2↑
三、实验题。
22、某化学兴趣小组利用镁条在空气中燃烧的实验验证质量守恒定律。
(1)请写出镁条与氧气反应的化学方程式__________ 。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律。我_________(填“同意”或“不同意”)小明的观点,因为__________
__________ 。
(3)小红按如图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】
①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【作出猜想】黄色固体为Mg3N2。
【实验探究】请设计实验,验证猜想。
实验操作 实验现象 实验结论
取少量黄色固体于试管中,加入少量_________,将湿润红色石蕊试纸放在试管口 _________ 黄色固体为氮化镁
【反思交流】
①若用镁条代替红磷完成测定空气中氧气含量的实验,不考虑其他因素的影响,进入水的体积会_________(填“大于”、“小于”或“等于”)瓶内空气总体积的。
②空气中的氮气的含量远大于氧气的含量,可是镁条在空气中燃烧的产物氧化镁却远多于氮化镁,合理的解释是__________ 。
【答案】(1)
(2) 不同意 所有的化学变化都遵循质量守恒定律,镁燃烧是镁与空气中氧气发生化合反应生成氧化镁
(3) 蒸馏水 红色的石蕊试纸变蓝 大于
氧气的化学性质比氮气更活泼,镁条更容易与氧气发生反应
四、计算类题。
23、化学兴趣小组的同学们要测定某过氧化氢溶液的溶质质量分数。他们称取50.0 g过氧化氢溶液放入盛有2.0 g二氧化锰的烧杯(烧杯质量为76.0 g)中。待完全反应后,称量反应后物质连同烧杯的质量为126.4 g(氧气逸出带出的水分忽略不计)。请计算回答。
(1)反应后产生氧气的质量是 g。
(2)该过氧化氢溶液的溶质质量分数是多少 (写出计算过程)
【答案】(1)1.6
(2)解:设生成1.6 g氧气需要过氧化氢的质量为x。
2H2O2 2H2+O2↑
68 32
x 1.6 g
= 解得x=3.4 g
该过氧化氢溶液的溶质质量分数为×100%=6.8%
答:该过氧化氢溶液的溶质质量分数为6.8%。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
