2024高考一轮复习 第十章 化学实验基础 实践素养检测(六) 探析化学实验(34张PPT)
文档属性
| 名称 | 2024高考一轮复习 第十章 化学实验基础 实践素养检测(六) 探析化学实验(34张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-11 20:19:45 | ||
图片预览









文档简介
(共34张PPT)
实践素养检测(六) 探析化学实验
Ⅰ.制备催化剂CuCl2
(1)通过查阅资料有两种方案可以制备
方案1:铜屑与H2O2在浓盐酸中反应
方案2:铜丝在氯气中燃烧
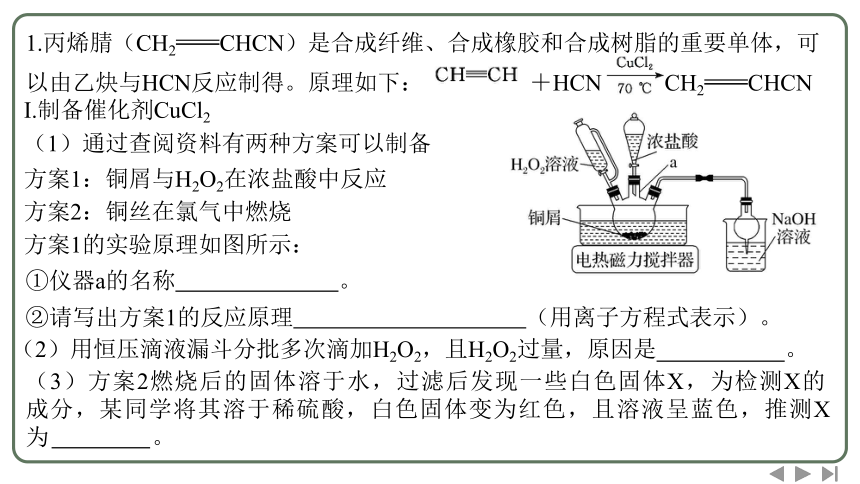
方案1的实验原理如图所示:
①仪器a的名称 。
1.丙烯腈(CH2CHCN)是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与HCN反应制得。原理如下: +HCN CH2CHCN
②请写出方案1的反应原理 (用离子方程式表示)。
(2)用恒压滴液漏斗分批多次滴加H2O2,且H2O2过量,原因是 。
(3)方案2燃烧后的固体溶于水,过滤后发现一些白色固体X,为检测X的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测X为 。
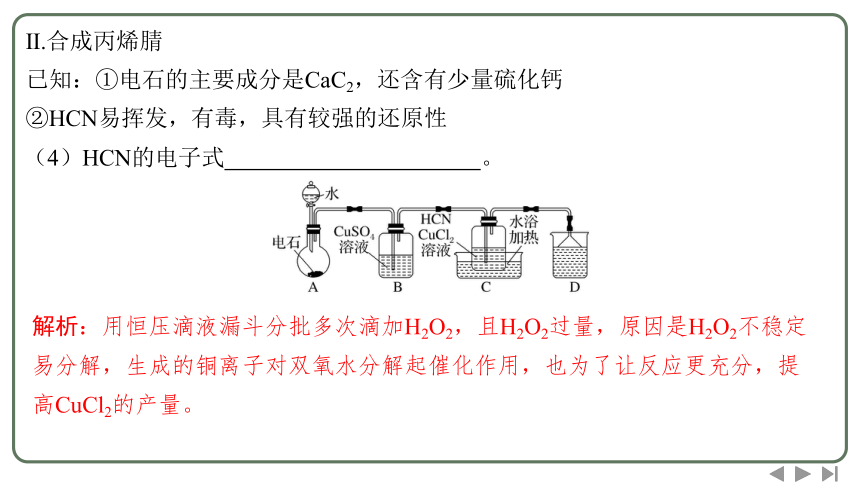
Ⅱ.合成丙烯腈
已知:①电石的主要成分是CaC2,还含有少量硫化钙
②HCN易挥发,有毒,具有较强的还原性
(4)HCN的电子式 。
解析:用恒压滴液漏斗分批多次滴加H2O2,且H2O2过量,原因是H2O2不稳定易分解,生成的铜离子对双氧水分解起催化作用,也为了让反应更充分,提高CuCl2的产量。
(5)纯净的乙炔是无色、无臭的气体。但用电石制取的乙炔时常伴有臭鸡蛋气味,这种物质是 。
解析:方案2燃烧后的固体溶于水,过滤后发现一些白色固体X,为检测X的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,说明该白色物质在酸性条件下反应生成Cu和Cu2+,根据氧化还原反应原理推测X为CuCl。
(6)从下列选择装置D中可盛放的溶液 (填字母)。
A.高锰酸钾溶液 B.NaOH溶液
C.饱和食盐水 D.盐酸溶液
解析:HCN易挥发,装置D主要处理挥发出的HCN气体,HCN有毒,具有较强的还原性,利用高锰酸钾强氧化性与具有强还原性物质HCN发生氧化还原反应,因此装置D中可盛放的溶液为A。
(7)工业用200 kg 含CaC2质量分数80%的电石,生产得到丙烯腈79.5 kg,计算产率 。
解析:工业用200 kg 含CaC2质量分数80%的电石,根据CaC2~CH2CHCN关系式,理论上得到丙烯腈质量为=132.5 kg,实际生产得到丙烯腈79.5 kg,则丙烯腈的产率=×100%=60%。
答案:(1)①三颈烧瓶 ②Cu+H2O2+2H+Cu2++2H2O
(2)H2O2不稳定易分解,让反应更充分,提高CuCl2的产量
(3)CuCl (4)H︰C N︰ (5)H2S气体
(6)A (7)60%
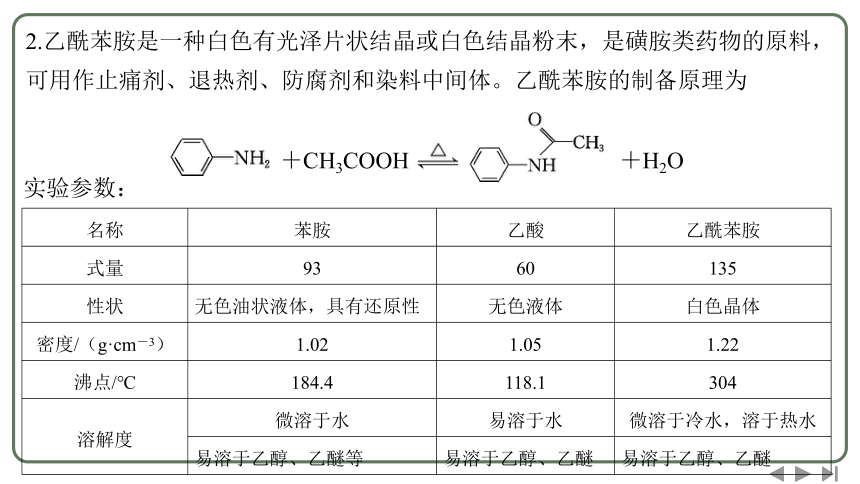
2.乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。乙酰苯胺的制备原理为
+CH3COOH +H2O
实验参数:
名称 苯胺 乙酸 乙酰苯胺
式量 93 60 135
性状 无色油状液体,具有还原性 无色液体 白色晶体
密度/(g·cm-3) 1.02 1.05 1.22
沸点/℃ 184.4 118.1 304
溶解度 微溶于水 易溶于水 微溶于冷水,溶于热水
易溶于乙醇、乙醚等 易溶于乙醇、乙醚 易溶于乙醇、乙醚
实验装置如图:
注:刺形分馏柱的作用相当于二次蒸馏,
用于沸点差别不太大的混合物的分离。
实验步骤:
步骤1:在圆底烧瓶中加入无水苯胺9.30 mL,冰醋酸15.4 mL,锌粉0.100 g, 安装仪器,加入沸石,调节加热温度,使分馏柱顶温度控制在105 ℃左右,反应约60~80 min,反应生成的水及少量醋酸被蒸出。
步骤2:在搅拌下,趁热将烧瓶中物料以细流状倒入盛有100 mL冰水的烧杯中,剧烈搅拌,并冷却结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步骤3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
(1)步骤1中所选圆底烧瓶的最佳规格是 (填字母)。
a.25 mL b.50 mL
c.150 mL d.200 mL
解析:根据圆底烧瓶中盛放液体的体积不超过容积的分析判断最佳规格是50 mL。
答案:b
(2)实验中加入少量锌粉的目的是 。
解析:锌粉具有还原性,实验中加入少量锌粉的目的是防止苯胺在反应过程中被氧化。
答案:防止苯胺在反应过程中被氧化
(3)步骤1加热可用 (填“水浴”“油浴”或“直接加热”)。从化学平衡的角度分析,控制分馏柱上端的温度在105 ℃左右的原因是 。
解析:由于步骤1加热的温度在105 ℃左右,而沸腾的水温度为100 ℃,不能达到该温度,所以步骤1可用油浴加热的方法;水的沸点是100 ℃,加热至105 ℃左右,就可以不断分离出反应过程中生成的水,促进反应正向进行。
答案:油浴 不断分离出反应过程中生成的水,促进反应正向进行,提高生成物的产率
(4)步骤2中结晶时,若冷却后仍无晶体析出,可采用的方法是 。洗涤乙酰苯胺粗品最合适的试剂是 (填字母)。
a.用少量冷水洗
b.用少量热水洗
c.先用冷水洗,再用热水洗
d.用酒精洗
解析:晶体析出时需要晶种,所以可以投入晶种促使晶体析出;由于乙酰苯胺微溶于冷水,溶于热水,所以洗涤粗品最合适的试剂是用少量冷水洗,以减少因洗涤造成的损耗。
答案:用玻璃棒摩擦容器内壁或投入晶种 a
(5)乙酰苯胺粗品因含杂质而显色,欲用重结晶进行提纯,步骤如下:热水溶解、 、过滤、洗涤、干燥(选取正确的操作并排序)。
a.蒸发结晶 b.冷却结晶
c.趁热过滤 d.加入活性炭
解析:可以用活性炭吸附杂质,再根据题干信息知乙酰苯胺溶于热水,所以采用的方法为趁热过滤、冷却结晶。
答案:dcb
(6)该实验最终得到纯品9.18 g,则乙酰苯胺的产率是 %(结果保留一位小数)。
解析:n(苯胺)==0.102 mol,n(乙酸)==0.269 5 mol,二者按物质的量之比1∶1反应,由于乙酸的物质的量大于苯胺的物质的量,所以产生乙酰苯胺的物质的量要以不足量的苯胺为标准,乙酰苯胺的理论产量为0.102 mol,而实际产量n(乙酰苯胺)==0.068 mol,所以乙酰苯胺的产率为×100%≈66.7%。
答案:66.7
3.三氯化硼(BCl3)用于制备光导纤维和有机硼化物等,其制备原理:B2O3+3C+3Cl22BCl3+3CO。某小组据此设计实验制备BCl3并测定其纯度,装置如图。
已知:BCl3的熔点为-107.3 ℃,沸点为12.5 ℃,极易水解产生H3BO3[或B(OH)3]和HCl。
实验(一):制备BCl3。
(1)水浴R选择 (填“热水浴”或“冰水浴”),装碱石灰的仪器是 (填名称)。
解析:BCl3的熔点为-107.3 ℃,沸点为12.5 ℃,应选择冰水浴冷凝三氯化硼,装碱石灰的仪器为(球形)干燥管。
答案:冰水浴 (球形)干燥管
(2)F装置的作用是 。
解析:一氧化碳有毒,会污染环境,装置F用于吸收一氧化碳。
答案:吸收CO
(3)已知:A装置中还原产物为Cr3+,其离子方程式为 。
实验(二):测定BCl3产品的纯度。
①准确称取w g产品,置于蒸馏水中,完全水解,并配成250 mL溶液。
②准确量取25.00 mL溶液于锥形瓶中。
③向其中加入V1 mL c1 mol·L-1 AgNO3溶液至沉淀完全,然后加入3 mL硝基苯(常温常压下,密度为1.205 g·cm-3),振荡。
④向锥形瓶中滴加3滴FeCl3溶液,然后逐滴加入c2 mol·L-1 KSCN标准溶液滴定过量的AgNO3溶液,消耗KSCN溶液的体积为V2 mL。已知:Ksp(AgCl)>Ksp(AgSCN)。
解析:装置A中浓盐酸与K2Cr2O7反应制备氯气,A装置中还原产物为Cr3+,依据得失电子守恒、电荷守恒和原子守恒可知,反应的离子方程式为Cr2+14H++6Cl-2Cr3++3Cl2↑+7H2O。
答案:Cr2+14H++6Cl-2Cr3++3Cl2↑+7H2O
(4)滴定终点时的现象是 。
解析:已知:Ksp(AgCl)>Ksp(AgSCN),因此步骤③加入硝基苯的目的是:覆盖AgCl,避免AgCl转化成AgSCN,使滴定终点不准确;根据滴定原理,当KSCN标准液将过量的硝酸银溶液反应完,就会与氯化铁反应显红色,因此滴定终点时的现象是:当滴入最后半滴KSCN溶液,溶液刚好由无色变为红色且半分钟不褪色。
答案:滴入最后半滴KSCN溶液,溶液刚好由无色变为红色且半分钟不褪色
(5)该产品中BCl3的质量分数为 %;如果其他操作都正确,仅滴定管没有用KSCN溶液润洗,测得产品中BCl3的质量分数 (填“偏高”“偏低”或“无影响”)。
解析:根据离子反应可知:n(Ag+)=n(Cl-)+n(SCN-),25.0 mL溶液中含n(Cl-)=n(Ag+)-n(SCN-)=c1V1×10-3 mol-c2V2×10-3 mol,则w g产品中BCl3的质量分数为w(BCl3)=×100%=%;如果其他操作都正确,仅滴定管没有用KSCN溶液润洗,则KSCN溶液浓度偏低,测得的过量的硝酸银的含量偏高,算得的转化为氯化银的硝酸银的含量偏低,测得产品中BCl3的质量分数偏低。
答案: 偏低
4.过碳酸钠(Na2CO4)是工业上常用的漂白剂和氧化剂。该产品中可能含有纯碱杂质,实验室在常温常压下利用如图所示装置判断样品中是否含有Na2CO3并测定样品中过碳酸钠的纯度。图中仪器c装有碱石灰,Q为弹性良好的气球,称取m g的样品放入其中,按图安装好仪器,打开漏斗的活塞,将稀硫酸滴入气球中。回答下列相关问题:
已知:常温常压下,气体摩尔体积约为24.5 L·mol-1。
(1)仪器a的名称为 。
解析:装置名称a与b是分开的,由仪器构造可知,a是分液漏斗,若a与b合在一起,就是恒压滴液漏斗。
答案:分液漏斗
(2)过碳酸钠易溶解于水,可以与酸反应生成两种气体,写出过碳酸钠与过量的稀硫酸反应的离子方程式: 。
解析:根据过氧根离子,可以与水反应生成氧气,则过碳酸钠与稀硫酸反应生成物为硫酸钠、CO2和O2,根据得失电子守恒、电荷守恒及原子守恒,反应的离子方程式为2C+4H+2CO2↑+O2↑+2H2O。
答案:2C+4H+2CO2↑+O2↑+2H2O
(3)利用装置Ⅱ测出气体的总体积与装置Ⅰ对比,若Ⅱ读数与Ⅰ读数比值约为 ,即可判断样品中无Na2CO3。
解析:由过碳酸钠和硫酸反应的方程式可知,当Ⅱ中测得生成3体积的气体时(2体积CO2和1体积O2),Ⅰ中测得除CO2被碱石灰吸收外还剩1体积O2,若样品中无Na2CO3,则无其他CO2,两者体积比为3∶1。
答案:3
(4)读取装置Ⅰ中量筒的体积为V mL,用含m、V的表达式表示样品中Na2CO4的百分含量为 。
解析:Ⅰ 中气体就是O2,这些O2与过碳酸钠的关系式为2Na2CO4~O2,根据常温常压下,Vm=24.5 L·mol-1,V mL O2的物质的量为= mol,过碳酸钠的物质的量为2× mol,则过碳酸钠的含量为×100%=%。
答案:%
(5)下列实验操作,可能会造成测定结果偏高的操作有 (填字母)。
A.若在导管b加一个止水夹并关闭止水夹
B.反应结束后,量筒液面高于水槽液面
C.反应结束后立即对量筒读数
D.称量样品时,有样品黏在滤纸上
解析:过碳酸钠的含量表达式为%,其中V是Ⅰ中量筒收集的O2体积,m为样品的质量。由表达式可知,测量的气体体积的大小决定纯度的高低;若在导管b加一个止水夹并关闭止水夹,硫酸占有体积,气体体积变大,导致测定结果偏高,A选;
答案:ABC
5.某研究小组为了探究化合物X的组成,设计并完成了如图实验:
②气体A为非金属气体单质,单质D常用来制作信号弹和烟火;
③金属化合物C是仅由两种相邻且同周期的金属元素组成的。
请回答下列问题:
(1)白色胶状沉淀F为 (填化学式),金属化合物C的组成为 (写最简比)。
(2)化合物X的一价阴离子与CH4具有相同的空间结构,写出该阴离子的电子式: 。
(3)③中通入过量CO2的目的是 。
已知:①化合物X由三种短周期元素(均不同主族)组成,且阴、阳离子个数之比为2∶1;
(4)气体A与单质D制备化合物H的过程中,通常产品中会夹杂单质D。有同学设计了如图所示的实验装置,检验m g产品中单质D的含量。
①写出化合物H与冷水反应的化学方程式:
。
②装置中导管a的作用是 。
③设该状态下的气体的摩尔体积为Vm L·mol-1,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产品中单质D的含量为 (用含m、Vm、V1、V2的代数式表示,忽略单质D与冰水的反应)。
解析:根据单质D常用来制作信号弹和烟火,推出单质D为Mg;根据单质B与金属化合物C和过量氢氧化钠反应可得到非金属单质气体A,推出气体A为H2;根据已知①和③,及向溶液E中通入过量二氧化碳有胶状沉淀F[Al(OH)3]生成,推出组成X的另一种元素为铝元素。根据图中已知的量可算出n[Al(OH)3]=0.09 mol,n(Mg)=0.045 mol,推出化合物X中:m(Al)=2.43 g,m(Mg)=1.08 g、m(H)=0.36 g(即0.36 mol氢原子),结合已知①推出化合物X中N(Al)∶N(Mg)∶N(H)=2∶1∶8,化合物X为Mg(AlH4)2。
(3)③中通入过量CO2目的是使溶液中的Al完全转化为Al(OH)3沉淀。
(4)①氢气与镁反应生成氢化镁,氢化镁中氢元素化合价为-1价,与水发生归中反应,其化学方程式为MgH2+2H2OMg(OH)2+2H2↑;②装置中导管a的作用是:保持分液漏斗内气体压强与锥形瓶内气体压强相等,使液体能顺
利流下;③碱式滴定管的0刻度在上方,实验前碱式滴定管中的液面低于实验后碱式滴定管的液面高度,即V1>V2,又因为镁与冷水不反应,则:
MgH2+2H2OMg(OH)2↓+2H2↑
26 g 2 mol
m(MgH2)
解得m(MgH2)= g,
故镁的质量分数为×100%=×100%。
答案:(1)Al(OH)3 Mg3Al2
(2)[H︰︰H]-
(3)使溶液中的Al完全转化为Al(OH)3沉淀
(4)①MgH2+2H2OMg(OH)2+2H2↑
②保持分液漏斗内气体压强与锥形瓶内气体压强相等,使液体能顺利流下
③×100%
6.四氯化锡(SnCl4),常温下为无色液体,易水解。某研究小组利用氯气与硫渣反应制备四氯化锡,其过程如图所示(夹持、加热及控温装置略)。
硫渣的化学组成
物质 Sn Cu2S Pb As Sb 其他杂质
质量分数/% 64.43 25.82 7.34 1.23 0.37 0.81
氯气与硫渣反应相关产物的熔、沸点
物质 性质 SnCl4 CuCl PbCl2 AsCl3 SbCl3 S
熔点/℃ -33 426 501 -18 73 112
沸点/℃ 114 1 490 951 130 221 444
(1)A装置中,盛浓盐酸装置中a管的作用是 ,b瓶中的试剂是 。
解析:由题图可知,装置A用于制备Cl2,饱和食盐水用于除去Cl2中的HCl,B装置为反应装置,在Cl2参与反应前要经过干燥,故饱和食盐水后为装有浓硫酸的洗气瓶,制备产品SnCl4,装置C为蒸馏装置,用于分离提纯产品。
(1)装置A中盛浓盐酸的仪器为恒压滴液漏斗,其中a管主要用于平衡烧瓶和恒压滴液漏斗中的压强,使浓盐酸顺利流入烧瓶中; Cl2在参与反应前要经过干燥,所以b瓶中的试剂为浓硫酸。
答案:平衡气压,使浓盐酸顺利流入烧瓶中 浓硫酸
请回答以下问题:
①生成SnCl4的化学反应方程式为 。
②其中冷凝水的入口是 ,e中试剂使用碱石灰而不用无水氯化钙的原因是 。
(2)氮气保护下,向B装置的三颈瓶中加入适量SnCl4浸没硫渣,通入氯气发生反应。
③实验中所得固体渣经过处理,可回收的主要金属有 和 。
解析:①硫渣中含Sn,与Cl2发生化合反应,即Sn+2Cl2SnCl4;②为了使冷凝回流的效果更明显,冷凝水的流向是下口进上口出,Cl2有毒,为了防止Cl2排到空气中污染环境,故选用碱石灰;③硫渣中含量较多的金属元素为Cu和Pb,所以固体渣经过回收处理可得到金属Cu和Pb。
答案:①Sn+2Cl2SnCl4 ②c 吸收未反应的Cl2,防止污染空气 ③Cu Pb
(3)得到的粗产品经C装置提纯,应控制温度为 ℃。
解析:通过相关物质的物理性质表可知,SnCl4的沸点为114 ℃,所以蒸馏时温度应控制在114 ℃。
答案:114
(4)SnCl4产品中含有少量AsCl3杂质。取10.00 g产品溶于水中,用0.020 00 mol·L-1的KMnO4标准溶液滴定,终点时消耗KMnO4标准溶液6.00 mL。测定过程中发生的相关反应有AsCl3+3H2OH3AsO3+3HCl和5H3AsO3+2KMnO4+6HCl5H3AsO4+2MnCl2+2KCl+3H2O。该滴定实验的指示剂是 ,产品中SnCl4的质量分数为 %(保留小数点后一位)。
解析:滴定时不需要额外添加指示剂,因为KMnO4本身为紫色,故其指示剂为KMnO4。滴定消耗的KMnO4的物质的量为n=c·V=0.02 mol·L-1×6×10-3 L=1.2×10-4 mol,根据反应方程式可知样品中AsCl3的物质的量为×1.2×10-4 mol=3×10-4 mol,质量m=n·M=3×10-4 mol×181.5 g·mol-1=5.445×10-2 g,AsCl3的质量分数为×100%,SnCl4的质量分数为1-×100%≈99.5%。
答案:KMnO4 99.5
感谢您的观看!
实践素养检测(六) 探析化学实验
Ⅰ.制备催化剂CuCl2
(1)通过查阅资料有两种方案可以制备
方案1:铜屑与H2O2在浓盐酸中反应
方案2:铜丝在氯气中燃烧
方案1的实验原理如图所示:
①仪器a的名称 。
1.丙烯腈(CH2CHCN)是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与HCN反应制得。原理如下: +HCN CH2CHCN
②请写出方案1的反应原理 (用离子方程式表示)。
(2)用恒压滴液漏斗分批多次滴加H2O2,且H2O2过量,原因是 。
(3)方案2燃烧后的固体溶于水,过滤后发现一些白色固体X,为检测X的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测X为 。
Ⅱ.合成丙烯腈
已知:①电石的主要成分是CaC2,还含有少量硫化钙
②HCN易挥发,有毒,具有较强的还原性
(4)HCN的电子式 。
解析:用恒压滴液漏斗分批多次滴加H2O2,且H2O2过量,原因是H2O2不稳定易分解,生成的铜离子对双氧水分解起催化作用,也为了让反应更充分,提高CuCl2的产量。
(5)纯净的乙炔是无色、无臭的气体。但用电石制取的乙炔时常伴有臭鸡蛋气味,这种物质是 。
解析:方案2燃烧后的固体溶于水,过滤后发现一些白色固体X,为检测X的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,说明该白色物质在酸性条件下反应生成Cu和Cu2+,根据氧化还原反应原理推测X为CuCl。
(6)从下列选择装置D中可盛放的溶液 (填字母)。
A.高锰酸钾溶液 B.NaOH溶液
C.饱和食盐水 D.盐酸溶液
解析:HCN易挥发,装置D主要处理挥发出的HCN气体,HCN有毒,具有较强的还原性,利用高锰酸钾强氧化性与具有强还原性物质HCN发生氧化还原反应,因此装置D中可盛放的溶液为A。
(7)工业用200 kg 含CaC2质量分数80%的电石,生产得到丙烯腈79.5 kg,计算产率 。
解析:工业用200 kg 含CaC2质量分数80%的电石,根据CaC2~CH2CHCN关系式,理论上得到丙烯腈质量为=132.5 kg,实际生产得到丙烯腈79.5 kg,则丙烯腈的产率=×100%=60%。
答案:(1)①三颈烧瓶 ②Cu+H2O2+2H+Cu2++2H2O
(2)H2O2不稳定易分解,让反应更充分,提高CuCl2的产量
(3)CuCl (4)H︰C N︰ (5)H2S气体
(6)A (7)60%
2.乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。乙酰苯胺的制备原理为
+CH3COOH +H2O
实验参数:
名称 苯胺 乙酸 乙酰苯胺
式量 93 60 135
性状 无色油状液体,具有还原性 无色液体 白色晶体
密度/(g·cm-3) 1.02 1.05 1.22
沸点/℃ 184.4 118.1 304
溶解度 微溶于水 易溶于水 微溶于冷水,溶于热水
易溶于乙醇、乙醚等 易溶于乙醇、乙醚 易溶于乙醇、乙醚
实验装置如图:
注:刺形分馏柱的作用相当于二次蒸馏,
用于沸点差别不太大的混合物的分离。
实验步骤:
步骤1:在圆底烧瓶中加入无水苯胺9.30 mL,冰醋酸15.4 mL,锌粉0.100 g, 安装仪器,加入沸石,调节加热温度,使分馏柱顶温度控制在105 ℃左右,反应约60~80 min,反应生成的水及少量醋酸被蒸出。
步骤2:在搅拌下,趁热将烧瓶中物料以细流状倒入盛有100 mL冰水的烧杯中,剧烈搅拌,并冷却结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步骤3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
(1)步骤1中所选圆底烧瓶的最佳规格是 (填字母)。
a.25 mL b.50 mL
c.150 mL d.200 mL
解析:根据圆底烧瓶中盛放液体的体积不超过容积的分析判断最佳规格是50 mL。
答案:b
(2)实验中加入少量锌粉的目的是 。
解析:锌粉具有还原性,实验中加入少量锌粉的目的是防止苯胺在反应过程中被氧化。
答案:防止苯胺在反应过程中被氧化
(3)步骤1加热可用 (填“水浴”“油浴”或“直接加热”)。从化学平衡的角度分析,控制分馏柱上端的温度在105 ℃左右的原因是 。
解析:由于步骤1加热的温度在105 ℃左右,而沸腾的水温度为100 ℃,不能达到该温度,所以步骤1可用油浴加热的方法;水的沸点是100 ℃,加热至105 ℃左右,就可以不断分离出反应过程中生成的水,促进反应正向进行。
答案:油浴 不断分离出反应过程中生成的水,促进反应正向进行,提高生成物的产率
(4)步骤2中结晶时,若冷却后仍无晶体析出,可采用的方法是 。洗涤乙酰苯胺粗品最合适的试剂是 (填字母)。
a.用少量冷水洗
b.用少量热水洗
c.先用冷水洗,再用热水洗
d.用酒精洗
解析:晶体析出时需要晶种,所以可以投入晶种促使晶体析出;由于乙酰苯胺微溶于冷水,溶于热水,所以洗涤粗品最合适的试剂是用少量冷水洗,以减少因洗涤造成的损耗。
答案:用玻璃棒摩擦容器内壁或投入晶种 a
(5)乙酰苯胺粗品因含杂质而显色,欲用重结晶进行提纯,步骤如下:热水溶解、 、过滤、洗涤、干燥(选取正确的操作并排序)。
a.蒸发结晶 b.冷却结晶
c.趁热过滤 d.加入活性炭
解析:可以用活性炭吸附杂质,再根据题干信息知乙酰苯胺溶于热水,所以采用的方法为趁热过滤、冷却结晶。
答案:dcb
(6)该实验最终得到纯品9.18 g,则乙酰苯胺的产率是 %(结果保留一位小数)。
解析:n(苯胺)==0.102 mol,n(乙酸)==0.269 5 mol,二者按物质的量之比1∶1反应,由于乙酸的物质的量大于苯胺的物质的量,所以产生乙酰苯胺的物质的量要以不足量的苯胺为标准,乙酰苯胺的理论产量为0.102 mol,而实际产量n(乙酰苯胺)==0.068 mol,所以乙酰苯胺的产率为×100%≈66.7%。
答案:66.7
3.三氯化硼(BCl3)用于制备光导纤维和有机硼化物等,其制备原理:B2O3+3C+3Cl22BCl3+3CO。某小组据此设计实验制备BCl3并测定其纯度,装置如图。
已知:BCl3的熔点为-107.3 ℃,沸点为12.5 ℃,极易水解产生H3BO3[或B(OH)3]和HCl。
实验(一):制备BCl3。
(1)水浴R选择 (填“热水浴”或“冰水浴”),装碱石灰的仪器是 (填名称)。
解析:BCl3的熔点为-107.3 ℃,沸点为12.5 ℃,应选择冰水浴冷凝三氯化硼,装碱石灰的仪器为(球形)干燥管。
答案:冰水浴 (球形)干燥管
(2)F装置的作用是 。
解析:一氧化碳有毒,会污染环境,装置F用于吸收一氧化碳。
答案:吸收CO
(3)已知:A装置中还原产物为Cr3+,其离子方程式为 。
实验(二):测定BCl3产品的纯度。
①准确称取w g产品,置于蒸馏水中,完全水解,并配成250 mL溶液。
②准确量取25.00 mL溶液于锥形瓶中。
③向其中加入V1 mL c1 mol·L-1 AgNO3溶液至沉淀完全,然后加入3 mL硝基苯(常温常压下,密度为1.205 g·cm-3),振荡。
④向锥形瓶中滴加3滴FeCl3溶液,然后逐滴加入c2 mol·L-1 KSCN标准溶液滴定过量的AgNO3溶液,消耗KSCN溶液的体积为V2 mL。已知:Ksp(AgCl)>Ksp(AgSCN)。
解析:装置A中浓盐酸与K2Cr2O7反应制备氯气,A装置中还原产物为Cr3+,依据得失电子守恒、电荷守恒和原子守恒可知,反应的离子方程式为Cr2+14H++6Cl-2Cr3++3Cl2↑+7H2O。
答案:Cr2+14H++6Cl-2Cr3++3Cl2↑+7H2O
(4)滴定终点时的现象是 。
解析:已知:Ksp(AgCl)>Ksp(AgSCN),因此步骤③加入硝基苯的目的是:覆盖AgCl,避免AgCl转化成AgSCN,使滴定终点不准确;根据滴定原理,当KSCN标准液将过量的硝酸银溶液反应完,就会与氯化铁反应显红色,因此滴定终点时的现象是:当滴入最后半滴KSCN溶液,溶液刚好由无色变为红色且半分钟不褪色。
答案:滴入最后半滴KSCN溶液,溶液刚好由无色变为红色且半分钟不褪色
(5)该产品中BCl3的质量分数为 %;如果其他操作都正确,仅滴定管没有用KSCN溶液润洗,测得产品中BCl3的质量分数 (填“偏高”“偏低”或“无影响”)。
解析:根据离子反应可知:n(Ag+)=n(Cl-)+n(SCN-),25.0 mL溶液中含n(Cl-)=n(Ag+)-n(SCN-)=c1V1×10-3 mol-c2V2×10-3 mol,则w g产品中BCl3的质量分数为w(BCl3)=×100%=%;如果其他操作都正确,仅滴定管没有用KSCN溶液润洗,则KSCN溶液浓度偏低,测得的过量的硝酸银的含量偏高,算得的转化为氯化银的硝酸银的含量偏低,测得产品中BCl3的质量分数偏低。
答案: 偏低
4.过碳酸钠(Na2CO4)是工业上常用的漂白剂和氧化剂。该产品中可能含有纯碱杂质,实验室在常温常压下利用如图所示装置判断样品中是否含有Na2CO3并测定样品中过碳酸钠的纯度。图中仪器c装有碱石灰,Q为弹性良好的气球,称取m g的样品放入其中,按图安装好仪器,打开漏斗的活塞,将稀硫酸滴入气球中。回答下列相关问题:
已知:常温常压下,气体摩尔体积约为24.5 L·mol-1。
(1)仪器a的名称为 。
解析:装置名称a与b是分开的,由仪器构造可知,a是分液漏斗,若a与b合在一起,就是恒压滴液漏斗。
答案:分液漏斗
(2)过碳酸钠易溶解于水,可以与酸反应生成两种气体,写出过碳酸钠与过量的稀硫酸反应的离子方程式: 。
解析:根据过氧根离子,可以与水反应生成氧气,则过碳酸钠与稀硫酸反应生成物为硫酸钠、CO2和O2,根据得失电子守恒、电荷守恒及原子守恒,反应的离子方程式为2C+4H+2CO2↑+O2↑+2H2O。
答案:2C+4H+2CO2↑+O2↑+2H2O
(3)利用装置Ⅱ测出气体的总体积与装置Ⅰ对比,若Ⅱ读数与Ⅰ读数比值约为 ,即可判断样品中无Na2CO3。
解析:由过碳酸钠和硫酸反应的方程式可知,当Ⅱ中测得生成3体积的气体时(2体积CO2和1体积O2),Ⅰ中测得除CO2被碱石灰吸收外还剩1体积O2,若样品中无Na2CO3,则无其他CO2,两者体积比为3∶1。
答案:3
(4)读取装置Ⅰ中量筒的体积为V mL,用含m、V的表达式表示样品中Na2CO4的百分含量为 。
解析:Ⅰ 中气体就是O2,这些O2与过碳酸钠的关系式为2Na2CO4~O2,根据常温常压下,Vm=24.5 L·mol-1,V mL O2的物质的量为= mol,过碳酸钠的物质的量为2× mol,则过碳酸钠的含量为×100%=%。
答案:%
(5)下列实验操作,可能会造成测定结果偏高的操作有 (填字母)。
A.若在导管b加一个止水夹并关闭止水夹
B.反应结束后,量筒液面高于水槽液面
C.反应结束后立即对量筒读数
D.称量样品时,有样品黏在滤纸上
解析:过碳酸钠的含量表达式为%,其中V是Ⅰ中量筒收集的O2体积,m为样品的质量。由表达式可知,测量的气体体积的大小决定纯度的高低;若在导管b加一个止水夹并关闭止水夹,硫酸占有体积,气体体积变大,导致测定结果偏高,A选;
答案:ABC
5.某研究小组为了探究化合物X的组成,设计并完成了如图实验:
②气体A为非金属气体单质,单质D常用来制作信号弹和烟火;
③金属化合物C是仅由两种相邻且同周期的金属元素组成的。
请回答下列问题:
(1)白色胶状沉淀F为 (填化学式),金属化合物C的组成为 (写最简比)。
(2)化合物X的一价阴离子与CH4具有相同的空间结构,写出该阴离子的电子式: 。
(3)③中通入过量CO2的目的是 。
已知:①化合物X由三种短周期元素(均不同主族)组成,且阴、阳离子个数之比为2∶1;
(4)气体A与单质D制备化合物H的过程中,通常产品中会夹杂单质D。有同学设计了如图所示的实验装置,检验m g产品中单质D的含量。
①写出化合物H与冷水反应的化学方程式:
。
②装置中导管a的作用是 。
③设该状态下的气体的摩尔体积为Vm L·mol-1,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产品中单质D的含量为 (用含m、Vm、V1、V2的代数式表示,忽略单质D与冰水的反应)。
解析:根据单质D常用来制作信号弹和烟火,推出单质D为Mg;根据单质B与金属化合物C和过量氢氧化钠反应可得到非金属单质气体A,推出气体A为H2;根据已知①和③,及向溶液E中通入过量二氧化碳有胶状沉淀F[Al(OH)3]生成,推出组成X的另一种元素为铝元素。根据图中已知的量可算出n[Al(OH)3]=0.09 mol,n(Mg)=0.045 mol,推出化合物X中:m(Al)=2.43 g,m(Mg)=1.08 g、m(H)=0.36 g(即0.36 mol氢原子),结合已知①推出化合物X中N(Al)∶N(Mg)∶N(H)=2∶1∶8,化合物X为Mg(AlH4)2。
(3)③中通入过量CO2目的是使溶液中的Al完全转化为Al(OH)3沉淀。
(4)①氢气与镁反应生成氢化镁,氢化镁中氢元素化合价为-1价,与水发生归中反应,其化学方程式为MgH2+2H2OMg(OH)2+2H2↑;②装置中导管a的作用是:保持分液漏斗内气体压强与锥形瓶内气体压强相等,使液体能顺
利流下;③碱式滴定管的0刻度在上方,实验前碱式滴定管中的液面低于实验后碱式滴定管的液面高度,即V1>V2,又因为镁与冷水不反应,则:
MgH2+2H2OMg(OH)2↓+2H2↑
26 g 2 mol
m(MgH2)
解得m(MgH2)= g,
故镁的质量分数为×100%=×100%。
答案:(1)Al(OH)3 Mg3Al2
(2)[H︰︰H]-
(3)使溶液中的Al完全转化为Al(OH)3沉淀
(4)①MgH2+2H2OMg(OH)2+2H2↑
②保持分液漏斗内气体压强与锥形瓶内气体压强相等,使液体能顺利流下
③×100%
6.四氯化锡(SnCl4),常温下为无色液体,易水解。某研究小组利用氯气与硫渣反应制备四氯化锡,其过程如图所示(夹持、加热及控温装置略)。
硫渣的化学组成
物质 Sn Cu2S Pb As Sb 其他杂质
质量分数/% 64.43 25.82 7.34 1.23 0.37 0.81
氯气与硫渣反应相关产物的熔、沸点
物质 性质 SnCl4 CuCl PbCl2 AsCl3 SbCl3 S
熔点/℃ -33 426 501 -18 73 112
沸点/℃ 114 1 490 951 130 221 444
(1)A装置中,盛浓盐酸装置中a管的作用是 ,b瓶中的试剂是 。
解析:由题图可知,装置A用于制备Cl2,饱和食盐水用于除去Cl2中的HCl,B装置为反应装置,在Cl2参与反应前要经过干燥,故饱和食盐水后为装有浓硫酸的洗气瓶,制备产品SnCl4,装置C为蒸馏装置,用于分离提纯产品。
(1)装置A中盛浓盐酸的仪器为恒压滴液漏斗,其中a管主要用于平衡烧瓶和恒压滴液漏斗中的压强,使浓盐酸顺利流入烧瓶中; Cl2在参与反应前要经过干燥,所以b瓶中的试剂为浓硫酸。
答案:平衡气压,使浓盐酸顺利流入烧瓶中 浓硫酸
请回答以下问题:
①生成SnCl4的化学反应方程式为 。
②其中冷凝水的入口是 ,e中试剂使用碱石灰而不用无水氯化钙的原因是 。
(2)氮气保护下,向B装置的三颈瓶中加入适量SnCl4浸没硫渣,通入氯气发生反应。
③实验中所得固体渣经过处理,可回收的主要金属有 和 。
解析:①硫渣中含Sn,与Cl2发生化合反应,即Sn+2Cl2SnCl4;②为了使冷凝回流的效果更明显,冷凝水的流向是下口进上口出,Cl2有毒,为了防止Cl2排到空气中污染环境,故选用碱石灰;③硫渣中含量较多的金属元素为Cu和Pb,所以固体渣经过回收处理可得到金属Cu和Pb。
答案:①Sn+2Cl2SnCl4 ②c 吸收未反应的Cl2,防止污染空气 ③Cu Pb
(3)得到的粗产品经C装置提纯,应控制温度为 ℃。
解析:通过相关物质的物理性质表可知,SnCl4的沸点为114 ℃,所以蒸馏时温度应控制在114 ℃。
答案:114
(4)SnCl4产品中含有少量AsCl3杂质。取10.00 g产品溶于水中,用0.020 00 mol·L-1的KMnO4标准溶液滴定,终点时消耗KMnO4标准溶液6.00 mL。测定过程中发生的相关反应有AsCl3+3H2OH3AsO3+3HCl和5H3AsO3+2KMnO4+6HCl5H3AsO4+2MnCl2+2KCl+3H2O。该滴定实验的指示剂是 ,产品中SnCl4的质量分数为 %(保留小数点后一位)。
解析:滴定时不需要额外添加指示剂,因为KMnO4本身为紫色,故其指示剂为KMnO4。滴定消耗的KMnO4的物质的量为n=c·V=0.02 mol·L-1×6×10-3 L=1.2×10-4 mol,根据反应方程式可知样品中AsCl3的物质的量为×1.2×10-4 mol=3×10-4 mol,质量m=n·M=3×10-4 mol×181.5 g·mol-1=5.445×10-2 g,AsCl3的质量分数为×100%,SnCl4的质量分数为1-×100%≈99.5%。
答案:KMnO4 99.5
感谢您的观看!
同课章节目录
