【核心素养目标】人教版(2019)高二化学选择性必修1 2.2 化学平衡(第2课时 化学平衡常数)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高二化学选择性必修1 2.2 化学平衡(第2课时 化学平衡常数) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-13 08:52:41 | ||
图片预览








文档简介
(共21张PPT)
第二节 化学平衡
第2课时 化学平衡常数
人教版选择性必修1
学习目标
1.知道化学平衡常数的含义,会根据化学反应书写化学平衡常数表达式。
2.能够利用化学平衡常数进行简单的计算。
3.了解浓度商和化学平衡常数的相对大小与反应方向间的联系。
学习目标
1.认识温度是决定化学平衡常数的唯一物理量,培养学生“变化观念与平衡思想”学科素养。
2.通过浓度商和化学平衡常数的相对大小判断化学平衡移动的方向,培养学生“证据推理与模型谁知”的学科素养。
素养目标
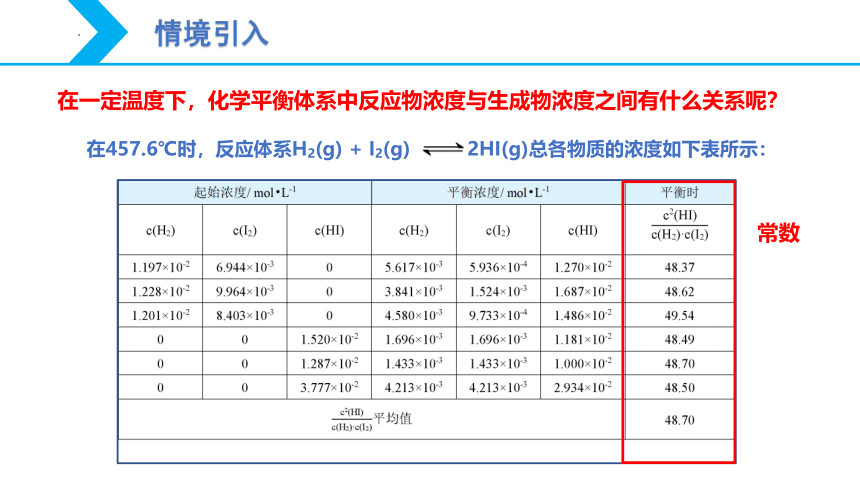
情境引入
在一定温度下,化学平衡体系中反应物浓度与生成物浓度之间有什么关系呢?
在457.6℃时,反应体系H2(g) + I2(g) 2HI(g)总各物质的浓度如下表所示:
常数
一、化学平衡常数
教学过程
K =
cp(C) cq(D)
cm(A) cn(B)
对于一般的可逆反应:m A(g) + n B(g) p C(g) + q D(g)
在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,该常数就是该反应的化学平衡常数(简称平衡常数),用符号K 表示。
1.概念:
2.表达式:
表达式中的各物质的浓度必须为平衡浓度
教学过程
3.意义:
K 越大,正反应进行的程度越大,即该反应进行的越完全,平衡时反应物的转化率越大;反之,K 越小,该反应进行程得越不完全,平衡时反应物的转化率越小。
(一般来说,当K>105时,该反应就进行得基本完全了。)
教学过程
4.注意:
(1)反应物或生成物中有固体或纯液体存在时,由于其浓度可看作“1”而不代入公式。
(注意:非水溶液中发生的反应,若有水参加或生成,则此时水的浓度不可视为常数,应写进平衡常数的表达式中)
(2)化学平衡常数是指某一具体反应的平衡常数,由于化学方程式的书写不同,平衡常数的表达式不同。
课堂练习
K=
c4 (H2O)
c4 (H2)
例1:写出下列反应的化学平衡常数表达式
例2:写出下列反应的化学平衡常数表达式,找出它们之间的联系。
课堂练习
c2(NH3)
K1=
c(N2) c3(H2)
c2(NH3)
K2=
c(N2) c3(H2)
c(NH3)
K3=
c1/2(N2) c3/2(H2)
教学过程
总结:平衡常数与方程式的关系
1.对于同一可逆反应,正反应和逆反应的平衡常数互为倒数;
2.若化学方程式中各物质的化学计量数都扩大或缩小至原来的n倍,则化学平衡常数变为原来的 n 次幂或 1/n 次幂。
3.若干方程式相加,则总反应的平衡常数等于分步平衡常数之乘积;若干方程式相减,则总反应的平衡常数等于分步平衡常数之商。
教学过程
5.影响化学平衡常数的因素
化学平衡常数是表明化学反应限度的一个特征值,通常情况下只受温度影响,与反应物或生成物的浓度无关。
升高温度 K 值增大 正反应为吸热反应
K 值减小 正反应为放热反应
降低温度 K 值增大 正反应为放热反应
K 值减小 正反应为吸热反应
已知方程式A(g) C(g) K1 和 B(g) D(g) K2 用K1、K2表示下列反应的平衡常数。
(1)C(g) A(g) K3 = __________
(2)2B(g) 2D(g) K4 = __________
(3)A(g) + B(g) C(g) + D(g) K5 = __________
(4)2A(g) + D(g) B(g) + 2C(g) K6 = __________
课堂练习
例3:
1/ K1
K22
K1·
K12/K2
二、浓度熵
教学过程
1.概念
在任意时刻,生成物浓度幂之积与反应物浓度幂之积的比值,称为浓度商,常用Q 表示。
2.表达式
对于可逆反应mA(g) + nB(g) pC(g) + qD(g) 浓度商 Q=____________
教学过程
3.利用浓度商、化学平衡常数判断反应方向
Q<K,反应向正反应方向进行;
Q=K,反应处于平衡状态;
Q>K,反应向逆反应方向进行。
对于反应C(s)+H2O(g) CO(g)+H2(g) ΔH>0,下列有关说法正确的是( )
A.平衡常数表达式为
B.增大体系压强,平衡常数K不发生变化
C.升高体系温度,平衡常数K减小
D.增加C(s)的量,平衡正向移动
典例1.
课堂练习
【答案】B
【解析】固态物质浓度为“常数”,视为“1”,不需写入平衡常数表达式,A项错误;K只与温度有关,因此增大体系压强,平衡常数K不发生变化,B项正确;升温该反应正向进行,K增大,C项错误;增加C(s)的量,平衡不移动,D项错误。
已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g),在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数
B.反应③的平衡常数
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
典例2.
课堂练习
【答案】B
【解析】在书写平衡常数表达式时,纯固体不写,A错误;由于反应③=反应①-反应②,因此平衡常数K=K1/k2,B正确;反应③中,温度升高,H2浓度减小,则平衡左移,即逆反应为吸热反应,正反应为放热反应,因此ΔH<0,C错误;对于反应③,在恒温恒容下,增大压强,如充入惰性气体,则平衡不移动,H2的浓度不变,D错误。
典例3.
课堂练习
可逆反应:2SO2+O2 2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2。下列说法正确的是(K 为平衡常数,Q 为浓度商)( )
A.Q不变,K变大,O2转化率增大
B.Q不变,K变大,SO2转化率减小
C.Q变小,K不变,O2转化率减小
D.Q增大,K不变,SO2转化率增大
【答案】C
【解析】当可逆反应2SO2+O2 SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2,平衡向右进行,但O2转化率减小,浓度商Q变小,K不变。
二、化学平衡常数有关计算
教学过程
在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L.
(1)计算该反应的平衡常数
(2)在上述温度下,该容器中若通入H2和I2蒸汽各0.20mol,试求达到化学平衡状态时各物质的浓度.。
典例4.
教学过程
典例5.
课堂练习
将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容器中,加热到800 ℃ ,充分反应达到平衡后,测得CO的浓度为0.005 mol·L-1 。求该反应的平衡常数及平衡时CO的转化率。
课堂小结
化学平衡常数
化学平衡常数
化学平衡常数的应用
概念
判断可逆反应是否达到平衡
表达式
比较可逆反应限度
意义
影响因素
判断可逆反应热效应
用于计算平衡浓度、物质的量分数、转化率等
感 谢 倾 听
第二节 化学平衡
第2课时 化学平衡常数
人教版选择性必修1
学习目标
1.知道化学平衡常数的含义,会根据化学反应书写化学平衡常数表达式。
2.能够利用化学平衡常数进行简单的计算。
3.了解浓度商和化学平衡常数的相对大小与反应方向间的联系。
学习目标
1.认识温度是决定化学平衡常数的唯一物理量,培养学生“变化观念与平衡思想”学科素养。
2.通过浓度商和化学平衡常数的相对大小判断化学平衡移动的方向,培养学生“证据推理与模型谁知”的学科素养。
素养目标
情境引入
在一定温度下,化学平衡体系中反应物浓度与生成物浓度之间有什么关系呢?
在457.6℃时,反应体系H2(g) + I2(g) 2HI(g)总各物质的浓度如下表所示:
常数
一、化学平衡常数
教学过程
K =
cp(C) cq(D)
cm(A) cn(B)
对于一般的可逆反应:m A(g) + n B(g) p C(g) + q D(g)
在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,该常数就是该反应的化学平衡常数(简称平衡常数),用符号K 表示。
1.概念:
2.表达式:
表达式中的各物质的浓度必须为平衡浓度
教学过程
3.意义:
K 越大,正反应进行的程度越大,即该反应进行的越完全,平衡时反应物的转化率越大;反之,K 越小,该反应进行程得越不完全,平衡时反应物的转化率越小。
(一般来说,当K>105时,该反应就进行得基本完全了。)
教学过程
4.注意:
(1)反应物或生成物中有固体或纯液体存在时,由于其浓度可看作“1”而不代入公式。
(注意:非水溶液中发生的反应,若有水参加或生成,则此时水的浓度不可视为常数,应写进平衡常数的表达式中)
(2)化学平衡常数是指某一具体反应的平衡常数,由于化学方程式的书写不同,平衡常数的表达式不同。
课堂练习
K=
c4 (H2O)
c4 (H2)
例1:写出下列反应的化学平衡常数表达式
例2:写出下列反应的化学平衡常数表达式,找出它们之间的联系。
课堂练习
c2(NH3)
K1=
c(N2) c3(H2)
c2(NH3)
K2=
c(N2) c3(H2)
c(NH3)
K3=
c1/2(N2) c3/2(H2)
教学过程
总结:平衡常数与方程式的关系
1.对于同一可逆反应,正反应和逆反应的平衡常数互为倒数;
2.若化学方程式中各物质的化学计量数都扩大或缩小至原来的n倍,则化学平衡常数变为原来的 n 次幂或 1/n 次幂。
3.若干方程式相加,则总反应的平衡常数等于分步平衡常数之乘积;若干方程式相减,则总反应的平衡常数等于分步平衡常数之商。
教学过程
5.影响化学平衡常数的因素
化学平衡常数是表明化学反应限度的一个特征值,通常情况下只受温度影响,与反应物或生成物的浓度无关。
升高温度 K 值增大 正反应为吸热反应
K 值减小 正反应为放热反应
降低温度 K 值增大 正反应为放热反应
K 值减小 正反应为吸热反应
已知方程式A(g) C(g) K1 和 B(g) D(g) K2 用K1、K2表示下列反应的平衡常数。
(1)C(g) A(g) K3 = __________
(2)2B(g) 2D(g) K4 = __________
(3)A(g) + B(g) C(g) + D(g) K5 = __________
(4)2A(g) + D(g) B(g) + 2C(g) K6 = __________
课堂练习
例3:
1/ K1
K22
K1·
K12/K2
二、浓度熵
教学过程
1.概念
在任意时刻,生成物浓度幂之积与反应物浓度幂之积的比值,称为浓度商,常用Q 表示。
2.表达式
对于可逆反应mA(g) + nB(g) pC(g) + qD(g) 浓度商 Q=____________
教学过程
3.利用浓度商、化学平衡常数判断反应方向
Q<K,反应向正反应方向进行;
Q=K,反应处于平衡状态;
Q>K,反应向逆反应方向进行。
对于反应C(s)+H2O(g) CO(g)+H2(g) ΔH>0,下列有关说法正确的是( )
A.平衡常数表达式为
B.增大体系压强,平衡常数K不发生变化
C.升高体系温度,平衡常数K减小
D.增加C(s)的量,平衡正向移动
典例1.
课堂练习
【答案】B
【解析】固态物质浓度为“常数”,视为“1”,不需写入平衡常数表达式,A项错误;K只与温度有关,因此增大体系压强,平衡常数K不发生变化,B项正确;升温该反应正向进行,K增大,C项错误;增加C(s)的量,平衡不移动,D项错误。
已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g),在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数
B.反应③的平衡常数
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
典例2.
课堂练习
【答案】B
【解析】在书写平衡常数表达式时,纯固体不写,A错误;由于反应③=反应①-反应②,因此平衡常数K=K1/k2,B正确;反应③中,温度升高,H2浓度减小,则平衡左移,即逆反应为吸热反应,正反应为放热反应,因此ΔH<0,C错误;对于反应③,在恒温恒容下,增大压强,如充入惰性气体,则平衡不移动,H2的浓度不变,D错误。
典例3.
课堂练习
可逆反应:2SO2+O2 2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2。下列说法正确的是(K 为平衡常数,Q 为浓度商)( )
A.Q不变,K变大,O2转化率增大
B.Q不变,K变大,SO2转化率减小
C.Q变小,K不变,O2转化率减小
D.Q增大,K不变,SO2转化率增大
【答案】C
【解析】当可逆反应2SO2+O2 SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2,平衡向右进行,但O2转化率减小,浓度商Q变小,K不变。
二、化学平衡常数有关计算
教学过程
在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L.
(1)计算该反应的平衡常数
(2)在上述温度下,该容器中若通入H2和I2蒸汽各0.20mol,试求达到化学平衡状态时各物质的浓度.。
典例4.
教学过程
典例5.
课堂练习
将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容器中,加热到800 ℃ ,充分反应达到平衡后,测得CO的浓度为0.005 mol·L-1 。求该反应的平衡常数及平衡时CO的转化率。
课堂小结
化学平衡常数
化学平衡常数
化学平衡常数的应用
概念
判断可逆反应是否达到平衡
表达式
比较可逆反应限度
意义
影响因素
判断可逆反应热效应
用于计算平衡浓度、物质的量分数、转化率等
感 谢 倾 听
