江西省抚州市黎川县2023-2024学年高二上学期开学考试化学试题(含答案)
文档属性
| 名称 | 江西省抚州市黎川县2023-2024学年高二上学期开学考试化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 975.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 00:00:00 | ||
图片预览




文档简介
黎川县2023-2024学年高二上学期开学考试
化学
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在本试卷和答题卡的相应位置上:
2.作答时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将答题卡交回。
一.单选题(每小题3分,共42分)
1.“碳中和”是指确定时间内排放的碳总量与吸取的碳总量相互抵消,实现二氧化碳相对“零排放”。下列措施对推进碳中和最有效的是
A.用汽油代替柴油 B.使用无磷洗衣粉
C.用二氧化碳合成淀粉 D.推行生活垃圾分类
2.下列反应属于取代反应的是
A.煤的液化 B.甲烷在空气中燃烧
C.异戊二烯反应生成聚异戊二烯 D.乙烷在光照条件下与氯气反应
3.下列有关化学用语的表述正确的是
A.乙烯的结构简式: B.乙醇的分子式:
C.的电子式: D.乙酸的分子结构模型:
4.NA是阿伏加德罗常数的值,下列说法正确的是
A.25℃,101 kPa时,22.4 L 中含有的原子数小于
B.32 g甲醇分子中含有C-H键的数目为
C.1 L 1 mol L盐酸中,HCl分子的数目为
D.密闭容器中,2 mol 和1 mol 催化反应后分子总数为
5.在下列溶液中,各离子能够大量共存的是
A.、、、 B.、、、
C.、、、 D.、、、
6.下列可以减慢化学反应速率的措施是
A.升高温度 B.降低温度
C.增大反应物浓度 D.增大固体反应物的接触面积
7.锂海水电池常用在海上浮标等助航设备中,其原理如图所示。
电池反应为。电池工作时,下列说法正确的是
A.如果将海水换成乙醇该装置仍可以构成个原电池该装置
B.电子从锂电极经导线流向镍电极
C.金属锂作负极,发生还原反应
D.理论上每转移电子可以生成
8.四个不同的密闭容器中,采用不同条件进行反应,根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
A. B.
C. D.
9.生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式为。工业由苯和乙烯为原料制备聚苯乙烯,根据所学乙烯知识,可以判断下列说法正确的是
A.聚苯乙烯能使溴的四氯化碳溶液褪色 B.聚苯乙烯是一种天然高分子
C.聚苯乙烯可由苯乙烯通过化合反应制得 D.聚苯乙烯单体的分子式为C8H8
10.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝,下列说法中错误的是
A.①②中除加试剂外,还需要进行过滤操作 B.a、b中铝元素的化合价不相同
C.③中需要通入过量的 D.④进行的操作是加热,而且d一定是氧化铝
11.实验室模拟工业海带提砷的流程如图。下列说法错误的是
A.“灼烧”用到的硅酸盐仪器有坩埚、泥三角、玻璃棒、酒精灯
B.“氧化”时发生反应的离子方程式为
C.“反萃取”所得有机层经处理后可循环再利用
D.“沉淀”时每生成碘,理论上转移电子
12.下列实验现象和结论都正确的是
选项 实验操作 现象 结论
A 向久置于空气中的Na2SO3溶液中加入BaCl2溶液 有白色沉淀生成 Na2SO3溶液变质了
B 向某溶液中滴加KSCN溶液 溶液显红色 原溶液中有Fe3+
C 将稀盐酸滴入碳酸钠溶液中产生的气体直接通入硅酸钠溶液 有白色沉淀生成 证明非金属性Cl>C>Si
D 向硝酸钡溶液中通入二氧化硫 有白色沉淀 该沉淀是亚硫酸钡
A.A B.B C.C D.D
13.“海泥电池”既可用于深海水下仪器的电源补给,又有利于海洋环境污染治理。电池工作原理如图所示,其中微生物代谢产物显酸性。
下列说法错误的是
A.B电极为负极
B.从海底沉积层通过交接面向海水层移动
C.微生物作用下发生反应:
D.除去,A电极消耗标准状况下
14.某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向第一份中逐渐加入铜粉,最多能溶解9.6g。向第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是
A.向第一份溶液中加入可以溶解更多的铜粉
B.段产生的气体是NO,BC段产生的气体是
C.段发生的反应为:
D.原混合酸中浓度为
二、填空题(共58分)
15.海藻中食含碘元素。某小组同学在实验室里用灼烧海藻的灰分提取碘,流程如下图所示:
(1)操作①的名称 ,操作③的名称 。实验室进行操作①使用的仪器有铁架台(带铁圈)、漏斗和 。
(2)操作②选用CCl4的理由是_____(填写序号)。
A.CCl4不溶于水 B.CCl4的密度比水大
C.碘在CCl4中比在水中溶解度更大 D.CCl4与碘水不反应
(3)用NaOH溶液反萃取后再加稀硫酸,可以分离I2和CCl4。有关化学方程式为:
碱性条件:;
酸性条件:。
以下是反萃取过程的操作,请填写相关空格:
①向装有I2的CCl4溶液的 (填仪器名称)中加入少量1mol/LNaOH溶液;
②振荡至溶液的 色消失,静置,分层,则 (填“上”。“下”)层为CCl4;
③将含碘的碱溶液从仪器的 (填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴1mol L-1H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体。
(4)本实验中可以循环利用的物质是 。
16.铁泥(主要成分为含少量、Fe及杂质;杂质与酸不反应,且难溶于水)是一种常见的工业废料,为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产铁红或七水合硫酸亚铁。
(1)过程Ⅰ中
①分离出杂质的操作是 。
②与硫酸反应的离子方程式为 。
(2)制备铁红
①过程Ⅱ加入的目的是 。
②过程Ⅲ中,加入氨水后,可观察到的现象为 。
③过程Ⅳ得到铁红的化学方程式为 。
(3)制备
①过程Ⅴ中,用离子方程式说明加入铁屑的主要目的是 。
②过程Ⅰ中加入硫酸至固体不再溶解,则经过程Ⅴ反应后所得溶液中的物质的量最多为 mol。
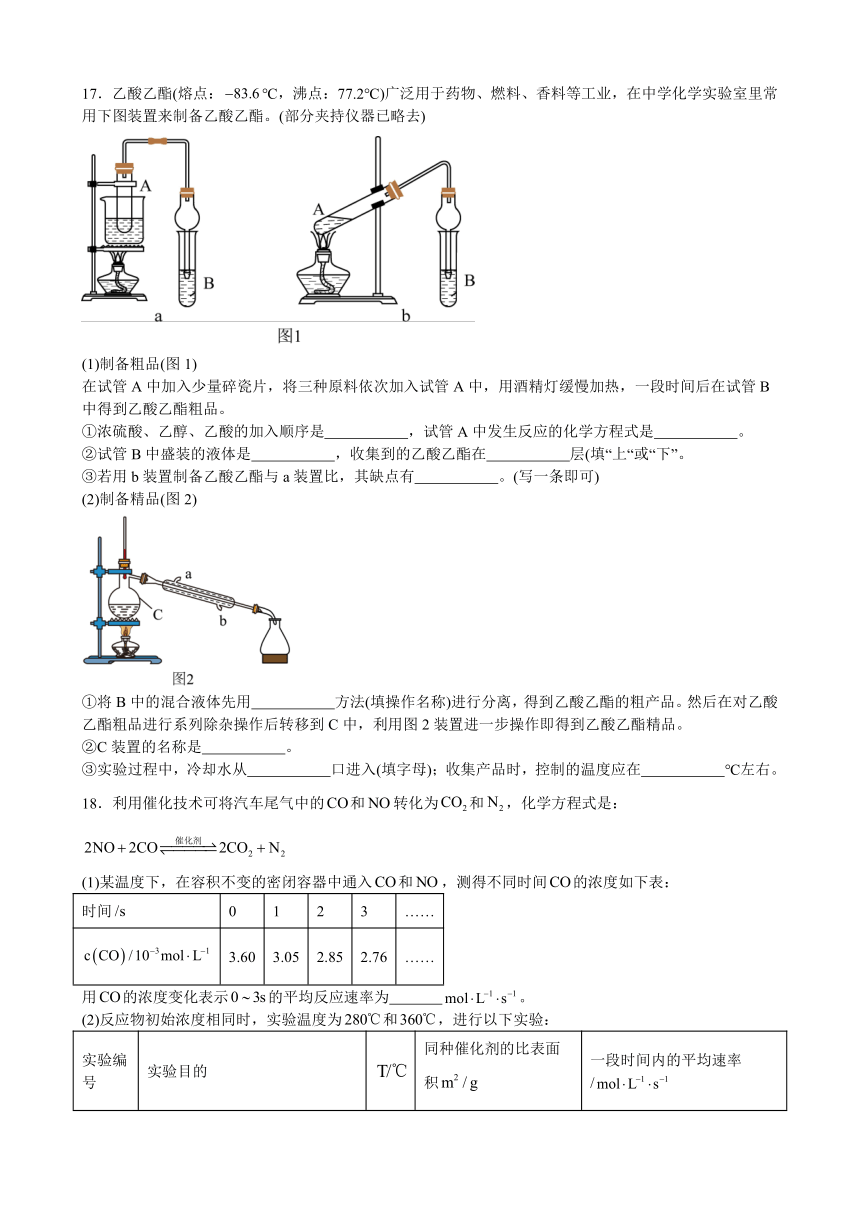
17.乙酸乙酯(熔点:℃,沸点:77.2℃)广泛用于药物、燃料、香料等工业,在中学化学实验室里常用下图装置来制备乙酸乙酯。(部分夹持仪器已略去)
(1)制备粗品(图1)
在试管A中加入少量碎瓷片,将三种原料依次加入试管A中,用酒精灯缓慢加热,一段时间后在试管B中得到乙酸乙酯粗品。
①浓硫酸、乙醇、乙酸的加入顺序是 ,试管A中发生反应的化学方程式是 。
②试管B中盛装的液体是 ,收集到的乙酸乙酯在 层(填“上“或“下”。
③若用b装置制备乙酸乙酯与a装置比,其缺点有 。(写一条即可)
(2)制备精品(图2)
①将B中的混合液体先用 方法(填操作名称)进行分离,得到乙酸乙酯的粗产品。然后在对乙酸乙酯粗品进行系列除杂操作后转移到C中,利用图2装置进一步操作即得到乙酸乙酯精品。
②C装置的名称是 。
③实验过程中,冷却水从 口进入(填字母);收集产品时,控制的温度应在 ℃左右。
18.利用催化技术可将汽车尾气中的和转化为和,化学方程式是:
(1)某温度下,在容积不变的密闭容器中通入和,测得不同时间的浓度如下表:
时间 0 1 2 3 ……
3.60 3.05 2.85 2.76 ……
用的浓度变化表示的平均反应速率为 。
(2)反应物初始浓度相同时,实验温度为和,进行以下实验:
实验编号 实验目的 同种催化剂的比表面积 一段时间内的平均速率/
Ⅰ 对照实验 280 80
Ⅱ 研究催化剂比表面积对尾气转化速率的影响 a 120
Ⅲ b c d
【实验分析与结论】
①补全表格a. ,b. ,c. ,d. 。
②测得,对比实验Ⅰ、Ⅱ,可得结论: 。
③通过实验可得到“催化剂的比表面积相同时,温度升高,可增大尾气的转化速率”的结论,证据是 。
1.C
A.用汽油代替柴油不能减少二氧化碳的排放,不能推进碳中和,故A错误;
B.使用无磷洗衣粉能有效防止水体污染,不能推进碳中和,故B错误;
C.用二氧化碳合成淀粉,减少了二氧化碳的排放,能推进碳中和,故C正确;
D.推行生活垃圾分类,有利于环保,但不能减少二氧化碳的排放,不能推进碳中和,故D错误;
故选:C。
2.D
A.煤的液化过程中生成甲醇等液体燃料,不属于取代反应,故A错误;
B.甲烷在空气中燃烧是甲烷被氧化的过程,属于氧化反应,故B错误;
C.异戊二烯反应生成聚异戊二烯属于加聚反应,故C错误;
D.乙烷在光照条件下与氯气反应是烷烃的取代反应,故D正确;
故选D。
3.D
A.乙烯分子中含有碳碳双键,其结构简式为,A错误;
B.乙醇的结构简式为,分子式为,B错误;
C.分子中原子分别与原子共用对电子,且碳原子和氯原子均达8电子稳定结构,其电子式为 ,C错误;
D.乙酸结构简式为,原子半径:,则乙酸的分子结构模型为 ,D正确;
答案选D。
4.A
A.标况下22.4 L CH4中为1mol,含有原子数为5NA,根据阿伏加德罗定律推论同压同体积时,,可知温度高则物质的量小,故25℃,101 kPa时,22.4 L CH4中的分子数小于1mol,含有的原子数小于5NA,A正确;
B.32 g甲醇的物质的量为1mol,分子结构式为,分子中含有C-H键的数目为3NA,B错误;
C.1 L 1 mol L 1盐酸中,溶液中无HCl分子,都电离为H+和Cl-, C错误;
D.密闭容器中,2 SO2+O22SO3,三氧化硫在高温下不稳定,分解生成二氧化硫和氧气,故反应后分子总数大于2NA,D错误;
故答案为:A。
5.C
A.银离子和氯离子能反应生成AgCl沉淀,两者不能大量共存,A错误;
B.氢离子与碳酸氢根离子反应生成二氧化碳和水,两者不能大量共存,B错误;
C.选项中的四种离子相互之间不反应,能大量共存,C正确;
D.钙离子和碳酸根离子反应生成碳酸钙沉淀,两者不能大量共存,D错误;
故答案选C。
6.B
A.升高温度,化学反应速率加快,故不选A;
B.降低温度,化学反应速率减慢,故选B;
C.增大反应物浓度,化学反应速率加快,故不选C;
D.增大固体反应物的接触面积,化学反应速率加快,故不选D;
选B。
7.B
A.将海水换成乙醇,乙醇与金属锂之间直接发生氧化还原反应,但缺乏电解质、无法形成原电池,故A错误;
B.电子从负极锂电极经导线移向正极镍电极,故B正确;
C.金属锂作负极,发生失电子的氧化反应,故C错误;
D.未指明气体是否处于标准状况,无法用气体摩尔体积计算,故D错误;
答案选B。
8.A
根据速率比等于计量数之比,将各物质表示速率转化为以氮气表示:
A.
B.
C.
D.
综上,生成氨气速率最快的,答案选A;
9.D
A.聚苯乙烯是由单体苯乙烯通过加聚反应生成的,聚苯乙烯中没有碳碳双键不能使溴的四氯化碳溶液褪色,A错误;
B.聚苯乙烯是一种有机合成高分子,B错误;
C.聚苯乙烯是由单体苯乙烯通过加聚反应生成的,C错误;
D.聚苯乙烯是由单体苯乙烯通过加聚反应生成的;苯乙烯的分子式为C8H8,D正确;
故选D。
10.B
氧化铝为两性氧化物,氧化铁为碱性氧化物,二氧化硅为酸性氧化物,根据流程,加入盐酸,氧化铝转化为AlCl3,Fe2O3转化为FeCl3,然后过滤,除去SiO2,利用氢氧化铝为两性氢氧化物,因此加入过量的NaOH,Fe3+以Fe(OH)3形式沉淀出来,Al3+转化成偏铝酸根离子,然后过滤,然后利用氢氧化铝不溶于碳酸,即碳酸的酸性强于氢氧化铝,偏铝酸钠溶液中通入CO2,得到氢氧化铝沉淀,然后加热得到氧化铝,电解氧化铝生成铝单质。
A.①中二氧化硅不反应,过滤除去二氧化硅;②中加入过量氢氧化钠将铁离子转化为氢氧化铁沉淀、铝离子转化为偏铝酸根离子,过滤除去沉淀;故除加试剂外,还需要进行过滤操作,A正确;
B.a是AlCl3和FeCl3混合液,b是NaAlO2溶液,两个溶液中Al的化合价都是+3价,B错误;
C.根据上述分析,③中通入CO2,得到氢氧化铝沉淀,C正确;
D.应④为氢氧化铝受热分解成氧化铝和水,电解氧化铝生成铝,故d一定是氧化铝,D正确;
故选B。
11.D
由流程可知,在坩埚中灼烧得到海带灰,溶解、浸泡后得到悬浊液,过滤分离出含I-的溶液,加入稀硫酸和H2O2发生,得到含碘的溶液,再加入CC14萃取、分液,得到I2的CCl4溶液,然后加入NaOH溶液反萃取,分液后得到的有机层为CCl4,向分液得到水层中加入稀硫酸得到I2,以此解答。
A.灼烧海带时用到的硅酸盐仪器有:坩埚、泥三角、玻璃棒、酒精灯,故A正确;
B.H2O2在酸性条件下将I-氧化为I2,离子方程式为,故B正确;
C.“反萃取”所得有机层为CCl4,可循环再利用,故C正确;
D.由分析可知,萃取后得到I2的CCl4溶液,然后加入NaOH溶液,I2转化为I-和IO-,反萃取后加入稀硫酸发生反应:I-+ IO-+2H+=I2+H2O,每生成碘,理论上转移电子,故D错误;
故选D。
12.B
A.向久置于空气中的Na2SO3溶液中加入BaCl2溶液,无法确定生成的白色沉淀是BaSO3还是BaSO4,故无法判断Na2SO3溶液是否变质,故A错误;
B.某溶液中滴加KSCN溶液,溶液显红色,说明原溶液中肯定含有Fe3+,故B正确;
C.将稀盐酸滴入碳酸钠溶液中,产生的气体中可能含有挥发出的氯化氢气体,直接通入硅酸钠溶液,生成白色沉淀,无法证明是氯化氢将硅酸制备出来还是碳酸制备出硅酸,故无法得出碳酸酸性强于硅酸,故C错误;
D.向硝酸钡溶液中通入二氧化硫,酸性条件下硝酸根将+4价硫氧化为+6价,故生成的白色沉淀为硫酸钡,故D错误。
答案为:B。
13.D
原电池A电极发生还原反应,做正极,反应式为O2+4e-+ 4H+ =2H2O,B电极发生氧化反应,做负极,反应式为2HS--4e-=2S+2H+;根据电池工作原理图可知微生物反应式为2CH2O++H+=2CO2+HS +2H2O。
A.根据分析可知B做负极,A正确;
B.阳离子向正极移动,H+从海底沉积层通过交接面向海水层移动,B正确;
C.根据电池工作原理图可知微生物作用下发生反应方程式:2CH2O++H+=2CO2+HS +2H2O,C正确;
D.3.0g CH2O物质的量为0.1mol,根据反应方程式可知反应后生成0.05molHS-,根据电极反应式可知转移电子0.1mol,则消耗0.025mol O2,A电极消耗标准状况下0.56L O2,D错误;
故答案为:D。
14.D
由图象可知,由于铁过量,OA段发生反应为:Fe++4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,据此分析解题。
A.由方程式3Cu+8H++2=3Cu2++2NO+4H2O,Fe++4H+=Fe3++NO↑+2H2O可知,两反应中和H+均按1:4反应的,第二份溶液中完全消耗掉,H+过量,故向第一份溶液中加入NaNO3可以溶解更多的铜粉,A正确;
B.由分析可知,段产生的气体是NO,BC段产生的气体是,B正确;
C.由分析可知,段发生的反应为:,C正确;
D.反应消耗14g铁,也就是=0.25mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.25mol,所以硫酸的浓度是=2.5mol/L,D错误;
故答案为:D。
15.(1)过滤 分液 烧杯、玻璃棒
(2)ACD
(3)分液漏斗 紫红 下 上
(4)CCl4
16.(1)过滤 Fe2O3+6H+=2Fe3++3H2O
(2)将二价铁氧化为三价铁 产生红褐色沉淀 2Fe(OH)3=Fe2O3+3H2O
(3)2Fe3++Fe=3Fe2+ 1.6
17.(1)先加乙醇,再加浓硫酸和乙酸 饱和碳酸钠溶液 上 受热不均匀
(2)分液 蒸馏烧瓶 b 77.2℃
18.(1)
(2)280 研究温度对尾气转化速率的影响 360 80 在其他条件相同时,同种催化剂的比表面积越大,反应速率越大
化学
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在本试卷和答题卡的相应位置上:
2.作答时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将答题卡交回。
一.单选题(每小题3分,共42分)
1.“碳中和”是指确定时间内排放的碳总量与吸取的碳总量相互抵消,实现二氧化碳相对“零排放”。下列措施对推进碳中和最有效的是
A.用汽油代替柴油 B.使用无磷洗衣粉
C.用二氧化碳合成淀粉 D.推行生活垃圾分类
2.下列反应属于取代反应的是
A.煤的液化 B.甲烷在空气中燃烧
C.异戊二烯反应生成聚异戊二烯 D.乙烷在光照条件下与氯气反应
3.下列有关化学用语的表述正确的是
A.乙烯的结构简式: B.乙醇的分子式:
C.的电子式: D.乙酸的分子结构模型:
4.NA是阿伏加德罗常数的值,下列说法正确的是
A.25℃,101 kPa时,22.4 L 中含有的原子数小于
B.32 g甲醇分子中含有C-H键的数目为
C.1 L 1 mol L盐酸中,HCl分子的数目为
D.密闭容器中,2 mol 和1 mol 催化反应后分子总数为
5.在下列溶液中,各离子能够大量共存的是
A.、、、 B.、、、
C.、、、 D.、、、
6.下列可以减慢化学反应速率的措施是
A.升高温度 B.降低温度
C.增大反应物浓度 D.增大固体反应物的接触面积
7.锂海水电池常用在海上浮标等助航设备中,其原理如图所示。
电池反应为。电池工作时,下列说法正确的是
A.如果将海水换成乙醇该装置仍可以构成个原电池该装置
B.电子从锂电极经导线流向镍电极
C.金属锂作负极,发生还原反应
D.理论上每转移电子可以生成
8.四个不同的密闭容器中,采用不同条件进行反应,根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
A. B.
C. D.
9.生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式为。工业由苯和乙烯为原料制备聚苯乙烯,根据所学乙烯知识,可以判断下列说法正确的是
A.聚苯乙烯能使溴的四氯化碳溶液褪色 B.聚苯乙烯是一种天然高分子
C.聚苯乙烯可由苯乙烯通过化合反应制得 D.聚苯乙烯单体的分子式为C8H8
10.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝,下列说法中错误的是
A.①②中除加试剂外,还需要进行过滤操作 B.a、b中铝元素的化合价不相同
C.③中需要通入过量的 D.④进行的操作是加热,而且d一定是氧化铝
11.实验室模拟工业海带提砷的流程如图。下列说法错误的是
A.“灼烧”用到的硅酸盐仪器有坩埚、泥三角、玻璃棒、酒精灯
B.“氧化”时发生反应的离子方程式为
C.“反萃取”所得有机层经处理后可循环再利用
D.“沉淀”时每生成碘,理论上转移电子
12.下列实验现象和结论都正确的是
选项 实验操作 现象 结论
A 向久置于空气中的Na2SO3溶液中加入BaCl2溶液 有白色沉淀生成 Na2SO3溶液变质了
B 向某溶液中滴加KSCN溶液 溶液显红色 原溶液中有Fe3+
C 将稀盐酸滴入碳酸钠溶液中产生的气体直接通入硅酸钠溶液 有白色沉淀生成 证明非金属性Cl>C>Si
D 向硝酸钡溶液中通入二氧化硫 有白色沉淀 该沉淀是亚硫酸钡
A.A B.B C.C D.D
13.“海泥电池”既可用于深海水下仪器的电源补给,又有利于海洋环境污染治理。电池工作原理如图所示,其中微生物代谢产物显酸性。
下列说法错误的是
A.B电极为负极
B.从海底沉积层通过交接面向海水层移动
C.微生物作用下发生反应:
D.除去,A电极消耗标准状况下
14.某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向第一份中逐渐加入铜粉,最多能溶解9.6g。向第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是
A.向第一份溶液中加入可以溶解更多的铜粉
B.段产生的气体是NO,BC段产生的气体是
C.段发生的反应为:
D.原混合酸中浓度为
二、填空题(共58分)
15.海藻中食含碘元素。某小组同学在实验室里用灼烧海藻的灰分提取碘,流程如下图所示:
(1)操作①的名称 ,操作③的名称 。实验室进行操作①使用的仪器有铁架台(带铁圈)、漏斗和 。
(2)操作②选用CCl4的理由是_____(填写序号)。
A.CCl4不溶于水 B.CCl4的密度比水大
C.碘在CCl4中比在水中溶解度更大 D.CCl4与碘水不反应
(3)用NaOH溶液反萃取后再加稀硫酸,可以分离I2和CCl4。有关化学方程式为:
碱性条件:;
酸性条件:。
以下是反萃取过程的操作,请填写相关空格:
①向装有I2的CCl4溶液的 (填仪器名称)中加入少量1mol/LNaOH溶液;
②振荡至溶液的 色消失,静置,分层,则 (填“上”。“下”)层为CCl4;
③将含碘的碱溶液从仪器的 (填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴1mol L-1H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体。
(4)本实验中可以循环利用的物质是 。
16.铁泥(主要成分为含少量、Fe及杂质;杂质与酸不反应,且难溶于水)是一种常见的工业废料,为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产铁红或七水合硫酸亚铁。
(1)过程Ⅰ中
①分离出杂质的操作是 。
②与硫酸反应的离子方程式为 。
(2)制备铁红
①过程Ⅱ加入的目的是 。
②过程Ⅲ中,加入氨水后,可观察到的现象为 。
③过程Ⅳ得到铁红的化学方程式为 。
(3)制备
①过程Ⅴ中,用离子方程式说明加入铁屑的主要目的是 。
②过程Ⅰ中加入硫酸至固体不再溶解,则经过程Ⅴ反应后所得溶液中的物质的量最多为 mol。
17.乙酸乙酯(熔点:℃,沸点:77.2℃)广泛用于药物、燃料、香料等工业,在中学化学实验室里常用下图装置来制备乙酸乙酯。(部分夹持仪器已略去)
(1)制备粗品(图1)
在试管A中加入少量碎瓷片,将三种原料依次加入试管A中,用酒精灯缓慢加热,一段时间后在试管B中得到乙酸乙酯粗品。
①浓硫酸、乙醇、乙酸的加入顺序是 ,试管A中发生反应的化学方程式是 。
②试管B中盛装的液体是 ,收集到的乙酸乙酯在 层(填“上“或“下”。
③若用b装置制备乙酸乙酯与a装置比,其缺点有 。(写一条即可)
(2)制备精品(图2)
①将B中的混合液体先用 方法(填操作名称)进行分离,得到乙酸乙酯的粗产品。然后在对乙酸乙酯粗品进行系列除杂操作后转移到C中,利用图2装置进一步操作即得到乙酸乙酯精品。
②C装置的名称是 。
③实验过程中,冷却水从 口进入(填字母);收集产品时,控制的温度应在 ℃左右。
18.利用催化技术可将汽车尾气中的和转化为和,化学方程式是:
(1)某温度下,在容积不变的密闭容器中通入和,测得不同时间的浓度如下表:
时间 0 1 2 3 ……
3.60 3.05 2.85 2.76 ……
用的浓度变化表示的平均反应速率为 。
(2)反应物初始浓度相同时,实验温度为和,进行以下实验:
实验编号 实验目的 同种催化剂的比表面积 一段时间内的平均速率/
Ⅰ 对照实验 280 80
Ⅱ 研究催化剂比表面积对尾气转化速率的影响 a 120
Ⅲ b c d
【实验分析与结论】
①补全表格a. ,b. ,c. ,d. 。
②测得,对比实验Ⅰ、Ⅱ,可得结论: 。
③通过实验可得到“催化剂的比表面积相同时,温度升高,可增大尾气的转化速率”的结论,证据是 。
1.C
A.用汽油代替柴油不能减少二氧化碳的排放,不能推进碳中和,故A错误;
B.使用无磷洗衣粉能有效防止水体污染,不能推进碳中和,故B错误;
C.用二氧化碳合成淀粉,减少了二氧化碳的排放,能推进碳中和,故C正确;
D.推行生活垃圾分类,有利于环保,但不能减少二氧化碳的排放,不能推进碳中和,故D错误;
故选:C。
2.D
A.煤的液化过程中生成甲醇等液体燃料,不属于取代反应,故A错误;
B.甲烷在空气中燃烧是甲烷被氧化的过程,属于氧化反应,故B错误;
C.异戊二烯反应生成聚异戊二烯属于加聚反应,故C错误;
D.乙烷在光照条件下与氯气反应是烷烃的取代反应,故D正确;
故选D。
3.D
A.乙烯分子中含有碳碳双键,其结构简式为,A错误;
B.乙醇的结构简式为,分子式为,B错误;
C.分子中原子分别与原子共用对电子,且碳原子和氯原子均达8电子稳定结构,其电子式为 ,C错误;
D.乙酸结构简式为,原子半径:,则乙酸的分子结构模型为 ,D正确;
答案选D。
4.A
A.标况下22.4 L CH4中为1mol,含有原子数为5NA,根据阿伏加德罗定律推论同压同体积时,,可知温度高则物质的量小,故25℃,101 kPa时,22.4 L CH4中的分子数小于1mol,含有的原子数小于5NA,A正确;
B.32 g甲醇的物质的量为1mol,分子结构式为,分子中含有C-H键的数目为3NA,B错误;
C.1 L 1 mol L 1盐酸中,溶液中无HCl分子,都电离为H+和Cl-, C错误;
D.密闭容器中,2 SO2+O22SO3,三氧化硫在高温下不稳定,分解生成二氧化硫和氧气,故反应后分子总数大于2NA,D错误;
故答案为:A。
5.C
A.银离子和氯离子能反应生成AgCl沉淀,两者不能大量共存,A错误;
B.氢离子与碳酸氢根离子反应生成二氧化碳和水,两者不能大量共存,B错误;
C.选项中的四种离子相互之间不反应,能大量共存,C正确;
D.钙离子和碳酸根离子反应生成碳酸钙沉淀,两者不能大量共存,D错误;
故答案选C。
6.B
A.升高温度,化学反应速率加快,故不选A;
B.降低温度,化学反应速率减慢,故选B;
C.增大反应物浓度,化学反应速率加快,故不选C;
D.增大固体反应物的接触面积,化学反应速率加快,故不选D;
选B。
7.B
A.将海水换成乙醇,乙醇与金属锂之间直接发生氧化还原反应,但缺乏电解质、无法形成原电池,故A错误;
B.电子从负极锂电极经导线移向正极镍电极,故B正确;
C.金属锂作负极,发生失电子的氧化反应,故C错误;
D.未指明气体是否处于标准状况,无法用气体摩尔体积计算,故D错误;
答案选B。
8.A
根据速率比等于计量数之比,将各物质表示速率转化为以氮气表示:
A.
B.
C.
D.
综上,生成氨气速率最快的,答案选A;
9.D
A.聚苯乙烯是由单体苯乙烯通过加聚反应生成的,聚苯乙烯中没有碳碳双键不能使溴的四氯化碳溶液褪色,A错误;
B.聚苯乙烯是一种有机合成高分子,B错误;
C.聚苯乙烯是由单体苯乙烯通过加聚反应生成的,C错误;
D.聚苯乙烯是由单体苯乙烯通过加聚反应生成的;苯乙烯的分子式为C8H8,D正确;
故选D。
10.B
氧化铝为两性氧化物,氧化铁为碱性氧化物,二氧化硅为酸性氧化物,根据流程,加入盐酸,氧化铝转化为AlCl3,Fe2O3转化为FeCl3,然后过滤,除去SiO2,利用氢氧化铝为两性氢氧化物,因此加入过量的NaOH,Fe3+以Fe(OH)3形式沉淀出来,Al3+转化成偏铝酸根离子,然后过滤,然后利用氢氧化铝不溶于碳酸,即碳酸的酸性强于氢氧化铝,偏铝酸钠溶液中通入CO2,得到氢氧化铝沉淀,然后加热得到氧化铝,电解氧化铝生成铝单质。
A.①中二氧化硅不反应,过滤除去二氧化硅;②中加入过量氢氧化钠将铁离子转化为氢氧化铁沉淀、铝离子转化为偏铝酸根离子,过滤除去沉淀;故除加试剂外,还需要进行过滤操作,A正确;
B.a是AlCl3和FeCl3混合液,b是NaAlO2溶液,两个溶液中Al的化合价都是+3价,B错误;
C.根据上述分析,③中通入CO2,得到氢氧化铝沉淀,C正确;
D.应④为氢氧化铝受热分解成氧化铝和水,电解氧化铝生成铝,故d一定是氧化铝,D正确;
故选B。
11.D
由流程可知,在坩埚中灼烧得到海带灰,溶解、浸泡后得到悬浊液,过滤分离出含I-的溶液,加入稀硫酸和H2O2发生,得到含碘的溶液,再加入CC14萃取、分液,得到I2的CCl4溶液,然后加入NaOH溶液反萃取,分液后得到的有机层为CCl4,向分液得到水层中加入稀硫酸得到I2,以此解答。
A.灼烧海带时用到的硅酸盐仪器有:坩埚、泥三角、玻璃棒、酒精灯,故A正确;
B.H2O2在酸性条件下将I-氧化为I2,离子方程式为,故B正确;
C.“反萃取”所得有机层为CCl4,可循环再利用,故C正确;
D.由分析可知,萃取后得到I2的CCl4溶液,然后加入NaOH溶液,I2转化为I-和IO-,反萃取后加入稀硫酸发生反应:I-+ IO-+2H+=I2+H2O,每生成碘,理论上转移电子,故D错误;
故选D。
12.B
A.向久置于空气中的Na2SO3溶液中加入BaCl2溶液,无法确定生成的白色沉淀是BaSO3还是BaSO4,故无法判断Na2SO3溶液是否变质,故A错误;
B.某溶液中滴加KSCN溶液,溶液显红色,说明原溶液中肯定含有Fe3+,故B正确;
C.将稀盐酸滴入碳酸钠溶液中,产生的气体中可能含有挥发出的氯化氢气体,直接通入硅酸钠溶液,生成白色沉淀,无法证明是氯化氢将硅酸制备出来还是碳酸制备出硅酸,故无法得出碳酸酸性强于硅酸,故C错误;
D.向硝酸钡溶液中通入二氧化硫,酸性条件下硝酸根将+4价硫氧化为+6价,故生成的白色沉淀为硫酸钡,故D错误。
答案为:B。
13.D
原电池A电极发生还原反应,做正极,反应式为O2+4e-+ 4H+ =2H2O,B电极发生氧化反应,做负极,反应式为2HS--4e-=2S+2H+;根据电池工作原理图可知微生物反应式为2CH2O++H+=2CO2+HS +2H2O。
A.根据分析可知B做负极,A正确;
B.阳离子向正极移动,H+从海底沉积层通过交接面向海水层移动,B正确;
C.根据电池工作原理图可知微生物作用下发生反应方程式:2CH2O++H+=2CO2+HS +2H2O,C正确;
D.3.0g CH2O物质的量为0.1mol,根据反应方程式可知反应后生成0.05molHS-,根据电极反应式可知转移电子0.1mol,则消耗0.025mol O2,A电极消耗标准状况下0.56L O2,D错误;
故答案为:D。
14.D
由图象可知,由于铁过量,OA段发生反应为:Fe++4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,据此分析解题。
A.由方程式3Cu+8H++2=3Cu2++2NO+4H2O,Fe++4H+=Fe3++NO↑+2H2O可知,两反应中和H+均按1:4反应的,第二份溶液中完全消耗掉,H+过量,故向第一份溶液中加入NaNO3可以溶解更多的铜粉,A正确;
B.由分析可知,段产生的气体是NO,BC段产生的气体是,B正确;
C.由分析可知,段发生的反应为:,C正确;
D.反应消耗14g铁,也就是=0.25mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.25mol,所以硫酸的浓度是=2.5mol/L,D错误;
故答案为:D。
15.(1)过滤 分液 烧杯、玻璃棒
(2)ACD
(3)分液漏斗 紫红 下 上
(4)CCl4
16.(1)过滤 Fe2O3+6H+=2Fe3++3H2O
(2)将二价铁氧化为三价铁 产生红褐色沉淀 2Fe(OH)3=Fe2O3+3H2O
(3)2Fe3++Fe=3Fe2+ 1.6
17.(1)先加乙醇,再加浓硫酸和乙酸 饱和碳酸钠溶液 上 受热不均匀
(2)分液 蒸馏烧瓶 b 77.2℃
18.(1)
(2)280 研究温度对尾气转化速率的影响 360 80 在其他条件相同时,同种催化剂的比表面积越大,反应速率越大
同课章节目录
